En 2017, lorsqu’à la demande des autorités de santé, une nouvelle formule de Levothyrox est commercialisée pour améliorer la stabilité du produit, de nombreux effets indésirables sont rapidement signalés. La responsabilité directe du changement de formulation dans leur survenue a fait débat mais s’est révélée extrêmement probable.1,2,3
Rappel des faits
Mars 2017 : nouvelle formule de Levothyrox imposée à 3 millions de malades
Le Levothyrox est en monopole de fait, quand l’Agence nationale de sécurité du médicament (ANSM) impose une nouvelle formule (NF), en remplacement de l’ancienne (AF) dont la tolérance était pourtant remarquable : 0,075 événement indésirable/100 000 mois de traitement. Motif ? Obtenir une meilleure stabilité du principe actif. Le rapport du comité technique de pharmacovigilance (CTPV) du 10 octobre 2017 résumait :4« Aucun changement lié à la modification de formule n’est attendu pour les patients en termes d’efficacité ou de tolérance du médicament. » Il vaut mieux car la Haute Autorité de santé (HAS) précise à l’époque : « Pas d’amélioration du service médical rendu » (ASMR V).
Mais, en un an, les signalements d’événements indésirables graves se multiplient, au point que des malades ont dû arrêter leur traitement : une situation inédite, selon le rapport du CTPV.4 Entre le 4 et le 8 septembre 2017, 68 % des médecins rapportent des effets indésirables de la NF, selon un sondage du Quotidien du médecin.5
C’est une crise sanitaire que la ministre de la Santé Agnès Buzyn ne déclare pas comme telle. Elle annonce l’introduction « lentement progressive » d’alternatives à cette NF, y compris le retour de l’AF, à partir d’octobre 2017. Alors, en quelques mois, apparaît un nouvel indice de l’impact du changement de formule : sur prescription médicale, 20 à 30 % des malades abandonnent la NF.
Une situation quasi expérimentale
La lévothyroxine, principe actif du Levothyrox, est inscrite sur la liste des médicaments essentiels de l’Organisation mondiale de la santé. La NF, dont les excipients principaux (mannitol et acide citrique) diffèrent de celui de l’AF (lactose), a les caractéristiques d’un nouveau médicament. Pour sa première mise sur le marché au monde, il est pourtant imposé sans essai clinique préalable, du jour au lendemain, à près de 3 millions de personnes qui ne peuvent s’en passer pour des raisons vitales.
Pour ce type de médicament et dans des conditions voisines, le passé regorge de situations ayant entraîné des effets indésirables observés après un simple changement d’usine de fabrication (Nouvelle-Zélande, 2007) ou d’excipients (Danemark, 2009 ; France, 2009 - 2010, Israël, 2011) ou lors du simple changement de procédé de fabrication (Belgique, 2015). À l’époque, l’Association française des malades de la thyroïde (AFMT) constate, et déplore pour les malades, que ces conditions de changement de formule aient été celles d’une situation quasi expérimentale. Aussi, dès la commission de suivi de septembre 2017, avec la Direction générale de la santé (DGS), le conseiller scientifique de l’AFMT propose une stratégie de sortie de crise fondée sur la méthodologie, l’objectivité et la transparence scientifique : « La recherche en thyroïdologie devrait s’engouffrer dans l’analyse des faits observés dans cette situation quasi expérimentale. » Une « mission d’information sur le médicament » a été la pseudo-réponse du ministère de la Santé.
Les autorités relativisent
« La crise du Levothyrox enfin résolue. Mission flash à l’Assemblée nationale le 31 octobre 2017 » ; sous ce titre, le rapporteur souligne la précision et la puissance de l’étude du laboratoire Merck : « La bioéquivalence est parfaite à 0,3 % près » ; elle est calculée chez 200 volontaires sains. Quant au mannitol et à l’acide citrique qui remplacent le lactose de l’AF, « aucun effet notoire n’est reconnu à ces excipients, qui sont d’ailleurs couramment utilisés par l’industrie agroalimentaire ». Les déséquilibres induits par le passage à la NF sont relativisés : « La TSH (thyroid-stimulating hormone) connaît naturellement des variations importantes et peut fluctuer selon l’activité du patient. L’Académie nationale de médecine et les spécialistes (…) sont unanimes : la nouvelle formule est meilleure, car elle est plus stable et d’un dosage plus précis, pendant toute la durée de validité du produit ». Donc « il n’y a pas de crise sanitaire mais une crise médiatique ».6
Dès lors, la crise se réduit à un défaut de communication, à un effet « nocebo » quasi exclusif et à des phénomènes sociologiques liés aux médias et aux réseaux sociaux. Un « point d’information » des Sociétés d’endocrinologie et de leur groupe de recherche sur la thyroïde cible déjà ces deux thèmes, le 11 septembre 2017.7
Quelques endocrinologues reconnus, dont certains cités dans ce rapport, affichent leurs convictions sur « cette invraisemblable crise » dans une tribune publiée dans Le Monde : « L’argument le plus fort (…) est pharmacologique. Le mannitol et l’acide citrique qui ont remplacé le lactose ne peuvent entraîner les manifestations décrites. On les retrouve à des doses nettement plus élevées dans de nombreux aliments, notamment les bonbons et chewing-gums sans sucre, sous les noms de code E421 et E330 »8, selon le Pr Jean-François Bergmann.9
Recherches et analyses
Recherche analytique et clinique pour l’AFMT, enquête sociologique pour le ministère de la Santé
La confusion confiture-chewing-gum/pharmacie est faite pour rassurer. Elle prend le risque d’ignorer la fonction des excipients dans le médicament et, autrement dit, d’une désinformation pharmaceutique et médicale, y compris vis-à-vis du règlement européen CE/1234/200. Ce dernier précise en effet que des « changements qualitatifs ou quantitatifs concernant un ou plusieurs excipients, susceptibles d’avoir des répercussions significatives sur la sécurité, la qualité ou l’efficacité du médicament » constituent une « modification majeure de type II ».
Elle contribue à justifier la négation de la gravité des souffrances des malades. Elle tend à substituer au statut de victimes celui d’hystériques et de boucs émissaires d’une crise sanitaire que l’État se refuse à déclarer comme telle.
Pour l’AFMT, la résolution de la crise passe nécessairement par la recherche, s’appuyant sur la chimie analytique (notamment des analyses minutieuses du contenu du médicament, de sa chimie et de son comportement biologique) et les données cliniques. D’ailleurs, le 5 octobre 2017,10 le CTPV recommande une discussion en groupe multidisciplinaire.
Le ministère de la Santé choisit de regarder ailleurs. Il crée une mission sur la communication, pilotée par un urgentiste (pratiquant des médias classiques et en ligne), comportant un sociologue, deux représentants des médecins généralistes, un pharmacien d’officine (soins de support), deux représentants d’associations de malades (rein, côlon)… Celle-ci relève des « manquements à la transparence et à la réactivité que chacun est en droit d’attendre des autorités de police sanitaire sur des sujets de santé » et une « minimisation du ressenti des patients et de leurs signalements ».11
Contestation de la bioéquivalence
Une synthèse de l’étude de bioéquivalence, sur laquelle les laboratoires Merck appuient leur demande de « variation » d’autorisation de mise sur le marché (AMM) de Levothyrox, est remise en question lors de la réunion de crise du 16 octobre 2017 à la Direction générale de la santé.
Pour qui connaît un peu les calculs statistiques, au premier coup d’œil, les résultats sont choquants. Le conseiller scientifique de l’AFMT est le seul à réagir en séance : « Un tel travail n’aurait jamais été accepté dans une revue clinique à comité de lecture. » Il n’est pas la « garantie d’une efficacité et d’une sécurité identiques à celle de l’ancienne formule » revendiquée par les autorités. Une étude clinique préalable aurait dû être conduite avant de donner l’AMM.12
Pourquoi ? Schématiquement, la bioéquivalence peut être établie quand l’évolution des concentrations sanguines moyennes du principe actif de deux formules différentes sont idéalement superposables ou associées à une faible dispersion, pendant quelques heures. Mais il faut savoir que plus les moyennes de concentrations sont élevées et plus l’effectif est grand, plus cette dispersion paraît artificiellement réduite par le calcul. Ici, un apport 6 fois plus élevé que les doses thérapeutiques habituelles s’ajoute à la sécrétion endogène. L’effectif de 204 volontaires sains est pléthorique : 5 à 10 fois moins suffisent habituellement pour ce type d’étude.
De plus, la définition même de la bioéquivalence n’est qu’une hypothèse, 13et cela aurait dû impliquer une certaine prudence, surtout concernant la lévothyroxine, dont la marge thérapeutique est étroite ou « critique ». En effet, ce type d’étude est totalement aveugle sur la TSH, qui est l’outil principal de suivi de l’équilibre thyroïdien, sur le temps au cours duquel l’équilibre thérapeutique s’établit (plusieurs semaines en état stable), sur la clinique et les interférences thérapeutiques.
L’AF et la NF n’étaient donc pas interchangeables pour un nombre notable de patients.
L’ANSM accepte alors la critique de la bioéquivalence sur les moyennes, mais se borne à souligner que les conditions dans lesquelles les données statistiques ont été obtenues sont conformes à la réglementation des AMM. L’AFMT s’insurge : « Quand une réglementation est inadaptée, on doit la changer » ; suggestion qui n’est bien sûr pas retenue !
La démarche scientifique de l’AFMT est centrée sur la sécurité des malades. Elle se heurte à la position de l’ANSM qui, de fait, est celle d’une administration à la fois juge et partie.
Échec des génériques du Levothyrox en 2009 - 2010, retrait en 2012 et 2016
Avant qu’elle ne devienne l’ANSM, l’Agence française de sécurité sanitaire des produits de santé (Afssaps) avait accordé en 2009 - 2010 une AMM à deux génériques du Levothyrox AF, l’un du laboratoire Robapharm/Teva et l’autre du laboratoire Biogaran. C’est sur la foi d’une étude de bioéquivalence satisfaisante qu’elle avait tenté de les imposer comme substituables au Levothyrox. Les pharmaciens étaient tenus de faire la substitution à l’officine.
Mais les effets indésirables du passage du Levothyrox AF à l’une ou l’autre de ces nouvelles formules avaient d’emblée été si nombreux que les médecins s’y étaient opposés en inscrivant « non substituable » sur les ordonnances de Levothyrox. Résultat : les deux laboratoires ont retiré ces génériques en 2012 et 2016. Fait intéressant, ils partageaient un même excipient, le mannitol, qui se trouve également dans le Levothyrox NF mais qui n’existait pas dans l’AF pour laquelle les signalements avaient toujours été extrêmement rares.
L’Afssaps a alors cru trouver une explication univoque : pour pallier le vieillissement du médicament, le laboratoire Merck compensait par un léger surdosage à la date de libération. L’Afssaps impose un délai de dix-huit mois aux laboratoires, dont Merck, pour que les variations de principe actif ne dépassent pas la valeur cible de +/- 5 % (au lieu de 10 %).
Mais quand l’AFMT remonte aux sources, elle relève que l’affirmation administrative n’est pas fondée sur une démarche scientifique rigoureuse. La Commission nationale de pharmacovigilance du 27 mars 2012 n’affirme pas avoir trouvé LA cause de TOUS les effets indésirables observés.14 Au contraire, elle s’exprime au conditionnel en se gardant de généraliser : « Ces différences pourraient expliquer la survenue de certains cas de déséquilibre thyroïdien lors de la substitution. »
Paradoxe : pour l’Afssaps, juge et partie, le princeps fiable doit changer pour justifier a posteriori les problèmes des génériques que n’avaient pas détecté les études de bioéquivalence. Quand une méthode statistique comme la bioéquivalence sur les moyennes a démontré son échec avec trois médicaments à marge thérapeutique étroite, quelle garantie clinique pourrait-elle apporter sur un quatrième ?
Nécessité d’analyse des comprimés de Levothyrox NF
Avec la NF, le laboratoire Merck va au-delà de la demande de l’Afssaps de resserrement de la concentration des comprimés en principe actif. Il en change aussi les excipients, dont l’un est celui des génériques en échec, pour en améliorer la stabilité et ainsi garantir une plus grande quantité de principe actif à péremption. On s’attend donc à des risques de surcharge (signes d’hyperthyroïdie). Or c’est l’inverse qui est observé deux fois plus souvent lors de la substitution.
Pour l’AFMT, c’est la preuve clinique que l’étude de bioéquivalence sur les moyennes, que l’ANSM a jugé suffisante pour autoriser la variation d’AMM, est aveugle sur la substituabilité. Elle l’est aussi sur la TSH, la sécrétion hormonale thyroïdienne, les malades, les effets de la prise chronique et l’impact d’autres traitements. Sans analyse comparative fine des comprimés, il est impossible de savoir si les changements ne sont pas plus profonds.
C’est pourquoi elle lance un appel national auprès de ses adhérents. Elle leur demande de lui confier toutes les boîtes de médicaments à base de thyroxine inutilisées et qu’ils ont conservé dans des conditions convenables. Elle obtient leur soutien. Ils lui confient même des échantillons, devenus très rares. Les plus anciens datent de 2015. Chaque numéro de lot est méticuleusement enregistré. Dès lors, une recherche comparative est menée sur 45 lots de médicaments produits par cinq industriels. Encore faut-il trouver des laboratoires de chimie analytique prêts à s’engager dans une recherche de haut niveau.
Compositions théorique et observée des comprimés de lévothyroxine
L’AFMT constate que les analyses de routine des laboratoires de l’ANSM ont un champ réduit au plus « classique » : principe actif, principaux excipients, quelques produits de vieillissement ou d’interaction entre les composants. Même les résultats des tests de dissolution sont alors impossibles à obtenir. Motif mis en avant : les laboratoires mobilisés par l’ANSM ne disposent pas de la technique qu’utilise le laboratoire Merck.
C’est pourquoi l’AFMT, guidée par les symptômes des malades, essaie de mobiliser les techniques d’analyses scientifiques qui correspondent à ce qu’elle recherche. À savoir, des impuretés relevant d’autres mécanismes physicochimiques que ceux retenus dans le cadre de normes administrativement définies.
L’association souhaite stimuler la démarche scientifique publique afin de découvrir les causes des souffrances des malades.15 Dans l’espoir d’attirer l’attention de laboratoires de chimie analytique français et étrangers, soutenue par ses seuls adhérents, elle engage une série d’analyses des comprimés :
- profils de nanoparticules et d’éléments métalliques différents entre AF et NF (laboratoire italien, microscopie électronique à balayage). Traces laissées par les matériaux des machines, voire de catalyseurs. Pas de toxicité pour les malades ;
- pureté énantiomérique (laboratoire américain) avec pic de composés dextrogyres sur la NF, qui méritent d’être analysés. Faute de standard de référence, la dextrothyroxine ne peut être exclue.
L’ANSM, informée par l’AFMT, suit mais n’innove guère :16 la dextrothyroxine est innocentée. Le pic est un « artefact ». Terme cache-misère récusé par l’AFMT, qui demande l’identification des composants. Pour l’ANSM, ce sont « probablement » des excipients.17 Probablement ? La Direction européenne de la qualité du médicament et soins de santé, émanation du Conseil de l’Europe, interroge et répond, dans sa fiche Pharmacopée européenne : assurer l’innocuité et la qualité du médicament : « Si le procédé de synthèse évolue ou si des impuretés différentes ou supplémentaires peuvent être présentes (…) les méthodes décrites dans les monographies permettent-elles de les déceler ? Les méthodes d’analyse ne permettent de contrôler que ce pourquoi elles ont été conçues. »18,19
2018, année charnière
2018 est une année charnière en raison de deux événements.
L’un totalement silencieux : l’AMM du Levothyrox NF est modifiée en 2018, sans publicité, pour une nouvelle usine de fabrication (Famar, Espagne). L’AFMT découvre que l’extension géographique de l’AMM s’associe à des changements dans les procédés de fabrication à fort impact potentiel, sans changement de la composition théorique des comprimés. Était-ce le début d’une « saison 2 » de la NF ?
L’autre largement visible : le projet d’étude clinique comparative AF/NF, envisagé dès septembre 2017,7 est proposé à la Direction générale de la santé par la Société française d’endocrinologie et la Société d’endocrinologie pédiatrique (6 février 2018).20 Il semble répondre à la demande de l ’AFMT, qui le récuse toutefois pour des raisons éthiques : l’étude a déjà été effectuée en grandeur nature chez 3 millions de patients et nombre d’entre eux ont souffert. Et parce qu’il y a un biais évident : seuls les malades ayant bien supporté le switch AF/NF auraient répondu… Au passage, le coût avoisinerait 760 000 euros.
Se pose aussi la question des lots utilisés.
Qui plus est, il apparaît que le projet aurait utilisé cette saison 2 de la NF sans que quiconque ait eu connaissance des modifications induites par le changement de l’AMM. Or, en avril 2018, la Suisse, qui devient le deuxième pays test pour la NF, n’enregistre pas de vague anormale de signalements.
C’est un point qui vient en écho d’une ligne du rapport flash de l’Assemblée nationale : « Il serait utile, comme l’a fait remarquer le Pr Philippe Lechat, de démontrer plus précisément que les lots utilisés pour ces études soient bien représentatifs de ceux mis sur le marché. »6
Les travaux de Jean-Christophe Garrigues, chercheur au Centre national de la recherche scientifique (CNRS), commencés en 2018, ralentis en France par les pesanteurs sociologiques et administratives, démontreront que ce n’est pas un détail !21
Confirmations scientifiques
Bioéquivalence ? Non
L’AFMT n’avait eu accès qu’à une synthèse de l’étude de bioéquivalence. Concordet, Toutain et collaborateurs réussissent à travailler sur les données brutes.22 Ils prouvent que plus de la moitié des résultats individuels de l’étude de bioéquivalence sont hors des limites. Ils s’interrogent, eux aussi, sur l’effectif hors du commun des volontaires sains recrutés.22
Ils valident les critiques affichées en séance dès octobre 2017 par le conseiller scientifique de l’AFMT. L’effectif considérable des volontaires sains inclus dans l’étude a masqué ce problème. À moyennes égales, un effectif qui augmente de 24 à 98 puis à 150 divise, en apparence, la dispersion des résultats, au point de faire passer la probabilité de bioéquivalence de 10,2 à 87,8 %, puis à 99,8 %. L’ancienne et la nouvelle formule ne sont pas substituables l’une par l’autre. Les résultats confirment l’origine et la réalité des problèmes d’hyper- et d’hypothyroïdie au changement de formule.
L’éditorial de juin 2019 de La Revue du Praticien, revue médicale de référence, résume la situation.2
Un article de l’Académie nationale de médecine, signé du Pr Lechat, en convient, six ans après l’alerte lancée par l’AFMT.23
L’absence de concrétisation d’une affirmation du président de Biogaran, sollicité par l’ANSM, pourrait en être rapprochée. « Biogaran a trouvé une nouvelle formule “ parfaitement stable ”, mais celle-ci ne devrait pas être disponible avant “ fin 2018 ”, le temps de mener une étude de bioéquivalence. »24 C’était en septembre 2017. On attend toujours.
Pics d’impuretés et analyses globales de différentes formulations
L’AFMT s’est interrogée sur des pics d’impuretés plus importants dans la NF que dans l’AF, en particulier en séance lors de la présentation d’une étude d’un laboratoire de l’ANSM.
En France, un chercheur toulousain en chimie analytique (Jean-Christophe Garrigues) s’engage, à son tour, en octobre 2018, sur la question des différences d’impuretés entre les deux formules et des événements indésirables.25 Son expertise est reconnue dans l’analyse de médicaments (antibiotiques).26,27 Il s’intéresse, au niveau des interactions moléculaires, aux mécanismes de rétention. Il utilise des techniques plus affûtées que celles mobilisés par l’ANSM. L’un des pics d’impuretés de la NF dépasse l’échelle du chromatogramme. Au moment où il envisage de communiquer ses résultats, sa démarche est aussitôt contestée puis bloquée, au sein du CNRS, où il travaille, qui conclut, à tort, en juillet 2019, à un artefact.28,29
À l’étranger, les travaux se poursuivent en collaboration entre Jean-Christophe Garrigues, du CNRS de Toulouse, et Lucie Nováková, de la Charles University, au sein d’un laboratoire de recherche international de haut niveau en chimie analytique du médicament, en Tchéquie. Les deux équipes, spécialistes de l’analyse des principes actifs pharmaceutiques et des formulations complexes, étudient les mécanismes de séparation de composés pharmaceutiques. Il en sort quatre publications majeures en science analytique en 2024 et 2025, dont celle sur la lévothyroxine.30 - 32 Elle paraît dans une revue à fort facteur d’impact en 2024,33 avec des signatures qui cumulent les prix et distinctions internationaux.
Ils démontrent une variabilité de la composition chimique du médicament selon les lots analysés. Ils prouvent qu’il s’agit bien d’impuretés qui résultent d’interactions chimiques inattendues entre les composants des comprimés ou des capsules.
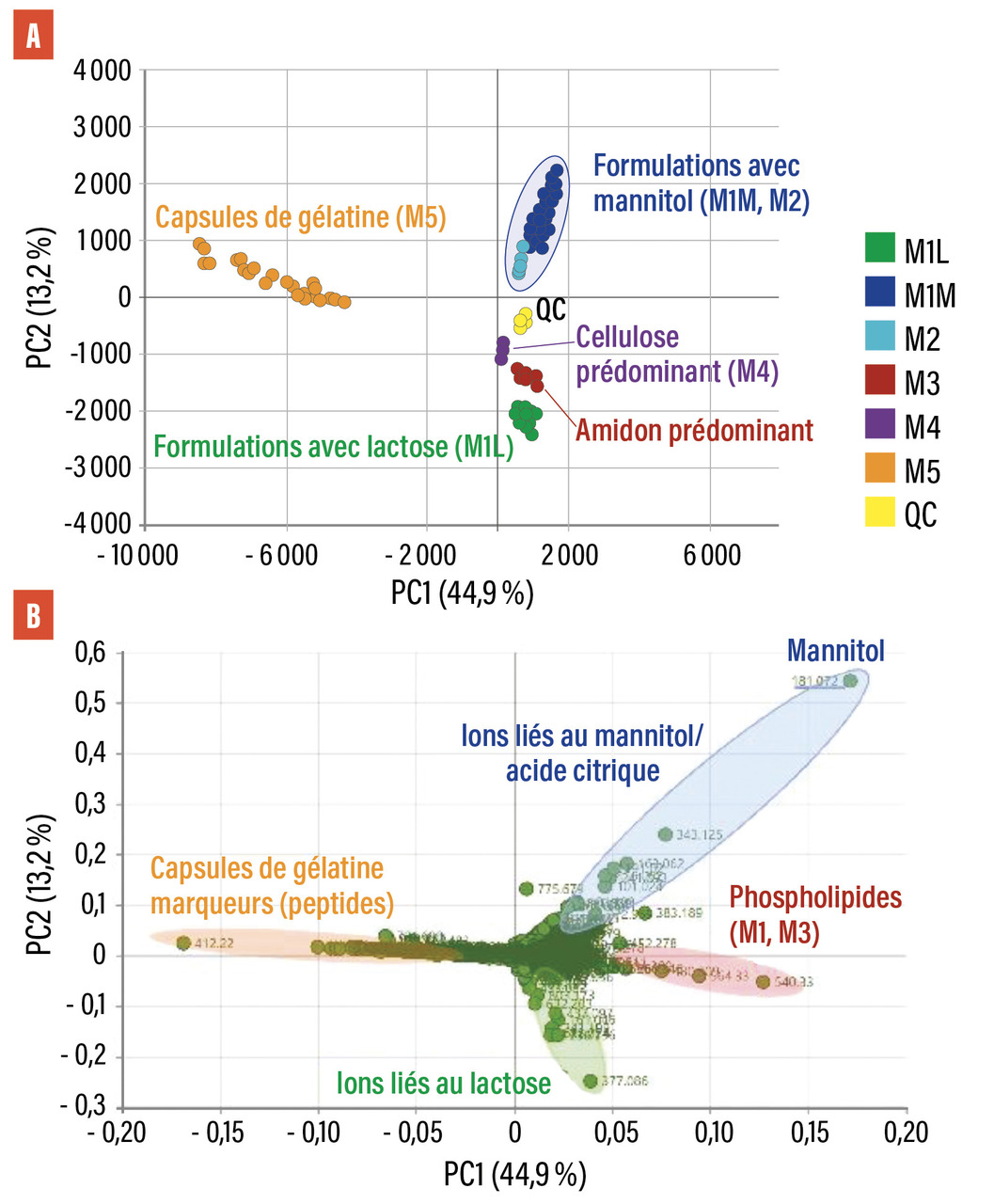
La fig. 1 A montre, quel que soit le lot, la stabilité des « profils d’impuretés » de l’AF : M1L lactose, points verts bien regroupés. Ainsi, la variabilité des lots AF est plus faible, quelle que soit la date de fabrication du lot. Cela est à rapprocher du fait qu’en utilisation clinique de l’AF et, depuis bien des années, les événements indésirables restent l’exception.
Au contraire, pour la NF, les résultats discriminent deux nuages qui s’étirent. La dispersion des résultats est un reflet de l’abondance et de la quantité des impuretés découvertes. La partie la plus « étirée », en bleu foncé, correspond à la NF. L’autre, environ trois fois plus resserrée, juste en dessous, en bleu clair, correspond à une autre formule (M2). La figure 1B relève les ions qui contribuent aux positions des échantillons de médicaments dans ce graphique.
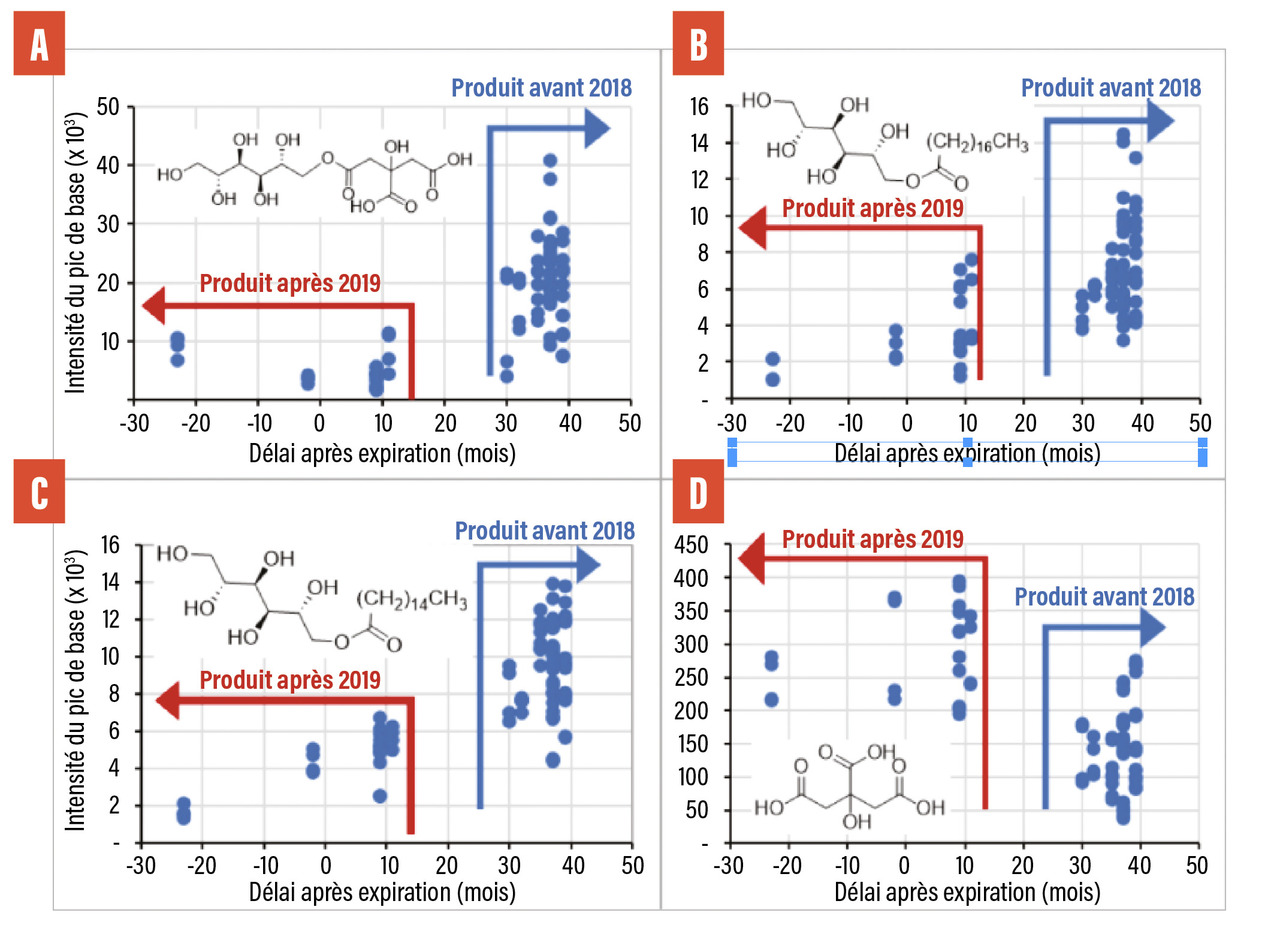
Les données supplémentaires (fig. 2 A, B, C) précisent les produits de réaction entre les excipients de la NF : citrate (A), palmitate (B) et stéarate (C) de mannitol. L’intensité observée est plus importante pour la NF de 2017 qu’après 2018, « l’année charnière ». C’est l’inverse, pour l’acide citrique (fig. 2 D).
Ces données sont à rapprocher de la vague de signalements observés dans les mois qui ont suivi l’introduction de la NF en 2017, puis à partir de 2018, saison 2, de la disparition des vagues de signalement en France et leur absence en Suisse et dans les autres pays d’Europe.
La stabilité du principe actif dans les comprimés d’AF et de NF et dans les autres médicaments est à souligner, y compris après la date de péremption. C’est la preuve que les échantillons ont été conservés dans de bonnes conditions. Les impuretés ne sont donc pas dues à d’éventuels aléas dans ce domaine.
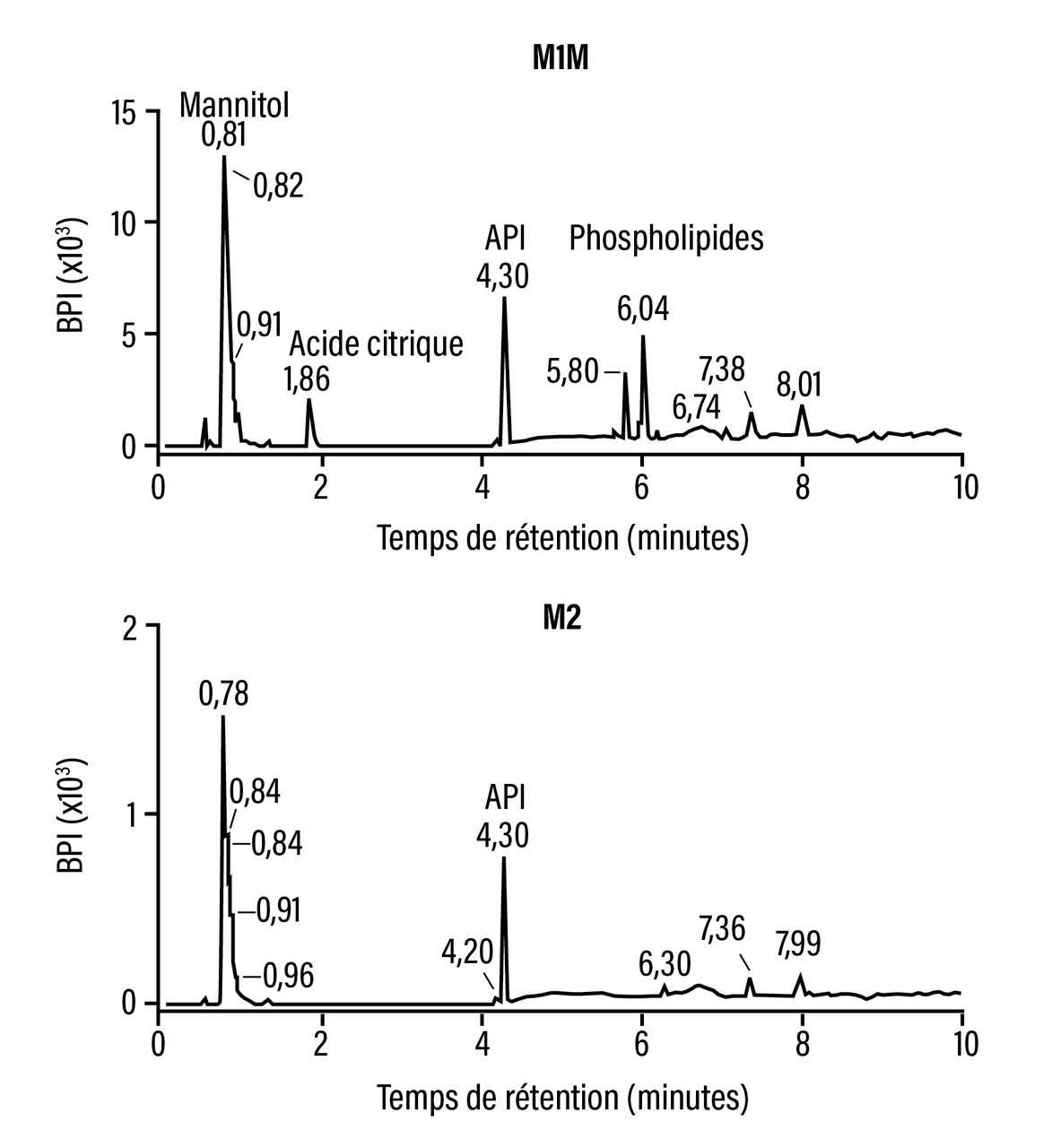
Des quantités très importantes de phospholipides, non déclarées et inattendues, sont découvertes dans la NF (fig. 3). L’origine en est un excipient abondant, l’amidon de maïs. Elles sont supérieures à celles de la lévothyroxine contenue dans tous les dosages jusqu’à 112 μg. L’ensemble est susceptible de modifier le profil de dissolution, d’absorption digestive et la biodisponibilité de la lévothyroxine, notamment chez les malades par rapport aux volontaires sains.
Évolution des impuretés entre le Levothyrox NF 2017 et la NF de la saison 2
Les comprimés des lots de NF introduits en France en 2017 contiennent cinq fois plus de stéarate et de palmitate de mannitol que ceux produits en saison 2. Or ces molécules viennent se rajouter aux phospholipides dont elles sont structurellement proches. Une telle combinaison peut affecter la biodisponibilité du principe actif.
En jeu également, l’interaction de l’acide citrique avec le mannitol se traduit par une diminution de sa concentration avec le temps.
La saison 2 de la NF coïncide donc :
- avec l’amélioration de la composition fine des comprimés observée en cours d’année 2018, année charnière ;
- avec l’AMM géographique « Famar », usine espagnole, associée à une variation des processus de fabrication, sans modification de formule ;
- en France, avec la disparition de la vague de signalements relevés par la pharmacovigilance et, pour l’AFMT, à travers les réponses à son questionnaire spécifique34 ;
- en Europe, avec l’absence de signalements en nombre lors de l’introduction de la NF en Suisse (deuxième pays dans lequel elle a été introduite) puis dans les autres pays.
Humilité et écoute sont indispensables
Les travaux menés en toute indépendance dans des laboratoires de très haut niveau, à Toulouse et à l’étranger, valident la démarche scientifique que l’AFMT avait engagée dès 2017 avec le soutien de ses adhérents.
Ils confirment que l’étude de bioéquivalence sur les moyennes devait d’emblée être mise en doute : NF et AF n’étaient pas substituables l’une par l’autre.
Ils démontrent que les lots de NF initialement introduits en France en 2017 (saison 1) contenaient davantage d’impuretés qu’en 2018 et plus tard (saison 2).
Ils font le lien entre l’interférence de composés inattendus, l’absence de bioéquivalence individuelle et les variations de biodisponibilité.
Ils questionnent la coïncidence avec la disparition des vagues de signalement sur la NF en France et leur absence lors de la commercialisation dans les autres pays à partir de 2018 (NF saison 2).
Ils confirment l’origine des problèmes d’hyper- et d’hypothyroïdie et éclairent les symptômes plus difficiles à classer.
Ils récusent pensées, croyances ou hypothèses infondées (nocebo) déployées en quasi-vérités dans la cacophonie médiatique et évitent à la sociologie de se fourvoyer dans des chausse-trappes.
Ils vont probablement amener une révision des mécanismes de contrôle des génériques de médicaments à marge thérapeutique étroite ou critique.
Ils mettent en avant le rôle déterminant des malades, rassemblés dans l’AFMT, sans laquelle les travaux de recherche internationaux n’auraient pu être engagés.
Ils redonnent tout son poids à la recherche scientifique fondée sur l’écoute des malades et l’humilité des médecins et des chercheurs.
En retour, ils apportent enfin à chaque malade, victime de ce changement de formule imprudemment et dogmatiquement imposé, la reconnaissance des souffrances, trop longtemps contestées, niées, sous-estimées ou travesties par ceux-là même qui auraient pu les protéger.
Droit de réponse du laboratoire Merck
Le laboratoire Merck nous a fait parvenir, le 2 avril 2025, un droit de réponse à notre article intitulé « Analyse scientifique 2017 - 2024 de la crise du Levothyrox par l’Association française des malades de la thyroïde » publié sur notre site. Comme l'exige la loi, nous le publions ci-dessous.
La modification des spécifications a été demandée par les autorités de santé pour garantir une précision accrue dans l’apport quantitatif en principe actif, essentiel pour les molécules à marge thérapeutique étroite comme la lévothyroxine.
La nouvelle formule de LEVOTHYROX, dispensée en France depuis 2017 a fait l’objet de nombreux contrôles dans les laboratoires de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) qui a confirmé sa qualité après avoir conduit quatre études scientifiques. Par ailleurs, cette nouvelle formule a été évaluée et autorisée par les autorités sanitaires de plus de 100 pays dans le monde. Ne serait-ce qu’en Europe, ce sont 18 millions de patients qui voient leur équilibre thyroïdien maintenu quotidiennement par la nouvelle formule de LEVOTHYROX.
Les enquêtes nationales de pharmacovigilance et l’étude de pharmacoépidémiologie (plus de 2 millions de patients inclus dans cette étude) menées à l’initiative de l’ANSM ne mettent pas en évidence d’augmentation de problèmes de santé graves (décès, hospitalisation, arrêts de travail d’au moins 7 jours) en lien avec la prise de LEVOTHYROX nouvelle formule ce qui est confirmé par l’ensemble des autorités sanitaires des pays dans lesquels la nouvelle formule est commercialisée.
Les deux formules de LEVOTHYROX (ancienne et nouvelle) contiennent des quantités différentes d’amidon de maïs (en quantité moindre dans la nouvelle formule). Les quantités de phospholipides issues de la dégradation de cet excipient, pour chacune des deux formules, sont très faibles et extrêmement éloignées l’une comme l’autre des quantités de phospholipides capables de venir modifier une biodisponibilité. Si bien que cette différence de contenu en amidon de maïs entre les deux formules est incapable de se traduire par une quelconque modification de ce paramètre pharmacocinétique. Ce qui est démontré par les résultats de l’étude de bioéquivalence.
Merck rappelle que la bioéquivalence entre l’ancienne et la nouvelle formule de LEVOTHYROX a été démontrée et avalisée par les autorités sanitaires conformément aux lignes directrices en vigueur.
Il convient de rappeler, s’agissant de la taille de l’effectif d’une étude de bioéquivalence, que celle-ci n’a aucun impact sur la possibilité d’obtenir un faux positif. En effet, le contrôle de ce risque de faux positif est obtenu par la prise en compte du taux erreur – dit de type 1 – réglementairement fixé à 5 %, lequel est totalement indépendant de la taille de la population, et qui a été celui exactement appliqué pour l’étude de bioéquivalence réalisée par Merck et validée par l’ANSM.
Il convient de rappeler que les études de bioéquivalence pour les médicaments à marge thérapeutique étroite, comme les spécialités à base de lévothyroxine, sont soumises à des exigences resserrées depuis la publication par le CHMP le 20 janvier 2010 d’une méthodologie précise, méthodologie à laquelle MERCK s’est rigoureusement conformée s’agissant de l’étude de bioéquivalence réalisée entre l’ancienne et la nouvelle formule de LEVOTHYROX.
S’agissant des médicaments génériques de « Lévothyrox ancienne formule » des laboratoires Teva/Ratiopharm et Biogaran, il convient de rappeler que les études de bioéquivalence réalisées à l’époque, par ces laboratoires, étaient conformes aux spécifications en vigueur lesquelles n’avaient pas fait l’objet d’un resserrement par les autorités. Il ne peut, en conséquence, être procédé à une comparaison entre ces médicaments génériques et la nouvelle formule de LEVOTHYROX.
Il n’existe pas de « nouvelle » nouvelle formule de LEVOTHYROX (« nouvelle formule saison 2 »). En effet, la modification de l’AMM approuvée par les autorités sanitaires en 2018 concerne l’ajout d’un nouveau site de production en Espagne (FAMAR) destiné à approvisionner le marché européen, excluant la Suisse. Il ne s’agit aucunement d’une modification de la composition du médicament. Ce transfert de technologie ne remet pas en cause les spécifications du produit fini ni sa qualité, sa sécurité et son efficacité.
2. Tenaillon A, Deleuze J. Levothyrox : un cas d’école du mépris de la parole des malades. La Rev Prat 2019;69(6);583.
3. Bertagna X, Bouchard P, Grimaldi A, Wémeau JL, Young J. Levothyrox : le temps de la raison. La Rev Prat 2018;68(2):123-5 et de nombreux articles de La Revue du Praticien : https://urls.fr/5dU6Vp
4. Agence nationale de sécurité du médicament et des produits de santé. Comité technique de pharmacovigilance. Rapport CTPV Rennes. 10 octobre 2017. https://urls.fr/nDdmoy
5. Anonyme. Vos patients sous Levothyrox se sont-ils plaints depuis le changement de formule ? Sondage. Le Quotidien du Médecin, 4-8 septembre 2017.
6. Door JP. La crise du Levothyrox enfin résolue. Mission flash sur le Levothyrox. Assemblée nationale, 31 octobre 2017. https://urls.fr/NGpCaG
7. Rodien P, Caron P, Reynaud R. Point d’information sur le Lévothyrox. Société française d’endocrinologie, Société française d’endocrinologie et diabétologie pédiatrique, Groupe de recherche sur la thyroïde, 11 septembre 2017. https://urls.fr/aKd5XO
8. Bertagna X, Bouchard P, Grimaldi A, Wemeau JL, Young J. Il faudra avoir une expertise sociologique de cette invraisemblable crise. Tribune, Le Monde, 28 décembre 2017. https://urls.fr/XbzjkS
9. Bergmann JF. Affaire du Levothyrox. L’analyse du Pr Jean-François Bergmann. Pharmacologie-Fréquence médicale, 27 novembre 2017. https://urls.fr/kqXWQ-
10. Agence nationale de sécurité des médicaments et des produits de santé. Réunion du Comité technique de pharmacovigilance – CT012017093, 10 octobre 2017. https://urls.fr/jMAPc2
11. Kierkzek G, Léo M. Rapport sur l’amélioration de l’information des usagers et des professionnels du médicament. Ministère de la Santé, 3 septembre 2018. https://urls.fr/jI_nMP
12. Guillet J. Notes de séance de l’Association française des malades de la thyroïde (AFMT) [non publié]. 16 octobre 2017.
13. Chow SC. Bioavailability and bioequivalence in drug development. Wiley Interdiscip Rev Comput Stat 2014;6(4):304–12. https://urls.fr/6EU3Jo
14. Agence française de sécurité sanitaire des produits de santé. Comité régional de pharmacovigilance de Rennes, enquête officielle relative aux risques liés à la substitution entre deux spécialités à base de lévothyroxine, In : Commission nationale de pharmacovigilance, 27 mars 2012. https://urls.fr/mUc8wD
15. Guillet J. Crise du Levothyrox. La science comme juge de paix ? Autorités et AFMT. Prémices. Association française des malades de la thyroïde et LinkedIn, 2 octobre 2019. https://urls.fr/hzLSMP
16. Duperray F. Contrôle des différents lots de la nouvelle formule de Levothyrox sur des lots identifiés par l’AFMT. In: ANSM, Direction des contrôles. Note de synthèse 18-A-0412, 14 décembre 2018. https://urls.fr/bSh1m0
17. Duperray F. Recherche de dextrothyroxine dans les spécialités Levothyrox et Euthyrox, comprimés sécables. In : ANSM. Direction des contrôles. Note de synthèse 18-A-0389, 5 juillet 2018.
18. Fiche d’information. Pharmacopée européenne, EDQM, Council of Europe2023 ; vol. 11.0. https://urls.fr/cH0Xa7
19. Guillet J. La question-clé de la crise sanitaire du Levothyrox. Appel à la rigueur scientifique. Communication Réseau environnement Santé, 13 juin 2019.
20. Société française d’endocrinologie. Proposition d’étude comparative Levothyrox AF/NF In : Direction générale de la santé. Comité de suivi #3. Point 4 : point d’information sur les études en cours de programmation, 6 février 2018.
21. Gorius A. Levothyrox : le CNRS cultive le secret autour de la nouvelle formule. Les Jours. 2018, épisode 16. https://urls.fr/b4gijc
22. Concordet D, Gandia P, Montastruc JL, et al. Why were more than 200 subjects required to demonstrate the bioequivalence of a new formulation of levothyroxine with an old one? Clin Pharmacokinet 2020;59:1–5.
23. Lechat P. Potentiel impact thérapeutique de la substitution en cours de traitement d’un princeps par un générique : limites de la bioéquivalence moyenne pour les médicaments à marge thérapeutique étroite. Bull Acad Nat Med 2023;207:490-500. https://urls.fr/wLFSqh
24. Meyer D. AFP. Levothyrox : Biogaran pourrait relancer un générique d'ici fin 2017. Sciences et avenir, 20 septembre 2017. https://urls.fr/vgn9ae
25. Thibert C. Levothyrox : nouvelle polémique sur la composition du médicament. Le Figaro, 5 octobre 2018. https://urls.fr/ql_UqM
26. Lafossas C, Benoit-Marquié F, Garrigues JC. Analysis of the retention of tetracyclines on reversed-phase columns: Chemometrics, design of experiments and quantitative structure-propertyrelationship (QSPR) study for interpretation and optimization. Talanta 2019;198:550-9.
27. Seraissol P, Lanot T, Baklouti S,et al. Evaluation of 4 quantification methods for monitoring 16 antibiotics and 1 beta-lactamase inhibitor in human serum by high-performance liquid chromatography with tandem mass spectrometry detection. J Pharm Biomed Anal 2022 ;219 : 114900.
28. Comité de suivi des médicaments à base de levothyroxine (6e réunion), 2 juillet 2019. https://urls.fr/MJLNF3
29. Mereo F. Levothyrox : au ministère de la Santé, études contre études, 2 juillet 2019. https://urls.fr/zj7nIe
30. Plachká K, Pilařová V, Gazárková TÁ, et al. AI-enhanced understanding of retention interactions in supercritical fluid chromatography: Neural network insights into retention on selected non-polar stationary phases. Anal Chem 2025. Epub ahead of print.
31. Plachká K. Pilařová V. Gazárková T, et al. Advancing fundamental understanding of retention interactions in supercritical fluid chromatography using artificial neural networks: Polar stationary phases with –OH moieties. Anal Chem 2024;6;96(31):12748-59.
32. Pilařováa V, Plachkáa K, Gazárkováa T, et al. Using artificial neural networks to elucidate retention interactions on stationary phases with amine moieties dedicated to supercritical fluid chromatography. Separation and Purification Technology 2025;356(B):129965.
33. Chmelařová H, Catapano MC, Garrigues JC, et al. Advancing drug safety and mitigating health concerns: High-resolution mass spectrometry in the levothyroxine case study. Journal of Pharmaceutical Analysis 2024;14(9):100970.
34. Guillet C. La crise du Levothyrox. Partie 1. https://urls.fr/WscZ7E

 Encadrés
Encadrés