Argumenter la démarche médicale et expliquer les principes de l’assistance médicale à la procréation.
Préservation de la fertilité féminine et masculine, de l’enfant à l’adulte.
Définition de l’assistance médicale à la procréation (anciennement appelée procréation médicalement assistée)
L’assistance médicale à la procréation (AMP) est destinée à répondre à un projet parental. En France, depuis juillet 1994, l’assistance médicale à la procréation est encadrée par les lois de bioéthique, qui sont révisées régulièrement en fonction des avancées scientifiques et sociétales. Ces pratiques font appel à des cliniciens et biologistes compétents, exerçant dans des établissements de santé autorisés. Depuis la loi du 2 août 2021 relative à la bioéthique, tout couple formé d’un homme et d’une femme ou de deux femmes, ou toute femme « non mariée » a accès à l’assistance médicale à la procréation. Avant cette date, seuls les couples composés d’un homme et d’une femme pouvaient bénéficier d’une AMP.
Près d’un couple sur quatre, en France, consulte pour une difficulté à concevoir. Un certain nombre de ces couples relèvent d’une prise en charge en AMP.
L’assistance médicale à la procréation regroupe les pratiques cliniques et biologiques qui, par la manipulation des gamètes, permettent de répondre à un projet parental. Elles comprennent l’insémination artificielle et le transfert d’embryons conçus par fécondation in vitro (FIV) sans micromanipulation ou avec micromanipulation (injection intracytoplasmique de spermatozoïde [ICSI, pour intracytoplasmic sperm injection]). Ces pratiques incluent également la conservation des tissus germinaux, des gamètes et des embryons obtenus in vitro. Les inductions simples de l’ovulation, avec rapports sexuels programmés, font partie des traitements médicaux de l’infertilité du couple et sortent du champ de l’assistance médicale à la procréation. Un couple formé d’un homme et d’une femme peut avoir recours au don de gamètes dans le cadre d’une stérilité, masculine (don de sperme) ou féminine (don d’ovocyte) mais aussi à l’accueil d’embryon (en cas de stérilité mixte).
Si l’AMP permet, d’une façon générale, de remédier à une infertilité médicalement diagnostiquée, ou de répondre au projet parental d’un couple de femmes ou d’une femme « non mariée », elle peut aussi être mise en œuvre pour éviter la transmission à l’enfant ou à un membre du couple d’une maladie d’une particulière gravité (par exemple, indication génétique : recours au don de gamète ; réalisation d’un diagnostic préimplantatoire [DPI] pour ne transférer que des embryons sains ; contexte viral [VIH, hépatites B et C, Zika…]).
La prise en charge en AMP nécessite de procéder à une évaluation médicale des deux membres du couple ou de la femme « non mariée », de vérifier l’absence de contre-indication à la grossesse et de mettre en œuvre les mesures préconceptionnelles, comme chez toute femme désireuse de grossesse : prévention des maladies infectieuses (par exemple la rubéole), mesures hygiénodiététiques (diminution d’une surcharge pondérale, arrêt du tabac, de l’alcool, supplémentation vitaminique…). Ces mesures favorisent aussi l’obtention de la grossesse. Compte tenu de la diminution de chances de conception avec l’âge, au-delà de 35 ans chez la femme, il ne faut pas retarder la mise en route d’une prise en charge en assistance médicale à la procréation adaptée.
En France, en 2019, 3,6 % des enfants nés (27 180) ont été conçus par une technique d’AMP.
Préalables requis avant la réalisation d’un acte d’AMP
La réglementation française impose, pour un accès à l’assistance médicale à la procréation, que les bénéficiaires remplissent des conditions d’âge, reçoivent une information au cours d’entretiens avec des membres de l’équipe médicale clinicobiologique pluridisciplinaire du centre sur la technique proposée (chances de réussite, pénibilité, contraintes, risques…), sur l’évaluation de ces pratiques par l’Agence de la biomédecine et sur les alternatives à l’assistance médicale à la procréation (chances de conception naturelle, autres traitements [notamment chirurgicaux] et adoption). Un dossier guide est remis aux demandeurs.
Les bénéficiaires d’une AMP doivent consentir préalablement à l’insémination artificielle ou au transfert des embryons. Lorsqu’il s’agit d’un couple, tout élément remettant en cause l’existence même du couple (décès d’un membre, demande de divorce, de séparation de corps…) fait obstacle à l’insémination ou au transfert des embryons. L’assistance médicale à la procréation ne peut être mise en œuvre que si le couple ou la femme « non mariée » y a préalablement consenti par écrit, après un délai de réflexion d’au moins un mois.
Les résultats des tests de sécurité sanitaire (sérologies VIH, hépatites B et C, syphilis…) doivent être connus avant la mise en œuvre de l’AMP.
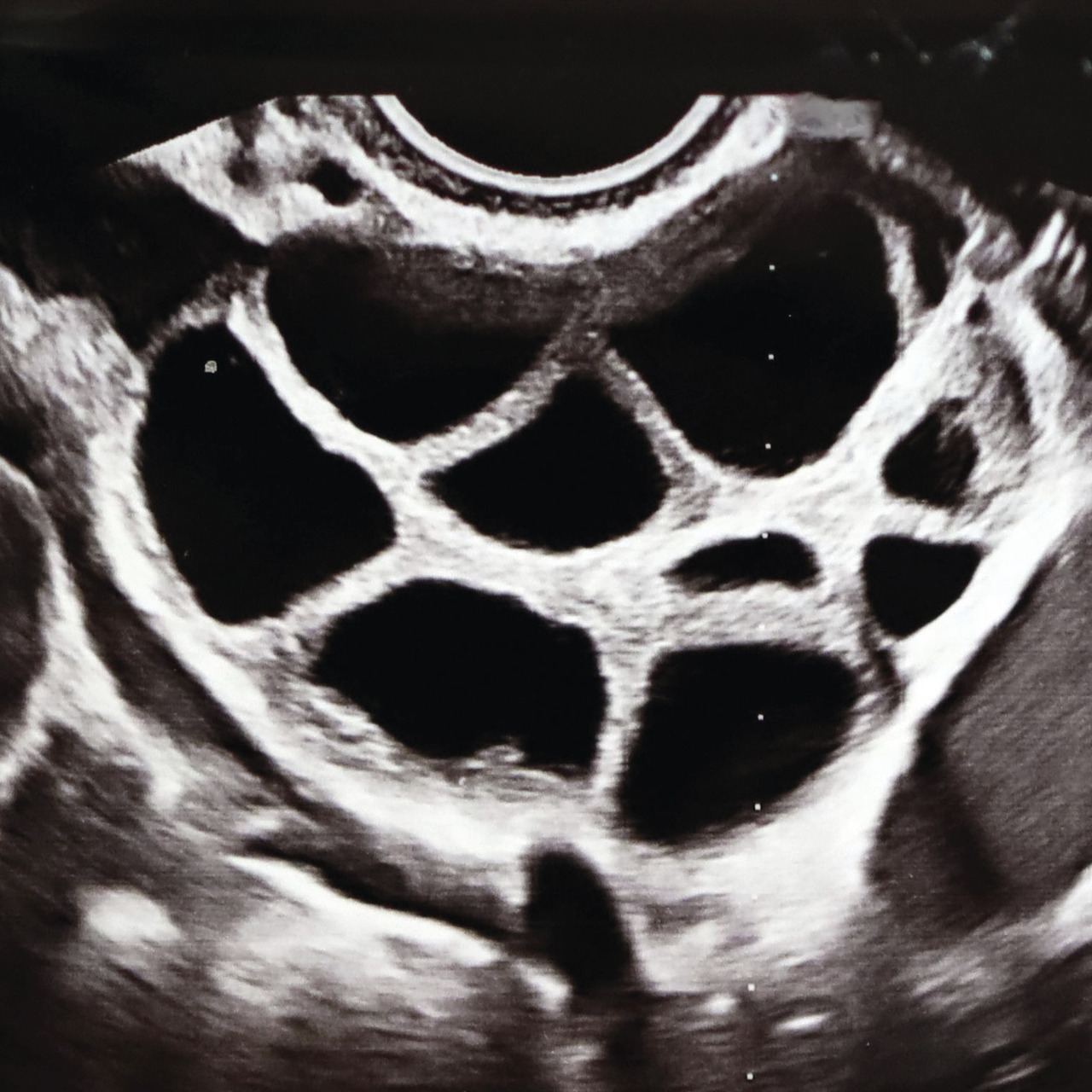
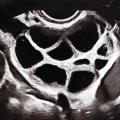
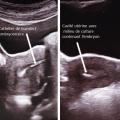
De même, l’évaluation médicale des deux membres du couple ou de la femme « non mariée » est effectuée avant la prise en charge ; elle comprend, entre autres, un bilan masculin (bilan spermologique avec test de migration-survie des spermatozoïdes [TMS]), lorsqu’il s’agit d’un couple hétérosexuel. Le bilan féminin comporte, quant à lui, une évaluation de la fonction ovarienne déterminée au préalable par un bilan hormonal et par une échographie endovaginale (avec appréciation du capital folliculaire antral correspondant au nombre de petits follicules antraux visibles au niveau des deux ovaires en début de cycle).
Enfin, un bilan psychosocial avec entretien psychologique peut être proposé ; il est systématique en cas de recours à un don de gamètes ou d’embryons.
Insémination artificielle intraconjugale
Définition
L’insémination artificielle consiste à déposer au niveau des voies génitales féminines, habituellement au niveau de la cavité utérine (insémination intra-utérine [IIU]), une préparation de spermatozoïdes afin de favoriser la rencontre des gamètes mâles et femelles. Elle s’accompagne, dans la majorité des cas, d’une stimulation ovarienne.
Préalables spécifiques
La perméabilité utéro-tubaire doit avoir été vérifiée (données de l’hystérosalpingographie ou de la cœlioscopie).
Les résultats du bilan spermologique doivent éliminer une tératozoospermie sévère, et le test de migration-survie des spermatozoïdes doit permettre de sélectionner un nombre de spermatozoïdes mobiles progressifs égal ou supérieur à un million avec une survie spermatique positive à 24 heures.
Une demande d’entente préalable doit avoir été effectuée auprès de la Caisse primaire d’assurance maladie (6 tentatives sont remboursées).
Indications des inséminations intra-utérines
Les indications sont au nombre de six :
- les causes cervicales, indications peu fréquentes, pouvant être révélées par un test post-coïtal de Hühner négatif (insuffisance ou altération de la glaire cervicale : glaire acide, conisation appuyée, par exemple) ;
- les altérations modérées du sperme, avec un test de migration-survie favorable ;
- les stérilités inexpliquées et les dysovulations, en général après échec de traitements simples d’induction/monitorage de l’ovulation ;
- les causes immunologiques (présence d’auto-anticorps antispermatozoïdes avec test de migration positif et survie favorable des spermatozoïdes) ;
- les rapports naturels non fécondants, avec troubles de l’éjaculation (par exemple, éjaculation rétrograde ou éjaculation provoquée en cas d’anéjaculation) ;
- les insémination artificielle avec donneur (IAD) ou sperme autoconservé. Parfois, ces préparations de sperme peuvent être inséminées en période préovulatoire en intracervical dans une glaire optimale (insémination intracervicale) ; elles peuvent être réalisées sans stimulation ovarienne sur cycle spontané monitoré.
Stimulation ovarienne et insémination
Le protocole de stimulation doit être adapté et permettre le développement d’un nombre limité de follicules en croissance (1 ou 2 follicules, au maximum 3) ; une stimulation mono- ou bifolliculaire permet de réduire les risques de grossesse multiple. Il fait généralement appel à des injections de gonadotrophines de type hormone folliculostimulante (FSH) à faibles doses. Un monitorage par examen échographique (endovaginal) de la croissance folliculaire et/ou des dosages hormonaux (estradiol plasmatique + hormone lutéinisante [LH]) est nécessaire. Un déclenchement programmé de l’ovulation (par injection de gonadotrophine chorionique [hCG]) permet de réaliser, trente-six heures après, l’acte d’insémination au plus près de l’ovulation. Les spermatozoïdes sélectionnés par un test de migration des spermatozoïdes sont injectés le plus rapidement possible, avec un cathéter adapté, au niveau de la cavité utérine en franchissant le col utérin, et dans un volume de préparation finale de 0,2 à 0,3 mL. Une insémination intra-utérine sur cycle spontané monitoré peut être envisagée, par exemple en cas de stérilité cervicale isolée ou de rapports sexuels naturels non fécondants, l’insémination se faisant le lendemain du pic spontané de LH.
Préparation du sperme
Le prélèvement de sperme est effectué par masturbation dans des conditions d’asepsie optimales. Après liquéfaction du sperme, une évaluation des paramètres spermatiques est réalisée (volume, mobilité, concentration, vitalité…). La technique de préparation proprement dite, validée par un test préalable de migration-survie des spermatozoïdes, a pour but de sélectionner les spermatozoïdes les plus mobiles et les plus morphologiquement normaux, tout en les isolant du plasma séminal.
Deux techniques peuvent être utilisées : la technique de centrifugation sur gradient de densité (qui favorise la sélection des spermatozoïdes mobiles ayant une tête normalement condensée et qui participe à l’élimination des éléments particulaires du sperme [cellules rondes, micro-organismes…]) et la technique de migration ascendante (qui favorise principalement la sélection des spermatozoïdes les plus mobiles).
Résultats
Les inséminations artificielles sont pratiquées régulièrement depuis près de quarante ans. Leurs résultats dépendent de la cause de l’infertilité, de l’âge de la patiente et de la qualité de la stimulation. L’évaluation faite en France (
Le principal risque des inséminations est la grossesse multiple.
Fécondation in vitro sans micromanipulation
Définition
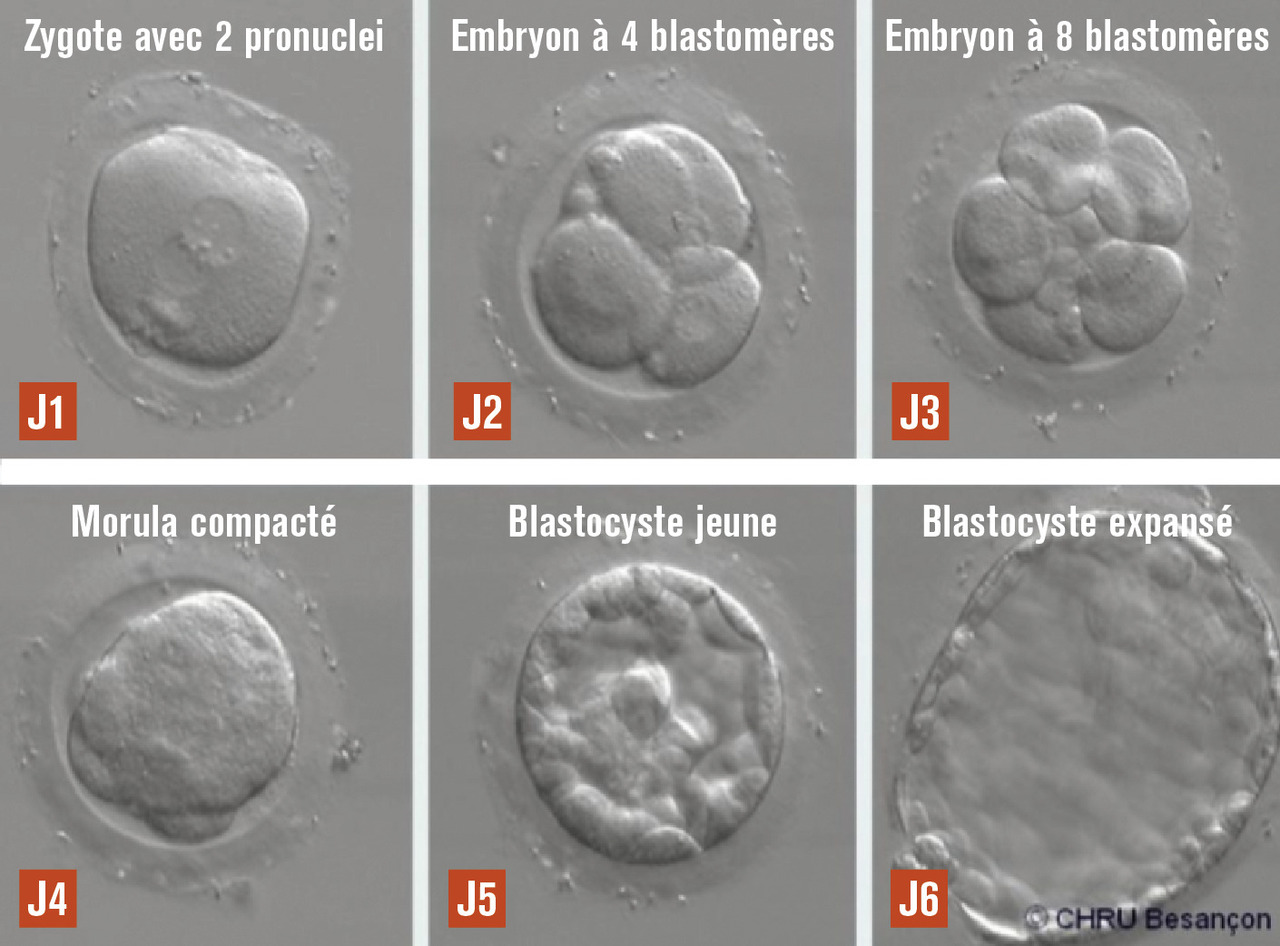
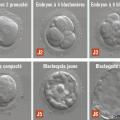
La fécondation in vitro consiste à réaliser, en extracorporel au laboratoire (in vitro), la rencontre des gamètes (spermatozoïdes et ovocytes), la fécondation et les premiers stades du développement de l’œuf fécondé en vue du transfert des embryons, au stade de la segmentation embryonnaire (J2-J3) ou au stade de blastocyste (J5-J6), dans la cavité utérine.
En 1978, Patrick C. Steptoe et Robert G. Edwards (Prix Nobel de médecine 2010) ont permis la naissance en Angleterre du premier enfant (Louise Brown) conçu par fécondation in vitro. Le premier bébé français (Amandine) est né en 1982.
Préalables spécifiques
Il faut disposer des résultats du bilan spermologique préalable avec test de migration-survie des spermatozoïdes ainsi que des résultats des tests relatifs à la sécurité sanitaire.
Les bénéficiaires doivent préalablement consentir à la congélation des embryons surnuméraires. En cas de refus, il peut être proposé une autoconservation ovocytaire, ou une stimulation ovarienne adaptée afin de réduire le nombre de follicules à ponctionner ; le nombre d’ovocytes à féconder est limité à 2 ou 3 en fonction du nombre d’embryons à transférer. Une demande d’entente préalable doit avoir été effectuée auprès de la Caisse primaire d’assurance maladie (4 tentatives sont prises en charge par les caisses d’assurance maladie).
Indications
Sept indications à la fécondation in vitro sans micromanipulation se distinguent :
- les stérilités et altérations tubaires (insuffisance fonctionnelle des trompes) [salpingite, hydrosalpinx, grossesse extra-utérine, échecs de chirurgie tubaire, ligature tubaire] ;
- les insuffisances spermatiques (oligo-, asthéno-, térato-zoospermies) modérées, où le test de migration-survie donne des résultats satisfaisants permettant d’inséminer un nombre suffisant de spermatozoïdes au voisinage de l’ovocyte ;
- les stérilités inexpliquées en première intention ou après échec d’autres traitements (inductions simples de l’ovulation, inséminations intra-utérines) ;
- les endométrioses, en première intention en l’absence de grossesse et/ou après échec des traitements médicaux et/ou chirurgicaux ;
- les anovulations et dysovulations après échec des inductions simples ou des inséminations ;
- les insuffisances ovariennes prématurées à capital folliculaire réduit mais suffisant pour l’efficacité de la technique ;
- les échecs d’insémination avec sperme de donneur.
Stimulation ovarienne et ponction folliculaire
Le protocole de stimulation vise à produire une croissance multifolliculaire en limitant le risque d’hyperstimulation ovarienne. Le type de protocole et les doses de gonadotrophines ont pour but d’assurer la croissance de plusieurs ou de la totalité des follicules recrutables de la patiente (follicules antraux > 2 mm ; 5 à 20). Ce compte folliculaire antral est apprécié par échographie endovaginale, et les chances de réponse à la stimulation sont évaluées par des dosages de FSH en début de cycle et/ou de l’hormone antimüllérienne (AMH). Les protocoles font appel à des doses élevées de gonadotrophines de type FSH, qui favorisent le processus de recrutement et la croissance folliculaire. Le monitorage est échographique (
Étapes biologiques
Elles se font au laboratoire, dans des conditions d’asepsie et en atmosphère contrôlée (température, pH, CO2). Le jour de la ponction (J0), les liquides folliculaires sont transportés au laboratoire le plus rapidement possible, et les complexes cumulo-ovocytaires (CCO) [
Parallèlement, le sperme est préparé comme pour une insémination artificielle intraconjugale.
Chaque complexe cumulo-ovocytaire est mis en présence d’un peu moins de 100 000 spermatozoïdes mobiles préparés. La fécondation s’effectue dans des incubateurs adaptés (incubateurs classiques ou de paillasse) [
Le lendemain (J1), les complexes cumulo-ovocytaires sont décoronisés (élimination mécanique des cellules folliculeuses et des cellules de la corona radiata, par mouvement de va-et-vient dans des pipettes ou tubes capillaires adaptés) afin de pouvoir visualiser les témoins de fécondation au niveau des ovocytes (
Le surlendemain (J2), si l’ovocyte a été fécondé, l’embryon est en général au stade de quatre blastomères (
Transfert embryonnaire
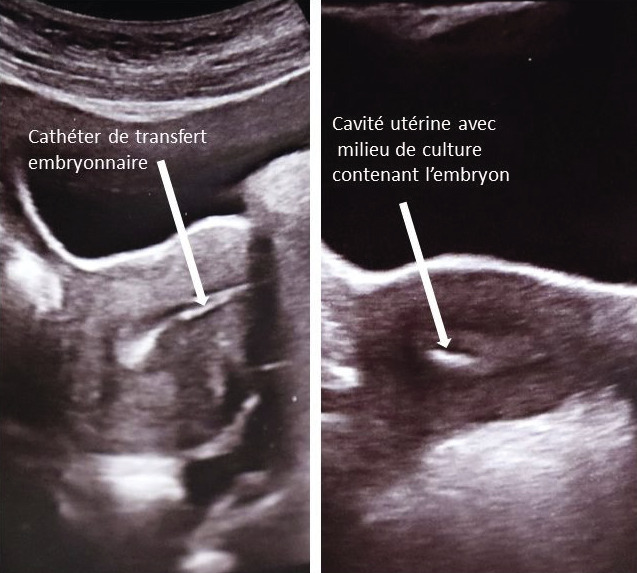
Un ou deux embryons sont transférés dans la cavité utérine à l’aide d’un cathéter de transfert adapté (
Les embryons surnuméraires, de qualité et non transférés, sont cryoconservés, en prévision d’un transfert ultérieur (transfert d’embryons congelés [TEC]), en cas d’absence de grossesse ou pour un nouveau projet parental sans avoir à réitérer les étapes initiales de la fécondation in vitro.
La congélation des embryons à longtemps été faite par la technique classique de congélation lente (
Le choix des embryons sélectionnés pour le transfert ou la cryoconservation se fait sur des critères de normalité de la fécondation (présence de 2 pronuclei), sur la présence du clivage précoce, et tient compte de critères morphologiques et de cinétique du développement embryonnaire initial (nombre et aspect des blastomères, taux de fragmentation cytoplasmique, anomalies nucléaires des blastomères…). Pour les blastocystes, les critères font intervenir l’aspect du trophectoderme, du bouton embryonnaire et du blastocèle. L’utilisation d’incubateurs de type « time lapse », permettant de suivre l’évolution morphologique des ovocytes fécondés et des embryons au cours de leur développement, facilite cette évaluation (
Résultats
Un dosage de ß-hCG plasmatique est réalisé quatorze jours après la ponction afin de rechercher une grossesse débutante (implantation embryonnaire). L’Agence de la biomédecine (
Les chances de réussite sont fonction de plusieurs paramètres :
- la réserve ovarienne (qui décroît de la période fœtale à la ménopause) ; plus elle est altérée, plus elle a un impact sur la réponse à la stimulation et sur les chances de réussite ;
- l’âge de la patiente ; plus l’âge de la femme avance, plus les chances de réussite diminuent ;
- l’origine de l’infertilité (endométriose, infertilité tubaire).
Fécondation in vitro avec micromanipulation
Définition
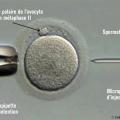
La fécondation in vitro avec micromanipulation consiste à réaliser la fécondation des ovocytes matures sur le plan méiotique (en métaphase II) en injectant un spermatozoïde directement dans le cytoplasme de l’ovocyte, en vue du transfert de l’embryon obtenu dans la cavité utérine. Cette injection de spermatozoïde, nécessitant une micromanipulation des gamètes, porte le nom anglais d’ICSI (intracytoplasmic sperm injection).
La première grossesse obtenue par ce procédé a été rapportée en 1992 par une équipe belge. Cette technique peut utiliser des spermatozoïdes éjaculés ou obtenus après prélèvement chirurgical.
Préalables spécifiques
La fécondation in vitro avec micromanipulation répondant à des indications d’insuffisances spermatiques sévères, un caryotype est prescrit chez l’homme. En cas d’azoospermie sécrétoire (dite non obstructive) ou d’oligozoospermie extrême, une recherche de microdélétions du chromosome Y est prescrite. En cas d’azoospermie excrétoire (dite obstructive) avec suspicion d’agénésie bilatérale congénitale des déférents (ABCD), une recherche des principales mutations du gène CFTR (impliqué dans la mucoviscidose) est effectuée. Une consultation de conseil génétique est nécessaire pour le couple en cas de suspicion d’une cause génétique à l’infertilité.
Comme pour la fécondation in vitro, une demande d’entente préalable doit avoir été effectuée auprès de la Caisse primaire d’assurance maladie (4 tentatives remboursées, avec ou sans micromanipulation).
Indications
La fécondation in vitro avec micromanipulation a cinq indications :
- les insuffisances spermatiques (oligo-asthéno-tératozoospermies) majeures qui ne permettent pas d’envisager des chances de fécondation par la technique classique ;
- les azoospermies (absence de spermatozoïdes dans l’éjaculat) dans lesquelles des spermatozoïdes peuvent être obtenus par une exploration chirurgicale.
On distingue deux types d’azoospermie dans cette indication :
- azoospermies sécrétoires avec une spermatogenèse complète présente au niveau de tubes séminifères (les spermatozoïdes sont prélevés par une biopsie testiculaire [TESE, pour testicular sperm extraction]) ;
- azoospermies excrétoires (obstacle au niveau des voies spermatiques) ; les spermatozoïdes sont prélevés par ponction au niveau de l’épididyme (MESA, pour microscopic epididymal sperm aspiration) ou au niveau testiculaire (TESE).
Le prélèvement chirurgical de spermatozoïdes est en général réalisé bien en amont de la tentative de fécondation in vitro avec micromanipulation ; les spermatozoïdes sont autoconservés par congélation en vue d’une utilisation différée. Plus rarement, le prélèvement de spermatozoïdes peut être réalisé en simultané, c’est-à-dire le même jour que le prélèvement ovocytaire ;
- les échecs de fécondation in vitro (ce sont des absences totales de FIV ou des paucifécondations n’ayant pas permis l’obtention d’une grossesse). Ces échecs sont en général dus à une insuffisance du pouvoir fécondant des spermatozoïdes ; il s’agit exceptionnellement de causes ovocytaires (par exemple, zones pellucides épaisses, immaturité ovocytaire) ;
- les causes immunologiques : présence d’auto-anticorps antispermatozoïdes avec test de migration des spermatozoïdes et/ou test de survie défavorables. La fécondation in vitro avec micromanipulation permet de court-circuiter le processus d’altération fonctionnelle (défaut de mobilité, anticorps immobilisants) ou physique (altérations membranaires, anticorps cytotoxiques) des spermatozoïdes secondaire à la présence des auto-anticorps ;
- le diagnostic préimplantatoire (analyse cytogénétique par hybridation in situ fluorescente ou génétique par technique PCR, d’un blastomère [une ou plusieurs cellules prélevées à partir de J3], ou du trophectoderme d’un embryon au stade blastocyste). La fécondation in vitro avec micromanipulation est réalisée afin d’augmenter les taux de fécondation et d’éviter la contamination par des spermatozoïdes du prélèvement destiné à l’analyse.
Stimulation ovarienne et ponction folliculaire
Ces étapes cliniques sont identiques à celles de la fécondation in vitro sans micromanipulation. On vise néanmoins à utiliser un protocole de stimulation ovarienne permettant de limiter la production d’ovocytes fragiles qui résisteraient moins à l’acte de micro-injection, ce qui pourrait compromettre le développement embryonnaire initial.
Étapes biologiques de la technique
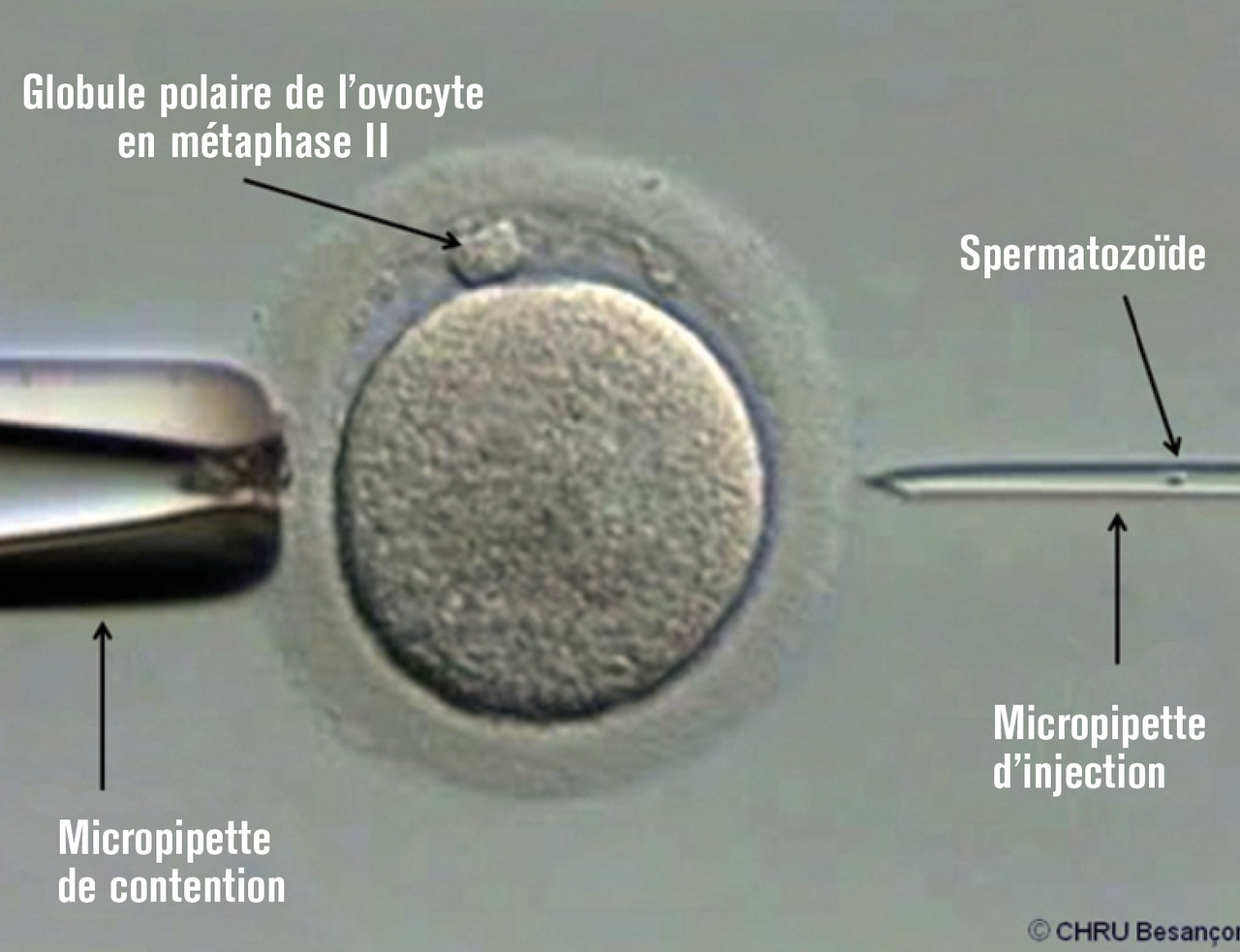
Cette technique nécessite des étapes supplémentaires par rapport à la fécondation in vitro sans micromanipulation. Avant d’injecter le spermatozoïde dans l’ovocyte, les complexes cumulo-ovocytaires sont soumis à une étape de décoronisation (dénudation) afin d’éliminer les cellules folliculaires. Cette décoronisation fait appel à une action mécanique couplée et une action enzymatique (par la hyaluronidase) ; elle permet ainsi d’observer l’ovocyte et d’apprécier son stade de maturité méiotique. Seuls les ovocytes en métaphase II présentant un globule polaire (où la vésicule germinative n’est plus visible) sont injectés.
Les spermatozoïdes sont préparés comme pour la fécondation in vitro sans micromanipulation ; la technique de centrifugation sur gradient de densité est préférée, pour son rendement et sa sélection de spermatozoïdes à tête normalement condensée. En cas d’oligozoospermie extrême, un simple lavage et une concentration du sperme sont préconisés.
Avant son injection dans le cytoplasme ovocytaire, le spermatozoïde est ralenti avec un milieu visqueux (généralement à base de polyvinylpyrrolidone [PVP]). Il est ensuite immobilisé avec la pipette de micro-injection en fragilisant son flagelle. Cette pipette de micro-injection permet d’injecter le spermatozoïde entier dans le cytoplasme ovocytaire en traversant la zone pellucide, l’espace périvitellin et la membrane plasmique ovocytaire. L’ovocyte, quant à lui, est maintenu lors de la micro-injection par une pipette de contention (
En l’absence de spermatozoïdes mobiles, donc vivants, dans la préparation (prélèvements chirurgicaux, nécrozoospermies, pathologies flagellaires…), la sélection des spermatozoïdes vivants peut se faire en stimulant leur production énergétique ou bien la perméabilité de leur membrane plasmique en milieu hypo-osmotique.
Le spermatozoïde peut être sélectionné sur un plan morphologique de façon plus précise, en éliminant les spermatozoïdes de forme anormale ou présentant des vacuoles au niveau de la tête, par la technique d’IMSI (intracytoplasmic morphologically selected sperm injection). Cette technique, qui fait appel à des grossissements optiques supérieurs souvent associés à un zoom numérique (6 000 × en IMSI versus 200 à 400 × en ICSI), augmenterait ainsi les chances de développement embryonnaire des ovocytes injectés dans ces indications.
Les autres étapes sont identiques à celles de la FIV sans micromanipulation.
Résultats
L’Agence de la biomédecine (
Complications des techniques d’assistance médicale à la procréation
Complications des stimulations ovariennes
Elles sont rares et, en général, évitables par une prise en charge adaptée :
- augmentation du risque de grossesses multiples en cas d’insémination artificielle réalisée après une stimulation ovarienne non contrôlée. À noter que les complications de la grossesse sont plus fréquentes après fécondation in vitro. Pour une insémination, afin de prévenir le risque de grossesse multiple, il est nécessaire de monitorer la stimulation ovarienne par échographie et d’annuler la tentative si plus de trois follicules ont une taille supérieure à 18 mm ;
- syndrome d’hyperstimulation ovarienne (HSO), déséquilibre hydroélectrolytique majeur, pouvant se compliquer d’accidents thrombotiques. Il peut mettre en jeu le pronostic vital par défaillance multiviscérale. Peuvent s’associer une ascite, une insuffisance rénale aiguë, une détresse respiratoire, un accident thromboembolique ;
- accidents thromboemboliques (plus fréquemment veineux et localisés au territoire cave supérieur). L’hyperestrogénie secondaire aux traitements de stimulation pouvant être responsable de troubles de l’hémostase, il est important de dépister les patientes à risque avant de prescrire une stimulation ;
- torsion d’annexe sur des ovaires augmentés de volume. Le traitement est chirurgical, il ne peut pas toujours être conservateur.
Complications des techniques de FIV
Les techniques de FIV ne sont pas dénuées de complications possibles :
- accident d’anesthésie générale ou locale ;
- accident dû à la ponction folliculaire (traumatique, hémorragique, septique…) ;
- risques inhérents aux grossesses multiples, favorisés par le transfert de deux embryons ou plus (menace d’accouchement prématuré, avortement spontané précoce ou tardif) ;
- risque augmenté de grossesse extra-utérine par passage tubaire de l’embryon après le transfert, phénomène favorisé par des pathologies utérines et tubaires ;
- augmentation des fausses couches précoces, repérées par les dosages systématiques de ß-hCG ;
- légère augmentation du risque de malformations, d’anomalies chromosomiques ou de pathologies génétiques. Elle est, d’une part, le fait du succès des tentatives de fécondation in vitro avec micromanipulation visant à traiter des stérilités masculines d’étiologie génétique connue ou encore non identifiée et, d’autre part, le fait de phénomènes épigénétiques secondaires aux conditions environnementales particulières des tentatives d’assistance de type fécondation in vitro ;
- altération de l’état psychologique (mauvais vécu de l’échec de l’assistance médicale à la procréation, après un parcours de prise en charge de l’infertilité [pouvant aussi être la cause de dysfonctions sexuelles et/ou de difficultés dans le couple]).
Congélation des gamètes en parcours d’AMP
La congélation de spermatozoïdes peut être réalisée avant la mise en œuvre d’une assistance médicale à la procréation (par exemple : prélèvements chirurgicaux de spermatozoïdes, électroéjaculations, oligozoospermies extrêmes et cryptozoospermie, où les variations de production de spermatozoïdes exposent à une absence de spermatozoïdes dans les éjaculats ou dans le prélèvement le jour de la ponction des ovocytes…). Il en est de même pour la vitrification des ovocytes réalisée au cours d’une assistance médicale à la procréation, lorsque le conjoint ne peut réaliser un prélèvement de sperme le jour de la ponction ovocytaire. Dans ces cas, la conservation est effectuée à court terme afin de disposer de gamètes pour répondre au projet parental par une technique d’assistance médicale à la procréation.
Les dons de sperme et d’embryons passent aussi obligatoirement par une étape de cryoconservation. La vitrification ovocytaire a permis d’appliquer cette étape de congélation au don d’ovocytes.
Préservation de la fertilité féminine et masculine, de l’enfant à l’adulte
La loi du 2 août 2021 autorise la préservation dite « sociétale » : une personne majeure peut bénéficier, après une prise en charge médicale par une équipe clinicobiologique pluridisciplinaire, du recueil, du prélèvement et de la conservation de ses gamètes en vue de la réalisation ultérieure, à son bénéfice, d’une assistance médicale à la procréation. Lorsqu’il s’agit de spermatozoïdes, l’intéressé peut consentir à ce qu’une partie de ses gamètes fasse l’objet d’un don.
Les préservations de la fertilité répondent principalement et avant tout à des indications d’ordre médical (
Toute personne devant recevoir un traitement présentant un risque d’altération de sa fertilité doit être informée des possibilités de conservation de gamètes ou de tissu germinal.
La congélation de gamètes (spermatozoïdes ou ovocytes), d’embryons au sein d’un couple en parcours d’AMP (les embryons ne pouvant être réutilisés que dans le projet parental de ce couple) ou de tissus germinaux (ovaire ou testicule prépubère) peut être proposée afin de préserver la fertilité d’un individu, lorsque celle-ci est susceptible d’être prématurément altérée par des traitements gonadotoxiques (radio- et/ou chimiothérapie, « castration » chirurgicale), qu’il s’agisse de traitements dans le champ du cancer ou non (par exemple, traitement conditionnant pour greffe de cellules souches hématopoïétiques pour pathologie hématologique non cancéreuse, chirurgie ovarienne, endométriose…) ou certaines pathologies (responsables d’une insuffisance ovarienne prématurée [IOP] ou d’une altération irrémédiable de la spermatogenèse [de causes génétiques, par exemple]). Dans ces cas, il s’agit d’une conservation à long terme.
Une préservation de la fertilité peut aussi être proposée dans un contexte de traitement à potentiel effet génotoxique ou mutagène, déconseillant fortement une conception, en cours ou dans les suites de son administration.
Plusieurs techniques de préservation de la fertilité peuvent parfois être mises en jeu, dans un souci d’efficacité et de meilleure intégration dans le parcours de prise en charge thérapeutique du patient.
Techniques de préservation de la fertilité chez la femme
Chez la femme en période d’activité génitale, une congélation par technique de vitrification d’ovocytes matures en métaphase II (obtenus par stimulation ovarienne, avec des protocoles voisins de ceux utilisés en technique de fécondation in vitro) peut être proposée.
Peuvent aussi être congelés des ovocytes n’ayant pas atteints le stade métaphase II, mais mis en maturation in vitro (MIV) avant ou après vitrification. Cette technique a des limites. Il faut, d’une part, un nombre suffisant d’ovocytes cryoconservés pour espérer une naissance par leur réutilisation future (le nombre moyen d’ovocytes vitrifiés doit être supérieur à 15-20) ; d’autre part, la stimulation ovarienne pour vitrification ovocytaire ne peut pas être proposée si un traitement gonadotoxique doit être immédiatement mis en œuvre ou s’il s’agit d’une pathologie hormonodépendante contre-indiquant une hyperœstrogénie. De plus, cette technique est plus difficile à proposer et à accepter en cas de virginité, notamment chez la mineure.
La congélation de cortex ovarien est une technique de préservation de la fertilité qui a l’avantage de pouvoir être proposée dans l’urgence avant la mise en route d’un traitement gonadotoxique, en cas de pathologie hormonosensible, chez la femme et chez la fillette avant la puberté. Elle permet de conserver un maximum de follicules préantraux (les seuls à résister aux étapes de congélation-décongélation). S’il est préférable de la réaliser avant tout traitement gonadotoxique, elle peut être mise en œuvre quand la réserve ovarienne est déjà diminuée (dans les pathologies responsables d’insuffisance ovarienne prématurée ou après altération de cette réserve du fait de l’âge ou de cures de traitements préalables gonadotoxiques). C’est la technique de choix en cas de traitements hautement ou définitivement gonadotoxiques (détruisant les follicules primordiaux de la réserve), comme les alkylants ou les cocktails chimiothérapiques ovariotoxiques, l’irradiation corporelle totale, l’ovariectomie… Elle nécessite un prélèvement d’ovaire (par cœlioscopie) : ovariectomie unilatérale (ou partielle ou bilatérale). Le cortex ovarien est disséqué de la médullaire, découpé en fragments de l’ordre de 0,5 cm2, congelés par technique de congélation lente ou vitrification et cryoconservés au moyen d’azote liquide.
Actuellement, la réutilisation de ce cortex se fait par technique d’autogreffe. En 2004, Jacques Donnez à obtenu, en Belgique, la naissance du premier enfant conçu par autogreffe de cortex ovarien. Le premier bébé français est, lui, né en 2009. Des fragments de cortex sont greffés sur l’ovaire restant et/ou en orthotopique (au niveau pelvien) dans une fossette péritonéale. Cette technique a l’avantage de restituer les fonctions endocrine et exocrine de l’ovaire. Mais elle peut être contre-indiquée en cas de pathologie néoplasique à risque de localisation de cellules malignes au niveau ovarien (leucémies aiguës, par exemple). Elle nécessite une qualification carcinologique du cortex préalable à sa réutilisation (recherche de maladie résiduelle). Des techniques alternatives de réutilisation du cortex ovarien cryoconservé sont à l’étude mais restent du domaine de la recherche : folliculogenèse in vitro ou ovaire artificiel (utilisation de follicules primordiaux isolés et purifiés incorporés dans des biomatrices 3D). En France, au 31 décembre 2021, 50 enfants étaient nés à la suite d’une autogreffe de cortex ovarien (données du Groupe de recherche et d’étude sur la cryoconservation de l’ovaire et du testicule [GRECOT]).
D’autres techniques peuvent être proposées en complément : la transposition ovarienne (dans des indications de radiothérapie pelvienne) ou l’utilisation d’agonistes de la GnRH pour freiner la folliculogenèse, mais cette dernière ne peut être considérée seule comme une technique de préservation de la fertilité.
Techniques de préservation de la fertilité chez l’homme
La congélation de sperme est la technique de prédilection chez l’homme. Elle doit être proposée chez l’adolescent pubère dès qu’un prélèvement de sperme par masturbation est possible. Elle doit se faire avant tout traitement gonadotoxique susceptible d’entraîner un arrêt de la spermatogenèse ou ayant un caractère génotoxique. Elle est aussi proposée avant vasectomie ou toute pathologie ou traitement pouvant entraîner un trouble non réversible de l’érection et/ou de l’éjaculation. Quand un prélèvement de sperme n’est pas possible, la conservation des gamètes peut faire appel à un prélèvement chirurgical de spermatozoïdes (au niveau testiculaire ou épididymaire et, si le centre en a la possibilité, une électro-éjaculation sous anesthésie générale peut être tentée avant l’acte chirurgical). Ce prélèvement chirurgical peut aussi être contemporain d’une castration pour tumeur testiculaire.
Chez le garçon prépubère, avant tout traitement hautement gonadotoxique susceptible d’altérer irrémédiablement la fertilité (notamment les traitements conditionnants pour allogreffe de cellules hématopoïétiques), une congélation de tissu testiculaire est proposée. Elle permet de conserver les cellules souches germinales (principalement les spermatogonies).
À ce jour, il n’y a pas de technique de réutilisation possible pour restaurer la fertilité. Les voies de recherche actuelles s’attachent à développer des techniques d’autogreffes de tissu testiculaire ou de cellules germinales, et la spermatogenèse in vitro.
En période pubertaire et en l’absence de spermatozoïdes dans le sperme, il est important de conserver des spermatozoïdes testiculaires par TESE si l’examen du tissu prélevé en révèle l’existence.
Don de gamètes et accueil d’embryons
En cas d’absence de gamètes chez l’un des membres du couple ou si ceux-ci ne peuvent permettre au couple de concevoir, on peut faire appel aux gamètes d’un tiers donneur : don de sperme (
Les couples de femmes ou les femmes « non mariées » ont recours à un don de sperme. Elles peuvent aussi accueillir un embryon.
Le don de gamètes ou d’embryons est soumis à des tests de sécurité sanitaire complémentaires, par rapport à l’assistance médicale à la procréation concernant les donneurs : sérologies HTLV1 (human T-cell lymphotropic virus type 1), HTLV2, CMV (cytomégalovirus) et recherche du risque de transmission d’une maladie infectieuse (par exemple, de type encéphalopathie subaiguë spongiforme transmissible).
Les personnes ayant recours à un don de gamètes ou d’embryons doivent obligatoirement donner leur consentement devant notaire, avant la réalisation des actes d’assistance médicale à la procréation.
Réglementation française et loi de bioéthique du 2 août 2021
La nouvelle loi relative à la bioéthique du 2 août 2021 donne accès à l’AMP pour les couples de femmes et les femmes seules « non mariées ».
Elle permet aussi, sans remettre en cause le principe de l’anonymat du don, à toute personne conçue par assistance médicale à la procréation avec tiers donneur, si elle le souhaite, d’accéder à sa majorité à l’identité et aux données non identifiantes du tiers donneur. Toute personne souhaitant procéder à un don doit consentir au préalable à la communication de ces données et de son identité. Mais aucun lien de filiation ne peut être établi entre l’auteur du don et l’enfant issu de l’assistance médicale à la procréation. Les données sont conservées par l’Agence de la biomédecine, et une commission d’accès aux données non identifiantes et de l’identité des tiers donneurs est créée. La loi prévoit que ces mesures entreront en vigueur à partir du 1er septembre 2022.
Les conditions d’âge pour bénéficier d’une assistance médicale à la procréation ont été définies par la loi : le prélèvement d’ovocytes peut être réalisé chez la femme jusqu’à son 43e anniversaire et le recueil de spermatozoïdes chez l’homme jusqu’à son 60e anniversaire. L’autoconservation des gamètes hors raison médicale est autorisée du 29e au 37e anniversaire chez la femme et du 29e au 45e anniversaire chez l’homme.
L’insémination artificielle, l’utilisation des gamètes et des tissus germinaux à des fins d’AMP, ainsi que le transfert d’embryons peuvent être réalisés jusqu’au 45e anniversaire chez la femme et 60e anniversaire chez le conjoint.
Dans l’état actuel de la législation française, l’assistance médicale à la procréation exclut l’insémination (ou le transfert) de l’embryon post-mortem ; elle n’autorise pas non plus la gestation pour autrui.
En France, le don de gamètes et l’accueil d’embryon sont encadrés par la loi de bioéthique. Le don est gratuit (seuls les frais occasionnés pour le don peuvent être pris en charge : examens médicaux, frais de transport…), anonyme et bénévole (libre et sans contrainte).
L’assistance médicale à la procréation avec tiers donneur peut être mise en œuvre lorsque les techniques d’AMP au sein du couple ne peuvent aboutir ou lorsque le couple renonce à une assistance médicale à la procréation avec les gamètes du couple, mais aussi pour les couples de femmes et les femmes « non mariées ».
L’insuffisance de donneurs est responsable d’une augmentation des délais d’attente pour les couples receveurs.
S’ils n’ont plus de projet parental ou en cas de décès de l’un d’eux, les deux membres d’un couple, ou le membre survivant, peuvent consentir à ce qu’il soit mis fin à la conservation de leurs embryons ou que leurs embryons soient accueillis par un autre couple (accueil d’embryons) ou fassent l’objet d’une recherche, ou à ce que les cellules dérivées à partir de ceux-ci soient utilisées à des fins exclusivement thérapeutiques.
POINTS FORTS À RETENIR
Près d’un couple sur quatre consulte pour infertilité, en France.
Plus de 8 millions d’enfants sont nés dans le monde à la suite d’une tentative de fécondation in vitro ± micromanipulation depuis que ces techniques existent.
L’insémination intra-utérine est une technique d’assistance médicale à la procréation simple qui doit être réservée, compte tenu des faibles chances de succès, aux indications pour lesquelles la qualité du sperme est préservée, l’infécondité de courte durée et l’âge de la femme jeune. C’est la technique de choix pour la prise en charge des couples de femmes ou des femmes « non mariées » qui ne présentent pas un degré d’infécondité compromettant la réussite de cette technique.
La fécondation in vitro est une technique d’assistance médicale à la procréation efficace pour laquelle la stimulation ovarienne doit être contrôlée, afin d’éviter les complications de type hyperstimulation ovarienne et la production d’un nombre élevé d’embryons surnuméraires. Le nombre d’embryon(s) transféré(s) doit, autant que faire se peut, être égal à 1 ou limité à 2, afin de diminuer le risque de grossesse gémellaire.
La fécondation in vitro avec micromanipulation répond aux indications masculines et permet d’obtenir des grossesses dans le cas où il y a très peu de spermatozoïdes disponibles.
Il faut plus de 1 million de spermatozoïdes mobiles sélectionnés par un test de migration des spermatozoïdes pour une insémination intra-utérine. Ce nombre passe à moins de 100 000 pour l’insémination en fécondation in vitro (mais, attention, ce nombre doit être révisé en fonction des paramètres spermatiques initiaux, car une diminution du nombre de spermatozoïdes fécondants dans la préparation expose à une paucifécondation ou à un échec de fécondation). Un seul spermatozoïde de qualité est nécessaire pour féconder un ovocyte en micromanipulation.
Les taux de naissance sont en moyenne, selon les données de l’Agence de la biomédecine, d’un peu plus de 10 % en insémination intra-utérine, et de 18 à 20 % en technique de type fécondation in vitro.
L’accès aux techniques d’assistance médicale à la procréation et leur réalisation sont réglementés en France par les lois de bioéthique et des guides de bonnes pratiques cliniques et biologiques.
Dans cet article
- Définition de l’assistance médicale à la procréation (anciennement appelée procréation médicalement assistée)
- Préalables requis avant la réalisation d’un acte d’AMP
- Insémination artificielle intraconjugale
- Fécondation in vitro sans micromanipulation
- Fécondation in vitro avec micromanipulation
- Complications des techniques d’assistance médicale à la procréation
- Congélation des gamètes en parcours d’AMP
- Préservation de la fertilité féminine et masculine, de l’enfant à l’adulte
- Don de gamètes et accueil d’embryons
- Réglementation française et loi de bioéthique du 2 août 2021

 Encadrés
Encadrés