Les arthrites juvéniles idiopathiques (AJI) peu-vent être scindées en deux principaux groupes, les formes systémiques considérées comme des maladies auto-inflammatoires (voir « Forme systémique d’arthrite juvénile idiopathique. Maladie de Still à début pédiatrique », page 1076 ) et les formes rhumatologiques non systémiques.
La prévalence des AJI en Europe et en Amérique du Nord est relativement stable et varie entre 16 et 150/100 000 enfants.1 En France, on estime à 5 000 le nombre d’enfants âgés de moins de 16 ans atteints d’AJI.
Les formes non systémiques, qui constituent la large majorité des AJI, sont définies par la présence d’une arthrite évoluant sur une durée d’au moins six semaines, avec une maladie débutant avant l’âge de 16 ans, sans autre cause identifiée.
Il s’agit d’une maladie de bon pronostic global, dont la prise en charge pluridisciplinaire repose sur les recommandations du Plan national de diagnostic et de soins (PNDS) 2023.2
Au cours des dernières décennies, de nombreux progrès thérapeutiques ont considérablement réduit la morbidité. Malgré cela, plus de la moitié des enfants continuent d’avoir une maladie active à l’âge adulte. Le rôle du médecin traitant (pédiatre ou généraliste) est essentiel pour accompagner la prise en charge globale, en lien avec le pédiatre rhumatologue, les autres acteurs de santé, les parents, les acteurs socioéducatifs. Il doit s’assurer de l’observance, de l’efficacité et de la tolérance du traitement, de la gestion du risque infectieux (mise à jour du calendrier vaccinal, prise en charge en première ligne des épisodes fébriles), sachant que beaucoup de ces patients sont sous traitements immunomodulateurs.
La prévalence des AJI en Europe et en Amérique du Nord est relativement stable et varie entre 16 et 150/100 000 enfants.1 En France, on estime à 5 000 le nombre d’enfants âgés de moins de 16 ans atteints d’AJI.
Les formes non systémiques, qui constituent la large majorité des AJI, sont définies par la présence d’une arthrite évoluant sur une durée d’au moins six semaines, avec une maladie débutant avant l’âge de 16 ans, sans autre cause identifiée.
Il s’agit d’une maladie de bon pronostic global, dont la prise en charge pluridisciplinaire repose sur les recommandations du Plan national de diagnostic et de soins (PNDS) 2023.2
Au cours des dernières décennies, de nombreux progrès thérapeutiques ont considérablement réduit la morbidité. Malgré cela, plus de la moitié des enfants continuent d’avoir une maladie active à l’âge adulte. Le rôle du médecin traitant (pédiatre ou généraliste) est essentiel pour accompagner la prise en charge globale, en lien avec le pédiatre rhumatologue, les autres acteurs de santé, les parents, les acteurs socioéducatifs. Il doit s’assurer de l’observance, de l’efficacité et de la tolérance du traitement, de la gestion du risque infectieux (mise à jour du calendrier vaccinal, prise en charge en première ligne des épisodes fébriles), sachant que beaucoup de ces patients sont sous traitements immunomodulateurs.
Identification de la pathologie
Le tableau clinique inaugural est classiquement un gonflement articulaire ou une gêne articulaire d’horaire inflammatoire (le matin et dans la deuxième partie de la nuit), une lombalgie ou une atteinte inflammatoire des insertions tendineuses (enthésites, talalgie ou fessalgie).
Les arthrites observées tardivement peuvent se compliquer de raideurs (en flexion) et d’une amyotrophie.
L’évaluation clinique est primordiale : toutes les articulations doivent être examinées, y compris les articulations temporomandibulaires,3 et les enthèses doivent être palpées, principalement au niveau des membres inférieurs.
Il existe une prédominance féminine pour les deux formes : oligoarticulaire et polyarticulaire.4 Lorsque la maladie débute avant l’âge de 6 ans, particulièrement chez les très jeunes enfants et en présence d’anticorps antinucléaires (AAN), il existe un risque d’uvéite chronique. Un examen ophtalmologique avec lampe à fente, à la recherche d’une uvéite antérieure, est indispensable. Il doit être effectué rapidement après le diagnostic, puis régulièrement (tous les trois mois) au cours des cinq premières années d’évolution.
Les arthrites observées tardivement peuvent se compliquer de raideurs (en flexion) et d’une amyotrophie.
L’évaluation clinique est primordiale : toutes les articulations doivent être examinées, y compris les articulations temporomandibulaires,3 et les enthèses doivent être palpées, principalement au niveau des membres inférieurs.
Il existe une prédominance féminine pour les deux formes : oligoarticulaire et polyarticulaire.4 Lorsque la maladie débute avant l’âge de 6 ans, particulièrement chez les très jeunes enfants et en présence d’anticorps antinucléaires (AAN), il existe un risque d’uvéite chronique. Un examen ophtalmologique avec lampe à fente, à la recherche d’une uvéite antérieure, est indispensable. Il doit être effectué rapidement après le diagnostic, puis régulièrement (tous les trois mois) au cours des cinq premières années d’évolution.
Éliminer les diagnostics différentiels
Les principaux diagnostics différentiels à éliminer au début de la maladie en tenant compte du tableau clinique sont relatifs à un agent infectieux (rhumatisme articulaire aigu dans les zones d’endémie, borréliose de Lyme, rickettsioses, mycobactéries, bartonellose, brucellose, salmonellose, viroses), à une hémopathie maligne, à une atteinte articulaire d’une maladie inflammatoire du tube digestif, à une maladie auto-immune (lupus systémique et autres connectivites) ou à une vascularite.5,6
Bilan biologique adapté selon le sous-type
Le bilan biologique initial recommandé dépend de la présentation clinique et du sous-type d’AJI suspecté (tableau 1 ). Il comporte systématiquement les examens suivants : hémogramme, protéine C-réactive (CRP), créatininémie, transaminases, bandelette urinaire, recherche d’AAN (associés à un risque élevé de survenue d’uvéite).
Formes polyarticulaires
Pour les formes polyarticulaires, il est recommandé d’effectuer initialement des radiographies ou échographies des articulations atteintes cliniquement. En cas d’atteinte symétrique et/ou des petites articulations, un dosage du facteur rhumatoïde (FR) et des anticorps anti-CCP peut se justifier, mais ne doit pas être systématiquement effectué dans les autres cas. De même, la recherche de l’antigène HLA-B27 ne doit être effectuée qu’en cas de suspicion clinique de spondyloarthropathie.Formes oligoarticulaires
Dans les formes oligoarticulaires, les radiographies initiales ne sont pas nécessaires (sauf en cas de doute sur un diagnostic différentiel). Un examen ophtalmologique à la lampe à fente est indispensable rapidement, surtout dans les formes du jeune enfant afin de dépister une uvéite à œil blanc asymptomatique. Dans les formes d’AJI liée aux enthésites, il faut privilégier l’imagerie par résonance magnétique (IRM) pour explorer l’atteinte axiale (rachis, bassin). L’examen de la courbe de croissance staturopondérale est important pour la recherche d’une atteinte digestive associée.Classification des AJI en sept sous-groupes
La classification internationale (ILAR 2001)7 délimite sept sous-groupes :
- la forme systémique (de 4 à 15 % des cas) ;
- les oligoarthrites (de 30 à 56 % des cas) ;
- les polyarthrites sans facteur rhumatoïde (de 11 à 28 %) ;
- les polyarthrites avec facteur rhumatoïde (de 2 à 7 %) ;
- les AJI liées aux enthésites (de 3 à 11 %) ;
- les AJI associées au psoriasis (de 2 à 11 %) ;
- les AJI indifférenciées (ne remplissant pas les critères d’une catégorie ou remplissant les critères de plusieurs catégories).
- la forme systémique, pour laquelle un diagnostic présomptif pourrait de surcroît être porté plus précocement, dès deux semaines d’évolution, et même en l’absence d’arthrite ;
- les oligo- et polyarthrites de début précoce (avant l’âge de 6 ans) avec AAN ;
- les polyarthrites avec FR et/ou anticorps antipeptides cycliques citrullinés (anti-CCP) ;
- les enthésites en rapport avec une AJI/spondylarthropathies juvéniles ;
- les AJI indifférenciées, pour toutes les autres AJI.
Formes oligoarticulaires
Elles représentent environ la moitié des AJI et sont une pathologie spécifiquement pédiatrique caractérisée par une atteinte articulaire asymétrique, touchant principalement les membres inférieurs, avec un début précoce (avant l’âge de 6 ans), une prédominance féminine (80 %) et un risque de survenue d’uvéite à œil blanc.9 Les grosses articulations, telles que les genoux ou les chevilles, sont le plus souvent touchées. La fièvre est absente ou modérée et transitoire.
Il s’agit d’une atteinte de quatre articulations au maximum au cours des six premiers mois d’évolution. Après six mois d’évolution, on distingue la forme oligoarticulaire persistante si un maximum de quatre articulations sont atteintes et la forme oligoarticulaire étendue si plus de cinq articulations sont touchées. Jusqu’à 50 % des enfants développent une forme oligoarticulaire étendue. L’atteinte des poignets et des mains peut être un facteur de risque d’évolution vers la forme polyarticulaire. Cette forme est associée à un haut risque d’uvéite antérieure chronique d’évolution insidieuse, sans signe d’appel clinique évident (appelé parfois « uvéite à œil blanc », sans rougeur ou douleur oculaire), surtout, mais pas exclusivement, en cas de présence d’AAN.10 Elle n’est diagnostiquée que par un examen systématique à la lampe à fente, à effectuer au moment du diagnostic, puis tous les trois mois pendant les cinq premières années d’évolution de la maladie. Cette uvéite peut survenir dans environ 20 à 30 % des cas et représente une réelle particularité pédiatrique. L’uvéite peut être responsable d’une morbidité oculaire importante, notamment d’une cécité définitive, en l’absence de dépistage précoce et de traitement approprié.11,12
En cas de monoarthrite récente, associée à de la fièvre et/ou une biologie inflammatoire, une ponction articulaire à visée bactériologique et une hémoculture doivent être effectuées en urgence pour éliminer une arthrite septique, et un prélèvement de toute porte d’entrée infectieuse éventuelle doit être réalisé.
Il s’agit d’une atteinte de quatre articulations au maximum au cours des six premiers mois d’évolution. Après six mois d’évolution, on distingue la forme oligoarticulaire persistante si un maximum de quatre articulations sont atteintes et la forme oligoarticulaire étendue si plus de cinq articulations sont touchées. Jusqu’à 50 % des enfants développent une forme oligoarticulaire étendue. L’atteinte des poignets et des mains peut être un facteur de risque d’évolution vers la forme polyarticulaire. Cette forme est associée à un haut risque d’uvéite antérieure chronique d’évolution insidieuse, sans signe d’appel clinique évident (appelé parfois « uvéite à œil blanc », sans rougeur ou douleur oculaire), surtout, mais pas exclusivement, en cas de présence d’AAN.10 Elle n’est diagnostiquée que par un examen systématique à la lampe à fente, à effectuer au moment du diagnostic, puis tous les trois mois pendant les cinq premières années d’évolution de la maladie. Cette uvéite peut survenir dans environ 20 à 30 % des cas et représente une réelle particularité pédiatrique. L’uvéite peut être responsable d’une morbidité oculaire importante, notamment d’une cécité définitive, en l’absence de dépistage précoce et de traitement approprié.11,12
En cas de monoarthrite récente, associée à de la fièvre et/ou une biologie inflammatoire, une ponction articulaire à visée bactériologique et une hémoculture doivent être effectuées en urgence pour éliminer une arthrite septique, et un prélèvement de toute porte d’entrée infectieuse éventuelle doit être réalisé.
Forme polyarticulaire sans FR ni anti-CCP
Il s’agit de polyarthrites se manifestant par l’atteinte de cinq articulations ou plus, lors des six premiers mois d’évolution. L’âge de début est variable et une prédominance féminine est retrouvée. Ce groupe hétérogène représente 20 % des AJI et comporte deux phénotypes différents :
- une atteinte articulaire symétrique et à prédominance distale sans facteurs antinucléaires (FAN) ressemblant aux polyarthrites rhumatoïdes séronégatives de l’adulte ;
- une atteinte asymétrique touchant plutôt les grosses articulations avec présence de FAN qui ressemble aux oligoarthrites extensives, avec également un risque d’uvéite antérieure.
Forme polyarthrite avec FR et/ou anti-CCP positifs
Les polyarthrites avec FR et/ou anti-CCP positifs peuvent correspondre à d’authentiques polyarthrites rhumatoïdes de début précoce, avec une atteinte articulaire bilatérale et symétrique, de début tardif (à un âge supérieur à 10 ans) chez une fille (70 %). Cette forme est rare chez l’enfant et représente environ 5 % des AJI avec une évolution plus agressive. L’atteinte articulaire est symétrique, distale, surtout des poignets, métacarpo-phalangiennes et interphalangiennes proximales. Des symptômes extra-articulaires sont aussi possibles, tels que des nodules rhumatoïdes ou d’exceptionnelles atteintes pulmonaires à type de pneumopathie interstitielle diffuse. Une polyarthrite du jeune enfant avec FR et/ou anti-CCP doit faire rechercher une maladie monogénique sous-jacente et, en premier lieu, une interféronopathie monogénique (syndromes SAVI, COPA notamment).
AJI associée aux enthésites/spondylarthropathies juvéniles
Elles concernent surtout les garçons (ratio : 7/1) et débutent vers l’âge de 10 ans par des arthrites souvent asymétriques des membres inférieurs. L’atteinte articulaire est classiquement limitée à quatre articulations, avec une prédominance aux membres inférieurs. Cette forme ressemble fortement aux spondylarthropathies de l’adulte, avec une particularité clinique : la fréquence des arthrites périphériques et des enthésites (plantaires et du tendon d’Achille : 50 %) et la rareté de l’atteinte axiale initiale (rachis ou sacro-iliaque).13 Certaines localisations sont particulièrement évocatrices, comme l’arthrite du gros orteil ou la présence de doigts « en saucisses ».
Au cours de l’évolution, une sacro-iléite ou une coxite radiologique peut apparaître dans 20 % des cas14 (bilatérale dans la moitié des cas), une IRM ciblée doit donc être systématiquement proposée en cas de douleur rachidienne ou du bassin.
Un examen clinique complet recherchant des signes cutanés, digestifs et évaluant la courbe de croissance staturopondérale est primordial afin de ne pas méconnaître une maladie inflammatoire chronique de l’intestin (MICI).
La recherche de l’antigène HLA-B27 peut être proposée et est retrouvée dans environ 70 % des cas.
Une uvéite douloureuse « à œil rouge » peut survenir au début ou durant l’évolution de la maladie (de 10 à 15 % des cas). L’examen ophtalmologique n’est ici pas systématique, mais doit être réalisé en cas de symptômes bruyants : œil rouge et douloureux.
Au cours de l’évolution, une sacro-iléite ou une coxite radiologique peut apparaître dans 20 % des cas14 (bilatérale dans la moitié des cas), une IRM ciblée doit donc être systématiquement proposée en cas de douleur rachidienne ou du bassin.
Un examen clinique complet recherchant des signes cutanés, digestifs et évaluant la courbe de croissance staturopondérale est primordial afin de ne pas méconnaître une maladie inflammatoire chronique de l’intestin (MICI).
La recherche de l’antigène HLA-B27 peut être proposée et est retrouvée dans environ 70 % des cas.
Une uvéite douloureuse « à œil rouge » peut survenir au début ou durant l’évolution de la maladie (de 10 à 15 % des cas). L’examen ophtalmologique n’est ici pas systématique, mais doit être réalisé en cas de symptômes bruyants : œil rouge et douloureux.
AJI associée au psoriasis
Elle est définie par une arthrite et du psoriasis ou une arthrite avec au moins deux des trois critères suivants : dactylite, ongles ponctués/onycholyse, psoriasis chez un parent. L’arthrite est souvent une oligoarthrite au diagnostic. L’atteinte polyarticulaire est asymétrique, avec une prédilection pour les interphalangiennes distales. Les particularités cliniques regroupent aussi l’atteinte unguéale, des dactylites et des enthésites. Il faut chercher attentivement du psoriasis sur les ongles, le cuir chevelu, les oreilles, l’ombilic. Le psoriasis est présent chez seulement 10 % des enfants au diagnostic et chez 25 % dans les deux ans après le diagnostic.15
La maladie persiste à l’âge adulte dans plus de la moitié des cas. La nouvelle classification des AJI propose de ne plus individualiser cette forme d’AJI devant une hétérogénéité du groupe avec un sous-groupe à prédominance féminine, à début précoce, souvent associée à la présence de FAN et parfois compliquée d’uvéite (proche des AJI oligoarticulaires), et un groupe à début plus tardif, à prédominance masculine, proche des arthrites avec enthésites.
La maladie persiste à l’âge adulte dans plus de la moitié des cas. La nouvelle classification des AJI propose de ne plus individualiser cette forme d’AJI devant une hétérogénéité du groupe avec un sous-groupe à prédominance féminine, à début précoce, souvent associée à la présence de FAN et parfois compliquée d’uvéite (proche des AJI oligoarticulaires), et un groupe à début plus tardif, à prédominance masculine, proche des arthrites avec enthésites.
Particularités sur le plan ophtalmologique
La survenue d’une uvéite torpide est l’une des complications les plus redoutables de l’AJI. Elle peut précéder le diagnostic articulaire dans 10 % des cas. La fréquence de survenue des uvéites varie de 10 à 30 % suivant les séries et concerne surtout les formes oligoarticulaires à FAN+ des filles commençant avant l’âge de 6 ans. L’uvéite est le plus souvent bilatérale, chronique et insidieuse ; elle ne peut donc être diagnostiquée que par un examen systématique à la lampe à fente au diagnostic, puis tous les trois mois pendant les cinq premières années d’évolution de la maladie. L’atteinte observée est souvent antérieure, le plus souvent chronique ou aiguë récidivante. L’atteinte peut être bilatérale d’emblée ou le devenir dans 70 à 80 % des cas. Il faut se référer au PNDS sur les uvéites chroniques non infectieuses de l’enfant et de l’adulte pour la prise en charge de cette complication.16 Après cette période de dépistage systématique, un examen ophtalmologique annuel est recommandé et un autodépistage peut être proposé à domicile au patient âgé de plus de 10 ans par un test de vision monoculaire de façon régulière.
Prise en charge thérapeutique
La prise en charge thérapeutique des AJI est multidisciplinaire. Elle est coordonnée par un médecin hospitalier d’un centre de référence ou de compétences en rhumatologie pédiatrique (https://www.fai2r.org/les-centres-fai2r/) en lien avec le médecin traitant, avec le concours d’au-tres spécialistes en fonction du tableau clinique et d’éventuelles comorbidités : orthopédiste pédiatre, ophtalmologiste, radiologue (si possible radiologue pédiatre), rhumatologue ou interniste adulte, médecin de médecine physique et de réadaptation, stomatologue, orthodontiste, cardiologue pédiatrique, médecin algologue, néphrologue pédiatre, endocrinologue pédiatre, gastroentérologue pédiatre, pneumopédiatre, réanimateur pédiatre, pédopsychiatre... Lorsque la situation clinique le justifie peuvent également intervenir : kinésithérapeute, ergothérapeute, infirmier, diététicien, psychologue, médecin scolaire ainsi que des travailleurs sociaux (assistant social, aide scolaire pour soutien à domicile ou dans l’établissement, auxiliaire de vie).
La prise en charge thérapeutique repose sur une stratégie « treat-to-target » consistant à se fixer des objectifs en fonction des différents stades de la maladie et à évaluer régulièrement la situation du patient pour adapter les traitements en vue de maîtriser l’inflammation et de limiter les complications de la maladie avec la plus faible toxicité possible.
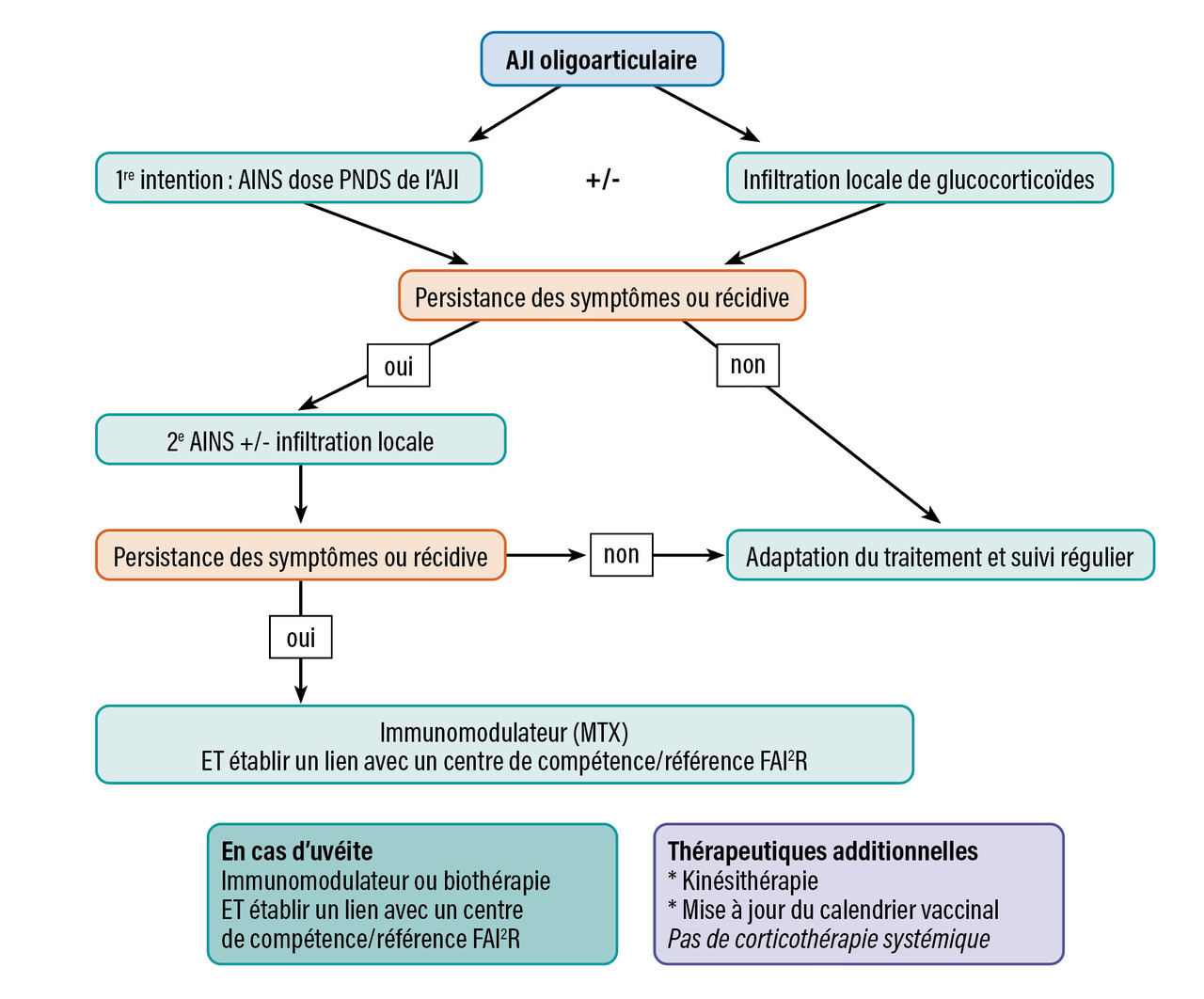
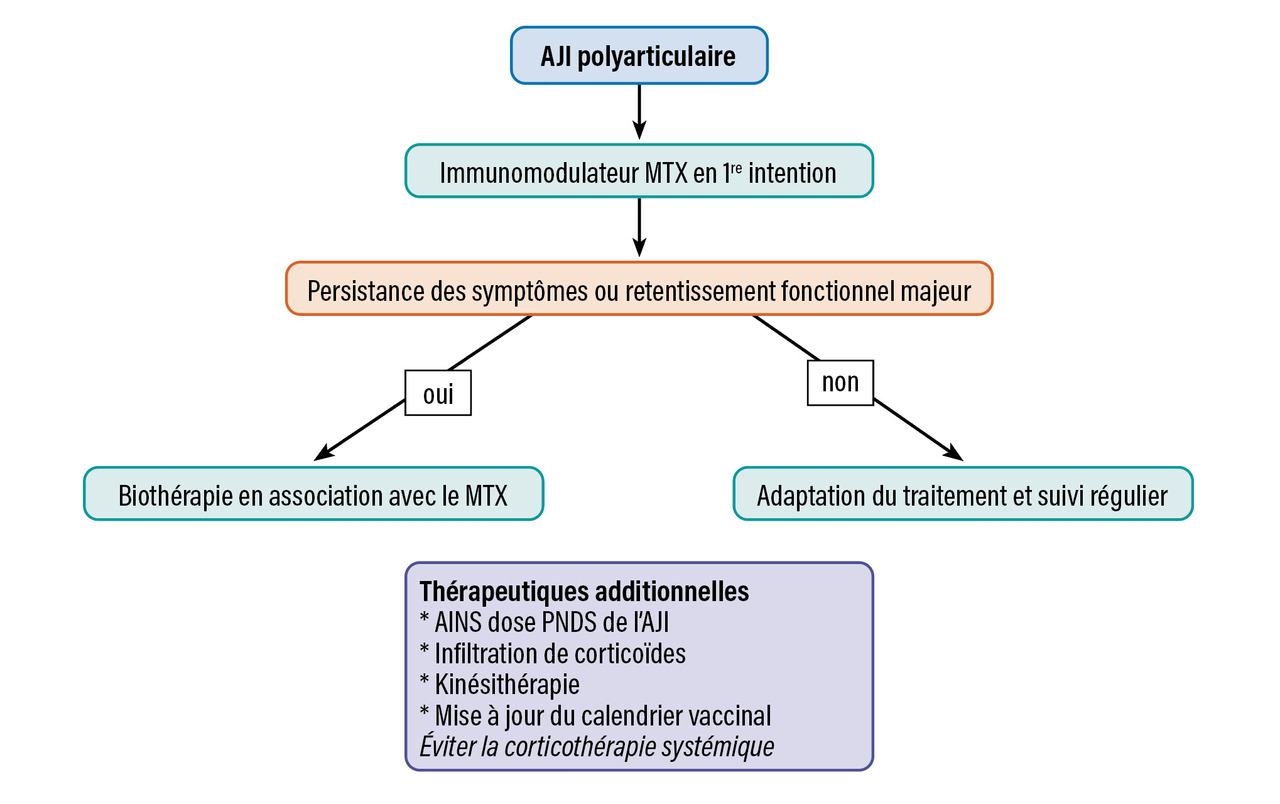
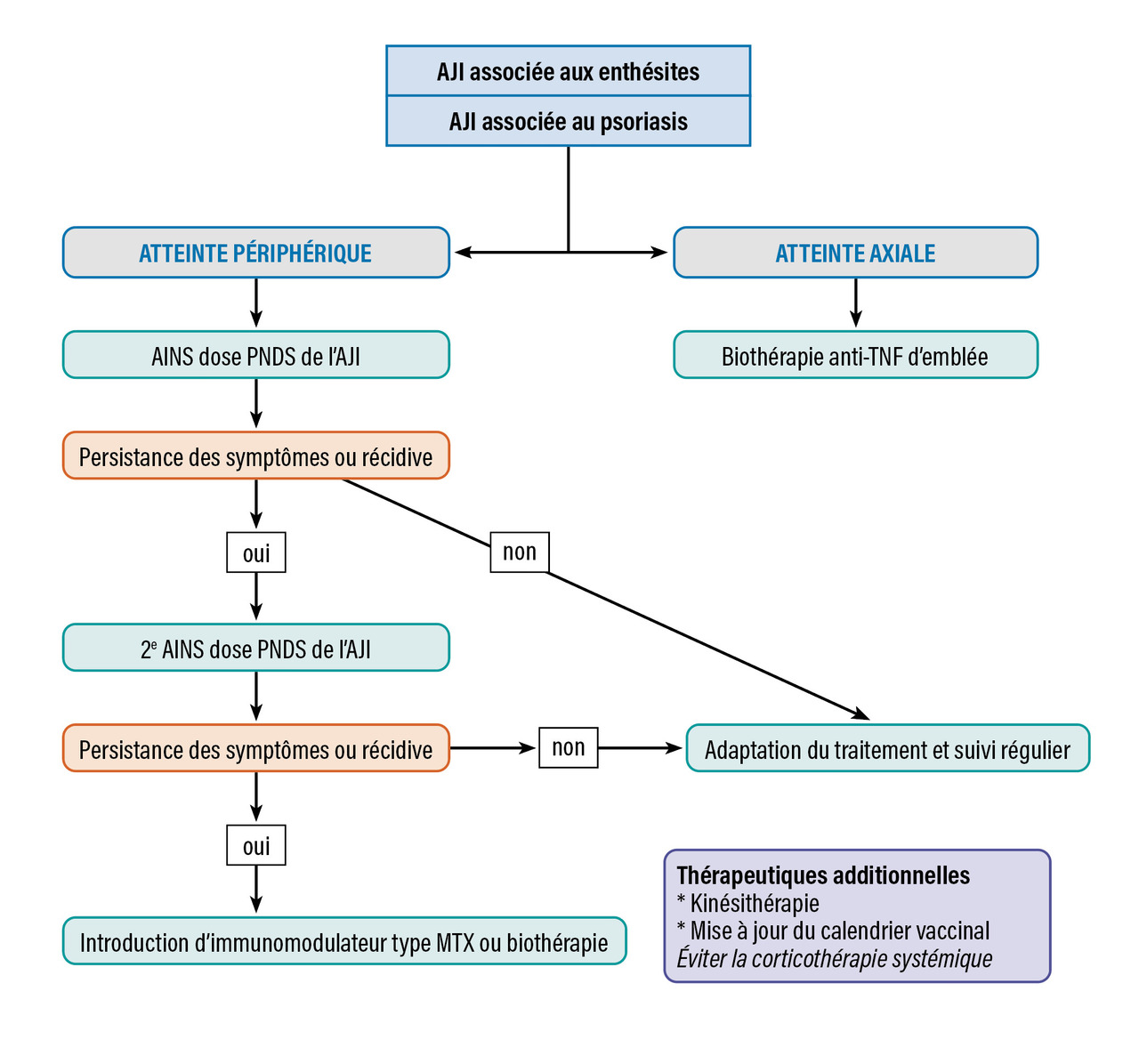
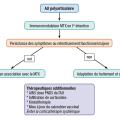
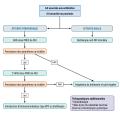
Il existe différents outils pour évaluer l’activité articulaire. Le plus courant est le score d’activité de l’AJI (juvenile arthritis disease activity score [JADAS]), utilisé pour suivre l’évolution de l’activité de la maladie en évaluant trois variables : compte articulaire des arthrites, échelle visuelle analogique (EVA) patient et EVA médecin. Les critères de Wallace permettent de définir la rémission clinique : absence d’arthrite, d’uvéite, VS et CRP normales, EVA médecin à 0 et dérouillage matinal de moins de quinze minutes. La prise en charge médicamenteuse en fonction du type d’AJI est résumée sur lesfigures 1, 2 et 3 .
La prise en charge thérapeutique repose sur une stratégie « treat-to-target » consistant à se fixer des objectifs en fonction des différents stades de la maladie et à évaluer régulièrement la situation du patient pour adapter les traitements en vue de maîtriser l’inflammation et de limiter les complications de la maladie avec la plus faible toxicité possible.
Il existe différents outils pour évaluer l’activité articulaire. Le plus courant est le score d’activité de l’AJI (juvenile arthritis disease activity score [JADAS]), utilisé pour suivre l’évolution de l’activité de la maladie en évaluant trois variables : compte articulaire des arthrites, échelle visuelle analogique (EVA) patient et EVA médecin. Les critères de Wallace permettent de définir la rémission clinique : absence d’arthrite, d’uvéite, VS et CRP normales, EVA médecin à 0 et dérouillage matinal de moins de quinze minutes. La prise en charge médicamenteuse en fonction du type d’AJI est résumée sur les
Place des AINS
Les AINS peuvent être utilisés en première intention en monothérapie dans certaines AJI de présentation peu sévère (sans polyarthrite, sans uvéite associée ou autre complication), en l’absence de contre-indication. Les posologies à doses anti-inflammatoires des principales molécules utilisées sont résumées dans le tableau 2 .
Les AINS sont parfois suffisants comme traitement dans des formes oligoarticulaires ou certaines formes d’AJI associées aux enthésites sans critère de gravité.
Si nécessaire, les AINS peuvent être associés à des traitements locaux, comme une infiltration articulaire de corticoïdes et/ou une prise en charge de rééducation.
Les AINS sont parfois suffisants comme traitement dans des formes oligoarticulaires ou certaines formes d’AJI associées aux enthésites sans critère de gravité.
Si nécessaire, les AINS peuvent être associés à des traitements locaux, comme une infiltration articulaire de corticoïdes et/ou une prise en charge de rééducation.
Traitement local par injection intra-articulaire de corticoïdes
Il peut être proposé en cas d’atteinte articulaire unique ou dans les formes d’évolution oligo- ou polyarticulaire. Cet acte se fait sous prémédication ou anesthésie générale selon l’âge de l’enfant, le nombre et le type d’articulations à infiltrer, le plus souvent en hospitalisation de jour. Le geste doit être suivi d’un repos articulaire de quarante-huit heures.
Trois types de traitement de fond
La corticothérapie systémique est généralement proscrite pour les formes non systémiques d’AJI et elle ne doit être utilisée – de manière limitée et brève – que dans des situations particulières, après discussion avec un centre de référence ou de compétence.
Actuellement, les traitements de fond sont essentiellement de trois types : les immunomodulateurs classiques comme le méthotrexate, les biothérapies (anti-TNF, anti-IL-6, agoniste de CTLA-4, anti-IL-17) et les thérapies ciblées comme les inhibiteurs de JAK (lire l’article « Biothérapies dans les arthrites juvéniles idiopathiques »page 1090 ).
Ces traitements de fond doivent être initiés en lien avec un centre de référence ou de compétence, après une évaluation et un bilan préthérapeutique minimal, et doivent être régulièrement surveillés. La durée minimale après initiation avant d’envisager un arrêt est de six mois de rémission clinico-biologique complète et, dans certains cas, radiologique (atteinte axiale des AJI associées aux enthésites, par exemple). Toute introduction d’un traitement de fond nécessite au préalable de vérifier, et au besoin d’implémenter, le calendrier vaccinal, d’informer les parents sur les risques liés aux immunosuppresseurs et aux biothérapies, et sur la nécessité de prendre un contact médical rapide en cas d’événement infectieux.
En cas d’échec du MTX per os ou d’intolérance digestive, une injection par voie sous-cutanée à la même dose peut être proposée.
Le bilan hépatique doit être surveillé de manière attentive chez ces patients, surtout en cas d’exacerbation de symptômes digestifs, pouvant être le reflet d’une toxicité hépatique. Certaines AJI polyarticulaires peuvent justifier d’emblée l’administration d’une biothérapie (le plus souvent par anti-TNF) de première intention (hors AMM) en association au MTX. Celui-ci est également recommandé en première intention en cas d’uvéite antérieure dépendante ou résistante au traitement oculaire local.
Aucune étude ne permet de préciser la place respective de ces deux anti-TNF en première intention, ni n’a comparé l’efficacité de deux anti-TNF différents.
En cas d’échec d’une première biothérapie, un changement pour une biothérapie de même classe ou d’une autre classe thérapeutique peut être discuté avec un centre de référence ou de compétence. L’infliximab n’a pas d’AMM pour le traitement de l’AJI, il peut être néanmoins proposé dans certaines formes réfractaires ou en cas de mauvaise observance du fait de son administration hospitalière par voie intraveineuse.
En cas d’échec d’au moins une biothérapie, l’utilisation du tofacitinib (inhibiteur de JAK) est envisageable avec AMM ; le baricitinib (inhibiteur de JAK) est une alternative dans les AJI polyarticulaires. La prescription des inhibiteurs de JAK doit être initiée uniquement après avis d’un centre de référence, voire d’une réunion de concertation pluridisciplinaire (RCP).
Toutes ces molécules nécessitent une surveillance clinico-biologique régulière. Il n’existe pas de rythme consensuel pour la surveillance clinique des patients sous biothérapies. Il est conseillé, sur la base d’avis d’experts, de revoir le patient six semaines après l’initiation du traitement, puis tous les trois à six mois pendant toute la durée du traitement. Le rythme de surveillance dépend de l’activité de la maladie. Il n’existe pas non plus de consensus sur la surveillance des paramètres biologiques sous biothérapies. Il est classiquement réalisé un bilan biologique standard (hémogramme, bilan hépatique et rénal) tous les trois à six mois, le délai dépendant aussi des médicaments associés et de l’activité de la maladie.
Actuellement, les traitements de fond sont essentiellement de trois types : les immunomodulateurs classiques comme le méthotrexate, les biothérapies (anti-TNF, anti-IL-6, agoniste de CTLA-4, anti-IL-17) et les thérapies ciblées comme les inhibiteurs de JAK (lire l’article « Biothérapies dans les arthrites juvéniles idiopathiques »
Ces traitements de fond doivent être initiés en lien avec un centre de référence ou de compétence, après une évaluation et un bilan préthérapeutique minimal, et doivent être régulièrement surveillés. La durée minimale après initiation avant d’envisager un arrêt est de six mois de rémission clinico-biologique complète et, dans certains cas, radiologique (atteinte axiale des AJI associées aux enthésites, par exemple). Toute introduction d’un traitement de fond nécessite au préalable de vérifier, et au besoin d’implémenter, le calendrier vaccinal, d’informer les parents sur les risques liés aux immunosuppresseurs et aux biothérapies, et sur la nécessité de prendre un contact médical rapide en cas d’événement infectieux.
Méthotrexate en première intention
Le méthotrexate (MTX) peut être proposé en traitement de fond de première intention dans les AJI polyarticulaires ou oligoarticulaires résistantes à un traitement par AINS et injections intra-articulaires. Son efficacité est alors évaluée après deux à trois mois. Il existe des données en faveur d’une introduction précoce du MTX dans ces formes.17,18 Son efficacité a été démontrée chez des enfants porteurs d’AJI polyarticulaire à la dose de 10 à 15 mg/m2 par semaine (0,3 à 0,5 mg/kg) per os, sans dépasser la dose de 25 mg par semaine. Une prise unique d’acide folique ou folinique (5 mg) au moins quarante-huit heures après la prise du méthotrexate pourrait améliorer la tolérance du traitement sans que cela n’ait jamais été rigoureusement démontré.En cas d’échec du MTX per os ou d’intolérance digestive, une injection par voie sous-cutanée à la même dose peut être proposée.
Le bilan hépatique doit être surveillé de manière attentive chez ces patients, surtout en cas d’exacerbation de symptômes digestifs, pouvant être le reflet d’une toxicité hépatique. Certaines AJI polyarticulaires peuvent justifier d’emblée l’administration d’une biothérapie (le plus souvent par anti-TNF) de première intention (hors AMM) en association au MTX. Celui-ci est également recommandé en première intention en cas d’uvéite antérieure dépendante ou résistante au traitement oculaire local.
Biothérapies dans les formes réfractaires
L’avènement des biothérapies a révolutionné le pronostic des formes d’AJI réfractaires aux traitements conventionnels. Les traitements ayant l’AMM en cas d’intolérance ou d’efficacité insuffisante du MTX sont les anti-TNF (étanercept et adalimumab ainsi que golimumab uniquement pour les enfants de plus de 40 kg), le tocilizumab (anti-IL-6), l’abatacept (CTLA4-Ig), le sécukinumab dans les AJI associées aux enthésites ou au psoriasis (anti-IL-17). En pratique courante, étanercept et adalimumab sont les plus utilisés.Aucune étude ne permet de préciser la place respective de ces deux anti-TNF en première intention, ni n’a comparé l’efficacité de deux anti-TNF différents.
En cas d’échec d’une première biothérapie, un changement pour une biothérapie de même classe ou d’une autre classe thérapeutique peut être discuté avec un centre de référence ou de compétence. L’infliximab n’a pas d’AMM pour le traitement de l’AJI, il peut être néanmoins proposé dans certaines formes réfractaires ou en cas de mauvaise observance du fait de son administration hospitalière par voie intraveineuse.
En cas d’échec d’au moins une biothérapie, l’utilisation du tofacitinib (inhibiteur de JAK) est envisageable avec AMM ; le baricitinib (inhibiteur de JAK) est une alternative dans les AJI polyarticulaires. La prescription des inhibiteurs de JAK doit être initiée uniquement après avis d’un centre de référence, voire d’une réunion de concertation pluridisciplinaire (RCP).
Toutes ces molécules nécessitent une surveillance clinico-biologique régulière. Il n’existe pas de rythme consensuel pour la surveillance clinique des patients sous biothérapies. Il est conseillé, sur la base d’avis d’experts, de revoir le patient six semaines après l’initiation du traitement, puis tous les trois à six mois pendant toute la durée du traitement. Le rythme de surveillance dépend de l’activité de la maladie. Il n’existe pas non plus de consensus sur la surveillance des paramètres biologiques sous biothérapies. Il est classiquement réalisé un bilan biologique standard (hémogramme, bilan hépatique et rénal) tous les trois à six mois, le délai dépendant aussi des médicaments associés et de l’activité de la maladie.
Les biothérapies améliorent le pronostic
La clinique reste fondamentale pour diagnostiquer une AJI, les examens complémentaires les plus utiles étant la mesure des paramètres de l’inflammation, la recherche de FAN et de FR/Ac anti-CCP dans les formes polyarticulaires. La prise en charge des formes non systémiques d’AJI est fondée sur des mesures pharmacologiques, non pharmacologiques et un soutien psychosocial. Elle doit être mise en œuvre en lien étroit avec un médecin hospitalier d’un centre de référence ou de compétences en rhumatologie pédiatrique. La prise en charge est pluridisciplinaire pour élaborer un plan personnalisé pour chaque enfant malade. Parmi les mesures non pharmacologiques, les kinésithérapeutes travaillent à maintenir les amplitudes articulaires et la fonction des articulations tandis que les ergothérapeutes aident les écoles à adapter l’environnement de travail de l’enfant, notamment en cas d’atteinte importante des mains ou des poignets. Enfin, les associations de patients et groupes de soutien sont également précieux pour éviter l’isolement social et émotionnel des enfants.
La classification actuelle est amenée à évoluer en regroupant des sous-groupes proches sur le plan clinique et grâce à l’amélioration de la compréhension de leurs mécanismes physiopathologiques. Les progrès réalisés du fait de l’introduction des biothérapies ont considérablement amélioré le pronostic de cette maladie.
La classification actuelle est amenée à évoluer en regroupant des sous-groupes proches sur le plan clinique et grâce à l’amélioration de la compréhension de leurs mécanismes physiopathologiques. Les progrès réalisés du fait de l’introduction des biothérapies ont considérablement amélioré le pronostic de cette maladie.
Références
1. Behrens EM, Beukelman T, Gallo L, et al. Evaluation of the presentation of systemic onset juvenile rheumatoid arthritis: Data from the Pennsylvania Systemic Onset Juvenile Arthritis Registry (PASOJAR). J Rheumatol 2008;35(2):343-8.
2. Protocole national de diagnostic et de soins (PNDS). Arthrites juvéniles idiopathiques. Décembre 2023. https://urlz.fr/sKiQ
3. Onel KB, Horton DB, Lovell DJ, et al. 2021 American College of Rheumatology guideline for the treatment of juvenile idiopathic arthritis: Therapeutic approaches for oligoarthritis, temporomandibular joint arthritis, and systemic juvenile idiopathic arthritis. Arthritis Rheumatol 2022;74(4):553-69.
4. Saurenmann RK, Rose JB, Tyrrell P, et al. Epidemiology of juvenile idiopathic arthritis in a multiethnic cohort: Ethnicity as a risk factor. Arthritis Rheum 2007;56(6): 1974-84.
5. Weiss JE, Ilowite NT. Juvenile idiopathic arthritis. Pediatr Clin North Am 2005;52(2):413-42.
6. Ravelli A, Martini A. Juvenile idiopathic arthritis. The Lancet 2007;369(9563):767-78.
7. Petty RE, Southwood TR, Manners P, et al. International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: Second revision, Edmonton, 2001. J Rheumatol 2004;31(2):390-2.
8. Martini A, Ravelli A, Avcin T, et al. Toward new classification criteria for juvenile idiopathic arthritis: First steps, Pediatric Rheumatology International Trials Organization International Consensus. J Rheumatol 2019;46(2):190-7.
9. Cassidy J, Kivlin J, Lindsley C, et al. Ophthalmologic examinations in children with juvenile rheumatoid arthritis. Pediatrics 2006;117(5):1843-5.
10. Grassi A, Corona F, Casellato A, et al. Prevalence and outcome of juvenile idiopathic arthritis-associated uveitis and relation to articular disease. J Rheumatol 2007;34(5):1139-45.
11. Heiligenhaus A, Niewerth M, Ganser G, et al, German Uveitis in Childhood Study Group. Prevalence and complications of uveitis in juvenile idiopathic arthritis in a population-based nation-wide study in Germany: Suggested modification of the current screening guidelines. Rheumatol Oxf Engl 2007;46(6):1015-9.
12. Ozdal PC, Vianna RNG, Deschenes J. Visual outcome of juvenile rheumatoid arthritis-associated uveitis in adults. Ocul Immunol Inflamm 2005;13(1):33-8.
13. Rosenthal A, Janow G. Enthesitis-related juvenile idiopathic arthritis. Pediatr Rev 2019;40(5):256-8.
14. Kan JH. Juvenile idiopathic arthritis and enthesitis-related arthropathies. Pediatr Radiol 2013;43(Suppl 1):S172-80.
15. Chua-Aguilera CJ, Möller B, Yawalkar N. Skin manifestations of rheumatoid arthritis, juvenile idiopathic arthritis, and spondyloarthritides. Clin Rev Allergy Immunol 2017;53(3):371-93.
16. Quartier-Dit-Maire P, Saadoun D, Belot A, et al. Protocole national de diagnostic et de soins (PNDS) sur les uvéites chroniques non infectieuses de l’enfant et de l’adulte. Mai 2020. https://urlz.fr/cTdw
17. Cespedes-Cruz A, Gutierrez-Suarez R, Pistorio , et al. Methotrexate improves the health-related quality of life of children with juvenile idiopathic arthritis. Ann Rheum Dis 2008;67(3):309-14.
18. Ravelli A, Davì S, Bracciolini G, et al. Intra-articular corticosteroids versus intra-articular corticosteroids plus methotrexate in oligoarticular juvenile idiopathic arthritis: A multicentre, prospective, randomised, open-label trial. Lancet Lond Engl 2017;389(10072):909-16.
2. Protocole national de diagnostic et de soins (PNDS). Arthrites juvéniles idiopathiques. Décembre 2023. https://urlz.fr/sKiQ
3. Onel KB, Horton DB, Lovell DJ, et al. 2021 American College of Rheumatology guideline for the treatment of juvenile idiopathic arthritis: Therapeutic approaches for oligoarthritis, temporomandibular joint arthritis, and systemic juvenile idiopathic arthritis. Arthritis Rheumatol 2022;74(4):553-69.
4. Saurenmann RK, Rose JB, Tyrrell P, et al. Epidemiology of juvenile idiopathic arthritis in a multiethnic cohort: Ethnicity as a risk factor. Arthritis Rheum 2007;56(6): 1974-84.
5. Weiss JE, Ilowite NT. Juvenile idiopathic arthritis. Pediatr Clin North Am 2005;52(2):413-42.
6. Ravelli A, Martini A. Juvenile idiopathic arthritis. The Lancet 2007;369(9563):767-78.
7. Petty RE, Southwood TR, Manners P, et al. International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: Second revision, Edmonton, 2001. J Rheumatol 2004;31(2):390-2.
8. Martini A, Ravelli A, Avcin T, et al. Toward new classification criteria for juvenile idiopathic arthritis: First steps, Pediatric Rheumatology International Trials Organization International Consensus. J Rheumatol 2019;46(2):190-7.
9. Cassidy J, Kivlin J, Lindsley C, et al. Ophthalmologic examinations in children with juvenile rheumatoid arthritis. Pediatrics 2006;117(5):1843-5.
10. Grassi A, Corona F, Casellato A, et al. Prevalence and outcome of juvenile idiopathic arthritis-associated uveitis and relation to articular disease. J Rheumatol 2007;34(5):1139-45.
11. Heiligenhaus A, Niewerth M, Ganser G, et al, German Uveitis in Childhood Study Group. Prevalence and complications of uveitis in juvenile idiopathic arthritis in a population-based nation-wide study in Germany: Suggested modification of the current screening guidelines. Rheumatol Oxf Engl 2007;46(6):1015-9.
12. Ozdal PC, Vianna RNG, Deschenes J. Visual outcome of juvenile rheumatoid arthritis-associated uveitis in adults. Ocul Immunol Inflamm 2005;13(1):33-8.
13. Rosenthal A, Janow G. Enthesitis-related juvenile idiopathic arthritis. Pediatr Rev 2019;40(5):256-8.
14. Kan JH. Juvenile idiopathic arthritis and enthesitis-related arthropathies. Pediatr Radiol 2013;43(Suppl 1):S172-80.
15. Chua-Aguilera CJ, Möller B, Yawalkar N. Skin manifestations of rheumatoid arthritis, juvenile idiopathic arthritis, and spondyloarthritides. Clin Rev Allergy Immunol 2017;53(3):371-93.
16. Quartier-Dit-Maire P, Saadoun D, Belot A, et al. Protocole national de diagnostic et de soins (PNDS) sur les uvéites chroniques non infectieuses de l’enfant et de l’adulte. Mai 2020. https://urlz.fr/cTdw
17. Cespedes-Cruz A, Gutierrez-Suarez R, Pistorio , et al. Methotrexate improves the health-related quality of life of children with juvenile idiopathic arthritis. Ann Rheum Dis 2008;67(3):309-14.
18. Ravelli A, Davì S, Bracciolini G, et al. Intra-articular corticosteroids versus intra-articular corticosteroids plus methotrexate in oligoarticular juvenile idiopathic arthritis: A multicentre, prospective, randomised, open-label trial. Lancet Lond Engl 2017;389(10072):909-16.