objectifs
Diagnostiquer un glaucome chronique.
Argumenter l'attitude thérapeutique et planifier le suivi du patient.
Diagnostiquer un glaucome chronique.
Argumenter l'attitude thérapeutique et planifier le suivi du patient.
Définition et physiopathologie
Le glaucome chronique est une neuropathie optique antérieure progressive qui se caractérise par :
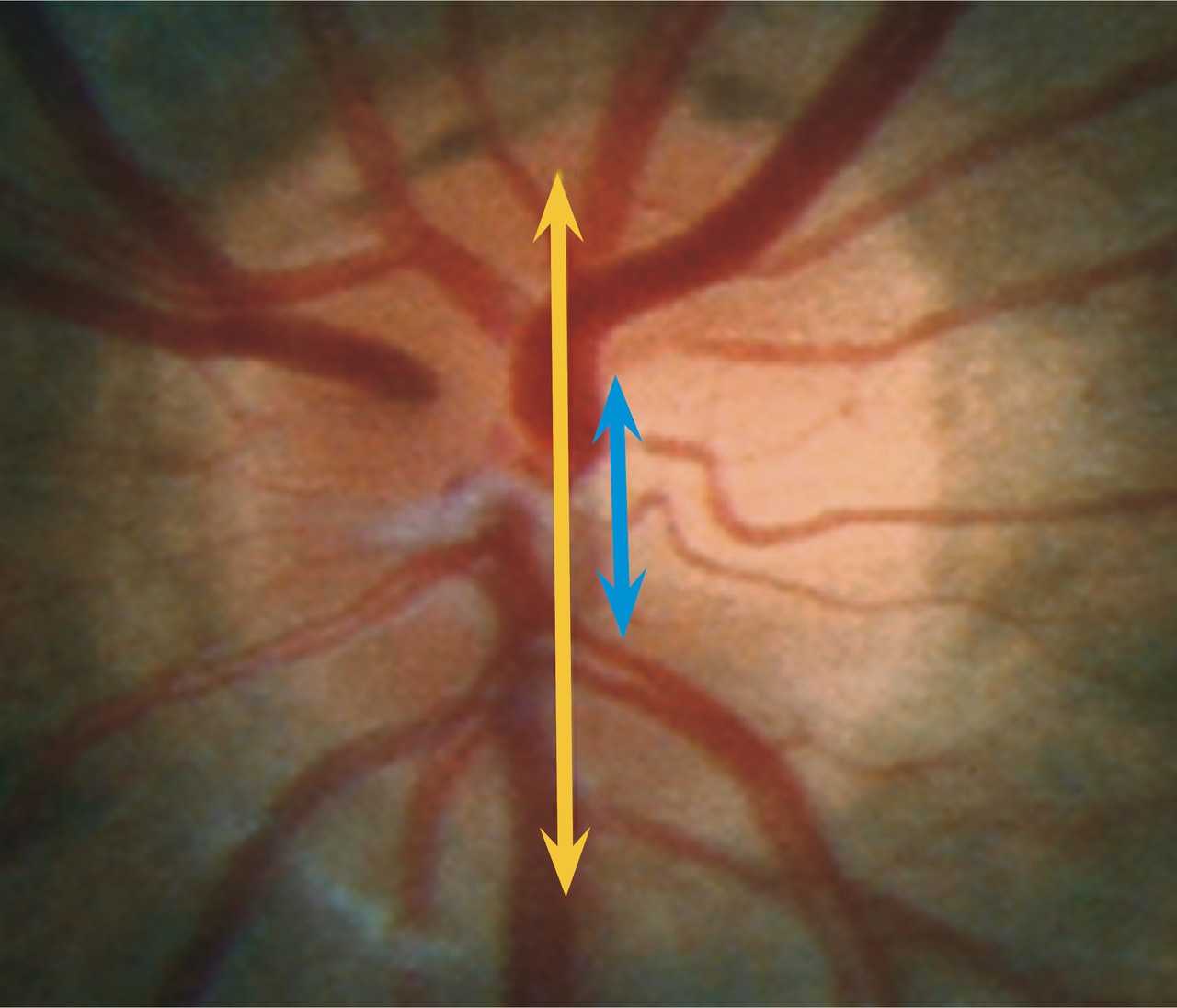
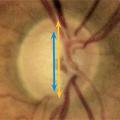
Petit rappel anatomique (fig. 1 ) : le nerf optique est la portion des voies visuelles qui naît de la papille optique et qui se termine au niveau du chiasma optique. La papille est la structure ronde, jaune-orangé, d’environ 2 mm située en nasal de la macula au fond d’œil par laquelle passe l’ensemble des fibres nerveuses provenant des cellules ganglionnaires rétiniennes. Neuropathie optique antérieure signifie atteinte dégénérative de cette papille, qui se traduit par son excavation visible au fond d’œil (creusement jusqu’à l’aspect de papille chaudron) [fig. 2 ].
Le mécanisme exact de la destruction des fibres optiques au niveau de la papille n’est pas complètement élucidé. L’hypertonie oculaire est le plus grand facteur de risque connu de neuropathie glaucomateuse.
Un glaucome chronique ne se résume en aucun cas à une hypertonie oculaire. L’hypertonie n’est qu’un facteur de risque, même si c’est le facteur de risque principal. Il existe des glaucomes sans hypertonie oculaire (glaucome à pression normale) mais aussi des hypertonies oculaires sans glaucome, c’est-à-dire sans modification pathologique du nerf optique.
Cette hypertonie oculaire agirait, selon les théories actuelles :
D’où vient cette augmentation pathologique de la pression intraoculaire (PIO) ? Pour rappel : la pression intraoculaire est régulée par la sécrétion de l’humeur aqueuse par les corps ciliaires, organes situés en arrière de l’iris. Cette humeur aqueuse circule vers l’avant de l’œil, passe au travers de la pupille pour atteindre la chambre antérieure de l’œil. Elle est réabsorbée au niveau du trabéculum dans l’angle irido-cornéen. Un déséquilibre de ce mécanisme de sécrétion-réabsorption de l’humeur aqueuse entraîne des variations tensionnelles. Dans le glaucome chronique à angle ouvert, il existe le plus fréquemment une dégénérescence pathologique du trabéculum. L’organe n’effectuant plus correctement sa fonction de réabsorption, la PIO s’élève progressivement.
En résumé, dans le glaucome chronique à angle ouvert, la dégénérescence pathologique du trabéculum entraîne une augmentation progressive et chronique de la pression intraoculaire qui, par des phénomènes mécaniques et ischémiques, détruit petit à petit les fibres optiques au niveau de la papille, se traduisant fonctionnellement par une atteinte du champ visuel, progressive et irréversible pouvant mener à la cécité.
- une excavation progressive de la tête du nerf optique (ou papille) ;
- entraînant des déficits du champ visuel ;
- avec pour principal facteur de risque l’hypertonie oculaire.
Petit rappel anatomique (
Le mécanisme exact de la destruction des fibres optiques au niveau de la papille n’est pas complètement élucidé. L’hypertonie oculaire est le plus grand facteur de risque connu de neuropathie glaucomateuse.
Un glaucome chronique ne se résume en aucun cas à une hypertonie oculaire. L’hypertonie n’est qu’un facteur de risque, même si c’est le facteur de risque principal. Il existe des glaucomes sans hypertonie oculaire (glaucome à pression normale) mais aussi des hypertonies oculaires sans glaucome, c’est-à-dire sans modification pathologique du nerf optique.
Cette hypertonie oculaire agirait, selon les théories actuelles :
- par un phénomène mécanique par étirement et cisaillement des fibres nerveuses au niveau de la tête du nerf optique ;
- par un phénomène ischémique, par insuffisance circulatoire des artères terminales qui vascularisent la papille optique.
D’où vient cette augmentation pathologique de la pression intraoculaire (PIO) ? Pour rappel : la pression intraoculaire est régulée par la sécrétion de l’humeur aqueuse par les corps ciliaires, organes situés en arrière de l’iris. Cette humeur aqueuse circule vers l’avant de l’œil, passe au travers de la pupille pour atteindre la chambre antérieure de l’œil. Elle est réabsorbée au niveau du trabéculum dans l’angle irido-cornéen. Un déséquilibre de ce mécanisme de sécrétion-réabsorption de l’humeur aqueuse entraîne des variations tensionnelles. Dans le glaucome chronique à angle ouvert, il existe le plus fréquemment une dégénérescence pathologique du trabéculum. L’organe n’effectuant plus correctement sa fonction de réabsorption, la PIO s’élève progressivement.
En résumé, dans le glaucome chronique à angle ouvert, la dégénérescence pathologique du trabéculum entraîne une augmentation progressive et chronique de la pression intraoculaire qui, par des phénomènes mécaniques et ischémiques, détruit petit à petit les fibres optiques au niveau de la papille, se traduisant fonctionnellement par une atteinte du champ visuel, progressive et irréversible pouvant mener à la cécité.
Épidémiologie et facteurs de risque
Épidémiologie
Deuxième cause de cécité dans les pays industrialisés (après la DMLA), le glaucome chronique à angle ouvert touche plus de 800 000 personnes en France, et 400 000 à 500 000 personnes sont atteintes d’un glaucome non diagnostiqué. Longtemps asymptomatique, le diagnostic se fait le plus souvent lors d’une consultation systématique chez l’ophtalmologiste pour un renouvellement de lunettes. La prévalence de la maladie est de 1 à 2 % dans la population caucasienne de plus de 40 ans et augmente avec l’âge, de 5 à 10 % pour les sujets de plus de 70 ans.
Le glaucome chronique à angle ouvert est une maladie liée au vieillissement, observé majoritairement dans la 2e partie de la vie.
Des campagnes de dépistage ont été réalisées en France afin de détecter des hypertonies méconnues, cependant seul un dépistage individuel est intéressant du fait de l’absence de test suffisamment sensible et spécifique pour réaliser un dépistage de masse.
Parce que la prévalence de la maladie augmente après 40 ans, un dépistage de la maladie est conseillé lors d’une consultation pour la prescription de lunettes de presbytie.
Le glaucome chronique à angle ouvert est une maladie liée au vieillissement, observé majoritairement dans la 2e partie de la vie.
Des campagnes de dépistage ont été réalisées en France afin de détecter des hypertonies méconnues, cependant seul un dépistage individuel est intéressant du fait de l’absence de test suffisamment sensible et spécifique pour réaliser un dépistage de masse.
Parce que la prévalence de la maladie augmente après 40 ans, un dépistage de la maladie est conseillé lors d’une consultation pour la prescription de lunettes de presbytie.
Facteurs de risque
Hypertonie oculaire
C’est le principal facteur de risque.Malgré des variations nycthémérales de la PIO, la tension oculaire moyenne mesurée dans la population générale est 16 mmHg. On définit une hypertonie oculaire quand celle-ci dépasse les 21 mmHg (2 écarts types au-dessus de la moyenne).
Il s’agit là de normes statistiques, il n’y a pas de chiffre consensuel à partir duquel un patient développe un glaucome. Ainsi :
- il existe des cas d’hypertonies avérées sans neuropathies glaucomateuses (cf. formes cliniques) ;
- il existe des cas de glaucome sans hypertonie, défini comme un glaucome à pression normale (patients avec par exemple une PIO à 17 mmHg mais avec une atteinte de la papille et des déficits du champ visuel).
Autres facteurs de risque
Les antécédents familiaux : il existe une hérédité dans environ un tiers des cas, avec des modèles de transmission autosomique dominante.L’ethnie : les sujets mélanodermes présentent des glaucomes à un âge plus jeune avec une sévérité plus importante.
L’âge : la prévalence du glaucome augmente avec l’âge, surtout après 70 ans.
La myopie : la myopie constitue un facteur de risque de glaucome à angle ouvert, surtout la myopie forte, où le risque est multiplié par 3.
Les maladies vasculaires : le facteur le plus fréquemment retrouvé est l’hypotension artérielle, orthostatique ou nocturne. Les acrosyndromes sont également à rechercher, en particulier dans les glaucomes à pression normale.
Formes cliniques
Le glaucome chronique à angle ouvert représente la majorité des pathologies glaucomateuses, il existe d’autres formes de glaucome.
À angle ouvert
Le glaucome à pression normale, piège diagnostique, présente une altération de la papille et du champ visuel mais avec des valeurs de PIO dans la normale statistique (moins de 21 mmHg).
Le glaucome cortisonique apparaît chez les patients étant traités au long cours par des corticoïdes locaux ou généraux.
Le glaucome pigmentaire, qui se caractérise par l’accumulation de pigments dans le trabéculum, entraîne une hypertonie chronique par obstruction de la réabsorption. Ses pigments proviennent de l’iris, érodé de manière mécanique par frottement avec le cristallin. On le retrouve plus fréquemment chez des hommes myopes.
Le glaucome exfoliatif, associé à la cataracte, se traduit par l’accumulation dans le segment antérieur et le trabéculum de matériel fibrillaire : plus fréquent dans la région nord-ouest de la France, il évolue plus rapidement avec une hypertonie oculaire plus sévère.
Le glaucome cortisonique apparaît chez les patients étant traités au long cours par des corticoïdes locaux ou généraux.
Le glaucome pigmentaire, qui se caractérise par l’accumulation de pigments dans le trabéculum, entraîne une hypertonie chronique par obstruction de la réabsorption. Ses pigments proviennent de l’iris, érodé de manière mécanique par frottement avec le cristallin. On le retrouve plus fréquemment chez des hommes myopes.
Le glaucome exfoliatif, associé à la cataracte, se traduit par l’accumulation dans le segment antérieur et le trabéculum de matériel fibrillaire : plus fréquent dans la région nord-ouest de la France, il évolue plus rapidement avec une hypertonie oculaire plus sévère.
Diagnostic différentiel
Le glaucome chronique à angle fermé, beaucoup moins bruyant que sa forme aiguë, par des fermetures successives et souvent asymptomatiques de l’angle irido-cornéen. Son évolution est souvent plus sévère et plus rapide que la forme de glaucome à angle ouvert primitif.
Les glaucomes secondaires, liée à une autre pathologie ophtalmologique : par exemple, le glaucome uvéitique, le glaucome post-traumatique.
Les glaucomes secondaires, liée à une autre pathologie ophtalmologique : par exemple, le glaucome uvéitique, le glaucome post-traumatique.
Examen du sujet glaucomateux
Symptômes
Malheureusement, le glaucome est une maladie très longtemps asymptomatique, d’où l’importance de son dépistage.
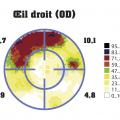
Indolore, le glaucome détruit lentement le champ visuel (fig. 3 ), et le sujet ne perçoit une gêne visuelle que très tardivement quand le champ visuel d’un œil est perdu.
De même, la plainte du patient pour caractériser une amputation du champ visuel est souvent décrite comme une gêne, l’impression de mal voir, alors que l’acuité visuelle reste à 10/10.
Indolore, le glaucome détruit lentement le champ visuel (
De même, la plainte du patient pour caractériser une amputation du champ visuel est souvent décrite comme une gêne, l’impression de mal voir, alors que l’acuité visuelle reste à 10/10.
Clinique
L’examen est bilatéral et comparatif.
L’acuité visuelle est très longtemps conservée dans le glaucome à 10/10 Parinaud 2.
Au stade agonique, le sujet peut présenter une acuité visuelle à 10/10 avec une perte totale du champ visuel : le sujet est alors incapable de se déplacer dans une pièce qu’il ne connaît pas alors qu’il lit 10/10.
La PIO est le premier des paramètres à savoir interpréter.
L’intervalle de valeurs normales est de 10 à 21 mmHg.
Dans le glaucome chronique, la PIO est dans la majorité des cas élevée, voire très élevée.
Elle se mesure en pratique quotidienne de deux manières :
La mesure de la PIO peut être biaisée par l’épaisseur de la cornée. La mesure de l’épaisseur de la cornée ou pachymétrie est importante à rechercher. Déformer une cornée épaisse nécessite plus de force qu’une cornée fine. Ainsi, si la cornée est fine, une valeur de PIO d’allure normale pourra être pathologique, et peut faire porter le diagnostic de glaucome à pression normale. De la même manière, si la cornée est épaisse, une valeur un peu au-dessus de la normale (par exemple 23 mmHg) pourra n’entraîner aucun retentissement sur le nerf optique et fera poser le diagnostic d’hypertonie oculaire simple isolée.
La gonioscopie ou étude biomicroscopique de l’angle irido- cornéen est également un facteur clinique important. En effet, un examen à la lampe à fente seul ne peut pas présumer d’un angle irido-cornéen ouvert ou fermé. On utilise alors, après anesthésie cornéenne, un verre d’examen dit contact type verre à trois miroirs de Goldmann (car il touche la cornée) pour visualiser l’angle irido-cornéen. La pupille ne doit pas être dilatée pour cet examen.
Une gonioscopie est à réaliser de façon systématique dans toute hypertonie oculaire pour en apprécier l’origine : elle permet de dire si l’angle est ouvert ou fermé.
Évidemment, l’angle irido-cornéen d’un glaucome à angle ouvert est ouvert.
L’analyse de la papille au fond d’œil : élément majeur du diagnostic puis du suivi, l’analyse de la papille permet d’évaluer cliniquement la présence puis la progression d’une neuropathie glaucomateuse. Celle-ci se réalise à la lampe à fente, avec un verre contact type gonioscope ou verre à trois miroirs, soit avec un verre non contact sur une pupille dilatée de préférence pour mieux apprécier les détails de la papille.
L’utilisation de rétinophotographie est très fréquente pour le suivi.
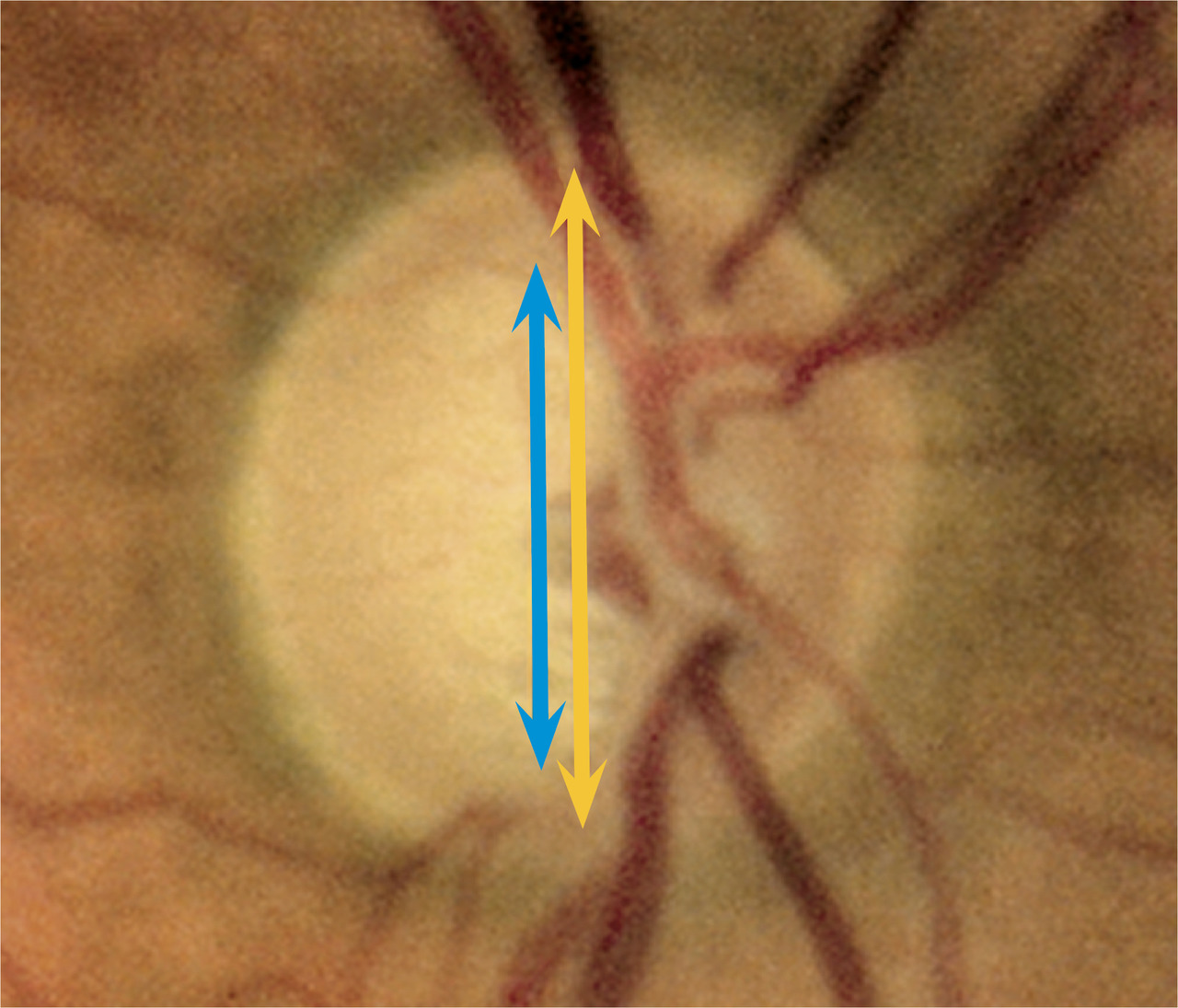
Dans un glaucome, la papille s’excave, se creuse par la destruction des fibres optiques.
Pour comprendre, la papille se décompose schématiquement en deux parties :
Ainsi, plus un rapport cup/disc se rapproche de 1, plus les fibres sont détruites. L’anneau neurorétinien perd de son épaisseur par destruction des fibres, et la papille se creuse.
Classiquement, la papille commence à s’excaver sur l’axe vertical, puis se creuse progressivement sur l’ensemble de l’anneau.
L’acuité visuelle est très longtemps conservée dans le glaucome à 10/10 Parinaud 2.
Au stade agonique, le sujet peut présenter une acuité visuelle à 10/10 avec une perte totale du champ visuel : le sujet est alors incapable de se déplacer dans une pièce qu’il ne connaît pas alors qu’il lit 10/10.
La PIO est le premier des paramètres à savoir interpréter.
L’intervalle de valeurs normales est de 10 à 21 mmHg.
Dans le glaucome chronique, la PIO est dans la majorité des cas élevée, voire très élevée.
Elle se mesure en pratique quotidienne de deux manières :
- tonométrie à l’aplanation, avec un tonomètre de Goldmann. Il s’agit, après avoir anesthésié la cornée, de placer un cône sur la cornée et d’y appliquer une force mesurée à l’aide d’une mollette graduée en mmHg. Cette technique est plus fiable que la tonométrie à air ;
- tonométrie à air pulsé automatisée. Il s’agit ici d’analyser la déformation de la cornée après un jet d’air projeté au centre de celle-ci. Cette technique est rapide, sans contact oculaire, ne nécessite pas d’anesthésie de la cornée, mais est moins fiable que l’aplanation pour les PIO élevées et pour les cornées très fines ou très épaisses.
La mesure de la PIO peut être biaisée par l’épaisseur de la cornée. La mesure de l’épaisseur de la cornée ou pachymétrie est importante à rechercher. Déformer une cornée épaisse nécessite plus de force qu’une cornée fine. Ainsi, si la cornée est fine, une valeur de PIO d’allure normale pourra être pathologique, et peut faire porter le diagnostic de glaucome à pression normale. De la même manière, si la cornée est épaisse, une valeur un peu au-dessus de la normale (par exemple 23 mmHg) pourra n’entraîner aucun retentissement sur le nerf optique et fera poser le diagnostic d’hypertonie oculaire simple isolée.
La gonioscopie ou étude biomicroscopique de l’angle irido- cornéen est également un facteur clinique important. En effet, un examen à la lampe à fente seul ne peut pas présumer d’un angle irido-cornéen ouvert ou fermé. On utilise alors, après anesthésie cornéenne, un verre d’examen dit contact type verre à trois miroirs de Goldmann (car il touche la cornée) pour visualiser l’angle irido-cornéen. La pupille ne doit pas être dilatée pour cet examen.
Une gonioscopie est à réaliser de façon systématique dans toute hypertonie oculaire pour en apprécier l’origine : elle permet de dire si l’angle est ouvert ou fermé.
Évidemment, l’angle irido-cornéen d’un glaucome à angle ouvert est ouvert.
L’analyse de la papille au fond d’œil : élément majeur du diagnostic puis du suivi, l’analyse de la papille permet d’évaluer cliniquement la présence puis la progression d’une neuropathie glaucomateuse. Celle-ci se réalise à la lampe à fente, avec un verre contact type gonioscope ou verre à trois miroirs, soit avec un verre non contact sur une pupille dilatée de préférence pour mieux apprécier les détails de la papille.
L’utilisation de rétinophotographie est très fréquente pour le suivi.
Dans un glaucome, la papille s’excave, se creuse par la destruction des fibres optiques.
Pour comprendre, la papille se décompose schématiquement en deux parties :
- le cup, zone centrale jaune blanchâtre ne comportant pas de fibres optiques ;
- l’anneau neurorétinien, partie jaune-orangé entourant le cup central, contenant les fibres optiques. Un rapport cup/disc compris entre 0 et 1 est considéré comme normal s’il est inférieur à 0,5.
Ainsi, plus un rapport cup/disc se rapproche de 1, plus les fibres sont détruites. L’anneau neurorétinien perd de son épaisseur par destruction des fibres, et la papille se creuse.
Classiquement, la papille commence à s’excaver sur l’axe vertical, puis se creuse progressivement sur l’ensemble de l’anneau.
Paraclinique
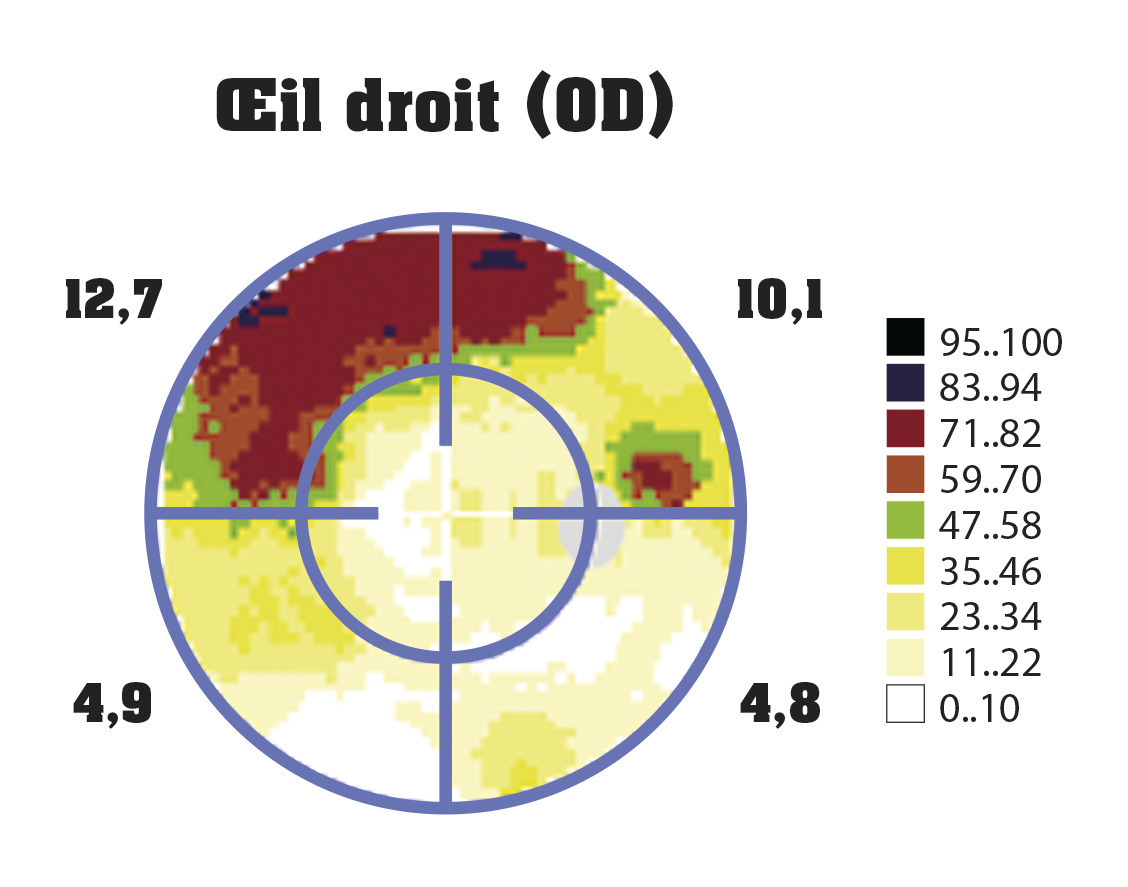
Le champ visuel est primordial dans le diagnostic et le suivi d’un glaucome. C’est un examen non invasif qui doit être répété fréquemment. La périmétrie statique automatisée en blanc-blanc est la méthode de référence pour le suivi du glaucome : le sujet a aussi la tête dans une coupole, il fixe un point central, des points lumineux apparaissent accompagnés d’un signal sonore, et il doit actionner un interrupteur lorsqu’il perçoit le point lumineux. Parfois, seul un signal sonore est généré, ce qui permet d’identifier d’éventuelles erreurs. Cette technique est rapide, fiable et reproductible dans le temps et permet d’apprécier la stabilité ou la dégradation du champ visuel.
(La périmétrie cinétique de Goldman 1er, méthode d’analyse du champ visuel décrite, ne doit plus être utilisée dans le suivi des glaucomes.)
Le champ visuel est un examen subjectif, il existe des variations en fonction de la fatigue ou de la motivation du patient. C’est un examen à réaliser assis, où le sujet fixe un point central pendant plusieurs minutes.
Au début de l’évolution glaucomateuse, le champ visuel peut être encore normal, puis il s’altère lorsque au moins 30 % des fibres nerveuses rétiniennes sont détruites.
Les altérations glaucomateuses du champ visuel sont (par ordre de sévérité) :
L’OCT des fibres optiques ou « RNFL (retinal nerve fibre layer). L’OCT ou tomographie en cohérence optique utilise un signal lumineux pour obtenir de manière non invasive une coupe quasi histologique de la rétine et une mesure de l’épaisseur des fibres optiques. Cet examen est aujourd’hui massivement utilisé dans le diagnostic et le suivi d’un glaucome en analysant la structure du nerf optique (épaisseur des fibres rétiniennes en parapapillaire) ou épaisseur des cellules ganglionnaires en région maculaire.
Exemple pour bien assimiler : un patient de 58 ans se présente pour un renouvellement de lunettes. La tonométrie à air pulsé automatisée retrouve une PIO à 26 mmHg aux deux yeux. Une pachymétrie normale permet d’éliminer une cornée épaisse, qui aurait pu fausser les mesures. L’examen à la lampe à fente à l’aide du verre à gonioscopie objective un angle ouvert non pigmenté. L’analyse de la papille au fond d’œil à l’aide d’une rétinographie non mydriatique retrouve une excavation à 0,7, ce qui motive la réalisation d’un champ visuel retrouvant un scotome arciforme. L’OCT retrouve une importante perte en fibres optiques. Le diagnostic de glaucome primitif à angle ouvert est posé.
(La périmétrie cinétique de Goldman 1er, méthode d’analyse du champ visuel décrite, ne doit plus être utilisée dans le suivi des glaucomes.)
Le champ visuel est un examen subjectif, il existe des variations en fonction de la fatigue ou de la motivation du patient. C’est un examen à réaliser assis, où le sujet fixe un point central pendant plusieurs minutes.
Au début de l’évolution glaucomateuse, le champ visuel peut être encore normal, puis il s’altère lorsque au moins 30 % des fibres nerveuses rétiniennes sont détruites.
Les altérations glaucomateuses du champ visuel sont (par ordre de sévérité) :
- le ressaut nasal : début d’altération classiquement nasale à la limite des 30 ° centraux dans un hémichamp supérieur ou inférieur ;
- le scotome arciforme de Bjerrum entre les 10 ° et 30 ° centraux contournant le point de fixation centrale et relié à la papille. Traduction d’un déficit fasciculaire complet ;
- la réduction concentrique du champ visuel, avec un îlot central résiduel, au stade très avancé, dit agonique.
L’OCT des fibres optiques ou « RNFL (retinal nerve fibre layer). L’OCT ou tomographie en cohérence optique utilise un signal lumineux pour obtenir de manière non invasive une coupe quasi histologique de la rétine et une mesure de l’épaisseur des fibres optiques. Cet examen est aujourd’hui massivement utilisé dans le diagnostic et le suivi d’un glaucome en analysant la structure du nerf optique (épaisseur des fibres rétiniennes en parapapillaire) ou épaisseur des cellules ganglionnaires en région maculaire.
Exemple pour bien assimiler : un patient de 58 ans se présente pour un renouvellement de lunettes. La tonométrie à air pulsé automatisée retrouve une PIO à 26 mmHg aux deux yeux. Une pachymétrie normale permet d’éliminer une cornée épaisse, qui aurait pu fausser les mesures. L’examen à la lampe à fente à l’aide du verre à gonioscopie objective un angle ouvert non pigmenté. L’analyse de la papille au fond d’œil à l’aide d’une rétinographie non mydriatique retrouve une excavation à 0,7, ce qui motive la réalisation d’un champ visuel retrouvant un scotome arciforme. L’OCT retrouve une importante perte en fibres optiques. Le diagnostic de glaucome primitif à angle ouvert est posé.
Stades de la maladie glaucomateuse
Le glaucome est une maladie souvent bilatérale asymétrique avec un œil plus atteint que l’autre (la bilatéralisation peut survenir après plusieurs années d’évolution).
On distingue :
On distingue :
- l’hypertonie oculaire isolée : PIO élevée sans atteinte du nerf optique. La conversion en glaucome peut survenir après plusieurs années d’évolution ;
- le glaucome précampimétrique et débutant : nerf optique altérés, champ visuel peu ou pas modifié : le sujet est encore asymptomatique ;
- le glaucome modéré : nerf optique et champ visuel altéré ;
- le glaucome sévère : nerf optique très excavé et champ visuel très altéré. À ce stade, le sujet ressent une gêne visuelle. Avec l’allongement de l’espérance de vie, les patients atteignent ce stade de glaucome handicapant visuellement les dernières années de leur vie.
Suivi du patient glaucomateux
Il s’agit de monitorer au fil du temps la PIO, l’excavation du nerf optique et l’examen du champ visuel pour évaluer la stabilité ou la progression de la maladie.
Le rythme de suivi, une fois la PIO normalisée, dépend du stade de la maladie : annuel pour les formes débutantes, il devient ensuite semestriel pour les formes modérées et sévères.
La surveillance du traitement nécessite de mesurer son efficacité sur la baisse de la PIO et de vérifier la bonne tolérance du traitement.
Le rythme de suivi, une fois la PIO normalisée, dépend du stade de la maladie : annuel pour les formes débutantes, il devient ensuite semestriel pour les formes modérées et sévères.
La surveillance du traitement nécessite de mesurer son efficacité sur la baisse de la PIO et de vérifier la bonne tolérance du traitement.
Traitement du glaucome
Le traitement du glaucome chronique à angle ouvert a pour objectif de ralentir voire de stopper la destruction des fibres optiques par la baisse de la PIO.
À ce jour, aucun traitement ne permet de restaurer la vision et les déficits du champ visuel, quand le nerf optique est très altéré, et aucun traitement n’est curatif.
Le traitement est constitué de trois volets qui se suivent le plus souvent : médical, physique (laser) et chirurgie.
À ce jour, aucun traitement ne permet de restaurer la vision et les déficits du champ visuel, quand le nerf optique est très altéré, et aucun traitement n’est curatif.
Le traitement est constitué de trois volets qui se suivent le plus souvent : médical, physique (laser) et chirurgie.
Traitement médical (tableau)
Les collyres hypotonisants sont à utiliser en première intention.
Les molécules qui ont l’AMM en première intention sont les analogues des prostaglandines et les bêtabloquants et sont les plus importantes à connaître. La première ligne de traitement est une monothérapie en mono-instillation. En effet, on tente de réduire le nombre de gouttes à instiller quotidiennement, car l’inobservance est un problème majeur dans le glaucome, comme dans toute maladie chronique asymptomatique.
Les analogues des prostaglandines : au niveau des DCI, le suffixe est « -prost » ; chef de file : latanoprost (bimatoprost, travoprost). Cette catégorie permet d’obtenir la baisse de PIO la plus importante (de 25 à 30 %).
Ils agissent par augmentation de la réabsorption de l’humeur aqueuse par voie uvéosclérale.
Les principaux effets secondaires sont locaux au niveau de l’œil : une hyperhémie conjonctivale fréquente (de 3 à 10 %) n’est pas un signe d’intolérance. Cependant, l’aspect inesthétique d’une hyperhémie conjonctivale marquée peut être une cause d’arrêt du traitement. L’assombrissement de la couleur de l’iris bicolore est rare, mais le patient doit être informé, et une pousse des cils est très fréquente.
Il existe peu de contre-indication, en dehors des uvéites actives et des kératites herpétiques actives.
Le traitement est administré en mono-instillation le soir.
L’usage des analogues de prostaglandines dans le traitement du glaucome a entraîné une baisse des chirurgies de glaucome de 30 % environ, preuve de leur efficacité.
Les bêtabloquants : au niveau des DCI, tout comme les bêtabloquants per os, le suffixe est « -ol » ; chef de file : timolol non sélectif, cartéolol avec activité sympathicomimétique, etc.
Ils agissent par diminution de la production de l’humeur aqueuse au niveau des corps ciliaires.
Les contre-indications sont les mêmes que celles des bêtabloquants par voie générale : asthme, bloc auriculoventriculaire de haut degré, insuffisance cardiaque, syndrome de Raynaud. Ces contre-indications sont impératives à rechercher car les effets systémiques peuvent être graves (malaise, hospitalisation). Ils n’ont quasiment pas d’effet secondaire locaux. La baisse pressionnelle est un peu moins forte (25 %) que celle obtenue avec les analogues de prostaglandine.
Les autres classes sont utilisées en compléments en cas de réponse insuffisante ou de contre-indication aux molécules de première intention.
Les agonistes alpha-2 adrénergiques : brimonidine. Instillation biquotidienne.
Les inhibiteurs de l’anhydrase carbonique : suffixe « olamide », exemple : en collyre brinzolamide, dorzolamide, en instillation biquotidienne et per os acétazolamide.
La pilocarpine n’est plus prescrite pour le traitement du GCAO.
Une monothérapie est instaurée en première intention : les analogues de prostaglandines ou les bêtabloquants. La maladie peut être contrôlée par une monothérapie chez environ la moitié des patients.
Suivant l’évolution, l’ophtalmologiste peut être amené à prescrire une bithérapie. Pour faciliter l’observance, des associations pharmacologiques fixes existent dans le même flacon réduisant le nombre de flacons et simplifiant le traitement. La majorité des associations fixes de collyre contiennent du timolol (exemple : timolol et dorzolamide, timolol et brinzolamide, timolol et brimonodine, ou timolol et analogue de prostaglandine). Une association fixe sans bêtabloquant existe, associant brinzolamide et brimonidine. Les effets secondaires des associations fixes sont ceux de chaque principe actif.
En cas de baisse pressionnelle insuffisante ou de remontée tensionnelle au cours de l’évolution de la maladie, une bithérapie est utilisée : une association bêtabloquant et analogues de prostaglandine est fréquemment prescrite.
Parfois, en attente d’un traitement chirurgical devant une hypertonie résistante à une tri- voire une quadrithérapie locale, on peut prescrire temporairement Diamox per os, inhibiteur de l’anhydrase carbonique. Une surveillance de la fonction rénale est de mise car Diamox est un diurétique qui provoque des hypokaliémies. Il entraîne également lithiase rénale et acidoses métaboliques. Enfin, l’allergie aux sulfamides est à prendre en compte.
Les molécules qui ont l’AMM en première intention sont les analogues des prostaglandines et les bêtabloquants et sont les plus importantes à connaître. La première ligne de traitement est une monothérapie en mono-instillation. En effet, on tente de réduire le nombre de gouttes à instiller quotidiennement, car l’inobservance est un problème majeur dans le glaucome, comme dans toute maladie chronique asymptomatique.
Les analogues des prostaglandines : au niveau des DCI, le suffixe est « -prost » ; chef de file : latanoprost (bimatoprost, travoprost). Cette catégorie permet d’obtenir la baisse de PIO la plus importante (de 25 à 30 %).
Ils agissent par augmentation de la réabsorption de l’humeur aqueuse par voie uvéosclérale.
Les principaux effets secondaires sont locaux au niveau de l’œil : une hyperhémie conjonctivale fréquente (de 3 à 10 %) n’est pas un signe d’intolérance. Cependant, l’aspect inesthétique d’une hyperhémie conjonctivale marquée peut être une cause d’arrêt du traitement. L’assombrissement de la couleur de l’iris bicolore est rare, mais le patient doit être informé, et une pousse des cils est très fréquente.
Il existe peu de contre-indication, en dehors des uvéites actives et des kératites herpétiques actives.
Le traitement est administré en mono-instillation le soir.
L’usage des analogues de prostaglandines dans le traitement du glaucome a entraîné une baisse des chirurgies de glaucome de 30 % environ, preuve de leur efficacité.
Les bêtabloquants : au niveau des DCI, tout comme les bêtabloquants per os, le suffixe est « -ol » ; chef de file : timolol non sélectif, cartéolol avec activité sympathicomimétique, etc.
Ils agissent par diminution de la production de l’humeur aqueuse au niveau des corps ciliaires.
Les contre-indications sont les mêmes que celles des bêtabloquants par voie générale : asthme, bloc auriculoventriculaire de haut degré, insuffisance cardiaque, syndrome de Raynaud. Ces contre-indications sont impératives à rechercher car les effets systémiques peuvent être graves (malaise, hospitalisation). Ils n’ont quasiment pas d’effet secondaire locaux. La baisse pressionnelle est un peu moins forte (25 %) que celle obtenue avec les analogues de prostaglandine.
Les autres classes sont utilisées en compléments en cas de réponse insuffisante ou de contre-indication aux molécules de première intention.
Les agonistes alpha-2 adrénergiques : brimonidine. Instillation biquotidienne.
Les inhibiteurs de l’anhydrase carbonique : suffixe « olamide », exemple : en collyre brinzolamide, dorzolamide, en instillation biquotidienne et per os acétazolamide.
La pilocarpine n’est plus prescrite pour le traitement du GCAO.
Une monothérapie est instaurée en première intention : les analogues de prostaglandines ou les bêtabloquants. La maladie peut être contrôlée par une monothérapie chez environ la moitié des patients.
Suivant l’évolution, l’ophtalmologiste peut être amené à prescrire une bithérapie. Pour faciliter l’observance, des associations pharmacologiques fixes existent dans le même flacon réduisant le nombre de flacons et simplifiant le traitement. La majorité des associations fixes de collyre contiennent du timolol (exemple : timolol et dorzolamide, timolol et brinzolamide, timolol et brimonodine, ou timolol et analogue de prostaglandine). Une association fixe sans bêtabloquant existe, associant brinzolamide et brimonidine. Les effets secondaires des associations fixes sont ceux de chaque principe actif.
En cas de baisse pressionnelle insuffisante ou de remontée tensionnelle au cours de l’évolution de la maladie, une bithérapie est utilisée : une association bêtabloquant et analogues de prostaglandine est fréquemment prescrite.
Parfois, en attente d’un traitement chirurgical devant une hypertonie résistante à une tri- voire une quadrithérapie locale, on peut prescrire temporairement Diamox per os, inhibiteur de l’anhydrase carbonique. Une surveillance de la fonction rénale est de mise car Diamox est un diurétique qui provoque des hypokaliémies. Il entraîne également lithiase rénale et acidoses métaboliques. Enfin, l’allergie aux sulfamides est à prendre en compte.
Traitement physique
Il est réalisé par le laser SLT (trabéculoplastie au laser Selecta). L’angle irido-cornéen est traité par des impacts de laser, amenant une amélioration de l’écoulement de l’humeur aqueuse par le trabéculum et une baisse de la PIO de 25 % environ. La réponse d’un patient au traitement est variable (sujets non répondeurs), de même que la durée de l’efficacité du laser dans le temps. Le laser SLT est possible chez des sujets intolérants aux collyres ou inobservants.
Le SLT est utilisé aussi pour réduire le nombre de collyres ou obtenir une baisse pressionnelle supplémentaire au traitement collyre.
Le SLT est utilisé aussi pour réduire le nombre de collyres ou obtenir une baisse pressionnelle supplémentaire au traitement collyre.
Chirurgie
Il existe deux principales techniques chirurgicales de chirurgie filtrante dans la prise en charge du glaucome :
- la trabéculectomie : c’est la technique la plus ancienne et la plus réalisée. Son principe repose sur la création d’une fistule entre la chambre antérieure de l’œil et l’espace sous-conjonctival après réalisation d’un volet scléral. Cette bulle se situe à la partie supérieure de l’œil et est le plus souvent cachée par la paupière supérieure. L’humeur aqueuse se draine de la chambre antérieure vers cet espace sous-conjonctival avant d’être réabsorbée par les lymphatiques conjonctivaux. Cette chirurgie présente des complications précoces : hyphéma (sang en chambre antérieure), hypotonie, baisse d’acuité visuelle transitoire et des complications tardives (fibrose de la bulle avec remontée tensionnelle, rarement endophtalmie) ;
- la sclérectomie profonde non perforante, technique plus récente, consiste en une ablation d’une grande partie du trabéculum sous un volet scléral sans fistule avec la chambre antérieure. Cette technique réduit les complications précoces.
Points forts
Glaucome chronique
Le glaucome chronique à angle ouvert est une neuropathie optique antérieure évolutive progressant en détruisant irréversiblement le champ visuel sous l’influence forte d’une pression intraoculaire trop élevée.
Plus fréquent avec l’âge, longtemps asymptomatique, un dépistage de la maladie est nécessaire après 45 ans pour instituer un traitement au stade débutant du glaucome.
L’excavation papillaire et le déficit du champ visuel progressent avec l’évolution de la maladie. L’acuité visuelle est atteinte dans les stades de glaucomes très évolués.
Le traitement repose sur l’obtention d’une baisse de pression intra-oculaire avec les collyres hypotonisants en première intention (analogue de prostaglandine ou bêtabloquant).
Rapport de la SFO 2014 : le glaucome primitif à angle ouvert.
European Glaucoma Society Guidelines, 4e édition.
European Glaucoma Society Guidelines, 4e édition.

 Encadrés
Encadrés