Chez les patients porteurs d’une insuffisance cardiaque (IC) gauche, la présence d’une hypertension pulmonaire (HTP), qui n’est pas une maladie mais une situation hémodynamique, est fréquente et est dite « post-capillaire » (HTPpc ou groupe 2 de la classification mondiale), au contraire des autres formes d’HTP.1
Forme d’HTP la plus fréquente
Ainsi, et compte tenu de la forte prévalence de l’insuffisance cardiaque dans le monde (environ 23 millions de patients), l’HTP liée aux pathologies cardiaques gauches représente la première forme d’HTP, soit environ 65 à 80 % des cas rencontrés.1
L’HTPpc concerne aussi bien les patients avec IC à fraction d’éjection ventriculaire gauche préservée (IC-FEP), modérément réduite ou réduite (IC-FER) en cas de cardiopathie valvulaire gauche, et enfin ceux avec une cardiopathie congénitale. Néanmoins, la prévalence précise de l’HTPpc chez les patients insuffisants cardiaques, et plus précisément au sein de ces différents groupes, est difficile à évaluer, car elle dépend de la méthode diagnostique (non invasive, avec l’échographie cardiaque, versus invasive, utilisant le cathétérisme cardiaque droit) ainsi que du seuil utilisé pour parler d’HTPpc. Des études observationnelles estiment que la prévalence de l’HTPpc se situe entre 40 et 72 % en cas d’IC-FER et entre 36 et 83 % en cas d’IC-FEP.1-3 Cette prévalence atteint 65 % chez les patients porteurs d’une sténose aortique et l’on peut considérer que presque tous les patients porteurs d’un rétrécissement mitral sévère développeront une HTPpc si celui-ci n’est pas corrigé.1
L’HTPpc des cardiopathies gauches représente toujours un tournant évolutif péjoratif de la pathologie cardiaque gauche sous-jacente, car c’est sans doute un marqueur de sévérité de l’IC. Dans l’IC-FEP comme dans l’IC-FER, Vanderpool et al. ont montré (au sein d’une cohorte rétrospective de patients avec IC ayant bénéficié d’un cathétérisme cardiaque droit) que la mortalité des patients avec une HTPpc était significativement supérieure à celle de ceux n’ayant pas d’HTP, et qu’elle était même comparable à celle de l’HTP précapillaire (médiane de survie d’environ cinq ans) avec également un sur-risque d’hospitalisation pour IC.4
L’HTPpc concerne aussi bien les patients avec IC à fraction d’éjection ventriculaire gauche préservée (IC-FEP), modérément réduite ou réduite (IC-FER) en cas de cardiopathie valvulaire gauche, et enfin ceux avec une cardiopathie congénitale. Néanmoins, la prévalence précise de l’HTPpc chez les patients insuffisants cardiaques, et plus précisément au sein de ces différents groupes, est difficile à évaluer, car elle dépend de la méthode diagnostique (non invasive, avec l’échographie cardiaque, versus invasive, utilisant le cathétérisme cardiaque droit) ainsi que du seuil utilisé pour parler d’HTPpc. Des études observationnelles estiment que la prévalence de l’HTPpc se situe entre 40 et 72 % en cas d’IC-FER et entre 36 et 83 % en cas d’IC-FEP.1-3 Cette prévalence atteint 65 % chez les patients porteurs d’une sténose aortique et l’on peut considérer que presque tous les patients porteurs d’un rétrécissement mitral sévère développeront une HTPpc si celui-ci n’est pas corrigé.1
L’HTPpc des cardiopathies gauches représente toujours un tournant évolutif péjoratif de la pathologie cardiaque gauche sous-jacente, car c’est sans doute un marqueur de sévérité de l’IC. Dans l’IC-FEP comme dans l’IC-FER, Vanderpool et al. ont montré (au sein d’une cohorte rétrospective de patients avec IC ayant bénéficié d’un cathétérisme cardiaque droit) que la mortalité des patients avec une HTPpc était significativement supérieure à celle de ceux n’ayant pas d’HTP, et qu’elle était même comparable à celle de l’HTP précapillaire (médiane de survie d’environ cinq ans) avec également un sur-risque d’hospitalisation pour IC.4
Définition actualisée
Il est primordial de se souvenir que le diagnostic de l’HTPpc requiert, comme pour toutes les autres formes d’HTP, une évaluation hémodynamique invasive, qui repose sur la pression artérielle pulmonaire moyenne (PAPm) et la pression artérielle pulmonaire d’occlusion (PAPO), et des mesures très précises.1
De plus, au sein des HTPpc, on distingue deux groupes : l’HTPpc isolée (avec uniquement une composante post-capillaire) et l’HTPpc dite « combinée » (avec une composante précapillaire associée à l’HTP post-capillaire).
Au cours des quinze dernières années, plusieurs définitions se sont succédé pour distinguer ces deux formes, témoignant de l’enjeu qu’il existe à mieux définir ces deux phénotypes de patients.2,5
Les recommandations européennes de 2015 préconisaient d’utiliser le niveau de résistance vasculaire pulmonaire (RVP = (PAPm – PAPO)/débit cardiaque) et le gradient de pression diastolique (DPG = PAP diastolique – PAPO) pour différencier les deux. Mais, au terme du 6e Symposium mondial de l’HTP, en 2018, les gradients de pression diastolique et transpulmonaire (TPG = PAPm – PAPO), sujets à controverses, ont été abandonnés au profit des RVP.2
Par la suite, Maron et al., sur une cohorte rétrospective nord-américaine, ont successivement montré que la mortalité toutes causes augmentait dès lors que le niveau de PAPm était > 19 mmHg et que celui de RVP était > 2,2 UW.6,7
Ainsi, les définitions retenues de l’HTPpc sont désormais les suivantes :
De plus, au sein des HTPpc, on distingue deux groupes : l’HTPpc isolée (avec uniquement une composante post-capillaire) et l’HTPpc dite « combinée » (avec une composante précapillaire associée à l’HTP post-capillaire).
Au cours des quinze dernières années, plusieurs définitions se sont succédé pour distinguer ces deux formes, témoignant de l’enjeu qu’il existe à mieux définir ces deux phénotypes de patients.2,5
Les recommandations européennes de 2015 préconisaient d’utiliser le niveau de résistance vasculaire pulmonaire (RVP = (PAPm – PAPO)/débit cardiaque) et le gradient de pression diastolique (DPG = PAP diastolique – PAPO) pour différencier les deux. Mais, au terme du 6e Symposium mondial de l’HTP, en 2018, les gradients de pression diastolique et transpulmonaire (TPG = PAPm – PAPO), sujets à controverses, ont été abandonnés au profit des RVP.2
Par la suite, Maron et al., sur une cohorte rétrospective nord-américaine, ont successivement montré que la mortalité toutes causes augmentait dès lors que le niveau de PAPm était > 19 mmHg et que celui de RVP était > 2,2 UW.6,7
Ainsi, les définitions retenues de l’HTPpc sont désormais les suivantes :
- HTPpc isolée : PAPm > 20 mmHg et PAPO > 15 mmHg et PVR < 2 UW ;
- HTPpc combinée : PAPm > 20 mmHg et PAPO >15 mmHg et PVR ≥ 2 UW.
Physiopathologie
Le premier déterminant hémodynamique de l’HTPpc est un trouble de la compliance ventriculaire gauche associé à une élévation des pressions de remplissage, avec pour conséquence une élévation rétrograde de la pression dans l’atrium gauche, elle-même transmise au système veineux, capillaire et artériel pulmonaire.2,3,8 Dans ce cas, le problème est principalement mécanique, et l’amélioration de la fonction ventriculaire gauche (systolique et/ou diastolique) et la restauration d’une volémie correcte permettent généralement d’améliorer, voire de normaliser, le niveau de pression pulmonaire : on parle d’HTPpc isolée.
S’il existe, en plus de ce phénomène passif et uniquement post-capillaire, une dysfonction endothéliale semblable à celle existant dans les formes précapillaires d’HTP, le remodelage artériel pulmonaire qui s’ensuit aboutit à une augmentation des RVP, et donc à une augmentation disproportionnée de la PAPm par rapport à la PAPO : on parle dans ce cas d’HTPpc combinée, et le traitement de l’IC gauche ne suffit pas à lui seul à corriger cette HTP.
Même si c’est séduisant sur le plan intellectuel, il n’existe pas de preuve formelle quant à l’existence d’un continuum entre ces deux formes et cela n’explique pas pourquoi certains patients développent une forme combinée et d’autres uniquement isolée. De plus, la forme combinée serait peut-être réversible si l’IC pouvait être significativement corrigée (en cas de transplantation cardiaque, par exemple). Le plus souvent, en l’absence de correction possible, il semble que la forme combinée soit plus fréquente en cas d’IC-FEP.3 In fine, les deux formes aboutissent à un découplage de l’unité fonctionnelle « cœur droit-circulation pulmonaire ». Initialement compensé, il évolue progressivement vers une dysfonction ventriculaire droite.
Alors que la définition hémodynamique de l’HTPpc est la même en cas d’IC-FEP ou d’IC-FER, il existe des différences physiopathologiques entre ces deux formes.3
Tout d’abord, les déclencheurs à l’origine de l’HTPpc ne sont pas tous les mêmes. L’HTPpc de l’IC-FEP est volontiers secondaire au syndrome métabolique, avec accumulation de facteurs de risque cardiovasculaire et atteinte coronarienne, alors que l’HTPpc de l’IC-FER est secondaire aux dysfonctions systoliques ventriculaire gauche post-infarctus ou sur cardiomyopathie dilatée avec ou sans insuffisance mitrale secondaire.3 Ainsi, sur le plan cellulaire, il existe une activation pro-inflammatoire excessive responsable d’une hypertrophie cellulaire myocardique puis ventriculaire concentrique dans l’IC-FEP alors qu’elle est excentrique et associée à une perte cellulaire et de la fibrose de remplacement dans l’IC-FER.
La dysfonction atriale gauche est aussi majeure, avec un trouble des fonctions contractile et réservoir. Dans l’IC-FEP, les mécanismes pro-inflammatoires favorisent le développement de la fibrillation atriale avec ou sans insuffisance mitrale. Dans l’IC-FER, la dilatation de l’oreillette gauche secondaire à la présence d’une insuffisance mitrale, plus ou moins dynamique avec l’effort, est un élément important.
Au sein de la circulation vasculaire pulmonaire, la dysfonction endothéliale joue ensuite un rôle central, quelle que soit la fraction d’éjection ventriculaire gauche (FEVG). Au niveau des veines pulmonaires, il existe un épaississement néo-intimal et une hypertrophie de la média. Aux niveaux capillaire et artériolaire pulmonaires, le barotraumatisme secondaire à l’élévation des pressions pulmonaires crée une fuite capillaire dans l’interstitium qui favorise les processus inflammatoires locaux, l’inhibition de la production de monoxyde d’azote (bénéfique), l’augmentation de l’expression de récepteur de l’endothéline (délétère) et ainsi la prolifération myofibroblastique, l’occlusion artériolaire et l’épaississement des septas alvéolaires.
En conséquence, il existe une élévation, plus ou moins importante, de la post-charge ventriculaire droite qui aboutit progressivement à un découplage, c’est-à-dire un dysfonctionnement, de l’unité fonctionnelle « cœur droit-circulation pulmonaire ». De plus, la présence d’une fibrillation atriale, d’une stimulation ventriculaire droite (pacemaker) et les facteurs de risque cardiovasculaire concourent eux aussi à une dysfonction ventriculaire droite intrinsèque, aggravant ce phénomène.
En conclusion, l’HTPpc se caractérise d’abord par un « phénotype ventricule gauche » prédominant qui évolue inexorablement vers un « phénotype ventriculaire droit » prédominant à mesure que la maladie évolue.1,3,9
S’il existe, en plus de ce phénomène passif et uniquement post-capillaire, une dysfonction endothéliale semblable à celle existant dans les formes précapillaires d’HTP, le remodelage artériel pulmonaire qui s’ensuit aboutit à une augmentation des RVP, et donc à une augmentation disproportionnée de la PAPm par rapport à la PAPO : on parle dans ce cas d’HTPpc combinée, et le traitement de l’IC gauche ne suffit pas à lui seul à corriger cette HTP.
Même si c’est séduisant sur le plan intellectuel, il n’existe pas de preuve formelle quant à l’existence d’un continuum entre ces deux formes et cela n’explique pas pourquoi certains patients développent une forme combinée et d’autres uniquement isolée. De plus, la forme combinée serait peut-être réversible si l’IC pouvait être significativement corrigée (en cas de transplantation cardiaque, par exemple). Le plus souvent, en l’absence de correction possible, il semble que la forme combinée soit plus fréquente en cas d’IC-FEP.3 In fine, les deux formes aboutissent à un découplage de l’unité fonctionnelle « cœur droit-circulation pulmonaire ». Initialement compensé, il évolue progressivement vers une dysfonction ventriculaire droite.
Alors que la définition hémodynamique de l’HTPpc est la même en cas d’IC-FEP ou d’IC-FER, il existe des différences physiopathologiques entre ces deux formes.3
Tout d’abord, les déclencheurs à l’origine de l’HTPpc ne sont pas tous les mêmes. L’HTPpc de l’IC-FEP est volontiers secondaire au syndrome métabolique, avec accumulation de facteurs de risque cardiovasculaire et atteinte coronarienne, alors que l’HTPpc de l’IC-FER est secondaire aux dysfonctions systoliques ventriculaire gauche post-infarctus ou sur cardiomyopathie dilatée avec ou sans insuffisance mitrale secondaire.3 Ainsi, sur le plan cellulaire, il existe une activation pro-inflammatoire excessive responsable d’une hypertrophie cellulaire myocardique puis ventriculaire concentrique dans l’IC-FEP alors qu’elle est excentrique et associée à une perte cellulaire et de la fibrose de remplacement dans l’IC-FER.
La dysfonction atriale gauche est aussi majeure, avec un trouble des fonctions contractile et réservoir. Dans l’IC-FEP, les mécanismes pro-inflammatoires favorisent le développement de la fibrillation atriale avec ou sans insuffisance mitrale. Dans l’IC-FER, la dilatation de l’oreillette gauche secondaire à la présence d’une insuffisance mitrale, plus ou moins dynamique avec l’effort, est un élément important.
Au sein de la circulation vasculaire pulmonaire, la dysfonction endothéliale joue ensuite un rôle central, quelle que soit la fraction d’éjection ventriculaire gauche (FEVG). Au niveau des veines pulmonaires, il existe un épaississement néo-intimal et une hypertrophie de la média. Aux niveaux capillaire et artériolaire pulmonaires, le barotraumatisme secondaire à l’élévation des pressions pulmonaires crée une fuite capillaire dans l’interstitium qui favorise les processus inflammatoires locaux, l’inhibition de la production de monoxyde d’azote (bénéfique), l’augmentation de l’expression de récepteur de l’endothéline (délétère) et ainsi la prolifération myofibroblastique, l’occlusion artériolaire et l’épaississement des septas alvéolaires.
En conséquence, il existe une élévation, plus ou moins importante, de la post-charge ventriculaire droite qui aboutit progressivement à un découplage, c’est-à-dire un dysfonctionnement, de l’unité fonctionnelle « cœur droit-circulation pulmonaire ». De plus, la présence d’une fibrillation atriale, d’une stimulation ventriculaire droite (pacemaker) et les facteurs de risque cardiovasculaire concourent eux aussi à une dysfonction ventriculaire droite intrinsèque, aggravant ce phénomène.
En conclusion, l’HTPpc se caractérise d’abord par un « phénotype ventricule gauche » prédominant qui évolue inexorablement vers un « phénotype ventriculaire droit » prédominant à mesure que la maladie évolue.1,3,9
Spécificités cliniques et de prise en charge
Approche diagnostique
En pratique, la situation principalement rencontrée est celle d’un patient dyspnéique (connu ou non insuffisant cardiaque) pour lequel une échocardiographie cardiaque est demandée. En plus de la recherche d’anomalie ventriculaire gauche, l’échographie cardiaque peut mettre en évidence une élévation de la pression artérielle pulmonaire systolique (via la vitesse maximale [Vmax] de l’insuffisance tricuspide) et/ou des signes indirects d’HTP.
L’enjeu est de ne pas méconnaître une HTP précapillaire lorsque l’on pense être face à une HTP liée à une IC, puisque l’implication thérapeutique est différente.
Pour cette problématique, les recommandations actuelles se fondent sur une stratégie en trois étapes :1
L’enjeu est de ne pas méconnaître une HTP précapillaire lorsque l’on pense être face à une HTP liée à une IC, puisque l’implication thérapeutique est différente.
Pour cette problématique, les recommandations actuelles se fondent sur une stratégie en trois étapes :1
- la première consiste à identifier les patients susceptibles d’appartenir au groupe d’HTPpc en fonction de leur phénotype clinique. Pour cela, un interrogatoire ainsi qu’un examen physique rigoureux sont fondamentaux ;
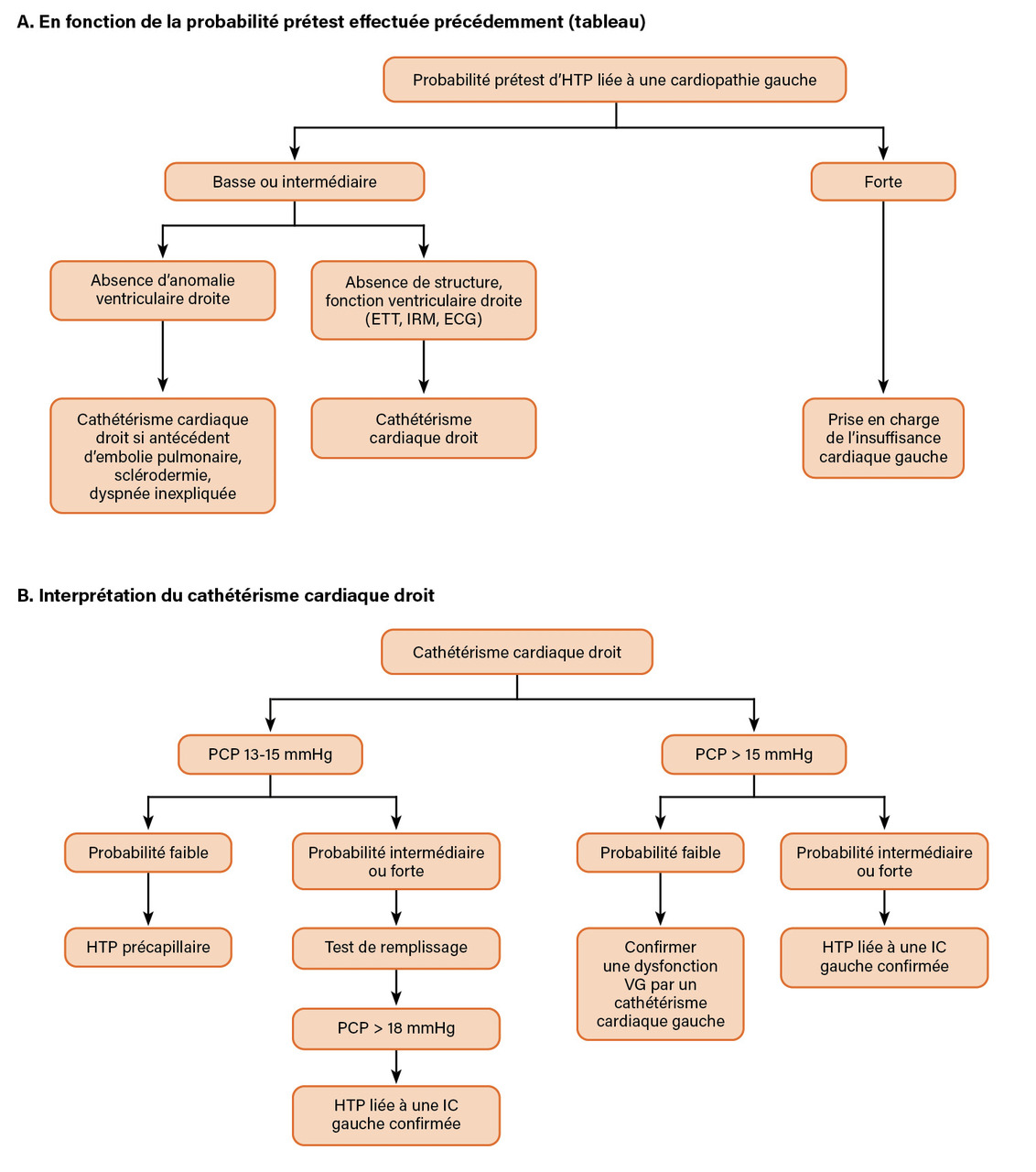
- la deuxième étape consiste, en fonction du phénotype des patients, à déterminer une probabilité prétest pour identifier ceux nécessitant une évaluation invasive par cathétérisme cardiaque droit (
tableau ).2 Plusieurs scores ont été proposés pour s’orienter vers une IC-FEP.10,11 En cas de probabilité forte d’HTP secondaire à une cardiopathie gauche, la prise en charge doit se concentrer sur l’IC et le cathétérisme cardiaque droit n’est pas nécessaire ;
- en cas de probabilité prétest faible ou intermédiaire, il faut passer à la troisième étape, qui consiste à effectuer un cathétérisme cardiaque droit en situation d’euvolémie (
figure [A et B] ).
Terrains particuliers
Lorsque la probabilité est intermédiaire ou basse, a fortiori s’il n’existe pas d’anomalie ventriculaire gauche échographique, il faut rechercher des facteurs de risque d’HTP précapillaire (à l’interrogatoire et à l’examen clinique). En particulier, la recherche d’antécédents d’embolie pulmonaire (en s’aidant d’une scintigraphie ventilation/perfusion), de signes cliniques de sclérodermie, de prise de toxiques (anorexigènes, amphétamines…), d’infection au virus de l’immunodéficience humaine (VIH) doit être systématique.
Lafigure (B) résume la conduite à tenir en fonction de la mesure de la PAPO et de la probabilité prétest. Le test de remplissage consiste à effectuer un remplissage de 500 mL de sérum salé isotonique durant cinq minutes et à analyser la « réponse » ventriculaire gauche : l’élévation de la PAPO au-delà de 18 mmHg traduit une dysfonction diastolique ventriculaire gauche, rendant le test positif.2
La
Prise en charge identique à celle de la cardiopathie gauche en l’absence de traitement spécifique
À l’heure actuelle, et cela malgré de nombreux essais thérapeutiques, il n’existe aucun traitement spécifique ayant montré (avec un bon niveau de preuve) une réelle efficacité pour traiter la maladie vasculaire pulmonaire existant dans l’HTPpc.2 En particulier, les thérapies vasodilatatrices de l’hypertension artérielle pulmonaire (HTAP) ne doivent pas être utilisées même en présence d’une part précapillaire (grade III, A).1,2 Ainsi, le traitement de l’HTPpc reste celui de la cardiopathie gauche.
En cas d’IC-FER, il est nécessaire de suivre les recommandations actuelles12 et d’utiliser l’ensemble des thérapeutiques possibles (médicamenteuses ou non) pour améliorer la volémie et la fonction ventriculaire gauche.
Pour l’IC-FEP, il est maintenant recommandé, en plus de l’optimisation de la congestion et des facteurs de risque cardiovasculaire, d’utiliser une gliflozine (inhibiteurs du cotransporteur sodium-glucose de type 2 [SGLT2]).13 En cas de cardiopathie valvulaire, la prise en charge repose sur le remplacement valvulaire quand il est indiqué, selon les recommandations européennes.14 La persistance d’une HTP après correction de la valvulopathie a fait l’objet d’un essai thérapeutique randomisé avec un inhibiteur de la phosphodiestérase 5 (iPDE5) versus placebo : l’iPDE5 s’est révélé délétère.
Chez les candidats à une transplantation cardiaque récusés car présentant une HTP post-capillaire combinée sévère, la mise en place d’assistance ventriculaire gauche a permis, dans certains cas, de normaliser les pressions pulmonaires de façon que ces patients puissent accéder à une transplantation.15
Enfin, les recommandations européennes de 2022 préconisent une approche individualisée en centre d’expertise et/ou de compétence chez des patients porteurs d’une HTPpc combinée avec des RVP > 5 UW (classe I - C).1
En cas d’IC-FER, il est nécessaire de suivre les recommandations actuelles12 et d’utiliser l’ensemble des thérapeutiques possibles (médicamenteuses ou non) pour améliorer la volémie et la fonction ventriculaire gauche.
Pour l’IC-FEP, il est maintenant recommandé, en plus de l’optimisation de la congestion et des facteurs de risque cardiovasculaire, d’utiliser une gliflozine (inhibiteurs du cotransporteur sodium-glucose de type 2 [SGLT2]).13 En cas de cardiopathie valvulaire, la prise en charge repose sur le remplacement valvulaire quand il est indiqué, selon les recommandations européennes.14 La persistance d’une HTP après correction de la valvulopathie a fait l’objet d’un essai thérapeutique randomisé avec un inhibiteur de la phosphodiestérase 5 (iPDE5) versus placebo : l’iPDE5 s’est révélé délétère.
Chez les candidats à une transplantation cardiaque récusés car présentant une HTP post-capillaire combinée sévère, la mise en place d’assistance ventriculaire gauche a permis, dans certains cas, de normaliser les pressions pulmonaires de façon que ces patients puissent accéder à une transplantation.15
Enfin, les recommandations européennes de 2022 préconisent une approche individualisée en centre d’expertise et/ou de compétence chez des patients porteurs d’une HTPpc combinée avec des RVP > 5 UW (classe I - C).1
Nouvelle classification à la suite du 7e Symposium mondial
En 2024, le 7e Symposium mondial sur l’HTP s’est déroulé à Barcelone. Il a été l’occasion de renforcer les recommandations européennes contre l’utilisation des traitements vasodilatateurs pulmonaires dans l’HTPpc.16 Au-delà, la principale nouveauté est l’établissement d’une classification en quatre stades des HTPpc :
Enfin, les experts ont mis en avant l’intérêt d’un phénotype très précis des cardiopathies gauches, en rappelant que l’HTPpc des cardiopathies valvulaires (aortique ou mitrale) est probablement différente de celle des cardiomyopathies (cardiomyopathie hypertrophique [CMH] et amylose au premier plan) et que des études sont nécessaires, au sein de ces sous-groupes, pour envisager la prise en charge de l’HTPpc la plus optimale possible.
- patients à risque (A) ;
- présence d’une cardiopathie gauche (B) ;
- cardiopathie gauche symptomatique (C) ;
- cardiopathie gauche avancée avec un « phénotype ventriculaire » droit au premier plan (D).
Enfin, les experts ont mis en avant l’intérêt d’un phénotype très précis des cardiopathies gauches, en rappelant que l’HTPpc des cardiopathies valvulaires (aortique ou mitrale) est probablement différente de celle des cardiomyopathies (cardiomyopathie hypertrophique [CMH] et amylose au premier plan) et que des études sont nécessaires, au sein de ces sous-groupes, pour envisager la prise en charge de l’HTPpc la plus optimale possible.
Espoir de nouveaux traitements
L’HTPpc est une complication fréquente de l’IC et en est un marqueur pronostique important. Isolée ou combinée, c’est l’optimisation thérapeutique du traitement de l’IC qui doit rester la priorité en l’absence de traitement spécifique de l’HTPpc. Parmi les essais cliniques en cours, celui sur le sotatercept représente un espoir, après l’échec récent des essais sur la décharge de l’oreillette gauche par des dispositifs de shunt interatriaux.
Références
1. Humbert M, Kovacs G, Hoeper MM, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J 2022;43(38):3618-731.
2. Vachiery JL, Tedford RJ, Rosenkranz S, et al. Pulmonary hypertension due to left heart disease. Eur Respir J 2019;53(1):1801897.
3. Guazzi M, Ghio S, Adir Y. Pulmonary hypertension in HFpEF and HFrEF: JACC review topic of the week. J Am Coll Cardiol 2020;76(9):1102-11.
4. Vanderpool RR, Saul M, Nouraie M, et al. Association between hemodynamic markers of pulmonary hypertension and outcomes in heart failure with preserved ejection fraction. JAMA Cardiol 2018;3(4):298-306.
5. Galie N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J 2016;37(1):67-119.
6. Maron BA, Hess E, Maddox TM, et al. Association of borderline pulmonary hypertension with mortality and hospitalization in a large patient cohort: Insights from the Veterans Affairs Clinical Assessment, Reporting, and Tracking Program. Circulation 2016;133(13):1240-8.
7. Maron BA, Brittain EL, Hess E, et al. Pulmonary vascular resistance and clinical outcomes in patients with pulmonary hypertension: A retrospective cohort study. Lancet Respir Med 2020;8(9):873-84.
8. Maron BA, Kovacs G, Vaidya A, et al. Cardiopulmonary hemodynamics in pulmonary hypertension and heart failure: JACC review topic of the week. J Am Coll Cardiol 2020;76(22):2671-81.
9. Hoeper MM, Lam CSP, Vachiery JL, et al. Pulmonary hypertension in heart failure with preserved ejection fraction: A plea for proper phenotyping and further research. Eur Heart J 2017;38(38):2869-73.
10. Reddy YNV, Carter RE, Obokata M, et al. A simple, evidence-based approach to help guide diagnosis of heart failure with preserved ejection fraction. Circulation 2018;138(9):861-70.
11. Paulus WJ, Tschöpe C, Sanderson JE, et al. How to diagnose diastolic heart failure: A consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J 2007;28(20):2539-50.
12. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;ehab368.
13. McDonagh TA, Metra M, Adamo M, et al. 2023 focused update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2023;44(37):3627-39.
14. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2021;ehab395.
15. Zimpfer D, Zrunek P, Roethy W, et al. Left ventricular assist devices decrease fixed pulmonary hypertension in cardiac transplant candidates. J Thorac Cardiovasc Surg 2007;133(3):689-95.
16. Maron BA, Bortman G, De Marco T, et al. Pulmonary hypertension associated with left heart disease. Eur Respir J 2024;64(4):2401344.
2. Vachiery JL, Tedford RJ, Rosenkranz S, et al. Pulmonary hypertension due to left heart disease. Eur Respir J 2019;53(1):1801897.
3. Guazzi M, Ghio S, Adir Y. Pulmonary hypertension in HFpEF and HFrEF: JACC review topic of the week. J Am Coll Cardiol 2020;76(9):1102-11.
4. Vanderpool RR, Saul M, Nouraie M, et al. Association between hemodynamic markers of pulmonary hypertension and outcomes in heart failure with preserved ejection fraction. JAMA Cardiol 2018;3(4):298-306.
5. Galie N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J 2016;37(1):67-119.
6. Maron BA, Hess E, Maddox TM, et al. Association of borderline pulmonary hypertension with mortality and hospitalization in a large patient cohort: Insights from the Veterans Affairs Clinical Assessment, Reporting, and Tracking Program. Circulation 2016;133(13):1240-8.
7. Maron BA, Brittain EL, Hess E, et al. Pulmonary vascular resistance and clinical outcomes in patients with pulmonary hypertension: A retrospective cohort study. Lancet Respir Med 2020;8(9):873-84.
8. Maron BA, Kovacs G, Vaidya A, et al. Cardiopulmonary hemodynamics in pulmonary hypertension and heart failure: JACC review topic of the week. J Am Coll Cardiol 2020;76(22):2671-81.
9. Hoeper MM, Lam CSP, Vachiery JL, et al. Pulmonary hypertension in heart failure with preserved ejection fraction: A plea for proper phenotyping and further research. Eur Heart J 2017;38(38):2869-73.
10. Reddy YNV, Carter RE, Obokata M, et al. A simple, evidence-based approach to help guide diagnosis of heart failure with preserved ejection fraction. Circulation 2018;138(9):861-70.
11. Paulus WJ, Tschöpe C, Sanderson JE, et al. How to diagnose diastolic heart failure: A consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J 2007;28(20):2539-50.
12. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;ehab368.
13. McDonagh TA, Metra M, Adamo M, et al. 2023 focused update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2023;44(37):3627-39.
14. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2021;ehab395.
15. Zimpfer D, Zrunek P, Roethy W, et al. Left ventricular assist devices decrease fixed pulmonary hypertension in cardiac transplant candidates. J Thorac Cardiovasc Surg 2007;133(3):689-95.
16. Maron BA, Bortman G, De Marco T, et al. Pulmonary hypertension associated with left heart disease. Eur Respir J 2024;64(4):2401344.