L’hypertension pulmonaire thromboembolique chronique (HTP-TEC) est une forme d’hypertension pulmonaire liée, d’une part, à une obstruction chronique des artères pulmonaires par du matériel fibreux, et, d’autre part, à une microvasculopathie secondaire. Elle survient le plus souvent après une ou plusieurs embolies pulmonaires (EP) aiguës qui peuvent parfois passer inaperçues. Elle appartient au groupe 4 de la classification des hypertensions pulmonaires (HTP) dans les dernières recommandations internationales et, comme les autres HTP, peut se compliquer, du fait de l’élévation des pressions dans les artères pulmonaires, d’une insuffisance ventriculaire droite, voire d’une défaillance cardiaque droite et mener au décès.1 En l’absence d’HTP, on utilise le terme de maladie pulmonaire thromboembolique chronique sans HTP.2,3
Épidémiologie et facteurs de risque
L’HTP-TEC est une pathologie rare dont la prévalence est estimée en France à 47 cas par million d’habitants, et dans le monde à environ 3 à 50 cas par million d’habitants, avec d’importantes variations selon les zones géographiques, les méthodes d’évaluation et les groupes d’âge.4,5
Un antécédent d’EP et de thrombose veineuse profonde (TVP) est rapporté chez respectivement 75 % et 56 % des patients ayant une HTP-TEC nouvellement diagnostiquée.6 Une HTP-TEC peut cependant être diagnostiquée en l’absence d’antécédent thromboembolique veineux documenté. Plusieurs facteurs de risque d’HTP-TEC ont été identifiés (tableau ).
L’incidence et la prévalence exactes de l’HTP-TEC après une EP aiguë ne sont pas connues. Une méta-analyse incluant 30 études et regroupant 10 249 patients suivis après une EP a été récemment publiée. Elle rapporte une incidence cumulée d’HTP-TEC de 1,5 % parmi les patients inclus dès le diagnostic d’EP et de 2,7 % parmi les patients survivants et présentant, ou non, des comorbidités majeures. Dans cette même étude, il apparaît que la fréquence de survenue d’une HTP-TEC était plus élevée en cas de récidive d’EP qu’en cas de premier épisode d’EP (odds ratio [OR] = 3) ou si l’EP était non provoquée (versus provoquée) [OR = 4,1].7
Une des raisons expliquant la grande variation d’incidence est la difficulté de distinguer une EP « aiguë » d’une EP survenant sur une HTP-TEC préexistante. Une seule étude a inclus des malades qui avaient eu une échocardiographie lors du diagnostic de l’épisode d’EP aiguë. Dans cette étude prospective, les malades, chez qui une HTP-TEC était diagnostiquée au cours du suivi, avaient une PAP systolique significativement plus élevée lors du diagnostic d’EP (70 ± 21 contre 41 ± 13 mmHg) et avaient tous des signes scanographiques d’HTP-TEC associés à des signes d’EP aiguë. La présentation clinique initiale d’une HTP-TEC peut donc mimer celle d’une EP aiguë.8 Ces résultats ont été confirmés par une étude qui a montré qu’une PAPs supérieure à 50 mmHg au moment du diagnostic d’EP était un facteur de risque indépendant de présenter une HTP-TEC au décours d’une EP (hazard ratio [HR] : 23,5).9
Un antécédent d’EP et de thrombose veineuse profonde (TVP) est rapporté chez respectivement 75 % et 56 % des patients ayant une HTP-TEC nouvellement diagnostiquée.6 Une HTP-TEC peut cependant être diagnostiquée en l’absence d’antécédent thromboembolique veineux documenté. Plusieurs facteurs de risque d’HTP-TEC ont été identifiés (
L’incidence et la prévalence exactes de l’HTP-TEC après une EP aiguë ne sont pas connues. Une méta-analyse incluant 30 études et regroupant 10 249 patients suivis après une EP a été récemment publiée. Elle rapporte une incidence cumulée d’HTP-TEC de 1,5 % parmi les patients inclus dès le diagnostic d’EP et de 2,7 % parmi les patients survivants et présentant, ou non, des comorbidités majeures. Dans cette même étude, il apparaît que la fréquence de survenue d’une HTP-TEC était plus élevée en cas de récidive d’EP qu’en cas de premier épisode d’EP (odds ratio [OR] = 3) ou si l’EP était non provoquée (versus provoquée) [OR = 4,1].7
Une des raisons expliquant la grande variation d’incidence est la difficulté de distinguer une EP « aiguë » d’une EP survenant sur une HTP-TEC préexistante. Une seule étude a inclus des malades qui avaient eu une échocardiographie lors du diagnostic de l’épisode d’EP aiguë. Dans cette étude prospective, les malades, chez qui une HTP-TEC était diagnostiquée au cours du suivi, avaient une PAP systolique significativement plus élevée lors du diagnostic d’EP (70 ± 21 contre 41 ± 13 mmHg) et avaient tous des signes scanographiques d’HTP-TEC associés à des signes d’EP aiguë. La présentation clinique initiale d’une HTP-TEC peut donc mimer celle d’une EP aiguë.8 Ces résultats ont été confirmés par une étude qui a montré qu’une PAPs supérieure à 50 mmHg au moment du diagnostic d’EP était un facteur de risque indépendant de présenter une HTP-TEC au décours d’une EP (hazard ratio [HR] : 23,5).9
Diagnostic
Le diagnostic d’HTP-TEC est posé dans trois situations :
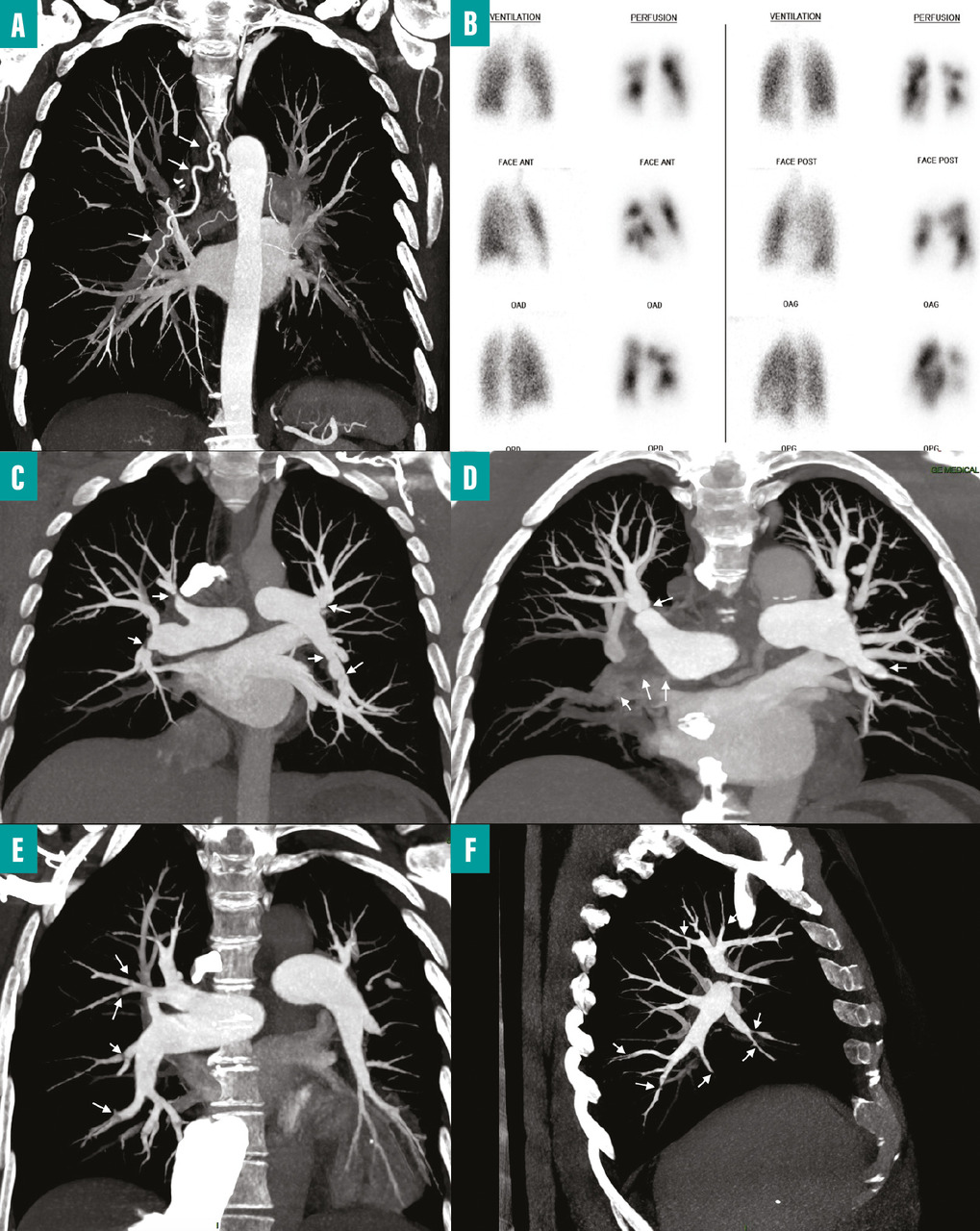
fig. 1B ) et une échographie cardiaque transthoracique afin de rechercher une HTP. En cas de probabilité intermédiaire ou élevée d’hypertension pulmonaire sur l’échographie cardiaque et d’anomalies de la perfusion pulmonaire sur la scintigraphie, il est recommandé d’adresser le patient à un centre de compétence de l’HTP pour confirmer le diagnostic d’HTP-TEC.
Le diagnostic de certitude repose sur la mise en évidence après au moins trois mois de traitement anticoagulant à dose curative :
- au moment du diagnostic d’une EP, chez les patients qui ont une PAPs supérieure à 50 à 60 mmHg et/ou des lésions spécifiques d’embolie pulmonaire chronique associées aux signes d’EP aiguë sur l’angioscanner thoracique (
tableau ). Ces patients doivent impérativement bénéficier d’un bilan de réévaluation après trois mois d’anticoagulation à dose curative ;
- au cours du suivi après une EP, chez les patients qui présentent une dyspnée persistante après au moins trois mois d’anticoagulation à dose curative ;
- au cours du bilan d’une hypertension pulmonaire.1,5
Le diagnostic de certitude repose sur la mise en évidence après au moins trois mois de traitement anticoagulant à dose curative :
- d’une HTP (PAPm > 20 mmHg au cathétérisme cardiaque droit) ;
- d’anomalies de la perfusion pulmonaire associées à une ventilation normale (défauts de perfusion non concordants) sur une scintigraphie pulmonaire de ventilation/perfusion ;
- de lésions thromboemboliques chroniques sur un angioscanner thoracique et/ou une angiographie pulmonaire.
Prise en charge
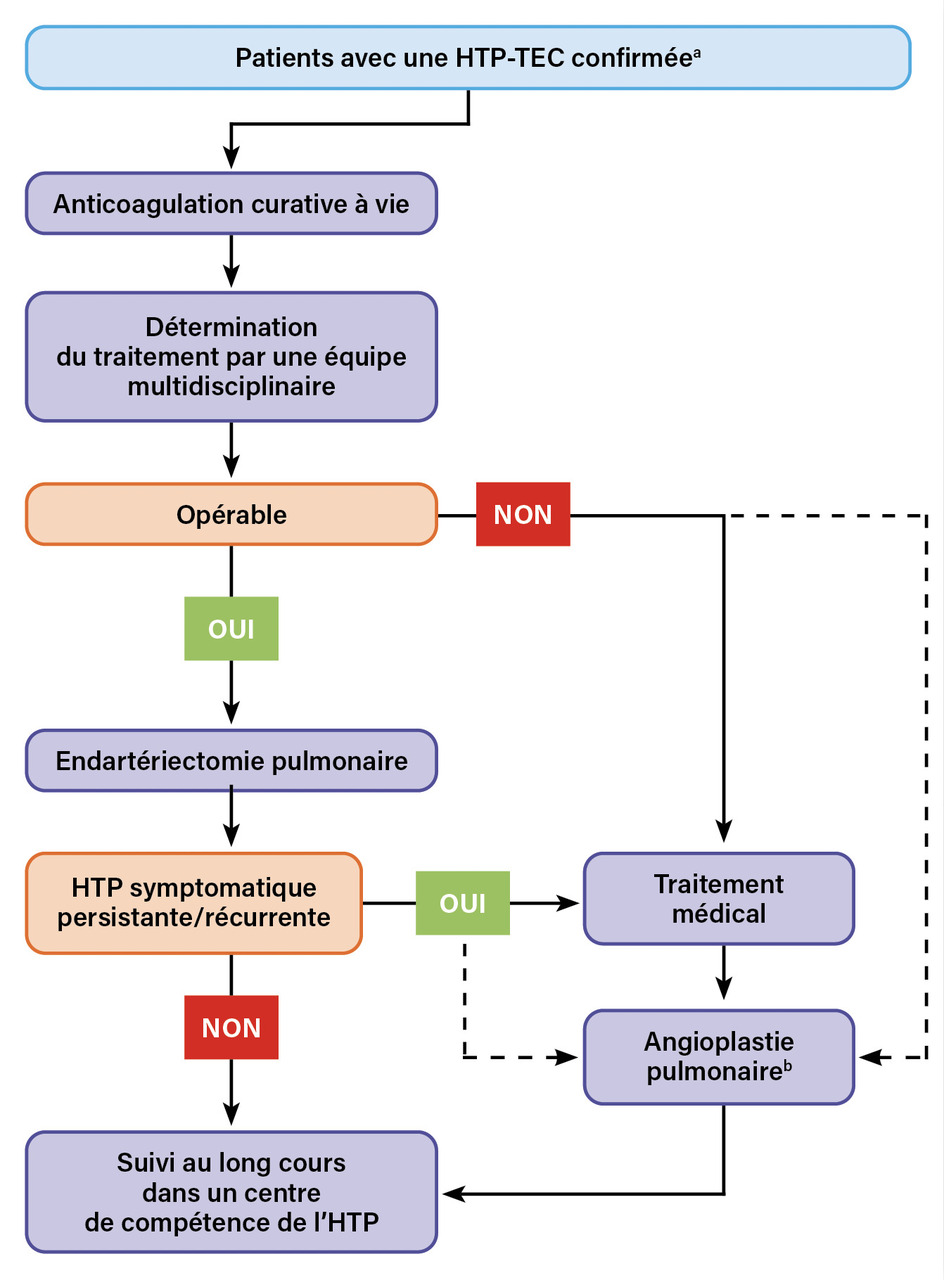
Tous les patients atteints d’HTP-TEC doivent être pris en charge dans un centre de compétence de l’HTP et évalués par une équipe multidisciplinaire afin de déterminer la stratégie thérapeutique la plus adaptée (fig. 2 ). L’équipe multidisciplinaire doit comporter un chirurgien pratiquant des endartériectomies pulmonaires, un radiologue ou un cardiologue effectuant des angioplasties pulmonaires, un médecin spécialisé dans l’HTP et un radiologue spécialisé en imagerie thoracique.11
Anticoagulation
L’anticoagulation curative à vie est recommandée pour tous les patients atteints d’HTP-TEC. Bien que l’expérience clinique avec les antivitamines K (AVK) soit plus importante, l’utilisation des anticoagulants oraux directs (AOD) est également possible dans cette indication. Toutefois, pour les patients avec un syndrome des antiphospholipides (10 % des patients atteints d’HTP-TEC), les AVK sont à privilégier en raison de leur efficacité supérieure à celle des AOD.1,11
Endartériectomie pulmonaire
L’endartériectomie pulmonaire demeure le traitement de référence chez les patients opérables (fig. 1C-D ). L’évaluation de l’opérabilité repose sur l’accessibilité des lésions à cette chirurgie ainsi que sur la présence ou l’absence de comorbidités significatives. Les lésions sont considérées comme accessibles à une endartériectomie pulmonaire lorsqu’elles se situent au niveau tronculaire, lobaire ou segmentaire proximal.
Cette intervention chirurgicale est réalisée par sternotomie médiane et nécessite une circulation extracorporelle et une hypothermie profonde afin d’assurer une neuroprotection en période d’arrêt circulatoire complet. Elle ne s’effectue que dans quelques centres experts dans le monde (hôpital Marie-Lannelongue en France).
Les progrès réalisés dans la prise en charge chirurgicale, périopératoire et dans la sélection des patients ont permis de réduire la mortalité périopératoire, qui est actuellement d’environ 2 à 3 %.
Dans la majorité des cas, cette intervention entraîne une amélioration très significative des symptômes, des capacités à l’exercice, de la qualité de vie et de l’hémodynamique pulmonaire.11 Elle est également associée à une amélioration de la survie, avec un taux de survie à cinq ans de 83 % pour les patients opérés, contre 55 % pour les patients ayant refusé la chirurgie dans une cohorte anglaise.12
Chez les patients ayant une HTP sévère, un traitement médical est parfois débuté en préopératoire afin de réduire les résistances vasculaires pulmonaires (RVP). Cette approche vise à diminuer les risques associés à l’intervention chirurgicale. L’efficacité de cette stratégie en matière de réduction de la mortalité périopératoire n’a toutefois pas été démontrée à ce jour.13
Cette intervention chirurgicale est réalisée par sternotomie médiane et nécessite une circulation extracorporelle et une hypothermie profonde afin d’assurer une neuroprotection en période d’arrêt circulatoire complet. Elle ne s’effectue que dans quelques centres experts dans le monde (hôpital Marie-Lannelongue en France).
Les progrès réalisés dans la prise en charge chirurgicale, périopératoire et dans la sélection des patients ont permis de réduire la mortalité périopératoire, qui est actuellement d’environ 2 à 3 %.
Dans la majorité des cas, cette intervention entraîne une amélioration très significative des symptômes, des capacités à l’exercice, de la qualité de vie et de l’hémodynamique pulmonaire.11 Elle est également associée à une amélioration de la survie, avec un taux de survie à cinq ans de 83 % pour les patients opérés, contre 55 % pour les patients ayant refusé la chirurgie dans une cohorte anglaise.12
Chez les patients ayant une HTP sévère, un traitement médical est parfois débuté en préopératoire afin de réduire les résistances vasculaires pulmonaires (RVP). Cette approche vise à diminuer les risques associés à l’intervention chirurgicale. L’efficacité de cette stratégie en matière de réduction de la mortalité périopératoire n’a toutefois pas été démontrée à ce jour.13
Traitement médical
Le traitement médical est indiqué chez les patients avec une HTP-TEC non opérable ou une HTP persistante/récurrente après endartériectomie pulmonaire.1,5,9
Le riociguat, un stimulateur de la guanylate cyclase soluble, est actuellement le seul traitement oral approuvé et remboursé dans l’HTP-TEC. Dans l’étude CHEST-1, il améliorait la distance parcourue au test de marche de six minutes ainsi que les symptômes et réduisait significativement les RVP.14
Le tréprostinil sous-cutané, un analogue de la prostacycline, a également démontré son efficacité sur la distance parcourue au test de marche de six minutes chez les patients avec une HTP-TEC non opérable ou une HTP persistante/récurrente après chirurgie.15 Toutefois, il ne bénéficie pas à ce jour d’un remboursement dans cette indication en France.
Plus récemment, dans une étude de phase II, le macitentan, un antagoniste oral des récepteurs de l’endothéline, a démontré un effet modéré sur les RVP dans l’HTP-TEC non opérable.16 Il n’est actuellement pas approuvé en France dans cette indication.1,9
Le riociguat, un stimulateur de la guanylate cyclase soluble, est actuellement le seul traitement oral approuvé et remboursé dans l’HTP-TEC. Dans l’étude CHEST-1, il améliorait la distance parcourue au test de marche de six minutes ainsi que les symptômes et réduisait significativement les RVP.14
Le tréprostinil sous-cutané, un analogue de la prostacycline, a également démontré son efficacité sur la distance parcourue au test de marche de six minutes chez les patients avec une HTP-TEC non opérable ou une HTP persistante/récurrente après chirurgie.15 Toutefois, il ne bénéficie pas à ce jour d’un remboursement dans cette indication en France.
Plus récemment, dans une étude de phase II, le macitentan, un antagoniste oral des récepteurs de l’endothéline, a démontré un effet modéré sur les RVP dans l’HTP-TEC non opérable.16 Il n’est actuellement pas approuvé en France dans cette indication.1,9
Angioplastie pulmonaire par ballonnet
La prise en charge interventionnelle par angioplastie artérielle pulmonaire concerne classiquement les patients avec une atteinte non accessible à la chirurgie (lésions segmentaires et sous-segmentaires) [fig. 1E-F ]. Cette technique endovasculaire, développée initialement au Japon, utilise des ballonnets de différents calibres pour dilater les lésions obstructives, telles que les sténoses des artères pulmonaires.17
L’angioplastie pulmonaire s’est révélée supérieure au riociguat en matière de réduction des RVP dans un essai randomisé français. L’angioplastie pulmonaire est cependant associée à des complications relativement fréquentes, telles que les hémoptysies et/ou les hémorragies pulmonaires, qui sont habituellement sans conséquences graves pour les patients. Ces complications sont liées à des lésions vasculaires induites par le guide ou le ballonnet. Il a été démontré qu’un traitement par riociguat pendant six mois avant le geste d’angioplastie permet de réduire significativement la fréquence de ces complications en améliorant l’hémodynamique pulmonaire, chez les patients qui ont des RVP supérieures à 4 UW.18 La mortalité périprocédure est inférieure à 2 % dans les centres expérimentés et la survie à cinq ans post-procédure est de l’ordre de 88 à 90 %.19 L’angioplastie pulmonaire est également indiquée chez les patients avec une HTP persistante/récurrente après endartériectomie pulmonaire et chez les patients non opérables en raison de comorbidités contre-indiquant la chirurgie, à condition que les lésions soient accessibles à cette procédure.1,13,19
L’angioplastie pulmonaire s’est révélée supérieure au riociguat en matière de réduction des RVP dans un essai randomisé français. L’angioplastie pulmonaire est cependant associée à des complications relativement fréquentes, telles que les hémoptysies et/ou les hémorragies pulmonaires, qui sont habituellement sans conséquences graves pour les patients. Ces complications sont liées à des lésions vasculaires induites par le guide ou le ballonnet. Il a été démontré qu’un traitement par riociguat pendant six mois avant le geste d’angioplastie permet de réduire significativement la fréquence de ces complications en améliorant l’hémodynamique pulmonaire, chez les patients qui ont des RVP supérieures à 4 UW.18 La mortalité périprocédure est inférieure à 2 % dans les centres expérimentés et la survie à cinq ans post-procédure est de l’ordre de 88 à 90 %.19 L’angioplastie pulmonaire est également indiquée chez les patients avec une HTP persistante/récurrente après endartériectomie pulmonaire et chez les patients non opérables en raison de comorbidités contre-indiquant la chirurgie, à condition que les lésions soient accessibles à cette procédure.1,13,19
Traitement multimodal
De nombreux patients peuvent présenter des lésions anatomiques qui associent une atteinte des artères pulmonaires lobaires, une atteinte des artères segmentaires et sous-segmentaires et une microvasculopathie. Ces constatations ont conduit au développement progressif d’une prise en charge multimodale. Cette approche implique de combiner les différents traitements disponibles afin de traiter les lésions accessibles à la chirurgie, les lésions accessibles à l’angioplastie pulmonaire et la microvasculopathie. Il n’y a actuellement pas de consensus concernant l’éligibilité à un traitement combiné multimodal. La sélection des patients s’effectue au cas par cas au cours d’une réunion de concertation multidisciplinaire dans le centre de référence de l’HTP.1
Principaux messages du 7e Congrès mondial de l’hypertension pulmonaire
Lors du 7e Congrès mondial de l’HTP, en 2024, les experts ont souligné l’importance cruciale d’une discussion multidisciplinaire au centre de la prise en charge des patients atteints d’HTP-TEC. Ils ont cependant relevé un certain nombre de lacunes concernant ces discussions multidisciplinaires : absence d’outils de classification radiologique standardisés ; absence de scores de risque préopératoires ou préangioplastie précis ; absence de preuves issues d’essais concernant l’objectivité des décisions, que ce soit entre ou au sein des équipes multidisciplinaires.
L’accent a également été mis sur l’évaluation rigoureuse de l’opérabilité des patients et sur l’importance des traitements interventionnels de désobstruction vasculaire (endartériectomie pulmonaire et angioplastie pulmonaire) dans la prise en charge des patients présentant une HTP-TEC. En effet, ces traitements, dans le cadre de stratégies multimodales, permettent actuellement d’atteindre une survie supérieure à 90 % à trois ans.20
Des critères de qualification des centres experts ont, par ailleurs, été établis. Pour les centres pratiquant l’angioplastie pulmonaire, une expérience de plus de cent procédures par an, une mortalité inférieure à 1 %, ainsi que la capacité de recourir à la circulation extracorporelle par extracorporeal membrane oxygenation (ECMO) sont exigées. Concernant les centres réalisant des endartériectomies pulmonaires, un minimum de cinquante interventions par an, avec une mortalité inférieure à 3 %, ainsi que la capacité d’utiliser l’ECMO sont requis. Enfin, les centres complets doivent réunir une expertise combinée en endartériectomie pulmonaire, angioplastie pulmonaire, HTP et ECMO pour assurer une prise en charge optimale des patients.21
L’accent a également été mis sur l’évaluation rigoureuse de l’opérabilité des patients et sur l’importance des traitements interventionnels de désobstruction vasculaire (endartériectomie pulmonaire et angioplastie pulmonaire) dans la prise en charge des patients présentant une HTP-TEC. En effet, ces traitements, dans le cadre de stratégies multimodales, permettent actuellement d’atteindre une survie supérieure à 90 % à trois ans.20
Des critères de qualification des centres experts ont, par ailleurs, été établis. Pour les centres pratiquant l’angioplastie pulmonaire, une expérience de plus de cent procédures par an, une mortalité inférieure à 1 %, ainsi que la capacité de recourir à la circulation extracorporelle par extracorporeal membrane oxygenation (ECMO) sont exigées. Concernant les centres réalisant des endartériectomies pulmonaires, un minimum de cinquante interventions par an, avec une mortalité inférieure à 3 %, ainsi que la capacité d’utiliser l’ECMO sont requis. Enfin, les centres complets doivent réunir une expertise combinée en endartériectomie pulmonaire, angioplastie pulmonaire, HTP et ECMO pour assurer une prise en charge optimale des patients.21
En résumé
Le dépistage de l’HTP-TEC par une échographie cardiaque et une scintigraphie pulmonaire de ventilation et perfusion est recommandé en cas de dyspnée persistante après une EP. Le diagnostic d’HTP-TEC est cependant le plus souvent effectué lors du bilan d’une HTP. La confirmation diagnostique nécessite de réaliser un cathétérisme cardiaque droit qui doit montrer la présence d’une HTP (pression artérielle pulmonaire moyenne supérieure à 20 mmHg) et des examens d’imagerie (angioscanner thoracique et/ou angiographie pulmonaire) qui doivent mettre en évidence des lésions thromboemboliques chroniques caractéristiques. La prise en charge optimale de l’HTP-TEC requiert une approche multidisciplinaire et le plus souvent multimodale, centrée sur l’individualisation du traitement pour chaque patient. Les options thérapeutiques incluent l’endartériectomie pulmonaire pour les cas opérables, le traitement médicamenteux et l’angioplastie pulmonaire pour les patients non opérables ou avec une HTP persistante/récurrente après chirurgie.
Références
1. Humbert M, Kovacs G, Hoeper MM, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J 2023;61(1):2200879.
2. Reddy SA, Swietlik EM, Robertson L, et al. Natural history of chronic thromboembolic pulmonary disease with no or mild pulmonary hypertension. J Heart Lung Transplant 2023;42(9):1275‑85.
3. Simonneau G, Fadel E, Vonk Noordegraaf A, et al. Highlights from the International Chronic Thromboembolic Pulmonary Hypertension Congress 2021. Eur Respir Rev 2023;32(167):220132.
4. Cottin V, Avot D, Levy-Bachelot L, et al. Identifying chronic thromboembolic pulmonary hypertension through the French national hospital discharge database. PloS One 2019;14(4):e0214649.
5. Delcroix M, Torbicki A, Gopalan D, et al. ERS Statement on chronic thromboembolic pulmonary hypertension. Eur Respir J 2021;57(6):2002828.
6. Pepke-Zaba J, Delcroix M, Lang I, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): Results from an international prospective registry. Circulation 2011;124(18):1973‑81.
7. Luijten D, Talerico R, Barco S, et al. Incidence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism: An updated systematic review and meta-analysis. Eur Respir J 2023;62(1):2300449.
8. Guerin L, Couturaud F, Parent F, et al. Prevalence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism. Prevalence of CTEPH after pulmonary embolism. Thromb Haemost 2014;112(3):598‑605.
9. Yang S, Yang Y, Zhai Z, et al. Incidence and risk factors of chronic thromboembolic pulmonary hypertension in patients after acute pulmonary embolism. J Thorac Dis 2015;7(11):1927‑38.
10. Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Respir J 2019;54(3):1901647.
11. Delcroix M, de Perrot M, Jaïs X, et al. Chronic thromboembolic pulmonary hypertension: Realising the potential of multimodal management. Lancet Respir Med 2023;S2213-2600(23)00292-8.
12. Quadery SR, Swift AJ, Billings CG, et al. The impact of patient choice on survival in chronic thromboembolic pulmonary hypertension. Eur Respir J 2018;52(3):1800589.
13. Mercier O, Dubost C, Delaporte A, et al. Pulmonary thromboendarterectomy: The Marie Lannelongue Hospital experience. Ann Cardiothorac Surg 2022;11(2):143-50.
14. Ghofrani HA, D’Armini AM, Grimminger F, et al. Riociguat f or the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med 2013;369(4):319‑29.
15. Sadushi-Kolici R, Jansa P, Kopec G, et al. Subcutaneous treprostinil for the treatment of severe non-operable chronic thromboembolic pulmonary hypertension (CTREPH): A double-blind, phase 3, randomised controlled trial. Lancet Respir Med 2019;7(3):239‑48.
16. Ghofrani HA, Simonneau G, D’Armini AM, et al. Macitentan for the treatment of inoperable chronic thromboembolic pulmonary hypertension (MERIT-1): Results from the multicentre, phase 2, randomised, double-blind, placebo-controlled study. Lancet Respir Med 2024;12(4):e21‑30.
17. Jevnikar M, Bokan A, Gille T, et al. Balloon pulmonary angioplasty: Are we there yet? Lessons learned and unanswered questions. Breathe 2022;18(4):220217.
18. Jais X, Brenot P, Bouvaist H, et al. Balloon pulmonary angioplasty versus riociguat for the treatment of inoperable chronic thromboembolic pulmonary hypertension (RACE): A multicentre, phase 3, open-label, randomised controlled trial and ancillary follow-up study. Lancet Respir Med 2022;10(10):961‑71.
19. Lang IM, Andreassen AK, Andersen A, et al. Balloon pulmonary angioplasty for chronic thromboembolic pulmonary hypertension: A clinical consensus statement of the ESC working group on pulmonary circulation and right ventricular function. Eur Heart J 2023;44(29):2659‑71.
20. Delcroix M, Pepke-Zaba J, D’Armini AM, et al. Worldwide CTEPH registry: Long-term outcomes with pulmonary endarterectomy, balloon pulmonary angioplasty, and medical therapy. Circulation 2024;150(17):1354‑65.
21. Kim NH, D’Armini AM, Delcroix M, et al. Chronic thromboembolic pulmonary disease. Eur Respir J 2024;2401294.
2. Reddy SA, Swietlik EM, Robertson L, et al. Natural history of chronic thromboembolic pulmonary disease with no or mild pulmonary hypertension. J Heart Lung Transplant 2023;42(9):1275‑85.
3. Simonneau G, Fadel E, Vonk Noordegraaf A, et al. Highlights from the International Chronic Thromboembolic Pulmonary Hypertension Congress 2021. Eur Respir Rev 2023;32(167):220132.
4. Cottin V, Avot D, Levy-Bachelot L, et al. Identifying chronic thromboembolic pulmonary hypertension through the French national hospital discharge database. PloS One 2019;14(4):e0214649.
5. Delcroix M, Torbicki A, Gopalan D, et al. ERS Statement on chronic thromboembolic pulmonary hypertension. Eur Respir J 2021;57(6):2002828.
6. Pepke-Zaba J, Delcroix M, Lang I, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): Results from an international prospective registry. Circulation 2011;124(18):1973‑81.
7. Luijten D, Talerico R, Barco S, et al. Incidence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism: An updated systematic review and meta-analysis. Eur Respir J 2023;62(1):2300449.
8. Guerin L, Couturaud F, Parent F, et al. Prevalence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism. Prevalence of CTEPH after pulmonary embolism. Thromb Haemost 2014;112(3):598‑605.
9. Yang S, Yang Y, Zhai Z, et al. Incidence and risk factors of chronic thromboembolic pulmonary hypertension in patients after acute pulmonary embolism. J Thorac Dis 2015;7(11):1927‑38.
10. Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Respir J 2019;54(3):1901647.
11. Delcroix M, de Perrot M, Jaïs X, et al. Chronic thromboembolic pulmonary hypertension: Realising the potential of multimodal management. Lancet Respir Med 2023;S2213-2600(23)00292-8.
12. Quadery SR, Swift AJ, Billings CG, et al. The impact of patient choice on survival in chronic thromboembolic pulmonary hypertension. Eur Respir J 2018;52(3):1800589.
13. Mercier O, Dubost C, Delaporte A, et al. Pulmonary thromboendarterectomy: The Marie Lannelongue Hospital experience. Ann Cardiothorac Surg 2022;11(2):143-50.
14. Ghofrani HA, D’Armini AM, Grimminger F, et al. Riociguat f or the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med 2013;369(4):319‑29.
15. Sadushi-Kolici R, Jansa P, Kopec G, et al. Subcutaneous treprostinil for the treatment of severe non-operable chronic thromboembolic pulmonary hypertension (CTREPH): A double-blind, phase 3, randomised controlled trial. Lancet Respir Med 2019;7(3):239‑48.
16. Ghofrani HA, Simonneau G, D’Armini AM, et al. Macitentan for the treatment of inoperable chronic thromboembolic pulmonary hypertension (MERIT-1): Results from the multicentre, phase 2, randomised, double-blind, placebo-controlled study. Lancet Respir Med 2024;12(4):e21‑30.
17. Jevnikar M, Bokan A, Gille T, et al. Balloon pulmonary angioplasty: Are we there yet? Lessons learned and unanswered questions. Breathe 2022;18(4):220217.
18. Jais X, Brenot P, Bouvaist H, et al. Balloon pulmonary angioplasty versus riociguat for the treatment of inoperable chronic thromboembolic pulmonary hypertension (RACE): A multicentre, phase 3, open-label, randomised controlled trial and ancillary follow-up study. Lancet Respir Med 2022;10(10):961‑71.
19. Lang IM, Andreassen AK, Andersen A, et al. Balloon pulmonary angioplasty for chronic thromboembolic pulmonary hypertension: A clinical consensus statement of the ESC working group on pulmonary circulation and right ventricular function. Eur Heart J 2023;44(29):2659‑71.
20. Delcroix M, Pepke-Zaba J, D’Armini AM, et al. Worldwide CTEPH registry: Long-term outcomes with pulmonary endarterectomy, balloon pulmonary angioplasty, and medical therapy. Circulation 2024;150(17):1354‑65.
21. Kim NH, D’Armini AM, Delcroix M, et al. Chronic thromboembolic pulmonary disease. Eur Respir J 2024;2401294.