objectifs
Les maladies inflammatoires chroniques de l’intestin (MICI) regroupent deux entités : la maladie de Crohn (MC) et la rectocolite hémorragique (RCH). La maladie de Crohn peut toucher l’ensemble du tube digestif, de la bouche à l’anus, mais trois segments sont plus souvent atteints : l’iléon, le côlon et l’anus. Les lésions intéressent l’ensemble de la paroi intestinale, ce qui explique la survenue de complications pariétales de type sténoses et fistules. La rectocolite hémorragique atteint le rectum dans 100 % des cas et une partie plus ou moins importante du côlon d’amont dans 80 % des cas. L’atteinte est plus superficielle, muqueuse et sous-muqueuse, à l’exception des formes les plus sévères (dites colites aiguës graves). Dans certains cas, la distinction entre les deux maladies est difficile : on parle alors de « colite indéterminée ». Les maladies inflammatoires chroniques de l’intestin sont considérées comme des affections de longue durée (ALD 30) car, bien qu’elles impactent faiblement sur l’espérance de vie, elles induisent une morbidité élevée et altèrent significativement la qualité de vie des malades.
Épidémiologie
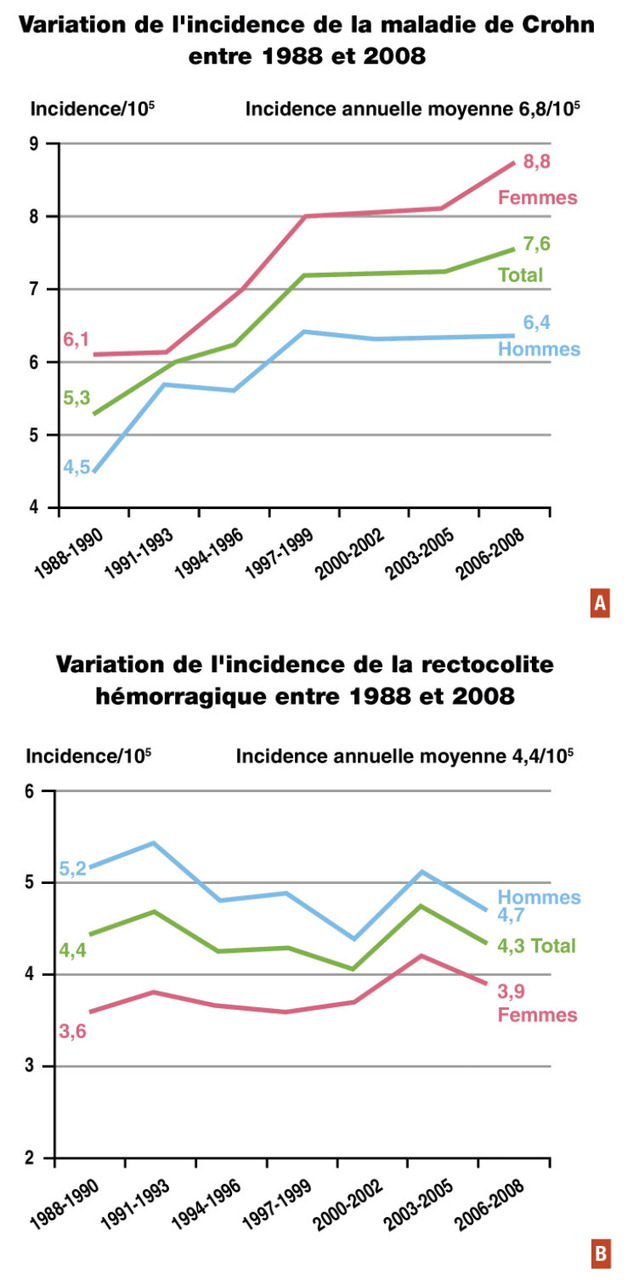
Les maladies inflammatoires chroniques de l’intestin peuvent apparaître à tous les âges, mais surviennent en majorité chez l’adulte jeune ; le pic pour la maladie de Crohn se situe entre 20 et 30 ans ; pour la rectocolite hémorragique, le diagnostic est un peu plus tardif avec un pic situé entre 30 et 40 ans. L’incidence de la maladie de Crohn a augmenté en France ces dernières années, passant de 5,3 à 7,6 pour 100 000 habitants entre 1988 et 2008 (fig. 1A). Dans la région Nord-Ouest, cette augmentation d’incidence persiste et est d’autant plus importante chez les adolescents (10-19 ans), chiffrée à + 71 % entre 1988 et 2008. Contrairement à la maladie de Crohn, l’incidence de la rectocolite hémorragique tend à rester stable en France avec une incidence de 4,4 pour 100 000 habitants en 2008 (fig. 1B) (registre EPIMAD). Les maladies inflammatoires chroniques de l’intestin prédominent en Europe et en Amérique du Nord avec un gradient nord-sud, cependant leur incidence tend à augmenter dans les pays en voie de développement. Il existe une légère prédominance masculine dans la rectocolite hémorragique et une prédominance féminine dans la maladie de Crohn.
Physiopathologie et facteurs de risque
Physiopathologie
Malgré les avancées, notamment dans le domaine de la génétique, l’origine des maladies inflammatoires chroniques de l’intestin reste encore imparfaitement comprise. Elles ont pour caractéristique commune la présence d’un infiltrat inflammatoire au niveau du tube digestif liée à une modification du microbiote intestinal perçue comme anormale et à l’origine d’une activation excessive du système immunitaire. Il s’y associe une augmentation de la perméabilité intestinale et un recrutement de cellules inflammatoires au niveau de la paroi intestinale favorisé par la production de cytokines pro-inflammatoires (TNF alpha, IL 1…) et la surexpression de récepteurs membranaires, sans que l’agent causal ait été identifié. Cette rupture de tolérance immunologique est probablement favorisée par des facteurs génétiques et environnementaux.
Implication du microbiote intestinal
Parmi les espèces bactériennes qui constituent le microbiote, trois grands groupes ont été mis en évidence : les firmicutes, les bacteroidetes et les actinobactéries. Il existe à l’état basal un équilibre entre la flore bactérienne propre à chaque individu et le système immunitaire, participant à la barrière intestinale. Il est actuellement admis qu’il existe chez les patients atteints de maladies inflammatoires chroniques de l’intestin un déséquilibre du microbiote (appelée dysbiose), qui favorise une réaction immunitaire inadaptée.
Génétique
La prédisposition génétique des maladies inflammatoires chroniques de l’intestin existe mais est relativement faible ; seuls 10 % des patients ont un antécédent familial. Pour un apparenté au premier degré, le risque de développer la maladie est de l’ordre de 1 à 3 % dans la maladie de Crohn et de 1 % dans la rectocolite hémorragique. En 2001, le gène dénommé NOD2/CARD15, a été identifié comme le premier gène de susceptibilité dans la survenue d’une maladie de Crohn. Ce gène code pour une protéine retrouvée majoritairement au niveau de l’iléon terminal, jouant un rôle central dans la reconnaissance de composés bactériens en activant la voie de signalisation pro-inflammatoire NFkb impliquée dans l’immunité cellulaire. Néanmoins, ce gène peut être retrouvé muté à l’état hétérozygote chez 8 à 15 % de la population générale. à ce jour, l’analyse du génome a permis d’identifier plus de 170 gènes impliqués dans le développement des maladies inflammatoires chroniques de l’intestin, soulignant le faible impact de la génétique dans l’émergence de ces maladies. La recherche de polymorphismes génétiques n’est actuellement pas indiquée en pratique clinique.
Facteurs environnementaux
Le tabac est le seul facteur environnemental clairement identifié comme facteur de risque dans la maladie de Crohn, multipliant par deux le risque de développer cette maladie. Il s’agit également d’un facteur aggravant dans la maladie de Crohn avec une relation dose-effet, augmentant le risque de poussée, le recours aux corticoïdes ainsi qu’aux immunosuppresseurs et le risque de récidive de la maladie en postopératoire. Dans la rectocolite hémorragique, le tabac constitue un facteur environnemental protecteur et son arrêt aggrave la maladie.
Un antécédent d’appendicectomie, d’autant plus si celle-ci est réalisée pour appendicite aiguë et à l’adolescence, réduit le risque de survenue d’une rectocolite hémorragique. à l’inverse, l’appendicectomie est un facteur de risque identifié de survenue de maladie de Crohn.
De nombreux autres facteurs (alimentation, stress, virus, la théorie hygiéniste…) ont été suspectés sans avoir été clairement validés dans la survenue ou non des maladies inflammatoires chroniques de l’intestin.
Diagnostic positif
Le diagnostic des maladies inflammatoires chroniques de l’intestin repose sur un ensemble d’arguments cliniques, endoscopiques et histologiques.
Quand évoquer le diagnostic de MICI ?
Les signes cliniques les plus fréquents sont des douleurs abdominales, une diarrhée, souvent chronique, et des rectorragies. Le tableau clinique s’installe habituellement progressivement en quelques mois. Dans 10 à 20 % des cas le début est brutal, à l’origine de difficultés diagnostiques. L’expression clinique varie en fonction de la localisation de l’atteinte digestive. Des douleurs en fosse iliaque droite avec diarrhée hydrique sont retrouvées notamment en cas de maladie de Crohn avec atteinte iléale ou iléocolique droite. Les douleurs peuvent être diffuses en cas d’atteinte étendue de la maladie. Une diarrhée glairo-sanglante, est souvent associée à une atteinte colique de la maladie de Crohn et est le symptôme le plus fréquemment retrouvé dans la rectocolite hémorragique. La caractérisation de la diarrhée doit être recherchée à l’interrogatoire : nombre de selles liquides, présence de selles nocturnes ou d’une incontinence anale, nombre de rectorragies, association à des faux besoins ou à des ténesmes. Une asthénie, une anorexie et un amaigrissement sont fréquemment associés aux maladies inflammatoires chroniques de l’intestin. La perte de poids doit être quantifiée. Chez l’enfant, une maladie inflammatoire chronique de l’intestin doit être suspectée en cas de retard staturo-pondéral. Enfin, l’examen proctologique fait partie intégrante de l’examen clinique, à la recherche de lésions ano-périnéales évocatrices de maladie de Crohn (fissure crohnienne, marisque, orifice fistuleux, abcès).
La maladie de Crohn peut aussi être révélée par une complication. En cas d’atteinte iléale sténosante, la constipation et les manifestations subocclusives sont au premier plan. Il peut exister des douleurs dites obstructives : douleurs abdominales et ballonnements majorés en période postprandiale, avec sensation de blocage, rapidement soulagés après l’émission de borborygmes, de gaz et de selles.
Le diagnostic de maladie inflammatoire chronique de l’intestin doit également être évoqué devant la découverte d’un syndrome inflammatoire biologique, d’une anémie, d’une carence martiale, ou d’une malabsorption (hypoalbuminémie, carences vitaminiques).
Définition et formes cliniques
La rectocolite hémorragique atteint de façon constante le rectum et une partie plus ou moins importante du côlon. Cette maladie épargne le reste du tube digestif (intestin grêle et marge anale en particulier). L’atteinte est superficielle, contrairement à la maladie de Crohn, muqueuse et sous-muqueuse. Les lésions sont continues du rectum vers le côlon d’amont, sans intervalle de muqueuse saine.
La maladie de Crohn peut atteindre l’ensemble du tube digestif. L’atteinte iléo-colique droite représente 40 % des cas. L’iléon, le côlon et l’anus sont les trois sites les plus souvent atteints. Les lésions sont segmentaires et discontinues, intéressant l’ensemble de la paroi intestinale (atteinte transmurale), favorisant la survenue de complications telles que des sténoses, des fistules et des abcès. Ces complications nécessitent fréquemment le recours à une résection chirurgicale conduisant progressivement à une perte du fonctionnement physiologique de l’intestin.
Le tableau 2 résume les caractéristiques propres à la rectocolite hémorragique et à la maladie de Crohn.
La sévérité d’une poussée de maladie inflammatoire chronique de l’intestin peut être évaluée par différents scores. Le score de Harvey-Bradshaw ou le CDAI (Crohn’s disease activity index) sont des scores cliniques ou clinicobiologiques évaluant l’activité de la maladie de Crohn. Dans la rectocolite hémorragique, l’activité clinique de la maladie peut aussi être évaluée par différents scores : le Mayo-score est le plus utilisé.
Manifestations extradigestives
Les manifestations extradigestives sont retrouvées chez 30 % à 50 % des patients atteints de maladies inflammatoires chroniques de l’intestin (tableau 3). Elles peuvent évoluer indépendamment ou parallèlement aux poussées digestives.
Les manifestations articulaires sont les plus fréquemment retrouvées (arthralgies périphériques, sacro-iliite). Les autres manifestations à rechercher sont ophtalmologiques (uvéite, conjonctivite et kératite) et cutanéo-muqueuses (érythème noueux, Pyoderma gangrenosum, aphtose buccale, syndrome de Sweet).
Les maladies inflammatoires chroniques de l’intestin peuvent être associées à d’autres pathologies dysimmunitaires telles que la spondylarthrite ankylosante ou la cholangite sclérosante primitive (CSP). La cholangite sclérosante primitive est plus souvent associée à la rectocolite hémorragique, touchant classiquement l’homme jeune et suspectée devant la présence d’une cholestase chronique chez un patient porteur d’une maladie inflammatoire chronique de l’intestin. Le diagnostic repose sur la présence de sténoses et de dilatations des voies biliaires intra- et/ou extra- hépatiques sur la bili-IRM.
Le risque de manifestations thromboemboliques (embolie pulmonaire, thrombose veineuse profonde) est accru au cours des maladies inflammatoires chroniques de l’intestin par rapport à la population générale, d’autant plus en cas de maladie active. Les manifestations thromboemboliques représentent un risque de mortalité dans les maladies inflammatoires chroniques de l’intestin. L’anticoagulation prophylactique par héparine de bas poids moléculaire est recommandée en cas de poussée sévère ou d’hospitalisation.
Confirmation diagnostique
L’iléocoloscopie est l’examen clé pour confirmer le diagnostic, apprécier la gravité et l’étendue des lésions et permet de pratiquer des biopsies multiples.
En cas de rectocolite hémorragique, la coloscopie retrouve, dès le bas rectum, une muqueuse érythémateuse et granitée, pouvant saigner spontanément ou au contact de l’endoscope, avec disparition de la trame vasculaire associée ou non à des érosions, des ulcérations superficielles ou profondes. Les lésions sont continues, d’un seul tenant, sans intervalle de muqueuse saine avec une limite supérieure nette. L’iléon est normal. Rarement, une iléite de reflux peut être mise en évidence dans les formes pancoliques, due à une béance de la valvule de Bauhin. Les formes rectales s’associent classiquement à une atteinte isolée de l’orifice appendiculaire (atteinte bipolaire). Le seul score validé pour évaluer l’activité endoscopique dans la rectocolite hémorragique est l’UCEIS (Ulcerative colitis endoscopic index of severity).
Dans la maladie de Crohn, les lésions endoscopiques sont discontinues, segmentaires, avec intervalles de muqueuse saine, et associent la présence d’une muqueuse érythémateuse avec disparition de la trame vasculaire et d’ulcérations superficielles ou profondes dans les formes sévères. Les ulcérations aphtoïdes sont dites caractéristiques de la maladie, mais ne permettent pas à elles seules de retenir le diagnostic de maladie de Crohn. L’atteinte de l’iléon terminal est observée dans 60 % des cas. La coloscopie permet de détecter des orifices fistuleux, une sténose ou des pseudo-polypes inflammatoires ou cicatriciels. L’endoscopie œsogastroduodénale permet de rechercher des lésions du tractus digestif haut évocatrices de maladie de Crohn et de réaliser des biopsies gastriques et duodénales en cas d’anomalie muqueuse. Le CDEIS (Crohn’s disease endoscopic index of severity) évalue la sévérité endoscopique dans la maladie de Crohn.
Dans 10 % des cas, la colite reste inclassée sans possibilité de différencier maladie de Crohn et rectocolite hémorragique : on parle alors de colite indéterminée.
En cas de suspicion de maladie inflammatoire chronique de l’intestin, des biopsies multiples et étagées en muqueuses saine et pathologique doivent être réalisées au cours du bilan endoscopique.
Histologie
L’histologie, bien qu’étant non spécifique, permet d’orienter fortement le diagnostic de maladie inflammatoire chronique de l’intestin.
Au cours de la rectocolite hémorragique, l’histologie associe typiquement une plasmocytose basale et un infiltrat inflammatoire au niveau de la lamina propria. La présence d’un infiltrat à polynucléaires neutrophiles, à l’origine d’abcès cryptiques, est corrélée à l’activité de la maladie inflammatoire mais peut également être retrouvée en cas de colite infectieuse. De façon plus tardive (environ 4 à 6 semaines après le début de la maladie) apparaît une désorganisation architecturale avec une distorsion des cryptes et une perte de la mucosécrétion.
Dans la maladie de Crohn, les prélèvements retrouvent la présence d’un infiltrat inflammatoire lymphoplasmocytaire intéressant l’ensemble de la paroi digestive. La mucosécrétion est conservée. Le granulome épithélioïde et gigantocellulaire sans nécrose caséeuse est une lésion histologique évocatrice de la maladie de Crohn, qui n’est pas observée de manière constante ; un granulome épithélioïde et gigantocellulaire sans nécrose caséeuse est retrouvé dans environ 30 % des cas sur des biopsies réalisées au cours d’une coloscopie et dans 60 % des cas sur une pièce de résection chirurgicale. Leur présence n’est donc pas indispensable au diagnostic. De plus, le granulome est une lésion aspécifique, présent également au cours d’infections telles que la yersiniose ou la tuberculose intestinale.
Imagerie
L’imagerie a une place déterminante dans le diagnostic et l’évaluation de l’étendue et de la sévérité des maladies inflammatoires chroniques de l’intestin, la détection de complications ou lors du suivi sous traitement. Les examens non irradiants doivent être privilégiés.
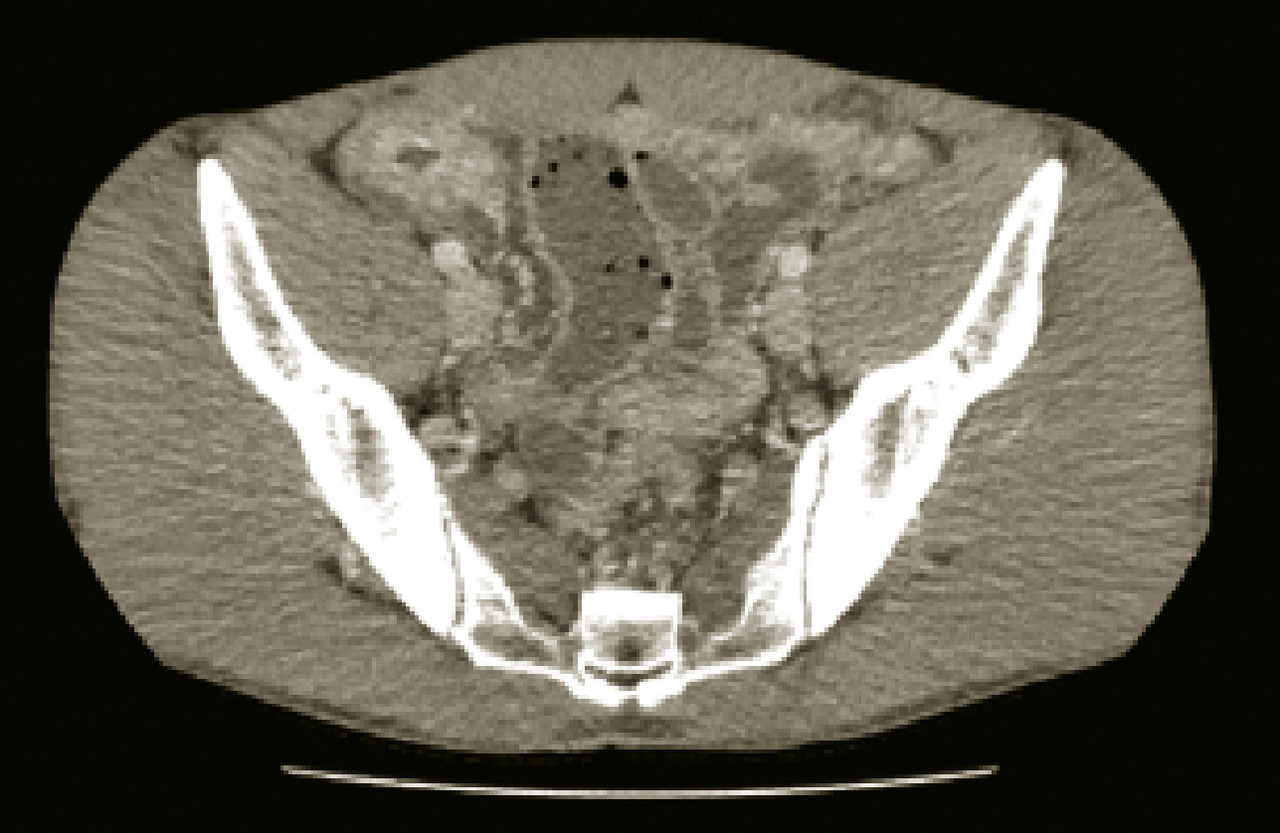
En cas de maladie de Crohn, sont recommandées systématiquement au diagnostic la réalisation d’endoscopies hautes et basses et un examen d’imagerie de l’intestin grêle pour permettre une cartographie précise des lésions sur l’ensemble du tube digestif. L’entéro-IRM est actuellement l’imagerie de choix recommandée par les centres experts dans l’exploration de l’intestin grêle, afin d’évaluer l’étendue initiale de l’atteinte et dans le cadre du suivi. En cas d’iléite, la sémiologie radiologique repose classiquement sur la mise en évidence d’un épaississement pariétal du grêle atteint, en cible avec œdème sous-muqueux, d’une hyperémie du mésentère avec signe du peigne et d’une prise de contraste pariétale après injection (fig. 2).
Le scanner abdominopelvien est l’examen d’imagerie de première intention réalisé dans les situations d’urgence afin de détecter des complications (abcès, fistule et sténoses dans la maladie de Crohn, colectasie, voire perforation en cas colite aiguë grave dans la rectocolite hémorragique).
L’échographie haute résolution est un examen séduisant dans l’étude du grêle, non irradiant, mais dont la sensibilité varie en fonction de la localisation de l’atteinte et qui est fortement opérateur dépendant.
En cas de maladie de Crohn, l’IRM périnéale est indispensable pour l’évaluation de lésions anopérinéales, notamment la détection de fistules, ou d’abcès.
La vidéocapsule endoscopique est un examen non invasif permettant une exploration du grêle, réalisée en seconde intention en cas de suspicion de maladie de Crohn du grêle avec évaluation endoscopique négative. Le risque de rétention capsulaire en cas de sténose digestive amène à limiter son utilisation dans la maladie de Crohn et rend indispensable la réalisation d’un examen d’imagerie de l’intestin grêle avant sa réalisation.
Le transit baryté du grêle n’est plus utilisé en pratique dans les maladies inflammatoires chroniques de l’intestin.
Biomarqueurs dans les maladies inflammatoires chroniques de l’intestin
Il est indispensable en cas de suspicion de maladie inflammatoire chronique de l’intestin de rechercher un syndrome inflammatoire systémique par le dosage des leucocytes et de la CRP, reflétant l’activité de la maladie.
La calprotectine fécale est un marqueur de l’état d’inflammation de la muqueuse colique, sa réalisation est actuellement peu effectuée en pratique clinique, ne bénéficiant pas de remboursement auprès de la Sécurité sociale.
Les anticorps anti-cytoplasme des polynucléaires neutrophiles de type périnucléaire (pANCA) dans la rectocolite hémorragique, et les anticorps anti-Saccharomyces cerevisiae (ASCA) dans la maladie de Crohn peuvent être recherchés. Leur dosage est néanmoins peu utile dans le diagnostic des maladies inflammatoires chroniques de l’intestin en raison d’une mauvaise sensibilité, sauf en cas de colite indéterminée, leur présence pouvant aider au diagnostic différentiel entre rectocolite hémorragique et maladie de Crohn.
Diagnostic différentiel
Certains diagnostics doivent être évoqués lors de la première poussée de maladie inflammatoire chronique de l’intestin et guider la réalisation de certains examens complémentaires.
Maladie de Crohn colique et rectocolite hémorragique
Le principal diagnostic différentiel d’une maladie inflammatoire chronique de l’intestin de début brutal est la colite infectieuse.
Les autres diagnostics pouvant être évoqués sont : colite médicamenteuse (anti-inflammatoires non stéroïdiens), colite ischémique, colite diverticulaire, colites associées aux maladies de système (lupus, maladie de Behçet…). Les colites limitées au rectum doivent être distinguées du syndrome de l’ulcère solitaire, de la rectite ischémique ou des infections sexuellement transmissibles (syphilis, Chlamydia, gonocoque, herpesvirus).
En cas de première poussée de colite, il est donc indispensable de réaliser des coprocultures avec une recherche de Clostridium difficile et des toxines A et B. De même, un examen parasitologique des selles doit être réalisé. Des biopsies avec envoi en bactériologie, virologie et parasitologie doivent être réalisées au cours d’une rectosigmoïdoscopie. En cas de rectite, et en cas de facteur de risque (sexualité anale), il doit être effectué des prélèvements anorectaux afin de réaliser une PCR gonocoque, une PCR Chlamydia, ou une PCR Herpesvirus.
Maladie de Crohn iléale ou iléocolique droite
Les principaux diagnostics différentiels à évoquer sont les entérocolites infectieuses (tuberculose, yersiniose, Campylobacter jejuni), les entérocolites médicamenteuses, et les lymphomes digestifs. En cas de premier épisode d’iléite terminale, le bilan initial comprendra la réalisation d’une sérologie Yersinia, d’une sérologie Campylobacter et la réalisation d’une intradermoréaction à la tuberculine ou d’un QuantiFERON selon le contexte clinique (antécédents de tuberculose, pays d’origine).
Évolution et complications
Évolution
Elle est marquée chez la majorité des malades atteints de maladies inflammatoires chroniques de l’intestin, par la survenue de poussées entrecoupées de phases de rémission.
Au cours de la rectocolite hémorragique, on observe fréquemment une extension des lésions, 2 patients sur 3 ayant une atteinte rectale développeront des lésions coliques. Au cours de la maladie de Crohn, la localisation initiale de la maladie reste classiquement stable au cours du temps, à l’inverse du phénotype de la maladie qui évolue avec l’apparition de complications de type sténoses, fistules ou abcès chez plus de 80 % des malades.
Complications aiguës
Les complications aiguës dans la maladie de Crohn sont dominées par la survenue d’abcès abdominaux ou pelviens, de fistules (grêlogrêliques, entérocutanées…), de perforation, de sténoses ou occlusions, et de complications ano-périnéales (fistules, abcès de la marge anale). Ces complications nécessitent souvent le recours à une intervention chirurgicale. Ainsi, parmi les malades atteints de maladie de Crohn, plus d’un malade sur deux sera opéré après 10 années d’évolution. Une récidive postopératoire de la maladie de Crohn est quasi constante au niveau muqueux, observée cliniquement dans 30 % des cas à 5 ans, et dans 50 % des cas à 10 ans.
La colite aiguë grave est une complication fréquente dans la rectocolite hémorragique ou la maladie de Crohn colique, observée chez environ 25 % des malades ; elle peut aussi être inaugurale d’une maladie inflammatoire chronique de l’intestin colique. La définition d’une colite aiguë grave est clinique, définie par un score de Lichtiger supérieur à 10 (tableau 1). La colite aiguë grave est une urgence médicochirurgicale pouvant engager le pronostic vital (mortalité estimée à 1 à 2 % des cas) et se compliquer de colectasie (distension colique supérieure à 6 cm) avec un risque significatif de perforation colique. Le scanner abdominal permet d’éliminer une complication intra-abdominale (perforation, abcès, mégacôlon toxique). L’évaluation endoscopique par rectosigmoïdoscopie prudente permet de rechercher les signes endoscopiques de gravité (ulcérations creusantes ou en puits, mise à nu de la musculeuse, décollements muqueux) et de réaliser des prélèvements à la recherche d’une surinfection bactérienne (Clostridium difficile) ou à cytomégalovirus. La colite aiguë grave justifie une hospitalisation d’urgence et l’instauration d’une thérapeutique spécifique dans les meilleurs délais.
Complications chroniques
Les complications à long terme sont dominées par le risque de cancer colorectal accru chez les patients atteints de rectocolite hémorragique ou de maladie de Crohn colique ancienne. Environ 1 % des cancers coliques recensés dans la population générale surviennent chez des patients atteints de maladie inflammatoire chronique de l’intestin. L’histoire naturelle du cancer colorectal dans la rectocolite hémorragique est différente des cancers sporadiques, passant par plusieurs étapes successives : inflammation, dysplasie de bas grade puis de haut grade et cancer, sans développement de lésions polyploïdes dans la majorité des cas. Le risque de dysplasie colique est lié à l’ancienneté et à l’étendue de la maladie inflammatoire chronique de l’intestin.
Il existe un sur-risque identifié de dysplasie et de cancer colorectal chez les patients atteints de rectocolite hémorragique en cas de maladie évoluant depuis plus de 7 ans et en cas de forme pancolique (s’étendant au-delà de l’angle colique gauche), avec un risque relatif multiplié par 15. Ce risque est multiplié par 3 dans les formes coliques gauches et identique à celui de la population générale en cas de rectite isolée. Les autres facteurs de risque de survenue de cancer colorectal dans la rectocolite hémorragique sont : un antécédent familial au premier degré de cancer colorectal ou une cholangite sclérosante primitive associée. Dans la rectocolite hémorragique, ce risque est estimé à 2 % après 8 ans d’évolution et atteint 8 % après 20 ans d’évolution. Un dépistage systématique de la dysplasie colique par coloscopie avec chromo-endoscopie doit être réalisé quel que soit l’étendue de la maladie après 7 années d’évolution ou être débuté dès le diagnostic en cas de cholangite sclérosante primitive associée. Le dépistage de la dysplasie repose sur la réalisation de biopsies étagées sur l’ensemble du cadre colique et de biopsies ciblées sur toute lésion en relief.
Le risque de cancer colorectal dans la maladie de Crohn étendue sur plus d'un tiers de la surface colique est comparable aux patients atteints de rectocolite hémorragique. Les recommandations de dépistage sont donc similaires dans cette population. La mise en évidence d’une sténose colique au cours du suivi d’une rectocolite hémorragique est fortement évocatrice d’un cancer colorectal.
En cas d’atteinte ancienne de l’intestin grêle, il a été mis en évidence un risque accru d’adénocarcinome du grêle estimé à 2,2 % après 25 ans d’évolution, de diagnostic difficile et souvent tardif. Le diagnostic est évoqué par l’entéroscanner ou l’entéro-IRM, ou est fait fortuitement sur une pièce opératoire.
L’amylose secondaire (AA pour amyloid associated) est une complication rare et potentiellement fatale des maladies inflammatoires chroniques de l’intestin, favorisée par l’inflammation prolongée non contrôlée.
Le suivi du poids ou de la courbe de croissance chez l’enfant, et des marqueurs nutritionnels est indispensable au cours des maladies inflammatoires chroniques de l’intestin, à la recherche d’une dénutrition.
Dans la maladie de Crohn, les résections chirurgicales itératives pour complication (sténose, abcès, fistule) ou pour échec du traitement médical peuvent aboutir à une perte du fonctionnement physiologique de l’intestin et au syndrome du grêle court.
Enfin, les patients atteints de rectocolite hémorragique ancienne, non contrôlée par le traitement médical, peuvent développer une microcolie ou microrectie, avec un aspect tubulisé et figé de la paroi colique ou rectale en endoscopie. On observe alors une diminution de l’absorption d’eau et d’électrolytes par le côlon ainsi que des capacités de réservoir du rectum, responsables d’une diarrhée chronique fortement invalidante.
Prise en charge des maladies inflammatoires chroniques de l’intestin
La stratégie thérapeutique repose sur le traitement de la poussée, puis la mise en place d’un traitement d’entretien. Les objectifs thérapeutiques sont les suivants : l’obtention d’une réponse clinique, d’une réponse biologique avec normalisation du syndrome inflammatoire, et d’une cicatrisation muqueuse. De plus, l’adaptation des traitements permet d’améliorer la qualité de vie des patients, de diminuer le nombre d’hospitalisations et d’éviter la survenue de complications. En effet, les maladies inflammatoires chroniques de l’intestin affectent la qualité de vie des malades avec un retentissement sur la vie familiale ou professionnelle. Ces pathologies font partie des affections de longue durée (ALD) et bénéficient d’une prise en charge à 100 % par l’assurance maladie.
Traitement médical
Plusieurs catégories de traitements peuvent être utilisées au cours des maladies inflammatoires chroniques de l’intestin :
les dérivés des 5 amino-salicylés (5-ASA ou Pentasa, Fivasa, Rowasa) possèdent une action anti-inflammatoire locale sur la muqueuse colorectale. Ils sont administrés par voie orale ou par voie locale en cas de rectite isolée (suppositoires, lavements) et sont utilisés dans la rectocolite hémorragique dans le cadre des poussées légères à modérées, puis en traitement de fond. Ils possèdent un rôle important dans la prévention du cancer colorectal dans les maladies inflammatoires chroniques de l’intestin avec atteinte étendue et ancienne ;
les corticoïdes représentent le traitement de choix des poussées modérées à sévères de rectocolite hémorragique ou de maladie de Crohn. Ils sont le plus souvent administrés par voie orale avec un schéma de décroissance rapide. En effet, leur utilisation prolongée est associée à de nombreux effets indésirables (ostéoporose, diabète induit…). L’arrêt brutal d’une corticothérapie prolongée expose les malades au risque d’insuffisance surrénalienne aiguë. En cas d’échec, les corticoïdes peuvent être administrés par voie intraveineuse.
les immunosuppresseurs, notamment l’azathioprine (classe des thiopurines) et le méthotrexate, sont utilisés en traitement d’entretien en cas d’échec de la corticothérapie, de corticodépendance ou en cas de poussées répétées. Leur utilisation nécessite une surveillance biologique étroite.
Les anti-TNF alpha (infliximab, adalimumab) représentent le traitement d’induction et d’entretien de choix en cas de poussée sévère de rectocolite hémorragique ou de maladie de Crohn, ou en cas d’échec des traitements précédents. Ils sont parfois utilisés en bithérapie avec un traitement immunosuppresseur afin de potentialiser l’effet thérapeutique et de limiter les phénomènes d’immunisation contre cette classe thérapeutique.
Traitement des poussées
Dans la rectocolite hémorragique, en cas de poussée légère à modérée, le traitement de première ligne repose sur les dérivés des 5-ASA par voie orale ou topique (suppositoires, lavements). En cas d’échec ou poussée sévère, le traitement repose sur l’introduction d’une corticothérapie par voie systémique (orale ou intraveineuse). En cas de corticorésistance, le recours aux anti-TNF alpha est recommandé.
Dans la maladie de Crohn, les dérivés des 5-ASA ne sont pas recommandés. Le traitement de première ligne en cas d’atteinte iléocæcale est le budésonide (corticoïde à libération iléocolique droite, ayant peu d’effet systémique). Le traitement des poussées plus sévère repose sur la corticothérapie systémique (orale ou intraveineuse). En cas de corticorésistance, un traitement d’induction par anti-TNF alpha est recommandé.
La colite aiguë grave est une urgence médicochirurgicale. Le traitement repose en premier lieu sur l’introduction d’une corticothérapie intraveineuse à 0,8 mg/kg. Une prévention thrombo- embolique est systématique. En cas d’absence d’amélioration significative de l’état clinique et biologique au 3e jour de la corticothérapie, une stratégie de seconde ligne doit être envisagée par ciclosporine ou par infliximab. La prise en charge chirurgicale doit être envisagée en cas d’échec de 2 lignes de traitement médical.
Traitement de fond
Le traitement d’entretien dans la rectocolite hémorragique repose sur la poursuite des 5-ASA en cas d’efficacité initiale de ces traitements. En cas d’échec des 5-ASA, un traitement immunosuppresseur peut être introduit (azathioprine). En cas de corticorésistance ou de corticodépendance, de poussées fréquentes (> 2/an), un traitement immunosuppresseur (azathioprine) est introduit. Un traitement par anti-TNF alpha peut être proposé en cas d’échec ou d’intolérance aux traitements immunosuppresseurs ou de poussées ayant nécessité un recours aux anti-TNF alpha pour être contrôlées.
Dans la maladie de Crohn, en cas de corticorésistance ou de corticodépendance, de poussées fréquentes (> 2 par an), un traitement immunosuppresseur (azathioprine, methotrexate) est introduit. En cas d’échec, un traitement par anti-TNF alpha peut être proposé.
Traitement chirurgical
La coloprotectomie avec anastomose iléo-anale est le seul traitement curatif existant dans la rectocolite hémorragique. La colectomie avec anastomose iléo-rectale est une alternative proposée par le chirurgien en raison des meilleurs résultats fonctionnels attendus. La coloprotectomie doit être proposée en cas d’échec du traitement médical, en cas de dysplasie ou de cancer ou en cas de colite aiguë grave avec échec de 2 lignes de traitement médical. La pochite, ou inflammation du réservoir iléal confectionné, est une complication fréquente survenant dans 5 à 10 % des cas après coloprotectomie.
Dans la maladie de Crohn, le traitement chirurgical doit être envisagé en cas de complication intra-abdominale (abcès, sténose, fistule, perforation) ou d’échec du traitement médical, la résection devant être la moins étendue possible en raison du risque de récidive postopératoire et d’insuffisance intestinale par syndrome du grêle court.
Traitement symptomatique
Un régime d’épargne digestive est conseillé transitoirement en cas de poussée, une alimentation équilibrée doit être encouragée en dehors des poussées. Le traitement symptomatique repose sur les antalgiques et les antispasmodiques. Les traitements morphiniques sont contre-indiqués en cas de poussée de maladies inflammatoires chroniques de l’intestin, augmentant le risque de colectasie. L’arrêt du tabac dans la maladie de Crohn est un objectif thérapeutique important.
La maladie de Crohn et la rectocolite hémorragique se déclarent principalement chez l’adulte jeune. Le tabagisme et l’appendicectomie sont les deux facteurs environnementaux clairement identifiés comme facteurs de risque dans la maladie de Crohn. Le diagnostic de maladies inflammatoires chroniques de l’intestin est fondé sur un faisceau d’arguments cliniques, biologiques, endoscopiques et histologiques. L’iléocoloscopie est l’examen clé dans le diagnostic des maladies inflammatoires chroniques de l’intestin, permettant d’apprécier la gravité et l’étendue des lésions, et la réalisation de biopsies multiples et étagées en muqueuses saine et pathologique. En cas de poussée, une cause infectieuse doit toujours être exclue, notamment par la réalisation de coproculture à la recherche d’une surinfection à Clostridium difficile toxinogène. La dysplasie et le cancer colorectal sont les complications à long terme redoutées au cours des maladies inflammatoires chroniques de l’intestin coliques, nécessitant un dépistage par coloscopie dans cette population à risque.
Message de l'auteur
Les questions susceptibles d’être posées à l’ECN porteraient en premier lieu sur les circonstances amenant au diagnostic de maladie de Crohn et de rectocolite hémorragique (anémie ferriprive, diarrhée chronique), la connaissance des complications potentiellement révélatrices des maladies inflammatoires chroniques de l’intestin (syndrome occlusif, colite aiguë grave…) et l’exclusion des principaux diagnostics différentiels.L’iléo-coloscopie est l’examen clé dans le diagnostic des maladies inflammatoires chroniques de l’intestin. La connaissance des caractéristiques lésionnelles propres à la maladie de Crohn et la rectocolite hémorragique est indispensable à la fin du second cycle des études médicales.Le dépistage du cancer colorectal et ses modalités de réalisation sont un enjeu majeur dans cette population d’âge jeune au moment du diagnostic et à risque augmenté par rapport à la population générale.Les principes thérapeutiques sont complexes, néanmoins l’étudiant doit comprendre l’implication de l’arrêt du tabac dans la maladie de Crohn

 Encadrés
Encadrés