objectifs
Diagnostiquer un œdème de Quincke et une anaphylaxie.
Prise en charge immédiate préhospitalière et hospitalière (posologies).
Introduction
Le terme d’anaphylaxie a été proposé au début du XXe siècle par Richier et Portier, faisant suite à leurs travaux sur la tentative d’immunisation d’un chien vis-à-vis de la toxine des méduses. La terminologie d’anaphylaxie adoptée par la communauté scientifique internationale doit être préférée à celle bien française et populaire de « choc anaphylactique ».
Le terme d’œdème de Quincke doit être abandonné au profit d’angio-œdème avec atteinte laryngée. En effet, la pathologie décrite par Quincke est l’angio-œdème bradykinique, pathologie génétique ou induite par des médicaments de mécanisme non allergique.
Physiopathologie
On distingue les réactions d’hypersensibilité dépendantes des immunoglobulines E (IgE) des réactions aux mécanismes non dépendants des IgE, appelées autrefois réactions anaphylactoïdes. En situation d’urgence, il est difficile d’établir le mécanisme étiologique, qui fera l’objet d’un bilan allergologique a posteriori. Quel que soit ce mécanisme, la prise en charge des symptômes repose sur les mêmes bases.
Réactions d’hypersensibilité IgE-dépendantes
Dans sa forme d’origine allergique IgE-dépendante, l’anaphylaxie est consécutive à une activation massive des basophiles plasmatiques et des mastocytes tissulaires, mais également d’autres types cellulaires. Il s’agit de l’hypersensibilité de type 1 de la classification de Gell et Coombs et du mécanisme d’anaphylaxie le plus fréquent. La réaction allergique se déroule en deux phases. Une exposition préalable à l’allergène initie la synthèse d’IgE spécifiques. Ces IgE vont se lier aux récepteurs de haute affinité (FceRI), situés sur la surface des mastocytes et des polynucléaires basophiles, par leur fragment Fc. Durant cette phase, dite de sensibilisation, il n’y a pas de conséquence fonctionnelle pour ces cellules.[1] Lors d’une exposition ultérieure, l’allergène se lie aux complexes igE-FceRI, provoquant le pontage des IgE et l’agrégation des récepteurs FceRI. Ces phénomènes permettent l’activation et la dégranulation des mastocytes et des basophiles, aboutissant à la libération des médiateurs préformés puis à la libération en cascade des médiateurs néoformés.[1, 2] D’autres types cellulaires sont également activés et parfois via une interaction des récepteurs de faible affinité. Cette activation entraîne une dégranulation cellulaire avec libération de médiateurs préformés, comme l’histamine, la tryptase, la chymase, la carboxypeptidase et l’héparine, puis une synthèse de leucotriènes LTB4, LTC4, LTD4 et LTE4, de prostaglandines D2 (PGD2), de thromboxane A2, de platelet-activating factor (PAF), de sérotonine, de bradykinine, de calcitonin gene-related peptide et de monoxyde d’azote. La néoformation de ces médiateurs est responsable des symptômes de la phase semi-tardive.[3, 4] La fixation de l’histamine sur les récepteurs H1 des cellules endothéliales va induire une vasodilatation et une fuite vasculaire, responsable de l’urticaire, de l’œdème cutané ou muqueux, de la chute de pression artérielle aboutissant au choc. Son action sur les récepteurs H1 des fibres musculaires lisses entraîne une contraction des muscles lisses bronchiques, responsable d’un bronchospasme, et une contraction des muscles lisses digestifs, entraînant des douleurs abdominales, des diarrhées et des vomissements. Son action sur les fibres nerveuses sensitives induit le prurit. Les leucotriènes LTB4, dont les récepteurs sont situés sur les polynucléaires neutrophiles, induisent le chimiotactisme et le recrutement de ces cellules. Les leucotriènes sulfidopeptidiques (Cys-LT) LTC4, LTD4et LTE4 sont responsables d’une bronchoconstriction, d’une vasodilatation et d’une hypersécrétion de mucus, provoquant bronchospasme et inflammation bronchique. Les prostaglandines entraînent une bronchoconstriction intense et rapide. Le thromboxane A2 est un puissant broncho- et vaso-constricteur. Le PAF est responsable d’une bronchoconstriction puissante. Il induit la dégranulation plaquettaire, et donc la libération de sérotonine.
Réactions d’hypersensibilité non IgE-dépendantes
Les IgG, classiquement considérées comme effecteurs des réactions de type II (cytotoxicité directe ou indirecte anticorps-dépendante) et de type III (maladies à complexes immuns) dans la classification de Gell et Coombs, peuvent également être responsables de réaction anaphylactique. L’activation mastocytaire peut également survenir par stimulation d’autres récepteurs présents sur les mastocytes : les opiacés, ou encore certains neuromédiateurs comme la substance P, le polypeptide intestinal vasoactif (VIP) ou la somatostatine. Il existe également des récepteurs aux anaphylatoxines C3a et C5a, produites lors de l’activation du complément, conduisant à la dégranulation mastocytaire en cas de stimulation. D’autres mécanismes ne résultant pas de l’activation des mastocytes peuvent être responsables de tableau clinique d’anaphylaxie. En effet, sous l’action de facteurs physicochimiques particuliers, le système contact peut être activé, entraînant l’auto-activation du facteur XII de la cascade de la coagulation. Celui-ci active à son tour la prékallicréine plasmatique en kallicréine plasmatique. Cette kininogénase entraîne la protéolyse du kininogène de haut poids moléculaire en bradykinine.[5, 6] Les propriétés pharmacologiques de la bradykinine sont liées aux récepteurs hautement spécifiques B1 et B2. La stimulation des récepteurs B2 entraîne un bronchospasme et une fuite vasculaire.[7, 8] Ce mécanisme a été responsable des réactions d’hypersensibilité à l’héparine contaminée par le chondroïtine sulfate A hypersulfaté.[5] Les mastocytoses systémiques représentent un facteur de risque de choc anaphylactique.
Définition
L’anaphylaxie est la manifestation la plus grave et sévère de l’allergie immédiate. Sa définition purement clinique a été établie par diverses sociétés savantes internationales avec certaines particularités et nuances notables.[9] Le Anaphylaxis Committee de la World Allergy Organization (WAO) vient de proposer une définition qui paraît désormais mieux adaptée : « L’anaphylaxie est une réaction d’hypersensibilité, d’installation généralement rapide et pouvant causer la mort. L’anaphylaxie sévère caractérisée par la mise en jeu du pronostic vital impacte l’état respiratoire et/ou circulatoire et peut apparaître sans les signes cutanés caractéristiques ni l’existence d’un choc circulatoire »[10] (
Épidémiologie
Depuis une dizaine d’années, de nombreuses données ont été colligées dans les centres de soins primaires ou en milieu hospitalier, permettant d’obtenir des données épidémiologiques relatives à la fréquence de l’anaphylaxie. Toutefois, on constate de grandes variations dans les chiffres selon l’âge et l’origine géographique des patients, les définitions de l’anaphylaxie, les critères d’inclusion et les recueils d’information.
Désormais, on estime la prévalence de l’anaphylaxie entre 0,02 et 1,6 % (anaphylaxie vraisemblable affectant l’adulte aux États-Unis), voire 5,1 % (anaphylaxie très probable affectant l’adulte aux États-Unis).[10-12]
L’incidence de l’anaphylaxie est évaluée à environ 50 épisodes pour 100 000 habitants/an. Jusqu’en 2005 l’incidence n’était que de 10 épisodes/100 000 habitants/an.12
Cette augmentation de la fréquence de l’anaphylaxie a été effective durant ces 2 dernières décades. En effet, le nombre d’hospitalisations aux États-Unis pour anaphylaxie durant la période 1999-2009 a augmenté de 2,2 % par an, soit de 21 à 25 millions d’habitants.[13] En Grande-Bretagne, le nombre d’hospitalisations a été multiplié par 7 entre 1992 et 2012 et notamment chez les enfants souffrant d’allergie alimentaire.[14]
La mortalité par anaphylaxie est un événement rare, avec une incidence de 0,12 à 1,06 décès/million d’habitants/an. Ainsi, l’anaphylaxie létale concerne seulement de 0,3 à 2 % des anaphylaxies.12 Le risque de décès affecte particulièrement les sujets âgés lors d’une anaphylaxie iatrogène en raison de comorbidités cardiovasculaires et pulmonaires sous-jacentes et de traitements médicamenteux aggravants.12 En revanche, l’anaphylaxie létale d’origine alimentaire touche les enfants, avec un risque notable chez l’adolescent (prises de risque, attitude de déni, non-observance des évictions, non-contrôle de l’asthme, exercice, non-disponibilité de l’adrénaline auto-injectable).[15]L’incidence de la mortalité par anaphylaxie alimentaire est évaluée entre 0,03 et 0,3 décès/million/an.[12, 15, 16]
Clinique
La symptomatologie des manifestations cliniques de l’anaphylaxie concerne différents organes : appareil respiratoire, appareil cardiovasculaire, appareil digestif, appareil neurologique et système cutanéomuqueux. L’évaluation clinique est l’étalon-or du diagnostic. Parmi les signes respiratoires, la rhinite se manifeste par un prurit nasal, des éternuements et une rhinorrhée claire. L’œdème laryngé est responsable d’une dyspnée inspiratoire, d’une dysphonie et/ou d’une dysphagie et d’hypersalivation. Il peut s’y associer un œdème de la luette, signe clinique à rechercher de manière systématique, de la langue, du cou ou du visage. L’expression clinique d’un bronchospasme sera, quant à elle, variable en fonction de la sévérité, allant d’une simple toux jusqu’à l’arrêt respiratoire. L’atteinte de l’appareil cardiovasculaire peut être responsable d’une hypotension artérielle ou d’une tachycardie. Les signes digestifs sont les nausées, les vomissements et les diarrhées. Il peut également exister des signes neurologiques, à type de céphalées, d’agitation, d’obnubilation, pouvant aller jusqu’au malaise avec perte de connaissance. Enfin, de manière non systématique, peuvent être associés des signes cutanéomuqueux : le prurit, particulièrement évocateur dans sa localisation palmoplantaire, mais également un érythème généralisé, une urticaire généralisée, ou encore, un angio-œdème. Le choc anaphylactique est le stade le plus grave, précédant l’arrêt cardiocirculatoire. Deux phases peuvent être distinguées :
- la phase hyperkinétique, caractérisée par l’apparition de signes initiaux souvent cutanéomuqueux, est rapidement suivie par une vasodilatation et une tachycardie. Il en résulte une augmentation du débit cardiaque et une stabilisation transitoire de la pression artérielle. Sans traitement, l’évolution se fait vers un tableau de choc hypovolémique, conduisant à un arrêt cardiorespiratoire par un désamorçage de la pompe cardiaque ;
- la phase hypokinétique est, elle, caractérisée par un effondrement du débit cardiaque, associé à une défaillance multiorganique. Dans 20 % des cas d’anaphylaxie, il existe une évolution biphasique des symptômes avec récurrence, survenant entre 1 et 72 heures, ce qui impose une surveillance clinique prolongée. L’anaphylaxie induite par l’exercice est une entité clinique particulière. Cette symptomatologie apparaît au décours d’un effort qui a été précédé de l’ingestion de certains aliments ou chez des patients souffrant de pollinose et réalisant l’effort en saison pollinique. Elle se caractérise par la survenue d’une urticaire, d’un angio-œdème, de signes respiratoires ou digestifs, pouvant aller jusqu’au choc anaphylactique.
Facteurs de risque
L’asthme, particulièrement s’il est sévère et non contrôlé, est un facteur de risque d’anaphylaxie et de décès.[17-19] Plusieurs autres facteurs de risque sont retrouvés dans la littérature : il s’agit des âges extrêmes de la vie, des mastocytoses cutanées ou systémiques, la mauvaise observance au traitement préventif, un traitement par bêtabloquants, inhibiteurs de l’enzyme de conversion ou antagonistes des récepteurs de l’angiotensine II qui interfèrent avec le métabolisme de la bradykinine, ou encore l’administration parentérale de l’allergène. Les maladies cardiovasculaires chroniques sont également associées à un risque de réactions sévères.19 Certains cofacteurs augmentent le risque de réactions allergiques, ou leur sévérité. Retrouvés dans près de 20 % des cas,19 il s’agit de l’exercice physique, de la fièvre, des infections aiguës, de la phase prémenstruelle et du stress. Les anti-inflammatoires non stéroïdiens (AINS) et l’alcool sont également susceptibles de majorer une réaction allergique.19 L’aspirine et les AINS agissent en potentialisant la synthèse de dérivés de l’acide arachidonique, bloquant la cyclo-oxygénase et favorisant ainsi la synthèse des leucotriènes.
Diagnostic de gravité
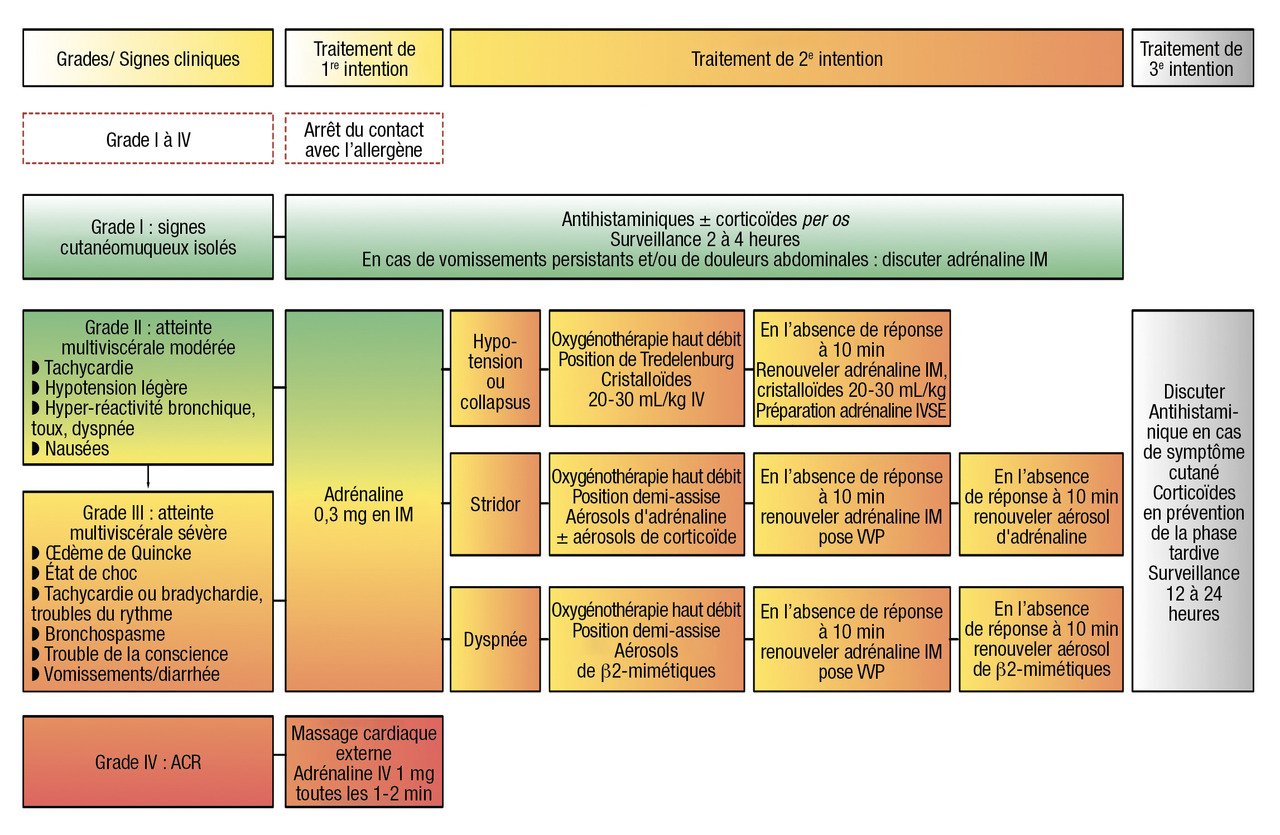
La classification de Ring et Messmer est habituellement utilisée pour classer les réactions anaphylactiques. Celle-ci comporte 4 grades de gravité croissante, qui conditionnent le traitement (
- le grade 1 correspond aux réactions bénignes, avec des signes cutanéomuqueux purs, sans atteinte viscérale : érythème généralisé, urticaire avec ou sans angio-œdème du visage, mais sans signe d’atteinte laryngée ;
- le grade 2 se manifeste par des signes d’atteintes multiviscérales et correspond à une anaphylaxie. Des signes cutanéomuqueux peuvent être présents, mais de manière inconstante. Ce grade correspond à des signes modérés à type de tachycardie, d’hypotension, d’hyperréactivité bronchique, de toux, de dyspnée ou de nausées. À ce stade, l’évolution est généralement favorable, avec un traitement bien conduit ;
- dans le cas contraire, une aggravation vers un grade 3 est possible. Il s’agit de réactions sévères : état de choc, tachycardie ou bradycardie, œdèmes laryngé, troubles du rythme cardiaque, bronchospasme, troubles de la conscience, vomissements ou diarrhée ;
- le grade 4 correspond à un arrêt cardiocirculatoire et/ou ventilatoire. En cas d’œdème du visage, trois signes de gravité sont à rechercher : dysphagie, dysphonie et dyspnée. Ces trois signes sont évocateurs d’œdème laryngé.
Diagnostics différentiels
Le diagnostic différentiel se fonde sur le tableau clinique et l’atteinte organique principale. Devant un tableau de choc anaphylactique, les autres causes de choc, à savoir cardiogénique, septique et hypovolémique, sont à éliminer. De plus, il faut garder à l’esprit la possibilité d’autres étiologies plus trompeuses : inhalation de corps étranger, asthme aigu grave, malaise vagal, hypoglycémie, syndrome paranéoplasique carcinoïde, attaque de panique. En cas d’œdème laryngé, deux autres mécanismes sont à évoquer, en plus du mécanisme mettant en jeu la libération d’histamine : il s’agit de l’angio-œdème bradykinique et de l’angio-œdème impliquant les leucotriènes. Dans le premier cas, l’angio-œdème est dû à un excès de synthèse ou à un défaut de dégradation des kinines. Il s’agit d’un angio-œdème blanc, non prurigineux et généralement douloureux. Il dure de 24 à 96 heures et est résistant à la corticothérapie. Dans le cas de l’angio-œdème induit par les leucotriènes, l’action inhibitrice sur la cyclo-oxygénase de l’aspirine ou des anti-inflammatoires non stéroïdiens oriente le métabolisme de l’acide arachidonique vers la production de leucotriènes, responsable d’un œdème d’aspect inflammatoire associé à une urticaire et une conjonctivite typique dite « yeux de lapin russe ».
Examens paracliniques
Aucun examen n’est nécessaire pour porter le diagnostic initial, et ceux-ci ne doivent pas retarder le traitement. Le dosage de l’histamine plasmatique et de la tryptase sérique peut être utile pour apporter la preuve d’une dégranulation des basophiles et des mastocytes lors d’une réaction d’hypersensibilité. La sensibilité des tests est variable en fonction de l’horaire du prélèvement et de la sévérité de la réaction. La négativité des tests ne doit donc pas faire exclure le diagnostic d’anaphylaxie.[20] Si l’on considère que la valeur de base pour un même individu est relativement stable, une dégranulation mastocytaire est confirmée lorsque la tryptase au pic est égale ou supérieure à 120 % de la tryptase basale + 2 µg/L.
Le dosage de l’histaminémie n’a plus sa place et est coté hors nomenclature.
Les autres médiateurs pouvant être libérés lors d’une réaction d’hypersensibilité, tels que les prostaglandines, les leucotriènes, la chymase, la carboxypeptidase 3, le PAF, ou encore la bradykinine ne sont pas dosés en pratique courante.
Étiologie
Tout allergène peut être responsable d’une anaphylaxie. Toutefois, les allergies alimentaires concernent plutôt les enfants et les adultes jeunes, et les allergies médicamenteuses et aux hyménoptères affectent surtout les personnes d’âge moyen ou les personnes âgées. L’anaphylaxie idiopathique, c’est-à-dire sans qu’il soit retrouvé une étiologie, doit rester un diagnostic d’élimination et atteindrait un maximum de 20 %.17
L’allergie alimentaire dépend des habitudes socioculturelles des patients et diffèrent chez les enfants et les adultes. Une étude européenne portant sur 1 970 enfants de moins de 18 ans ayant eu une anaphylaxie détermine les aliments les plus souvent incriminés parmi les causes alimentaires (66 %, soit 1 291 observations) : arachides (25 %), fruits à coque (23 %), laits de vache et de chèvre (12 %), œufs de poule (10 %).[21]
Les médicaments les plus souvent incriminés sont les bêtalactamines et les AINS. Les dernières données du Groupe d’étude des réactions anaphylactoïdes peranesthésiques (GERAP) placent toujours les curares comme la première cause d’anaphylaxie peropératoire (60,6 %), suivis par les antibiotiques (18,2 %), les colorants (bleu de méthylène et bleu patenté V) (5,4 %) et le latex (5,2 %) qui occupe désormais la 4e place et dont le rôle diminue grâce aux mesures de prévention.[22]
Orientations thérapeutiques
Les recommandations européennes et françaises proposent un algorithme de traitement de l’anaphylaxie identique pour l’enfant et l’adulte.[17, 23] La
Traitement de première ligne : l’adrénaline
Le traitement de l’anaphylaxie repose sur l’utilisation de l’adrénaline, qui doit être précoce et de première intention par voie intramusculaire (face antéro-externe du tiers moyen de la cuisse) et qui peut être le cas échéant renouvelée 5 à 10 minutes plus tard si besoin.[17, 23, 24] En effet, les propriétés pharmacologiques de l’adrénaline sont parfaitement adaptées au traitement de l’anaphylaxie.[17] La non-utilisation d’adrénaline ou son retard d’injection sont très souvent retrouvés en cas d’évolution fatale.[25, 26] L’injection d’adrénaline n’aurait été effectuée avant l’arrêt cardiaque seulement chez un quart des sujets décédés.[27]
Il n’y a pas de contre-indication de l’usage de l’adrénaline par voie intramusculaire, pouvant toutefois entraîner aux posologies habituelles pâleur transitoire, nausées, palpitations et céphalées.[17]
Les doses recommandées sont de l’ordre de 0,01 mg/kg avec un maximum de 0,5 mg. Des stylos auto-injectables dosés à 0,15 mg, 0,30 mg et 0,50 mg sont actuellement disponibles. (
Traitement de deuxième ligne
Dès que possible, il fait appel à des secours, et le cas échéant la soustraction à l’allergène déclenchant est réalisée.
La posture du patient doit être celle qui est la plus adaptée à la situation, c’est-à-dire en position de Trendelenburg en cas d’instabilité hémodynamique ou de malaise, en position demi- assise en cas de détresse respiratoire, en décubitus latéral gauche en cas de grossesse et enfin en position latérale de sécurité en cas de troubles de la conscience.
Les médications à ce stade seront l’administration d’oxygène à fort débit ou au masque, un remplissage vasculaire si besoin jusqu’à 20 mL/kg de fluide de type cristalloïdes, et enfin le recours à des bêta-2-agonistes en cas de bronchospasme.17, 23
Traitement de troisième ligne
La place des antihistaminiques et des corticoïdes, bien trop souvent prescrits en première ligne, doit être limitée. Les antihistaminiques ont un intérêt en cas d’atteinte cutanée.17, 23
La durée de surveillance en milieu hospitalier est de six heures au minimum après résolution de l’épisode. En cas d’atteinte respiratoire sévère ou cardiovasculaire, la surveillance est prolongée, 12 à 24 heures.17, 23
Le patient quittera le service des urgences avec un courrier détaillé et également une seringue auto-injectable d’adrénaline.
Prise en charge allergologique
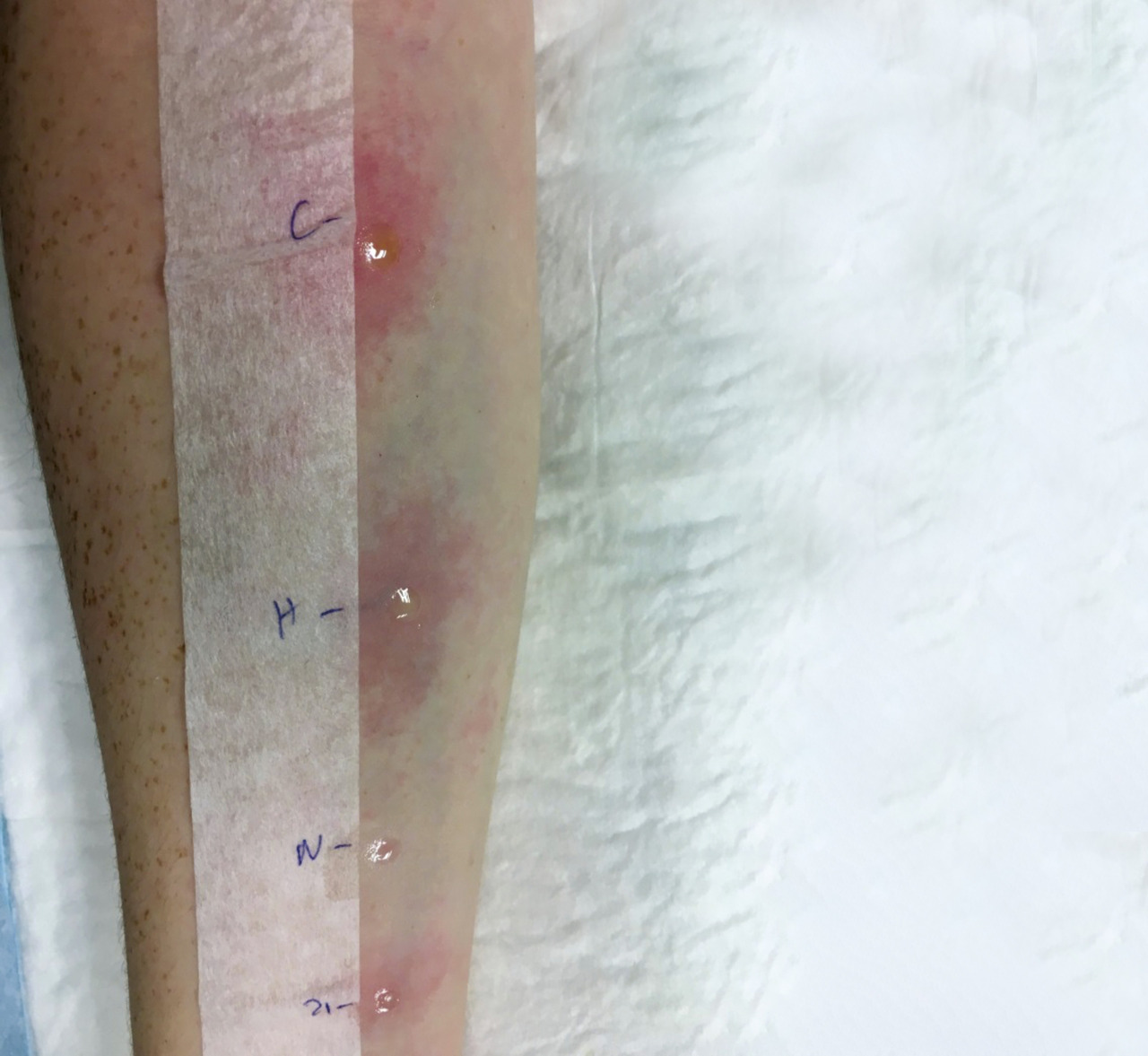
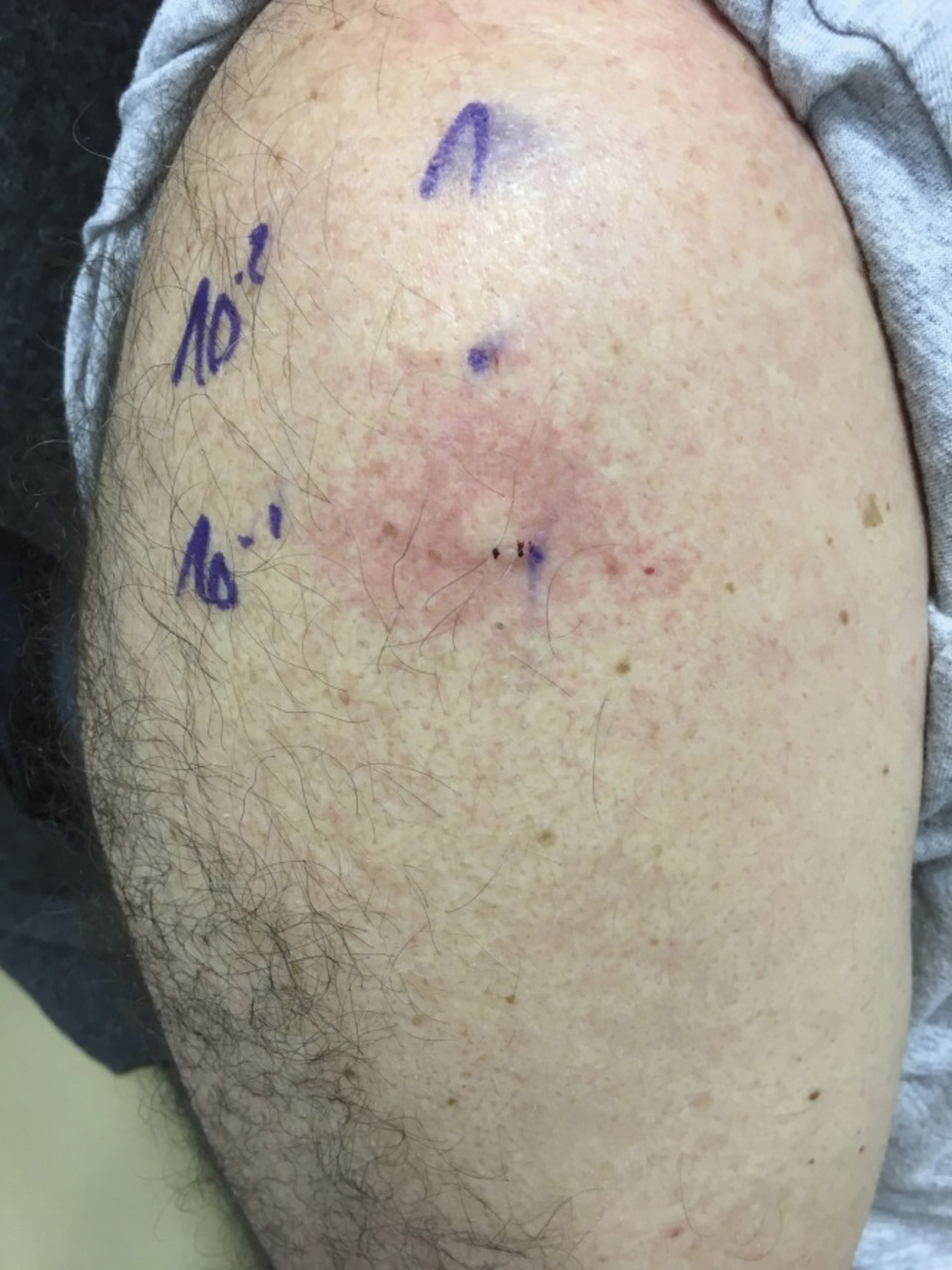
Un patient ayant présenté une anaphylaxie devra être orienté dans un délai de 4 à 6 semaines vers un allergologue afin d’identifier l’allergène responsable, voire de prescrire les différentes médications en cas d’urgence si cela n’a pas été fait lors du passage aux urgences. Les tests reposent en première intention sur les tests cutanés (prick-tests, habituellement poursuivis par des intradermoréactions pour les venins et les allergies médicamenteuses) [
Un programme d’éducation thérapeutique des patients ou de l’entourage (éviction de l’allergène, utilisation de l’adrénaline auto-injectable) est indispensable, venant ainsi compléter la prise en charge du patient.
Conclusion
La prise en charge pluridisciplinaire et coordonnée de l’anaphylaxie nécessite notamment la coopération des différents professionnels de santé (urgentistes, réanimateurs, pédiatres, médecins traitants, allergologues, médecins de l’Éducation nationale et pharmaciens). La prévention de la récidive repose sur une éviction de l’allergène et, à défaut, le patient devra disposer d’une seringue d’adrénaline auto-injectable, sauf dans le cas particulier de l’allergie médicamenteuse.
POINTS FORTS À RETENIR
Le terme d’anaphylaxie, auquel s’ajoute le grade de la réaction (de 1 à 4), est préféré à celui de choc anaphylactique.
Le terme d’œdème de Quincke ne doit plus être utilisé.
Plusieurs mécanismes peuvent déclencher une activation mastocytaire (IgE- ou non IgE-dépendants).
Le traitement de première ligne d’une anaphylaxie, dès le grade 2, est l’adrénaline en intramusculaire.
Œdème de Quincke et anaphylaxie
➥ bases physiologiques de l’anaphylaxie ;
➥ diagnostic et traitement d’une anaphylaxie et d’un angio-œdème (avec les posologies) ;
➥ mesures préventives à la suite d’une réaction allergique.
1. Galli SJ. Pathogenesis and management of anaphylaxis: current status and future challenges. Journal of Allergy and Clinical Immunology 2005;115(3):571-4.
2. Finkelman FD, Rothenberg ME, Brandt EB, Morris SC, Strait RT. Molecular mechanisms of anaphylaxis: lessons from studies with murine models. J Allergy Clin Immunol 2005;115(3):449‑57;quiz 458.
3. Jönsson F, Mancardi DA, Kita Y, Karasuyama H, Iannascoli B, Van Rooijen N, et al. Mouse and human neutrophils induce anaphylaxis. J Clin Investr 2011;121(4):1484‑96.
4. Mertes PM, Pinaud M. What are the physiopathological mechanisms? How can severe anaphylactoid reactions be explained. Ann Fr Anesth Reanim 2002;21 Suppl 1:55s‑72s.
5. Li B, Suwan J, Martin JG, Zhang F, Zhang Z, Hoppensteadt D, et al. Oversulfated chondroitin sulfate interaction with heparin-binding proteins: New insights into adverse reactions from contaminated heparins. Biochem Pharmacol 2009;78(3):292‑300.
6. Montpas N, Désormeaux A, Keire D, Adam A. Les réactions anaphylactoïdes associées à l’héparine d’origine chinoise. Annales pharmaceutiques françaises 2011;69(5):258‑64.
7. Leeb-Lundberg LMF, Marceau F, Müller-Esterl W, Pettibone DJ, Zuraw BL. International union of pharmacology. XLV. Classification of the kinin receptor family: from molecular mechanisms to pathophysiological consequences. Pharmacol Rev 2005;57(1):27‑77.
8. Bas M, Adams V, Suvorava T, Niehues T, Hoffmann TK, Kojda G. Nonallergic angioedema: role of bradykinin. Allergy 2007;62(8):842‑56.
9. Turner PJ, Campbell DE, Motosue MS, Campbell RL. Global Trends in Anaphylaxis Epidemiology and Clinical Implications. J Allergy Clin Immunol Pract 28 nov 2019.
10. Turner PJ, Worm M, Ansotegui IJ, El-Gamal Y, Rivas MF, Fineman S, et al. Time to revisit the definition and clinical criteria for anaphylaxis? World Allergy Organ J. 2019;12(10):100066.
11. Wood RA, Camargo CA, Lieberman P, Sampson HA, Schwartz LB, Zitt M, et al. Anaphylaxis in America: the prevalence and characteristics of anaphylaxis in the United States. J Allergy Clin Immunol 2014;133(2):461‑7.
12. Tejedor-Alonso MA, Moro-Moro M, Múgica-García MV. Epidemiology of Anaphylaxis: Contributions From the Last 10 Years. J Investig Allergol Clin Immunol 2015;25(3):163‑75; quiz follow 174-5.
13. Ma L, Danoff TM, Borish L. Case fatality and population mortality associated with anaphylaxis in the United States. J Allergy Clin Immunol 2014;133(4):1075‑83.
14. Turner PJ, Gowland MH, Sharma V, Ierodiakonou D, Harper N, Garcez T, et al. Increase in anaphylaxis-related hospitalizations but no increase in fatalities: an analysis of United Kingdom national anaphylaxis data, 1992-2012. J Allergy Clin Immunol 2015;135(4):956-63.e1.
15. Pouessel G, Beaudouin E, Tanno LK, Drouet M, Deschildre A, Labreuche J, et al. Food-related anaphylaxis fatalities: Analysis of the Allergy Vigilance Network® database. Allergy 2019;74(6):1193‑6.
16. Turner PJ, Jerschow E, Umasunthar T, Lin R, Campbell DE, Boyle RJ. Fatal Anaphylaxis: Mortality Rate and Risk Factors. J Allergy Clin Immunol Pract 2017;5(5):1169‑78.
17. Muraro A, Roberts G, Worm M, Bilò MB, Brockow K, Fernández Rivas M, et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy 2014;69(8):1026‑45.
18. González-Pérez A, Aponte Z, Vidaurre CF, Rodríguez LAG. Anaphylaxis epidemiology in patients with and patients without asthma: A United Kingdom database review. Journal of Allergy and Clinical Immunology 2010;125(5):1098-104.e1.
19. Beaudouin E, Lavaud F. Rôle des cofacteurs dans l’anaphylaxie alimentaire. /data/revues/18770320/v57i8/S187703201730430X/ [Internet]. 8 déc 2017 [cité 1 mars 2020]; Disponible sur: https://www.em-consulte.com/en/article/1184234
20. Vitte J. Human mast cell tryptase in biology and medicine. Mol Immunol 2015;63(1):18‑24.
21. Grabenhenrich LB, Dölle S, Moneret-Vautrin A, Köhli A, Lange L, Spindler T, et al. Anaphylaxis in children and adolescents: The European Anaphylaxis Registry. J Allergy Clin Immunol 2016;137(4):1128-37.e1.
22. Tacquard C, Collange O, Gomis P, Malinovsky J-M, Petitpain N, Demoly P, et al. Anaesthetic hypersensitivity reactions in France between 2011 and 2012: the 10th GERAP epidemiologic survey. Acta Anaesthesiol Scand 2017;61(3):290‑9.
23. Gloaguen A, Cesareo E, Vaux J, Valdenaire G, Ganansia O, Renolleau S, et al. Prise en charge de l’anaphylaxie en médecine d’urgence. Recommandations de la Société française de médecine d’urgence (SFMU) en partenariat avec la Société française d’allergologie (SFA) et le Groupe francophone de réanimation et urgences pédiatriques (GFRUP), et le soutien de la Société pédiatrique de pneumologie et d’allergologie (SP2A). Revue Française d’Allergologie 2017;57(8):595‑614.
24. Simons FER, Ardusso LRF, Dimov V, Ebisawa M, El-Gamal YM, Lockey RF, et al. World Allergy Organization Anaphylaxis Guidelines: 2013 update of the evidence base. Int Arch Allergy Immunol 2013;162(3):193‑204.
25. Pumphrey RS. Lessons for management of anaphylaxis from a study of fatal reactions. Clin Exp Allergy 2000;30(8):1144‑50.
26. Bock SA, Muñoz-Furlong A, Sampson HA. Further fatalities caused by anaphylactic reactions to food, 2001-2006. J Allergy Clin Immunol 2007;119(4):1016‑8.
27. Xu YS, Kastner M, Harada L, Xu A, Salter J, Waserman S. Anaphylaxis-related deaths in Ontario: a retrospective review of cases from 1986 to 2011. Allergy Asthma Clin Immunol 2014;10(1):38.
28. Pouessel G, Beaudouin E, Renaudin J-M, Drumez E, Moneret-Vautrin D-A, Deschildre A. Pratiques et adhésion aux recommandations pour la prescription des dispositifs auto-injectables d’adrénaline : enquête auprès des allergologues du réseau allergo-vigilance. Revue française d’allergologie [Internet]. déc 2015 [cité 2 janv 2016]. Disponible sur: http://linkinghub.elsevier.com/retrieve/pii/S187703201500442X
29. Lefèvre S, Mertes P-M, Kanny G. L’anaphylaxie : de la physiopathologie au traitement. Journal européen des urgences et de réanimation 2015;27(2):97‑104.

 Encadrés
Encadrés