Connaître les principes de la prise en charge d’une ostéoporose.
Connaître les signes cliniques et biologiques devant faire évoquer le diagnostic d’ostéomalacie.
Ostéoporose
Définitions (rang A)
L’ostéoporose est une maladie généralisée du squelette caractérisée par un abaissement de la masse osseuse et une altération de la micro-architecture osseuse, conduisant à une altération de la résistance osseuse et à une augmentation du risque fracturaire. Il s’agit d’une maladie silencieuse, dont l’enjeu est de déterminer, à l’échelle de chaque patient, le risque fracturaire.
On entend par fracture d’allure ostéoporotique une fracture survenant pour un mécanisme de faible cinétique (par exemple une chute de sa hauteur) ou sans traumatisme au-delà de l’âge de 50 ans. Tous les os du squelette peuvent être concernés, à l’exception du crâne, des doigts, des orteils, du rachis cervical et des trois premières vertèbres thoraciques.
On distingue les fractures sévères : fracture vertébrale (FV), fracture de l’extrémité supérieure du fémur (ESF), fracture de l’extrémité supérieure de l’humérus (ESH), fracture du bassin (sacrum, branches ilio- et ischiopubienne), fracture de trois côtes adjacentes. Ces fractures sont dites sévères car associées à une mortalité importante : dans l’année qui suit une fracture de l’extrémité supérieure du fémur, une femme sur six et un homme sur quatre décède. Par opposition, le poignet est un exemple de site de fracture non sévère. Selon son âge, le patient n’est pas exposé au même type de fracture : on considère la fracture du poignet comme une fracture sentinelle de l’ostéoporose pouvant survenir dès l’âge de 50 ans ; il convient de bien démontrer qu’il s’agit d’une fracture d’allure ostéoporotique, ce qui n’est pas toujours le cas. Les fractures vertébrales surviennent le plus souvent entre 50 et 60 ans, et les fractures de l’extrémité supérieure du fémur à partir de 70 ans, avec un pic vers 80 ans. Dans près de deux tiers des cas, la fracture vertébrale est asymptomatique. Typiquement, elle se manifeste par une douleur aiguë (le plus souvent lombaire), mécanique. Toute lombalgie aiguë survenant au-delà de l’âge de 50 ans est une fracture vertébrale jusqu’à preuve du contraire. Les symptômes peuvent être masqués en cas de corticothérapie orale concomitante.
Épidémiologie (rang B)
L’ostéoporose est une maladie fréquente : au-delà de 50 ans, une femme sur deux et un homme sur cinq ont une fracture ostéoporotique au cours de leur vie. L’incidence augmente avec les années. Les dernières données épidémiologiques disponibles en France retrouvent annuellement environ 35 000 fractures du poignet de type Pouteau-Colles, 70 000 fractures vertébrales, et 60 000 fractures de l’extrémité supérieure du fémur.
Physiopathologie
Physiologie osseuse (rang A)
L’os est un tissu vivant qui se renouvelle lors d’un processus appelé « remodelage osseux » : les cellules à l’origine de la résorption osseuse sont les ostéoclastes, tandis que les ostéoblastes sont les cellules responsables de la formation osseuse.
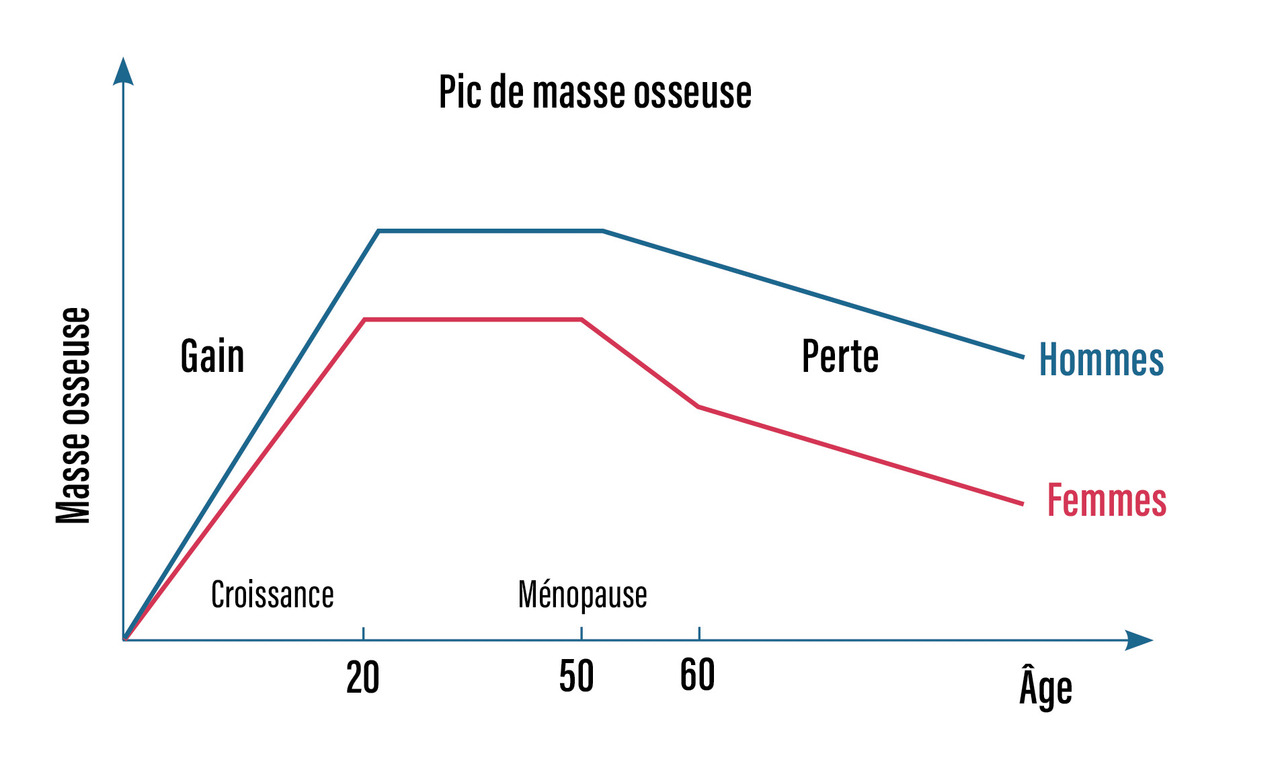
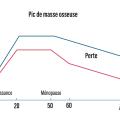
La valeur maximale de la densité minérale osseuse (DMO), appelée pic de masse osseuse, est atteinte en fin de croissance (entre 20 et 30 ans) et constitue le capital osseux. Ce capital est déterminé génétiquement (60 à 80 %) mais aussi par la puberté, les apports calciques et protéiques, et l’activité physique (fig. 1). Au moment de la ménopause, la carence œstrogénique est à l’origine d’une perte osseuse significative et rapide, pendant plusieurs années (- 2 à 3 % au rachis par an) avant de ralentir. Cette perte osseuse prédomine au niveau de l’os trabéculaire. Chez l’homme, l’andropause, survenant à un âge plus tardif, est associée à une perte osseuse plus linéaire.
Au cours de l’ostéoporose, on constate un déséquilibre du remodelage en faveur de la résorption. Ceci a pour conséquence un amincissement des corticales, un amincissement, une raréfaction et une perforation des travées osseuses, et une augmentation de la porosité corticale.
Déterminants de l’ostéoporose (rang B)
Dans les déterminants de l’ostéoporose, on retrouve :
- la perte osseuse en lien avec le vieillissement osseux physiologique ;
- une hérédité familiale ; le capital osseux est déterminé génétiquement pour une part importante (60 à 80 %). Le risque d’ostéoporose est augmenté chez les patients avec une hérédité au premier degré ;
- une activité physique régulière dite « en charge » participe à préserver le capital osseux (et prévenir le risque de chute). A contrario, une sédentarité ou une immobilisation prolongée est à l’origine d’une perte osseuse ;
- la réaction d’hyperparathyroïdie secondaire prolongée est à l’origine d’une perte osseuse corticale et trabéculaire. Il s’agit d’une réaction physiologique se manifestant par une augmentation de la sécrétion de parathormone (PTH) secondaire, entre autres, à une carence calcique et/ou en vitamine D.
Causes d’ostéoporose (rang A)
Primitive
La principale cause d’ostéoporose dite primitive, que ce soit chez la femme ou chez l’homme, est la carence hormonale (ménopause chez la femme, andropause chez l’homme).
Secondaires
Les causes secondaires peuvent être d’origine :
- endocrinienne (hyperthyroïdie, hyperparathyroïdie, hypercorticisme, hypogonadisme) ;
- médicamenteuse : post-cortisonique (première cause d’ostéoporose chez le sujet jeune), due à l’hormonothérapie des cancers du sein (antiaromatase) ou de la prostate (antiandrogéniques) ;
- digestive : maladie cœliaque, maladies inflammatoires chroniques de l’intestin (MICI), malabsorption (après chirurgie de résection), surcharge en fer (hémochromatose).
L’ostéoporose peut aussi survenir dans un contexte de rhumatisme inflammatoire, par exemple la polyarthrite rhumatoïde. La mastocytose est également une cause d’ostéopathie fragilisante secondaire.
Diagnostic (rang A)
La stratification du risque fracturaire d’un patient nécessite :
- la recherche des facteurs de risque d’ostéopathie fragilisante ;
- la réalisation d’une ostéodensitométrie (DMO) ;
- la recherche des facteurs de risque de chute.
Facteurs de risque d’ostéopathie fragilisante
Parmi les facteurs de risque d’ostéopathie, le principal reste l’antécédent personnel de fracture, que ce soit périphérique ou vertébrale, indépendamment de la densité minérale osseuse. Le concept de « risque imminent de refracture à court terme » (dans les deux premières années) a été décrit, mais il existe aussi un risque persistant même plusieurs années (plus de dix ans) après le premier événement fracturaire.
Les autres facteurs de risque sont listés dans l’encadré.
Ostéodensitométrie osseuse, l’examen de référence
La DMO (ou ostéodensitométrie osseuse) constitue l’examen de référence pour évaluer la densité minérale osseuse. Elle repose sur une technique d’absorptiométrie biphotonique à rayons X (DXA). Il s’agit d’une méthode juste (exactitude de la mesure), reproductible (dans le suivi) et inoffensive (irradiation minime).
Modalités de mesure
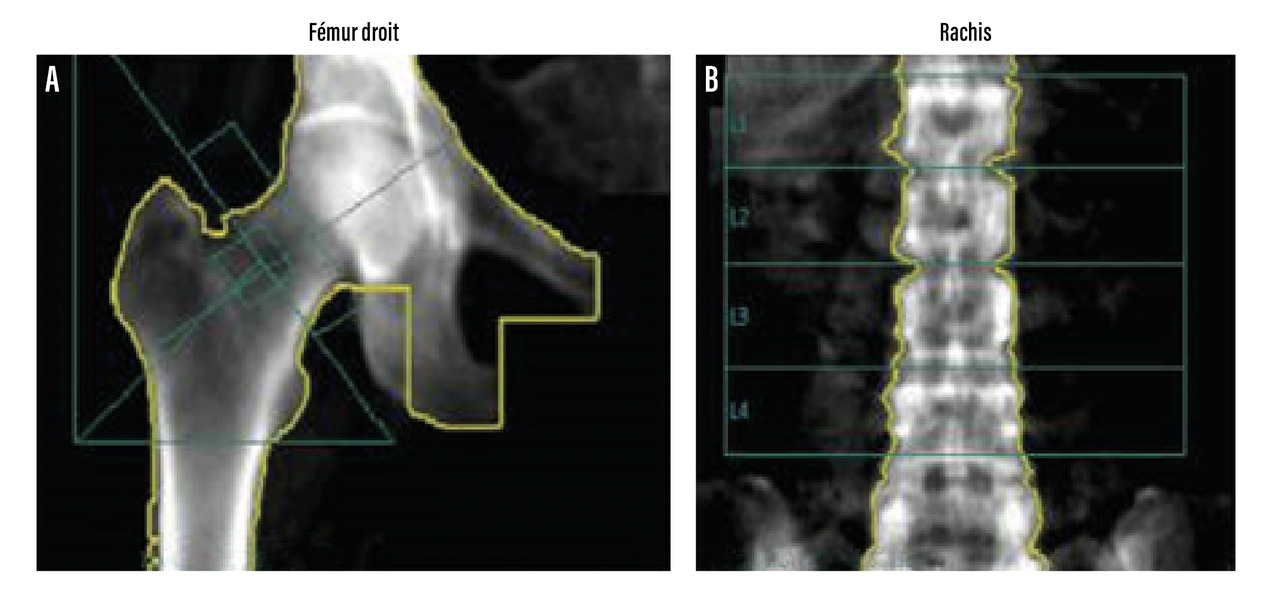
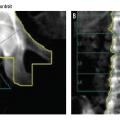
La mesure se fait habituellement sur deux sites, dont la proportion en os cortical et trabéculaire varie, à savoir au niveau du rachis lombaire (riche en os trabéculaire) et de la hanche (riche en os cortical) [fig. 2]. En l’absence de mesure possible sur ces sites (en raison de lésion arthrosique trop importante, prothèse, arthrodèse), la mesure peut se faire au poignet.
Interprétation des résultats
Les résultats sont exprimés de la façon suivante (tableau 1) :
- le T score est le nombre d’écart type entre la valeur du sujet et la valeur moyenne des adultes jeunes de même sexe ;
- le Z score est le nombre d’écart type entre la valeur du sujet et la valeur moyenne des adultes de même sexe et de même âge ;
- la densité minérale osseuse est exprimée en g/cm2.
Chez les femmes ménopausées et les hommes de plus de 50 ans, on prend en compte le T score ; dans les autres cas, le Z score. La masse osseuse est évaluée à un instant t avec le T score ou le Z score, et deux examens de suivi sont comparés sur la densité minérale osseuse, à la recherche d’une variation significative ou non.
Il a été démontré qu’une diminution d’un écart type de la densité minérale osseuse est associée à un doublement du risque fracturaire.
Indications prises en charge par l’Assurance maladie
Il convient de connaître les indications remboursées par la Sécurité sociale (Haute Autorité de santé, 2006).
Pour un premier examen, la DMO est remboursée :
- en cas d’antécédent personnel fracturaire non traumatique de fracture vertébrale ou de fracture non vertébrale (c’est-à-dire périphérique) ;
- en cas de corticothérapie au long cours (définie par prise équivalent prednisone supérieure à 7,5 mg/j pendant plus de trois mois) ;
- en cas d’antécédents de pathologies pourvoyeuses d’ostéoporose : hypogonadisme prolongé (en lien avec une maladie, secondaire aux médicaments ou induite par une chirurgie), hyperthyroïdie évolutive non traitée ; hypercorticisme ; hyperparathyroïdie primitive ; ostéogenèse imparfaite.
Indications supplémentaires chez la femme ménopausée :
- antécédent de fracture du col fémoral sans traumatisme majeur chez un parent du premier degré ;
- indice de masse corporelle (IMC) inférieur à 19 kg /m2 ;
- ménopause avant l’âge de 40 ans quelle qu’en soit la cause ;
- antécédent de prise de corticoïdes (plus de 7,5 mg/j durant plus de trois mois).
Examens complémentaires (rang A, en dehors des paragraphes précisés « rang B »)
Radiographies standard
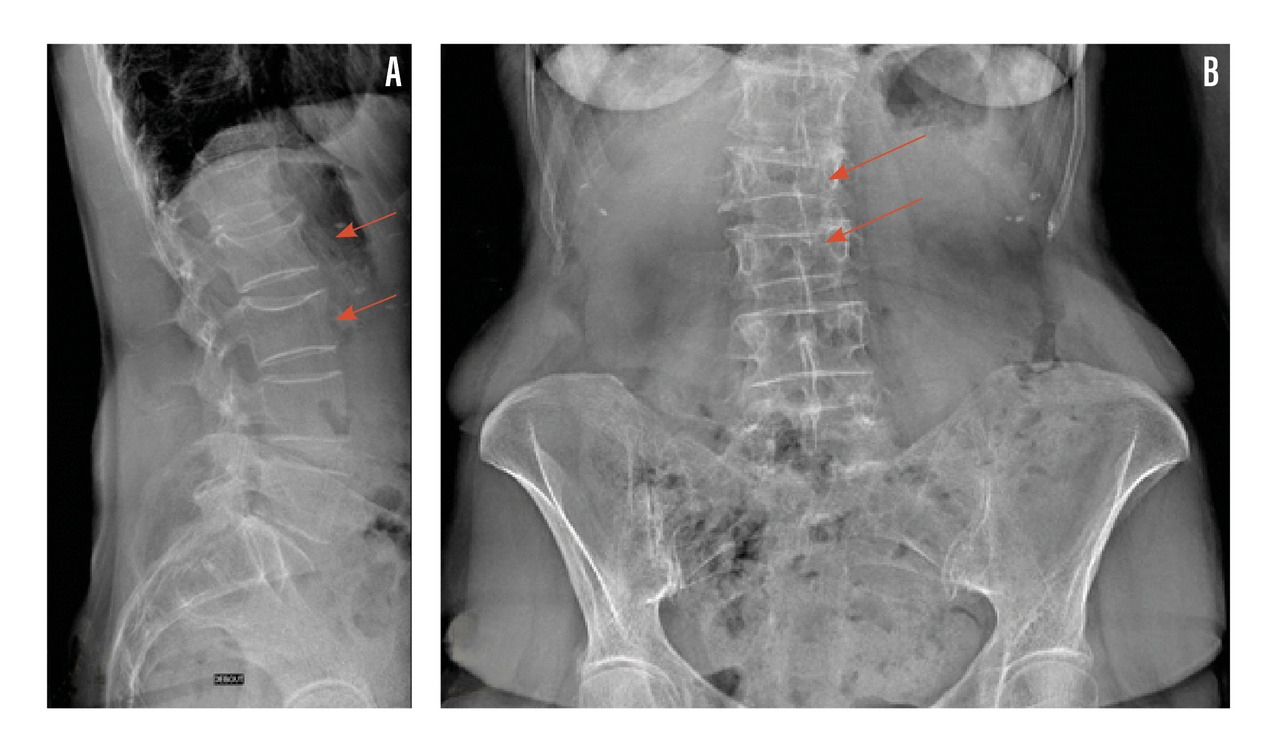
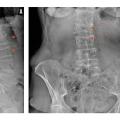
Il est indiqué de réaliser des radiographies du rachis dorso-lombaire devant des rachialgies et/ou une perte de taille supérieure ou égale à 4 cm afin de dépister une éventuelle fracture vertébrale asymptomatique (fig. 3).
Lors d’une fracture vertébrale, on recherche les signes en faveur de la nature bénigne ostéoporotique : siège de la fracture en-dessous de T3, respect du mur vertébral postérieur et de l’arc postérieur, caractère symétrique de la fracture, absence d’ostéolyse (rang B).
Imagerie par résonance magnétique (IRM) ou scanner rachidien
Aucun de ces signes sur les radiographies standard n’est parfaitement spécifique.
Dans certaines situations, une imagerie complémentaire de type IRM et/ou scanner peut s’avérer nécessaire.
L’IRM permet de confirmer le caractère récent de la fracture (présence d’un hypersignal en T2), la nature bénigne ostéoporotique de la fracture (absence de remplacement médullaire notamment), l’absence d’atteinte des parties molles, l'absence de recul pathologique du mur postérieur, l'absence de retentissement sur les structures neurologiques, notamment du cordon médullaire selon l’étage de la fracture vertébrale.
Sur le scanner, on vérifie l’absence de lésion lytique ou condensante suspecte, une corticale « nette » ou l’absence de rupture de la corticale.
Le diagnostic différentiel principal est celui d’une origine tumorale (hémopathie, localisation secondaire d’un cancer solide).
Explorations biologiques
Une ostéopathie fragilisante, qu’elle soit fracturaire ou non, nécessite un bilan biologique pour éliminer certains diagnostics différentiels (par exemple une pathologie tumorale) et réaliser un bilan préthérapeutique. Dans le cadre de l’ostéoporose, ce bilan est normal, en dehors d’une éventuelle carence en vitamine D.
Il n’y a pas de consensus sur le bilan biologique minimal de première intention. Néanmoins, les dosages suivants sont proposés :
- hémogramme, à la recherche notamment de cytopénies ;
- électrophorèse des protéines sériques (EPS), à la recherche d’un pic d’allure monoclonale ou d’une hypogammaglobulinémie ;
- protéine C-réactive (CRP), à la recherche d’un syndrome inflammatoire biologique ;
- calcémie (hypercalcémie pouvant orienter vers une cause maligne), phosphatémie, 25(OH) vitamine D, albuminémie (pour corriger la calcémie) ;
- créatininémie avec estimation du débit de filtration glomérulaire (DFG), à la recherche d’une insuffisance rénale pouvant orienter vers un myélome multiple, et évaluation de la fonction rénale à visée préthérapeutique ;
- bilan hépatique comprenant ASAT, ALAT, gamma-GT et phosphatases alcalines totales.
En deuxième intention (selon les résultats du premier bilan et/ou la sévérité de l’ostéoporose), le bilan est élargi, à la recherche d’une cause secondaire :
- endocrinienne : TSH (hyperthyroïdie), PTH (hyperparathyroïdie), cortisol urinaire des vingt-quatre heures (hypercorticisme), testostérone chez l’homme (hypogonadisme) ;
- digestive : anticorps antitransglutaminase (maladie cœliaque), bilan martial (hémochromatose).
Prise en charge thérapeutique
Prérequis (rang A)
Avant d’envisager un éventuel traitement spécifique de l’ostéoporose, il convient de mettre en place des mesures hygiénodiététiques :
- assurer des apports calciques alimentaires satisfaisants d’au moins 1 000 à 1 200 mg par jour. En pratique, il est possible de s’aider du questionnaire d’évaluation des apports (par exemple le questionnaire du Groupe de recherche et d'information sur les ostéoporoses (Grio) disponible en ligne [www.grio.org]). Les apports calciques alimentaires sont privilégiés, leur source principale est représentée par les produits laitiers, à très bonne teneur en calcium et autres nutriments (dont les protéines) qui sont importants pour la qualité osseuse et musculaire. La consommation d’eau richement minéralisée (Contrex, Courmayeur, Hépar) peut constituer une aide complémentaire. Une supplémentation médicamenteuse calcique n’est envisagée qu’en dernier recours ;
- obtenir un taux de 25(OH)vitamine D sanguine d’au moins 30 ng/mL. La supplémentation vitaminique D peut se réaliser de façon quotidienne (gouttes) ou mensuelle (par exemple, une ampoule de 50 000 UI, à boire tous les mois) ;
- assurer une activité physique régulière en charge (en moyenne trente minutes, deux ou trois fois par semaine) ;
- corriger certains facteurs modifiables, comme la consommation d’alcool et de tabac ;
- rechercher la posologie minimale de corticoïdes oraux ;
- prévenir le risque de chute avec, si besoin, évaluation spécifique gériatrique en consultation dédiée « chute ».
Traitements disponibles (rang B)
Il existe des traitements à visée osseuse spécifique dont les objectifs sont la prévention fracturaire primaire ou secondaire. Selon la molécule, la diminution du risque de fracture périphérique se situe entre 30 et 50 % (50 % pour les fractures de l’ESF) et de 40 à 70 % pour les fractures vertébrales.
Il convient de distinguer les molécules dites anti-résorptives de celles à l’origine d’une stimulation de la formation osseuse.
Traitement hormonal substitutif de la ménopause
Il s‘agit d’un traitement que l’on propose précocement (entre 50 et 60 ans), notamment chez les femmes qui ont des symptômes climatériques marqués, en l’absence de contre-indication gynécologique (antécédent néoplasique familial ou selon des facteurs de risque individuels) et en mesurant le risque thromboembolique. On attend de ce traitement hormonal une prévention des fractures vertébrales.
Modulateurs sélectifs du récepteur aux œstrogènes (SERM) : raloxifène
Il s’agit d’un traitement quotidien (60 mg/j) qui permet une diminution de l’incidence des fractures vertébrales et une augmentation modérée de la DMO. Il est possible de l’utiliser avant 70 ans. Il est contre-indiqué en cas d’antécédent thromboembolique et de cancer hormonodépendant (sein, endomètre) et utilisé avec précaution en cas de symptômes climatériques marqués car il peut être à l’origine de bouffées de chaleur.
Bisphosphonates
Ces molécules ont une forte affinité osseuse. Elles diminuent la résorption osseuse et le remodelage osseux par les ostéoclastes. Elles peuvent être administrées :
- par voie orale à un rythme hebdomadaire ou mensuel ; par exemple, alendronate 70 mg en une prise hebdomadaire, risédronate 35 mg en prise hebdomadaire ou 75 mg en prise mensuelle ;
- par voie intraveineuse, annuellement : acide zolédronique à 5 mg.
Les formes qui ne sont pas gastrorésistantes doivent être avalées avec certaines précautions : le matin à jeun, avec un verre d’eau du robinet, sans se recoucher dans la demi-heure qui suit (risque d’œsophagite). La prise concomitante de calcium ou d’un autre médicament susceptible d’en diminuer l’ absorption doit être évitée.
Ces traitements sont contre-indiqués notamment en cas d’insuffisance rénale avec un débit de filtration glomérulaire (DFG) inférieur à 30 mL/min/1,73 m2 (mais également en cas d’hypocalcémie, et pendant la grossesse) et nécessitent une surveillance buccodentaire régulière en raison du risque rare d’ostéonécrose de la mâchoire (1 cas pour 10 000 patients traités par an) : prévention des foyers infectieux, précaution si tabagisme ou en cas de coprescription avec certains autres traitements (corticothérapie orale ou certaines chimiothérapies).
Dénosumab
Seule biothérapie actuellement disponible, le dénosumab est un anticorps monoclonal anti-RANK ligand (RANKL) de forte affinité, qui empêche la fixation de RANKL au récepteur RANK situé à la surface des ostéoclastes et de leurs précurseurs, et inhibe leur activation. Il n’a pas d’effet rémanent, contrairement aux bisphosphonates.
Il s’agit d’un traitement de deuxième ligne en France, après les bisphosphonates, s’administrant par voie sous-cutanée (une injection de 60 mg tous les six mois). Il diminue le risque fracturaire vertébral et périphérique et augmente la masse osseuse. Ce traitement nécessite un contrôle de la calcémie avant chaque injection du fait de sa contre-indication en cas d’hypocalcémie. Son mode d’action nécessite, en fin de séquence thérapeutique, un relais par bisphosphonates afin de prévenir « un effet rebond ». Comme pour les bisphosphonates, il existe un risque théorique d’ostéonécrose des maxillaires (1 cas pour 10 000 patients traités par an) avec les mêmes recommandations de surveillance buccodentaire.
Tériparatide
Ce produit est le seul ostéoformateur disponible à ce jour. Il contient la séquence active de la PTH humaine endogène, spécifiquement son fragment 1 - 34. Ce traitement se fixe de manière spécifique au récepteur de la PTH, avec la même affinité que la PTH elle-même. Le protocole de traitement nécessite une injection quotidienne sous-cutanée sur une période de dix-huit mois, condition requise pour le remboursement, pouvant aller jusqu'à vingt-quatre mois selon l’autorisation de mise sur le marché (AMM). Il peut être proposé en cas de présence de deux fractures vertébrales ostéoporotiques. Il augmente la masse osseuse et diminue le risque fracturaire vertébral et périphérique. Le tériparatide a, en revanche, quelques contre-indications : enfants, grossesse, allaitement, hypercalcémie, hyperparathyroïdie primitive, maladie de Paget, ostéomalacie, antécédent tumoral et de radiothérapie. À l’issue de la séquence thérapeutique, un relais par un antirésorbeur (type bisphosphonate) est nécessaire.
Particularités des options thérapeutiques chez l’homme (rang B)
Il existe une AMM et un remboursement pour les bisphosphonates (alendronate, risédronate) et le tériparatide. Le dénosumab dispose d’une indication dans le traitement de l’ostéoporose masculine (mais n’est alors pas remboursé) et dans le traitement de la perte osseuse associée à un traitement hormono-ablatif dans le cadre d’un cancer de la prostate.
Particularités en cas d’insuffisance rénale (rang B)
Les bisphosphonates sont contre-indiqués en cas d’insuffisance rénale avec DFG inférieur à 30 à 40 mL/min/1,73 m2 (variable selon le type de molécule). Le tériparatide est contre-indiqué en cas d’insuffisance rénale sévère (un seuil de 30 mL/min/1,73 m2 peut être retenu). Et il s’agit d’être prudent en cas d’insuffisance rénale chronique modérée.
Le dénosumab n’est pas contre-indiqué en cas d’insuffisance rénale. Cependant, on peut anticiper un problème concernant le traitement de relais ultérieur par bisphosphonates, nécessaire pour prévenir l’effet rebond.
La prise en charge de l’ostéoporose chez les patients insuffisants rénaux sévères, voire dialysés, relève d’une prise en charge par une équipe spécialisée avec une collaboration rhumatologique et néphrologique.
Indications thérapeutiques
Il existe actuellement des recommandations sur les indications thérapeutiques concernant l’ostéoporose post-ménopausique (tableau 2), masculine, post-cortisonique (fig. 4) et en cas d’hormonothérapie pour néoplasies mammaire et prostatique (rang A).
Pour l’ostéoporose post-ménopausique (rang B) [fig. 5] :
- en cas de fracture sévère avec un T score ≤ - 1, un traitement doit être débuté ;
- en cas de fracture non sévère avec un T score ≤ - 2, un traitement est indiqué ;
- en l’absence de fracture mais si T score ≤ - 3, un traitement doit être mis en place.
Pour les situations dites intermédiaires (fracture non sévère et - 2 < T score ≤ - 1 ; absence de fracture et - 3 < T score ≤ - 2), on peut s’aider du FRAX (fracture risk assessment tool) , outil d’aide à l’évaluation du risque fracturaire.
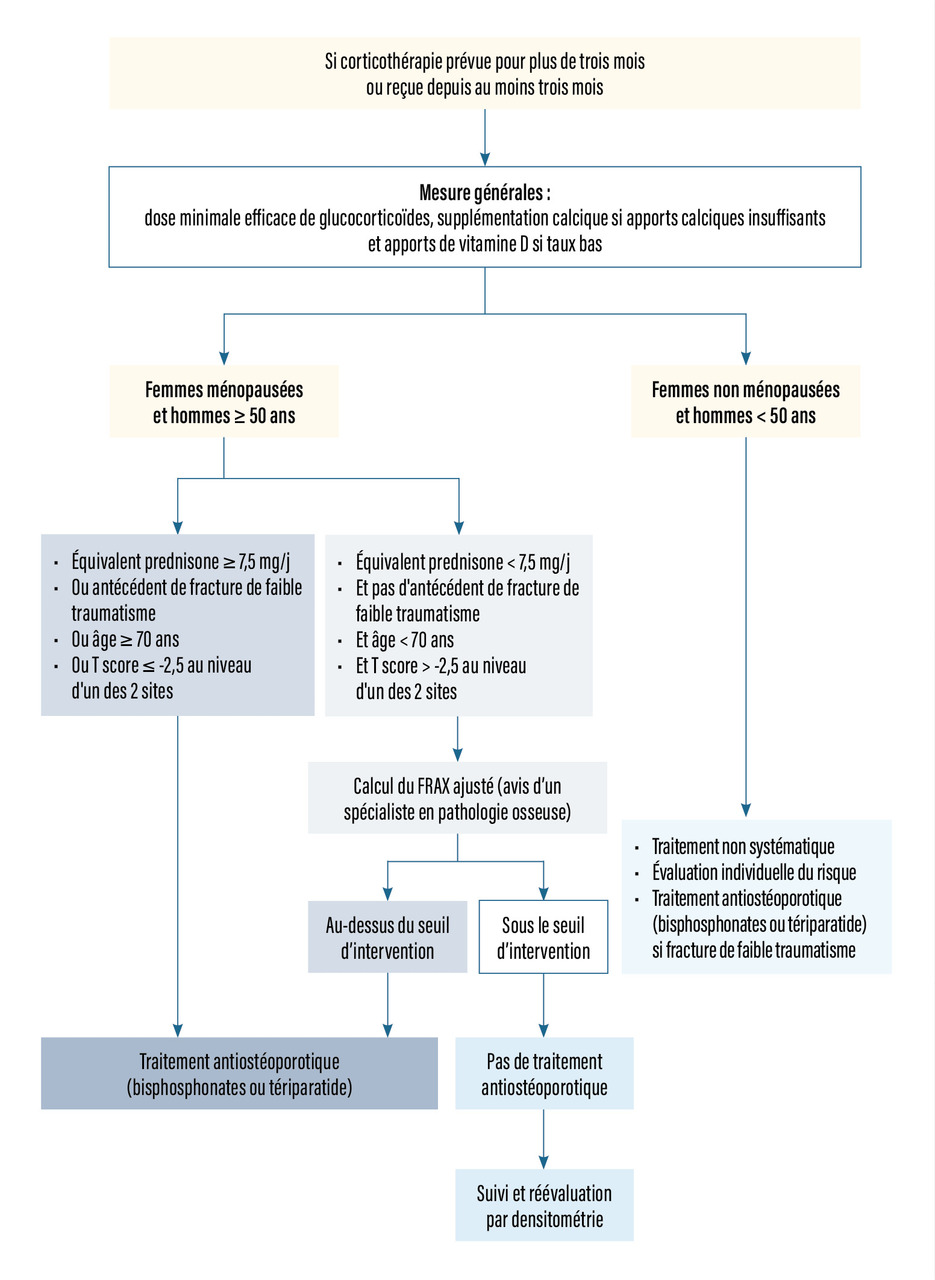
Dans l’ostéoporose post-cortisonique (rang B) :
- un traitement doit être instauré chez les femmes et les hommes de plus de 50 ans (fig. 4) :
- qui vont recevoir une corticothérapie au long cours ;
- qui ont déjà eu une fracture d’allure ostéoporotique ;
- qui ont déjà une ostéoporose densitométrique ;
- qui sont âgés de plus de 70 ans.
Éléments de suivi (rang C)
Les patients atteints d’ostéoporose doivent bénéficier d’un suivi régulier. Lors de l’instauration d’un traitement spécifique à visée osseuse, il est crucial d’évaluer l'adhésion, l’observance et la tolérance du patient au traitement.
Un contrôle de la densitométrie osseuse est recommandé en cours et en fin de séquence thérapeutique, par exemple un an après un cycle de trois perfusions d’acide zolédronique.
Il est également important de dépister tout nouveau facteur de risque d’ostéoporose, une fracture vertébrale asymptomatique, avec une mesure annuelle de la taille. Une radiographie doit être réalisée si une perte de taille de deux cm ou plus est observée lors du suivi.
Des recommandations précises existent concernant les critères permettant de valider une pause ou une fenêtre thérapeutique, mais sortent du cadre de cet item.
Ostéomalacie
Définition (rang A)
Il s’agit d’une ostéopathie bénigne diffuse raréfiante du tissu osseux due à un défaut ou à un retard de minéralisation de la matrice osseuse nouvellement formée, avec une accumulation de tissu ostéoïde. L’os est alors « mou », avec une diminution de sa résistance. Chez l’enfant, on parle de rachitisme, avec un défaut ou retard de minéralisation du cartilage de croissance.
Signes cliniques (rang A)
Cette pathologie doit être évoquée devant des douleurs osseuses, déformations osseuses, fissures/fractures osseuses (dont côtes, membres inférieurs, bassin), ou devant une faiblesse musculaire proximale des membres inférieurs (sans signes de localisation neurologique) faisant évoquer des anomalies du métabolisme phosphocalcique.
Signes biologiques (rang A)
On recherche les anomalies suivantes :
- hypocalcémie ;
- hypophosphatémie ;
- déficit en 25(OH)vitamine D (qui peut être très profond) ;
- augmentation de la PTH (hyperparathyroïdie secondaire à l’hypocalcémie et à l’hypovitaminose D) ;
- anomalies urinaires dont hypocalciurie, taux de réabsorption du phosphore diminué.
Bilan d’imagerie (rang C)
Radiographies
Elles peuvent être normales, surtout en cas d’événement fissuraire. On recherche attentivement un aspect de déminéralisation avec transparence osseuse accentuée, des fissures, ou des stries de Looser-Milkmann (bandes claires radiotransparentes, de quelques millimètres d’épaisseur [2 à 3 mm], perpendiculaires à la corticale).
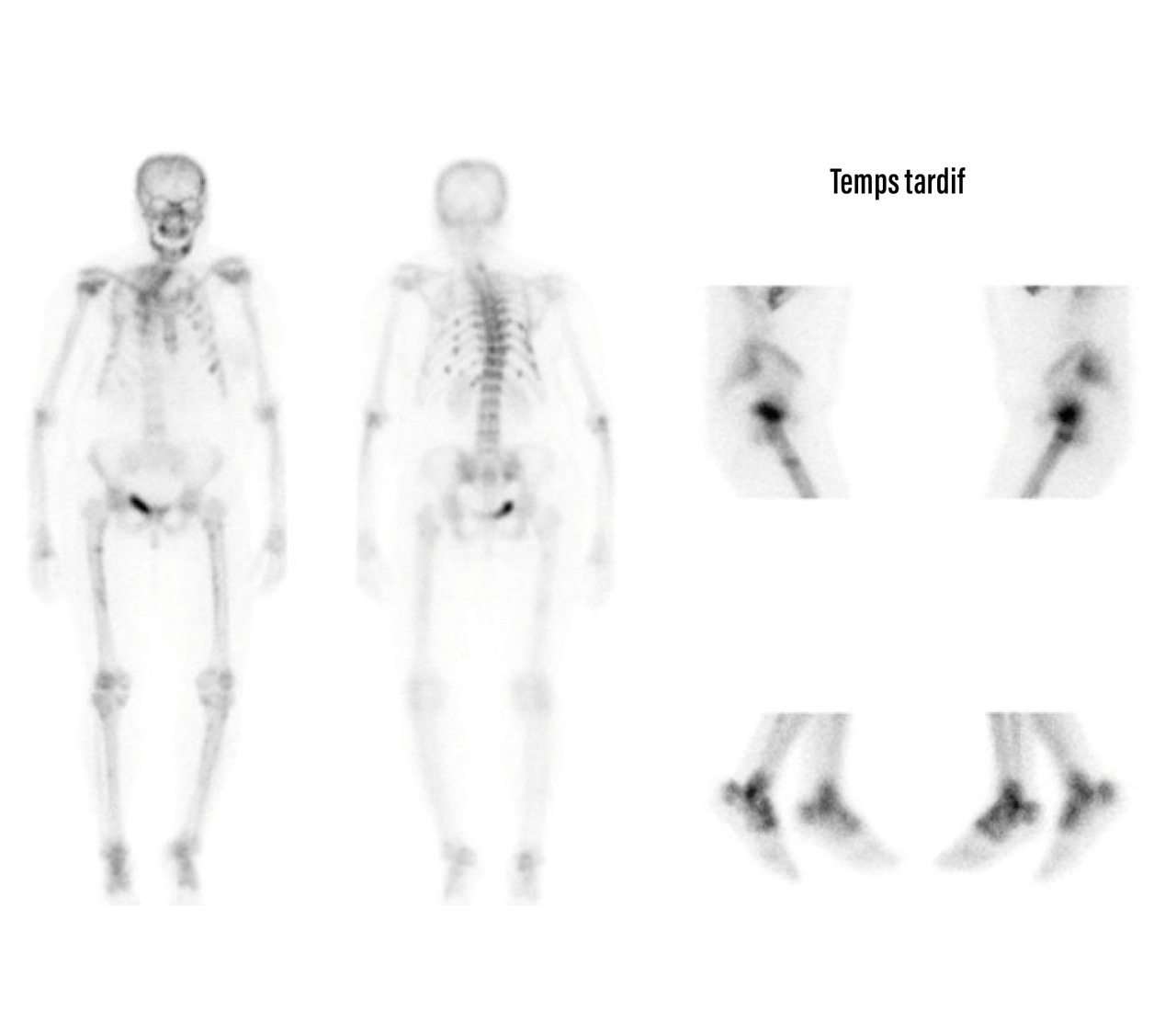
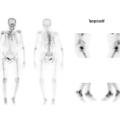
Scintigraphie osseuse au technétium marqué (Tc- 99m)
Cet examen peut mettre en évidence un ou plusieurs foyers d’hyperfixation (fig. 5).
Étiologie (rang C)
Il existe différentes causes : carence calcique et/ou vitaminique D (carence d’apport, diminution de l’absorption digestive), troubles du métabolisme de la vitamine D (avec résistance à son action ou non) ; carence en phosphore (défaut d’apport, perte rénale).
• L’ostéoporose est une maladie osseuse silencieuse qui ne provoque pas de douleurs, sauf en cas de fracture, contrairement à l’ostéomalacie.
• L’évaluation du risque fracturaire est individuelle, reposant sur le dépistage des facteurs de risque d’ostéopathie, sur la densitométrie osseuse, ainsi que sur la recherche de facteurs de risque de chute.
• Une fracture d’aspect ostéoporotique est identifiée par la survenue d'une fracture à faible cinétique, comme une chute de sa propre hauteur, ou sans aucun traumatisme apparent, chez une personne de plus de 50 ans.
• Les explorations complémentaires servent à confirmer la nature bénigne ostéoporotique d’une fracture : analyses biologiques standard et imagerie appropriée, afin d’exclure toute cause secondaire.
• La prise en charge d’une ostéoporose doit être globale (règles hygiénodiététiques, traitement spécifique et prévention du risque de chute).
Facteurs de risque d’ostéopathie fragilisante
- Antécédent personnel de fracture
- Âge
- Origine caucasienne
- Antécédents familiaux au premier degré d’ostéoporose et/ou de fracture, notamment de l’extrémité supérieure du fémur
- Ménopause précoce (avant l’âge de 40 ans)
- Aménorrhée primaire ou secondaire
- Indice de masse corporelle (IMC) inférieur à 19 kg/m²
- Consommation de tabac, d’alcool
- Corticothérapie au long cours (plus de 7,5 mg/j pendant plus de trois mois)
- Autres causes médicamenteuses : inhibiteur de l’aromatase, analogue LH-RH
- Comorbidités associées : rhumatisme inflammatoire (dont polyarthrite rhumatoïde) ; endocrinopathie (hyperthyroïdie, hyperparathyroïdie primitive ; diabète de types 1 et 2) ; digestives (maladie cœliaque) ; maladies inflammatoires chroniques (Crohn, rectocolite hémorragique) ; pathologies neurologiques (maladie de Parkinson)
- Carence d’apport vitaminocalcique
- Immobilisation prolongée
Rappelons l’importance de l’évaluation des facteurs de risque de chute : troubles de l’acuité visuelle, troubles neuromusculaires, polymédication.

 Encadrés
Encadrés