Connaître les principes du traitement de la giardiose, de l’oxyurose, du tæniasis, de l’anguillulose.
Similitudes et différences
L’intitulé « Parasitoses digestives » recouvre, dans son acception EDN (item n° 172), des parasites dont la fréquence, la répartition géographique, la physiopathologie, la pathogénicité et le traitement sont très divers. Le principal point commun à la majorité d’entre eux, sauf l’anguillulose, est que ces parasites sont contractés par voie digestive et qu’ils sont donc logiquement responsables de troubles digestifs, mais pas seulement digestifs. Les regrouper en un seul chapitre impose donc une approche comparative et surtout une démarche de diagnostic différentiel dans le cadre de troubles digestifs dont les causes peuvent être aussi bactériennes, virales ou non infectieuses. Pour deux parasitoses, la cryptosporidiose et l’anguillulose, la clinique peut être plus sévère pour des patients dont l’immunité est réduite, jusqu’à une issue rapidement fatale, justifiant une attention particulière.
L’oxyurose, l’ascaridiose et l’anguillulose sont causées par des vers ronds (helminthes, nématodes), le tæniasis par des vers plats (plathelminthes, cestodes). La giardiose, l’amœbose et la cryptosporidiose sont causées par des protozoaires, bien que ces parasites soient morphologiquement dissemblables. Il faut donc classer ces parasitoses digestives en trois groupes : les protozoaires, les vers ronds et les vers plats. Cette approche permet de mieux appréhender les signes qui peuvent être observés (clinique) ou recherchés (diagnostic) selon les circonstances, et donc de hiérarchiser l’orientation diagnostique en fonction du cas clinique proposé (tableau 1).
Les différences entre ces parasitoses digestives sont nombreuses. Tout d’abord, concernant leur mode de contamination : certaines se transmettent de façon interhumaine (oxyure), ou après une phase de maturation dans le milieu extérieur chaud et humide (ascaris), ou après passage chez un hôte non humain (tænia), alors que d’autres sont surtout liées à la pollution du milieu extérieur (anguillule) et des aliments par des excrétas humains ou animaux (amibes, giardia, cryptosporidies).
La deuxième différence est que l’histoire naturelle de ces parasitoses fait intervenir, ou non, un cycle d’évolution plus ou moins complexe au sein de l’humain infecté. L’existence de ce cycle génère des symptômes évocateurs importants pour le diagnostic et pour l’attitude thérapeutique et le suivi des patients. Comprendre un cycle parasitaire permet souvent de confirmer ou d’infirmer un diagnostic sur des arguments simples.
La troisième différence concerne les signes cliniques non spécifiques. Fièvre, diarrhée et émission de parasites par voie anale sont trois éléments simples permettant de réaliser une approche diagnostique facile à utiliser dans les cas les plus typiques, de l’ordre de ceux qui peuvent être proposés à un concours (tableaux 2 et 3).
Points essentiels
Oxyurose
Cette parasitose est fréquente chez les enfants en bas âge. Elle présente un caractère familial, une contamination essentiellement interhumaine et une absence constante de gravité. Les vers adultes sont dans la région iléocæcale, et les femelles migrent la nuit au niveau de la marge anale pour pondre leurs œufs. Cette migration est responsable d’un prurit vespéral et nocturne qui, lui-même, favorise la recontamination si l’enfant porte ses doigts à la bouche après le grattage anal. Parfois, un prurit vulvaire peut être associé. Le prurit provoque des troubles du sommeil et donc une irritabilité diurne chez les enfants fatigués.
Ce tableau clinique suffit au diagnostic. Mais en cas de doute, un prélèvement peut être réalisé sur la marge anale, à l’aide d’un bout de papier collant (Scotch-test ou test de Graham), le matin, avant la toilette. Les vers adultes sont visibles à l’œil nu, soit au niveau de l’anus, soit dans les selles, soit dans les sous-vêtements. Les œufs peuvent être dispersés dans la literie et retrouvés dans la poussière de maison, favorisant la recontamination et la dissémination au sein de la famille.
Le traitement repose sur le flubendazole ou l’albendazole, sous la forme d’une dose unique, à répéter trois semaines plus tard pour traiter les parasites en cours de cycle (tableau 4). Toute la famille (parents et fratrie) doit être traitée selon le même schéma, et en même temps. Le traitement est bien supporté et ne comporte pas d’effets indésirables notables.
Couper les ongles court (pour éviter de transporter les œufs après grattage), laver vêtements et linge de lit et aspirer les poussières qui peuvent contenir des œufs sont des mesures améliorant l’efficacité du traitement.
Ascaridiose
Cette parasitose est surtout présente en zone tropicale. Elle est très rare en Europe et concerne essentiellement les voyageurs au retour d’un séjour tropical. Elle est causée par un grand ver rond (20 cm), dont les œufs sont présents dans l’eau ou l’alimentation (crudités) en cas de péril fécal et de défaut d’hygiène, qui peut être responsable de complications mécaniques.
Après ingestion des œufs, les larves sont libérées dans l’intestin, franchissent la paroi intestinale, gagnent le foie par la veine porte, puis le cœur par la veine sus-hépatique et la veine cave, et enfin le poumon. Au sein de l’alvéole pulmonaire, la larve passe dans le système aérien, remonte l’arbre bronchique jusqu’au pharynx, où elle est déglutie dans le tube digestif. Cette phase de migration tissulaire est responsable d’un tableau de bronchite asthmatiforme (syndrome de Loeffler : toux, fébricule, infiltrat pulmonaire labile) associée à une hyperéosinophilie importante (souvent > 1 000/mm3), évoluant selon une courbe en cloche (dite « courbe de Lavier ») en fonction des étapes de migration larvaire.
Les vers adultes se développent dans le tube digestif, soit de façon asymptomatique, soit en étant responsables de distension, de douleurs abdominales et de petits épisodes diarrhéiques. Surtout, les vers peuvent s’accumuler en cas d’infestation récurrente et causer des saignements digestifs, une occlusion intestinale aiguë, ou se loger dans différents canaux (appendice, cholédoque) et entraîner des complications locales dont l’issue est parfois chirurgicale (appendicite, angiocholite, pancréatite et, rarement, abcès hépatique).
Le diagnostic repose sur l’examen parasitologique des selles répété à trois reprises, afin de mettre en évidence les œufs. Cet examen est réalisé à nouveau au décours du traitement pour confirmer son efficacité.
L’hyperéosinophilie décroît lorsque les parasites sont adultes dans la lumière du tube digestif. La sérologie est sans intérêt. Le traitement repose aussi sur le flubendazole (trois jours) ou l’albendazole (cure unique) [tableau 4]. La prévention se fonde sur l’hygiène individuelle et la prévention du péril fécal.
Anguillulose
L’anguillulose est une parasitose causée par un ver rond, Strongyloides stercoralis, qui infecte probablement 100 millions de personnes dans le monde, essentiellement en situation de mauvais état sanitaire.
Les vers adultes mesurent 0,2 cm et les larves environ 200 µm. Cette petite taille facilite la pénétration transcutanée des larves qui se sont développées dans le milieu extérieur. Après avoir traversé la peau par un mécanisme actif, les larves sont transportées dans les capillaires pulmonaires, passent dans les alvéoles, le larynx et descendent dans l’intestin où elles deviennent adultes. Les femelles pénètrent dans la lamina propria duodénale et jéjunale, et émettent une cinquantaine d’œufs chaque jour. Ces œufs libèrent des larves, qui sont en majorité éliminées dans les selles mais qui peuvent aussi pénétrer d’autres tissus et entretenir de nouveaux cycles, expliquant la persistance possible de cette maladie pendant une décennie. Les larves éliminées dans les selles évoluent pendant une semaine sur le sol chaud et humide où elles deviennent infectantes. Ce cycle complexe explique le risque de multiplication endogène en cas de baisse de l’immunité, évoluant vers l’anguillulose maligne, qui dissémine, avec les larves, les bactéries entériques dans tous les organes, rapidement mortelle.
Sur le plan clinique, la pénétration est généralement asymptomatique, la phase de migration larvaire donne un tableau de pneumonie éosinophile, avec toux, dyspnée, sifflement et parfois hémoptysie. L’infection chronique est responsable de douleurs abdominales, de nausées et vomissements et d’altération de l’état général. La migration de certaines larves peut donner un tableau de larva currens cutanée.
En cas d’immunodépression chez une personne porteuse d’anguillules, une hyperinfestation peut s’installer très vite et évoluer vers le décès, sans solution thérapeutique. Ce risque majeur justifie la recherche systématique d’une anguillulose asymptomatique chez toute personne ayant voyagé en zone tropicale sans limitation de date, avant l’initiation d’une immunodépression thérapeutique (exemple : corticoïdes, transplantation) ou pathologique (exemple : hémopathie).
Le diagnostic biologique repose sur les tests de détection d’antigène et d’ADN dans les selles, sur la sérologie et l’hémogramme pour la réaction allergique (hyperéosinophilie) et sur l’examen parasitologique des selles après une méthode de concentration.
Le traitement de référence fait appel à l’ivermectine pendant seulement un ou deux jours pour les formes simples ou à l’albendazole pendant sept jours. Le suivi doit être extensif et prolongé pour éviter les récurrences.
Tæniasis et cysticercose
Le tæniasis est une maladie double par plusieurs aspects. Deux parasites en sont responsables (Taenia saginata et Taenia solium), deux hôtes intermédiaires sont concernés (bœuf et cochon, respectivement) et deux syndromes différents sont en cause (tæniasis et cysticercose, respectivement).
Le « ver solitaire » (Taenia saginata) est causé par l’ingestion de viande de bœuf insuffisamment cuite. Il est asymptomatique ou responsable de troubles digestifs à type de douleurs abdominales, troubles de l’appétit, sialorrhée, parfois troubles du transit (alternance diarrhée-constipation). Il se caractérise par l’émission d’anneaux par l’anus de façon active, qui peuvent être retrouvés dans les sous-vêtements et rarement dans les selles. Parfois, des manifestations allergiques peuvent être associées. Il peut persister plusieurs années chez l’homme.
Taenia solium est contracté par l’ingestion de viande porcine ou de charcuterie contaminées. Il est rare en Europe, absent en France et retrouvé uniquement en cas de contamination en pays d’endémie. Les anneaux sont éliminés de façon passive avec les selles. Le problème causé par ce parasite est l’existence de la forme kystique tissulaire chez l’homme, responsable de la cysticercose, une impasse parasitaire. Il s’agit de la présence de forme larvaire du parasite, dans l’œil, le cerveau, les muscles, ou tout autre organe. Les kystes entraînent d’abord une réaction granulomateuse, puis se calcifient, et les symptômes dépendent essentiellement de leur localisation. Au cours de la neurocysticercose, toute la symptomatologie neurologique est possible, en fonction des localisations, des rapports anatomiques et du nombre de lésions.
Le diagnostic du tæniasis repose sur l’identification des anneaux émis en dehors (sous-vêtements) ou avec les selles (examen parasitologique des selles). L’hyperéosinophilie est inconstante et modérée. La sérologie est sans intérêt pour le tæniasis, mais plus utile pour la cysticercose.
Le traitement repose sur l’utilisation du praziquantel en doses uniques (tableau 4).
La surveillance du traitement repose sur la sédation des symptômes, l’arrêt de l’émission d’anneaux ou l’élimination du ver adulte. La prévention impose la consommation de viande cuite ou congelée (de façon industrielle, les congélateurs familiaux ne permettant pas d’atteindre la température nécessaire), la surveillance vétérinaire des abattoirs et la lutte contre le péril fécal.
Giardiose
Giardia duodenalis (syn. G. lamblia, G. intestinalis)est un parasite très fréquent en pays faiblement développé et cause des infections liées à l’eau et l’alimentation. Il est souvent retrouvé chez le voyageur ou après consommation de denrées alimentaires d’importation. La contamination des cultures et des élevages de coquillages est secondaire à des pollutions. Les kystes du parasite, formes de résistance dans le milieu extérieur, sont présents dans beaucoup des eaux de surface de la planète, et l’homme se contamine à partir de ces eaux et par le péril fécal. La source de contamination de l’eau peut être humaine ou animale (bovins, chiens, castors). La contamination interhumaine par contact direct est fréquente et possible par voie sexuelle. La baignade en lac, rivière ou en eaux récréationnelles peut être une source de contamination pour les enfants. Après ingestion, les kystes donnent des formes végétatives qui sont mobiles et se multiplient dans le duodénum. La fixation sur les entérocytes des microvillosités de la paroi intestinale est responsable d’atrophie villositaire et de malabsorption en cas d’infection chronique.
Souvent asymptomatique, la giardiose peut se manifester par des troubles digestifs à type de diarrhée non sanglante, douleurs abdominales, dyspepsie et anorexie. Les selles sont souvent graisseuses, malodorantes et décolorées. Les signes peuvent persister de nombreuses semaines et faire errer le diagnostic notamment chez l'enfant.
Le diagnostic d’orientation se fait par des techniques antigéniques ou moléculaires sur les selles, avec une bonne fiabilité. L’examen parasitologique des selles fraîches émises au laboratoire, et répété trois fois, est l’examen clé de confirmation du diagnostic biologique. Les selles des malades peuvent éliminer 1010 kystes par jour et celles des porteurs sains jusqu’à 108, démontrant ainsi le risque de transmission. Le taux d’éosinophiles dans le sang est normal, et la sérologie est sans intérêt.
La maladie peut disparaître spontanément en huit jours en l’absence d’autre facteur ou persister plusieurs mois. Le traitement est fait par métronidazole ou albendazole, et un contrôle parasitologique des selles est nécessaire un mois après le traitement (tableau 4). Les échecs thérapeutiques sont de plus en plus fréquents sans que leur cause soit clairement identifiée.
Amœbose
L’amœbose peut donner des formes graves, parfois létales, avec une fréquence élevée. De très nombreuses personnes sont porteuses asymptomatiques de ce parasite dans le monde, mais il peut être aussi responsable soit de dysenterie, soit d’abcès amibien, dont les complications sont parfois létales (100 000 morts par an). Il est maintenant admis que seul Entamoeba histolytica est pathogène pour l’homme. Toutes les autres amibes digestives sont considérées comme non pathogènes.
Il s’agit d’une maladie liée au péril fécal essentiellement présente dans les pays à faible niveau d’hygiène et qui peut être diagnostiquée au retour d’un voyage tropical ou chez des migrants d’un pays endémique. Les kystes d’amibes sont très résistants dans le milieu extérieur. Après ingestion, ils se transforment en trophozoïtes, dont les propriétés d’adhésion et la sécrétion d’enzymes protéolytiques permettent la destruction des cellules de la paroi intestinale, la formation d’abcès de la sous-muqueuse et la diffusion par voie sanguine vers d’autres organes.
L’amœbose, lorsqu’elle est symptomatique, se manifeste soit sous forme d’amibiase intestinale aiguë, soit sous forme extra-intestinale d’abcès amibiens (du foie le plus souvent, ou du poumon et du cerveau). L’immunodépression est associée à des formes plus sévères.
L’amibiase intestinale aiguë a un début brutal sous forme d’un syndrome dysentérique avec diarrhée glairo-sanglante afécale (3 à 10 selles/j), douleurs (épreintes et ténesmes) et absence de fièvre dans 70 % des cas. L’aggravation est progressive, avec atteinte de l’état général et évolution défavorable en l’absence de traitement. Les lésions de la muqueuse intestinale laissent des cicatrices responsables d’une colite chronique postamibienne après guérison de l’épisode aigu, qui se caractérise par une alternance diarrhée-constipation. Le diagnostic repose sur la clinique, sur les tests antigéniques dans les selles et le sang, la PCR et sur l’examen parasitologique des selles répété trois fois. La sérologie est souvent négative, le taux d’éosinophiles est normal, une hyperleucocytose est parfois retrouvée. Le diagnostic différentiel recherche des causes bactériennes de dysenterie et doit donc associer une coproculture et une série d’hémocultures.
L’abcès amibien se localise généralement au foie, mais le poumon et le cerveau peuvent être atteints. Cette localisation est secondaire à la dysenterie amibienne, mais l’épisode digestif peut avoir été asymptomatique ou être passé inaperçu.
Le début est progressif, avec douleur de l’hypochondre droit, fièvre élevée, hépatomégalie lisse et douloureuse, et altération rapide de l’état général, jusqu’à une issue fatale en l’absence de traitement.
Le diagnostic repose sur l'échographie hépatique qui visualise l’abcès amibien du foie, sa localisation (souvent lobe droit) et ses rapports anatomiques. La radiographie pulmonaire montre une atteinte tissulaire ou une élévation de la coupole diaphragmatique droite en réponse à l’atteinte hépatique. La sérologie de l’amœbose est positive à ce stade. Elle est associée à une hyperleucocytose sanguine. En revanche, l’examen parasitologique des selles est négatif en l’absence de syndrome dysentérique.
Le traitement de l’amœbose (tableau 4) fait intervenir deux principes actifs différents. Le premier est un amœbicide tissulaire, qui tue les trophozoïtes dans les tissus intestinaux et hépatiques. Les malades présentant une amœbose intestinale ou extra-intestinale doivent recevoir un traitement actif contre les parasites virulents (métronidazole pendant dix jours), puis un agent intraluminal. Les porteurs asymptomatiques doivent être traités par un agent intraluminal (paromomycine) pour prévenir les risques de diffusion. Donc, les deux traitements sont successifs : une cure d’amœbicide tissulaire (métronidazole) puis une cure d’amœbicide de contact (paromomycine, pendant 7 jours). Le classique métronidazole peut être avantageusement remplacé par le tinidazole, plus efficace et mieux toléré. La surveillance est clinique (amélioration des symptômes et défervescence thermique) et paraclinique (négativation de l’examen parasitologique des selles, décroissance du volume de l’abcès en échographie, normalisation de la formule sanguine et décroissance du taux de la sérologie en cas d’atteinte tissulaire).
Cryptosporidiose
Il existe plusieurs espèces de Cryptosporidium (protozoaire) dont Cryptosporidium hominis, infectant uniquement l’homme, et Cryptosporidium parvum, parasite de l’homme et de plusieurs espèces de mammifères (bovins, ovins). Le premier est donc plutôt urbain, le second plutôt rural.
La cryptosporidiose est une parasitose cosmopolite observée sous forme sporadique ou épidémique (cas liés à une transmission par un réservoir d’eau de consommation, les piscines, les contacts interhumains, crèches, animaux infectés...). Le parasite est présent au minimum dans 1 % des selles de personnes immunocompétentes et jusqu’à 10 % dans les pays à faible niveau d’hygiène.
La contamination s’effectue par ingestion d’oocystes dont la dose infectante est faible. Les oocystes étant directement infectants dès leur émission et très résistants dans l’environnement (y compris dans l’eau chlorée et après filtration), la contamination peut être directe ou indirecte par ingestion d’eau ou d’aliments souillés par des oocystes. Il existe rarement une contamination par inhalation, à partir de gouttelettes aériennes émises par la toux de malades.
Cryptosporidium est un parasite de l’épithélium intestinal du grêle, dont la multiplication conduit à la formation d’oocystes (œufs), forme de résistance, de dissémination et de contamination libérée avec les selles. La multiplication des parasites dans les entérocytes entraîne une perturbation des fonctions de réabsorption et de sécrétion de la bordure en brosse et une inflammation locale, causant à terme une malabsorption.
L’incubation est de trois à douze jours et la sévérité est très variable. Chez un sujet immunocompétent, la cryptosporidiose est responsable d’une diarrhée muqueuse consistant en 3 à 10 selles par jour, liquides et non sanglantes, persistantes (7 - 14 jours). Cette diarrhée s’associe à des douleurs abdominales, des nausées et une fièvre modérée. Ces symptômes sont spontanément résolutifs en une dizaine de jours sans traitement. Chez les enfants en bas âge, on peut observer des formes diarrhéiques prolongées (plus de 14 jours) avec retard de croissance et malnutrition.
Chez les patients immunodéprimés la cryptosporidiose est responsable d’une diarrhée prolongée devenant chronique et s’associant à une forte malabsorption. Elle peut être directement ou indirectement responsable de décès. Une atteinte des voies biliaires est fréquente et contribue très probablement à l’entretien de la parasitose digestive. Des formes pulmonaires sont exceptionnelles. L’atteinte des voies respiratoires est possible et se manifeste par l’association d’une toux chez un patient présentant une diarrhée prolongée.
Le diagnostic biologique de la cryptosporidiose repose sur la détection d’antigènes ou d’ADN dans les selles, ainsi que la microscopie après une coloration spéciale des selles. Des oocystes peuvent être retrouvés dans le liquide jéjunal ou la bile et très exceptionnellement dans le liquide de lavage broncho-alvéolaire chez l’immunodéprimé.
Aucun traitement n’est totalement efficace, que ce soit chez les patients immunocompétents ou immunodéprimés. Un traitement symptomatique peut être nécessaire dans les formes sévères.
Le nitazoxanide sous autorisation d’accès compassionnel montre une efficacité très incomplète et une disponibilité restreinte.
Il n’existe ni chimioprophylaxie ni vaccin. La prévention individuelle consiste à réduire le risque de contamination par des oocystes, en respectant des règles d’hygiène alimentaire et en évitant l’ingestion d’eau ou d’aliments pouvant être souillés par des matières fécales. Chez les patients fortement immunodéprimés, cette prévention conduit à recommander exclusivement la consommation d’eau embouteillée.
S’orienter face à une suspicion de parasitose digestive
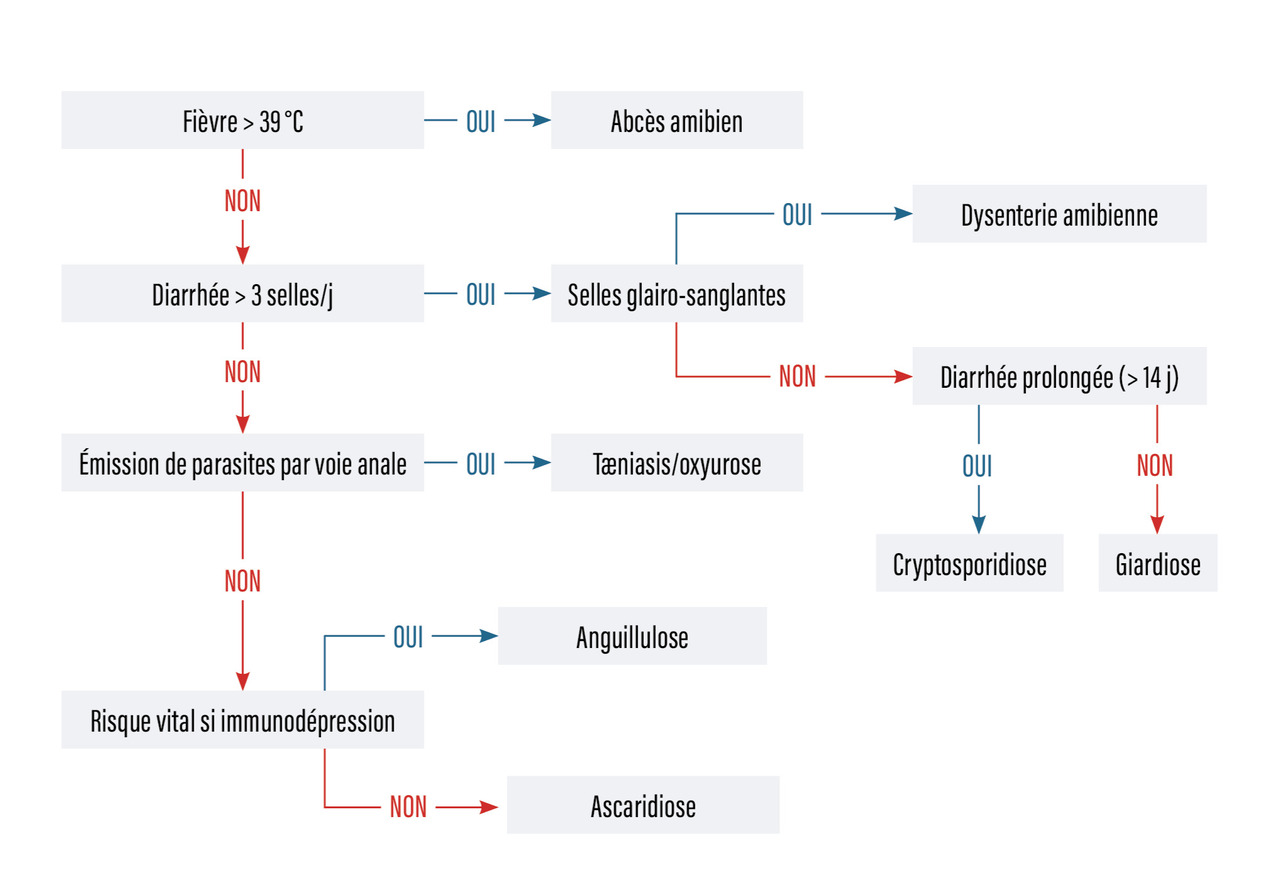
Devant une suspicion de parasitose digestive, quelques éléments simples permettent de s’orienter rapidement vers l’une ou l’autre des parasitoses du programme (figure). Une fièvre élevée et mal supportée est très en faveur d’un abcès amibien, et il faut rechercher les autres signes de cette localisation. Une diarrhée importante, si elle est afécale et glairo-sanglante, est fortement évocatrice de dysenterie amibienne. Si elle s’accompagne de selles non sanglantes, le diagnostic de giardiose est probable. Une diarrhée abondante et persistante, parfois en épidémie ou chez l’enfant ou le patient immunodéprimé, oriente fortement vers une cryptosporidiose. Enfin, avant d’induire une immunodépression chez un patient ayant séjourné en zone tropicale, sans notion de délai, il est indispensable de rechercher une anguillulose. L’émission de parasites par l’anus se retrouve surtout au cours de l’oxyurose et du tæniasis, et pas au cours de l’ascaridiose en dehors des suites d’un traitement efficace. Cette brève démarche diagnostique, qui n’aborde que les points superficiels de ces maladies, doit être complétée par une réflexion plus complète sur le cas, en intégrant aussi l’épidémiologie, la présence d’une hyperéosinophilie et les résultats de l’examen parasitologique des selles.
Giroux JN. Hyperéosinophilie isolée. Rev Prat Med Gen 2009;23(828):658.
ANOFEL. Parasitoses et mycoses des zones tempérées et tropicales. Masson (2e éd).
Université numérique francophone des sciences de la santé et du sport. umvf.univ-nantes.fr/parasitologie/