S’agit-il d’une embolie pulmonaire aiguë ?
Dans un contexte de dyspnée aiguë, l’analyse sémiologique est indispensable et repose principalement sur l’interrogatoire. Il est important de préciser le terrain du patient, les circonstances mais également le rythme, la position et l’horaire de survenue de cette dyspnée.
On recherche également les signes fonctionnels et cliniques associés.
Dans le cas de notre patient, la dyspnée est isolée et de survenue brutale. L’absence de douleur thoracique associée est peu en faveur d’un pneumothorax. Une exacerbation d’asthme doit également être évoquée devant une dyspnée aiguë, mais l’absence d’épisodes similaires dans le passé, l’absence de sibilants ainsi que la chronologie (2 semaines d’évolution) permettent d’éliminer ce diagnostic. Le diag- nostic d’œdème pulmonaire est lui aussi improbable (absence de facteurs de risque cardiovasculaire, d’orthopnée, de toux et d’expectorations mousseuses). Enfin, l’absence de fièvre et de toux nous font écarter le diagnostic de pneumopathie infectieuse.
Dans le cas de l’embolie pulmonaire, la dyspnée peut être accompagnée ou non d’une douleur thoracique. L’auscultation pulmonaire est le plus souvent normale. La tachycardie et les signes d’insuffisance cardiaque droite sont possibles en cas d’embolie pulmonaire.
En cas de suspicion d’embolie pulmonaire aiguë, la première étape consiste à rechercher un état de choc défini par une pression artérielle systolique (PAS) < 90 mmHg ou une chute de la PAS ≥ 40 mmHg pendant plus de 15 minutes, en dehors d’un contexte de nouvelle arythmie, d’hypovolémie ou de sepsis.1 Si oui, l’embolie pulmonaire est à haut risque de mortalité (5 % des patients suspects d’embolie pulmonaire), et les stratégies diagnostique et thérapeutique diffèrent dans ce contexte.
En l’absence d’hypotension artérielle, la probabilité clinique d’embolie pulmonaire doit être évaluée à l’aide d’un score prédictif validé tel que le score de Wells ou le score de Genève (tableaux 1 et 2). Cette probabilité clinique détermine la stratégie diagnostique.1
En cas de probabilité clinique faible ou intermédiaire d’embolie pulmonaire, la valeur prédictive négative élevée des D-dimères justifie qu’ils soient systématiquement dosés afin de réduire la nécessité de réaliser un examen d’imagerie. Un taux de D-dimères strictement inférieur à 500 µg/L ou inférieur à un seuil adapté à l’âge chez les patients de plus de 50 ans (âge x 10) permet d’exclure le diagnostic d’embolie pulmonaire dans un contexte de probabilité clinique non forte. En cas de D-dimères positifs, la réalisation d’un examen morphologique de confirmation (angiotomodensitométrie [angio-TDM] thoracique ou scintigraphie de ventilation/perfusion) est nécessaire pour porter le diag- nostic d’embolie pulmonaire (fig. 1).
En cas de forte probabilité clinique, la réalisation des D-dimères est inutile. Les examens morphologiques (tomodensitométrie [TDM] ou scintigraphie) sont réalisés d’emblée afin de confirmer ou d’exclure le diagnostic d’embolie pulmonaire (fig. 1). L’échographie veineuse des membres inférieurs est utile lorsque la scintigraphie et la TDM thoracique ne peuvent pas être réalisées. La mise en évidence d’une thrombose veineuse profonde associée à une forte probabilité clinique d’embolie pulmonaire permet de porter le diagnostic. En revanche, l’absence de thrombose veineuse profonde ne permet pas d’exclure le diagnostic d’embolie pulmonaire.
Dans le cas de monsieur M., l’embolie pulmonaire étant probable (en raison de l’antécédent de thrombose veineuse profonde et de la tachycardie à 115 batt/min), l’angio-TDM thoracique est réalisée d’emblée et confirme le diagnostic d’embolie pulmonaire proximale bilatérale (fig. 2) avec dilatation des cavités cardiaques droites et reflux dans la veine cave inférieure.
Quelle prise en charge pour une embolie pulmonaire aiguë ?
Après un diagnostic positif d’embolie pulmonaire chez un patient stable (non à haut risque), il est nécessaire d’évaluer le risque de mortalité précoce par l’intermédiaire d’un score clinique prédictif de risque, de préférence le pulmonary embolism severity index (score PESI) ou sa version simplifiée, le score sPESI (tableau 3), définissant ainsi les niveaux de bas risque et de risque intermédiaire.1
Chez les patients à risque intermédiaire, l’évaluation des lésions myocardiques (via le dosage d’un biomarqueur tel que la troponine, le peptide natriurétique de type B [BNP] et sa fraction terminale [NT-proBNP]) et de la fonction ventriculaire droite (par échocar- diographie) permet de différencier les patients à risque intermédiaire élevé et ceux à risque intermédiaire faible (fig. 3). Cette stratification du risque de mortalité précoce permet de décider d’une orientation adaptée du patient en hospitalisation conventionnelle ou en unité de soins intensifs, ainsi que de la nécessité de reperfusion primaire.
Chez notre patient, on calcule un score sPESI à 3 et un score PESI en classe V, définissant un niveau de risque intermédiaire de mortalité précoce (risque de mortalité entre 3 et 25 %). Un dosage de troponine à 0,13 µg/L, de BNP à 700 pg/mL et une dysfonction ventriculaire droite avec un tricuspid annular plane systolic excursion (TAPSE) à 12 mm, objectivée par une échocardiographie transthoracique, classent le patient avec un risque intermédiaire élevé. Il est alors hospitalisé en unité de soins intensifs de pneumologie où l’anticoagulation efficace par héparine de bas poids molé- culaire (HBPM) est poursuivie et un traitement par warfarine ainsi qu’une oxygénothérapie jusqu’à 8 L d’O2 par minute sont débutés. L’indication d’une reperfusion primaire par thrombolyse est discutée mais non réalisée du fait d’une évolution favorable sous anticoagulation seule.
En cas d’embolie pulmonaire sans état de choc ni hypotension artérielle, le traitement principal relève de l’anticoagulation efficace. Celle-ci doit être débutée sans délai, avant même le diagnostic formel, en cas de haut risque ou de risque intermédiaire. Le traitement conventionnel consiste à administrer une anticoagulation parentérale par HBPM, fondaparinux, ou héparine non fractionnée en cas d’insuffisance rénale sévère avec un relais par anticoagulants oraux. Le choix des anticoagulants oraux peut se porter sur les antagonistes de la vitamine K (AVK), débutés dès le premier jour (warfarine). Le traitement anticoagulant parentéral doit être poursuivi au moins 5 jours, jusqu’à obtention d’un international normalized ratio (INR) entre 2 et 3. Le choix peut également se porter, en l’absence d’insuffisance rénale sévère, sur les anticoagulants oraux directs (AOD) tels que le rivaroxaban ou l’apixaban qui peuvent être débutés d’emblée sans traitement anticoagulant parentéral préalable.1 Le dabigatran peut également être utilisé dans l’embolie pulmonaire mais nécessite 5 jours de traitement anticoagulant parentéral préalable.1
Une reperfusion par thrombolyse est indiquée d’emblée pour les embolies pulmonaires à haut risque.1 En cas de risque intermédiaire élevé, une surveillance accrue est recommandée et la stratégie de reperfusion est discutée en cas de dégradation hémodynamique ultérieure. Les indications d’embolectomie chirurgicale ou de traitement endovasculaire sont réservées aux contre-indications ou aux échecs de thrombolyse.
La durée du traitement anticoagulant dépend de la cause et des facteurs de risque thrombotique du patient. En cas d’embolie pulmonaire idiopathique, une durée d’anticoagulation supérieure à 3 mois est préconisée (grade I), elle peut se poursuivre au long cours si le risque hémorragique est faible. En cas d’événement thrombotique idiopathique, le traitement anticoagulant doit être poursuivi à vie.
Le patient reste oxygénodépendant 5 jours après le début de l’anticoagulation efficace. Le diag- nostic d’infarctus pulmonaire de la base gauche est posé, et une antibiothérapie probabiliste par amoxicilline-acide clavulanique est débutée permettant une évolution favorable et un retour à domicile. Il est indiqué de poursuivre le traitement par AVK au long cours, puisqu’il s’agissait du deuxième épisode thrombotique idiopathique. Une semaine plus tard, monsieur M. se présente dans un service d’urgences en raison de l’apparition d’une douleur de la hanche droite ne cédant pas aux antalgiques de palier 1, sans notion de traumatisme. Il est normotendu, avec une PAS de 105 mmHg, tachycarde à 108 batt/min, eupnéique au repos avec une saturation à 97 % en air ambiant. Le reste de l’examen est sans particularité. Une angio-TDM abdomino- pelvienne est réalisée et montre un hématome du muscle ilio-psoas droit.
Saignement sous AVK
En cas d’hémorragie grave survenant sous AVK, l’objectif est d’obtenir un INR inférieur à 1,5 dans les plus brefs délais. Il est impératif de suspendre le traitement anticoagulant, de mesurer l’INR et d’administrer en urgence un concentré de complexes prothrombiniques (CCP) et 10 mg de vitamine K par voie orale ou intraveineuse lente quel que soit l’INR de départ (fig. 4).2
Un contrôle de l’INR doit être effectué à 30 minutes de l’administration du CCP. Si celui-ci est supérieur à 1,5, une nouvelle dose de CCP est administrée, avec un nouveau contrôle de l’INR 6 à 8 heures plus tard.
Dans le cas où un traitement anticoagulant doit être poursuivi, un relais par héparine est préconisé de manière transitoire, et les AVK doivent être repris au cas par cas dans un délai fonction du risque hémorragique et de l’indication initiale du traitement anticoagulant.
Dans le cas de monsieur M., l’INR de départ est dosé à 5,15 et l’hémoglobine à 8,5 g/dL. Il est administré 10 mg de vitamine K et 2 doses de CCP avant d’obtenir un INR inférieur à 1,5. Le patient est également transfusé de 2 culots globulaires. Les AVK sont suspendus et un filtre-cave est posé pour prévenir la récidive d’une embolie pulmonaire. Il est décidé de reprendre une anticoagulation curative par HBPM 7 jours après l’épisode hémorragique. Le traitement anticoagulant curatif par HBPM est poursuivi pendant 1 semaine sans complication, puis le traitement par AVK est réintroduit. Le patient rentre à domicile, avec une infirmière pour une aide à la prise des traitements et une surveillance biologique rapprochée de l’hémogramme et des INR.
Trois ans plus tard
Trois ans plus tard, monsieur M. se plaint d’une dyspnée chronique d’apparition progressive l’amenant à consulter son médecin traitant. Il décrit une dyspnée pour des efforts minimes, classée NYHA III, accompagnée d’une toux chronique sèche. L’examen clinique montre une saturation en oxygène en air ambiant à 92 %, une auscultation pulmonaire normale, des bruits du cœur réguliers sans souffle à 88 batt/min accompagnés d’un éclat du deuxième bruit et d’œdèmes des membres inférieurs bilatéraux symétriques remontant jusqu’aux genoux. Un ECG est réalisé, révélant un bloc de branche droit. La radiographie thoracique ne révèle pas d’anomalie notable et les gaz du sang trouvent une hypoxémie à 67 mmHg et une PaCO2 à 2 mmHg.
Il est alors adressé à un cardiologue de ville pour la réalisation d’une échographie transthoracique (ETT). Cette dernière mon- tre des cavités droites dilatées, avec une dysfonction ventri- culaire droite et une pression artérielle pulmonaire systolique estimée à 110 mmHg, le cœur gauche est sans anomalie (fraction d’éjection ventriculaire gauche [FEVG] estimée à 60 %).
S’agit-il d’une hypertension pulmonaire thromboembolique chronique ?
L’hypertension pulmonaire est définie par une élévation de la pression artérielle pulmonaire moyenne supérieure ou égale à 25 mmHg au repos mesurée par un cathétérisme cardiaque droit.3, 4
Les signes fonctionnels et cliniques d’hypertension pulmonaire sont non spécifiques. Le plus souvent, il existe une dyspnée d’effort chronique, pouvant s’accompagner d’une toux sèche, de douleurs thoraciques, voire de syncope. Ces signes fonctionnels peuvent s’accompagner d’insuffisance cardiaque droite, tels que les œdèmes des membres inférieurs, la turgescence jugulaire et le reflux hépato-jugulaire. L’auscultation pulmonaire est normale (en dehors des hypertensions pulmonaires secondaires à une pathologie pulmonaire chronique). L’auscultation cardiaque révèle le plus souvent un souffle d’insuf- fisance tricuspidienne et un éclat du deuxième bruit cardiaque.
L’échographie cardiaque est l’examen réalisé en première intention en cas de suspicion d’hypertension pulmonaire et possède un rôle central dans le dépistage de cette pathologie. Elle permet une estimation de la pression artérielle pulmonaire systolique (PAPs) via la mesure de la vitesse de régurgitation tricuspidienne. Une PAPs supérieure ou égale à 35 mmHg est en faveur d’une hypertension pulmonaire. D’autres signes échographiques indirects permettent de suspecter une hyper- tension pulmonaire : une dilatation des cavités cardiaques droites, un septum interventriculaire paradoxal, une augmentation du diamètre de l’artère pulmonaire…
Les hypertensions pulmonaires liées aux pathologies cardiaques gauches ou aux pathologies pulmonaires étant les plus fréquentes et ne nécessitant pas de traitement spécifique, il n’est nécessaire de réaliser un cathétérisme cardiaque droit que s’il existe un doute sur la cause (grade IIb) ou si une transplantation d’organe est envisagée (grade I).
Ainsi, en cas de suspicion échographique d’hypertension pulmonaire, la première étape consiste à réaliser un ECG, une radiographie thoracique des épreuves fonctionnelles respiratoires (EFR) et une TDM thoracique afin de rechercher une cause évidente de l’hypertension pulmonaire (pathologie cardiaque gauche ou pulmonaire chronique). En l’absence de cause cardiaque ou pulmonaire, le cathétérisme cardiaque droit est indiqué pour confirmer le diagnostic d’hypertension pulmonaire. La scintigraphie pulmonaire de ventilation et de perfusion est l’examen de choix pour rechercher des défects perfusionnels témoignant de séquelles thrombo- emboliques.
Le diagnostic d’hypertension pulmonaire thromboembolique chronique est retenu en cas d’hypertension pulmonaire précapillaire au cathétérisme cardiaque droit (pression artérielle pulmonaire moyenne [PAPm] supérieure ou égale à 25 mmHg avec une pression artérielle pulmonaire d’occlusion [PAPo] inférieure ou égale à 15 mmHg), et de défects perfusionnels sans anomalie ventilatoire à la scintigraphie pulmonaire.3, 4
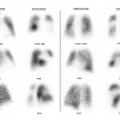
Monsieur M. est adressé par son cardiologue dans un centre de compétence en hypertension pulmonaire. Le cathétérisme cardiaque droit confirme le diag- nostic d’hypertension pulmonaire précapillaire avec une PAPm à 73 mmHg et une PAPo à 12 mmHg. La scintigraphie pulmonaire objective de multiples défects perfusionnels segmentaires et sous-segmentaires bilatéraux sans anomalie ventilatoire en regard (fig. 5).
Quelle prise en charge pour une hypertension pulmonaire thromboembolique chronique ?
La prise en charge de l’hyper- tension pulmonaire thrombo- embolique chronique dépend de la localisation des séquelles thromboemboliques, proximale ou distale. Deux examens sont utiles à ce stade, l’angio-TDM thoracique (fig. 6) et l’angiographie pulmonaire (fig. 7).
En cas de forme proximale accessible à une chirurgie, le traitement par endartériectomie pulmonaire est recommandé en 1re intention en l’absence de contre-indication (fig. 8).3, 4 En cas de forme distale ou de patient non opérable, il existe deux options thérapeutiques :
– l’administration d’un ou plusieurs traitements médicamenteux vasodilatateurs spécifiques (en 1re intention, un stimulateur direct de la guanylate cyclase soluble, le riociguat) ;
– la réalisation de séances d’angioplastie pulmonaire (dilatation des artères pulmonaires à l’aide de ballonnets sans mise en place de stents).
Quelle que soit la stratégie théra- peutique adoptée, il est nécessaire de poursuivre un traitement anticoagulant à vie. Un régime sans sel strict est préconisé et un traitement diurétique peut être prescrit en cas d’hypervolémie.
Une réévaluation clinique et hémodynamique par cathétérisme cardiaque droit doit être réalisée au cours de la première année (géné- ralement à 6 mois) afin d’évaluer l’efficacité du traitement. En cas de réponse thérapeutique insuffisante, le renforcement du traitement spécifique médicamenteux ou la réalisation de nouvelles séances d’angioplastie pulmonaire sont discutés. En cas de réponse thérapeutique optimale, une surveillance est programmée, annuelle ou biannuelle en fonction de la sévérité de la pathologie. Une normalisation hémodynamique au repos est possible, mais les récidives sont fréquentes et justifient de ce fait un suivi régulier.