Savoir évoquer un état de choc septique chez l’enfant et l’adulte.
Connaître les bases de la prise en charge d’un choc septique chez l’adulte et l’enfant (voir item 332).
Définitions
Ainsi, le sepsis se distingue de l’infection (invasion de l’organisme par un micro-organisme), de la septicémie (présence d’un agent microbien dans le sang) et de la bactériémie (présence d’une bactérie dans le sang). Si tout sepsis est par définition une infection, la grande majorité des infections ne conduit pas à un sepsis. Cette distinction est primordiale, en particulier pour l’urgence à traiter.
Le score SOFA (sepsis-related organ failure assessment) [disponible sur http://medicalcul.free.fr/sofa.html ] est utilisé pour déterminer la dysfonction d’organe. Ce score concerne six « organes », et chaque dysfonction est graduée de 0 (absence de dysfonction) à 4 (dysfonction très sévère) en fonction de critères qui lui sont propres. Ainsi, le score SOFA peut varier de 0 à 24. Toute infection associée à une augmentation du score SOFA d’au moins 2 points est un sepsis. En présence d’une infection, il est primordial de connaître les éléments du score SOFA afin de diagnostiquer un sepsis : l’atteinte neurologique est évaluée par le score de Glasgow ; l’atteinte respiratoire par le rapport pression partielle artérielle en oxygène/fraction inspirée en oxygène (PaO2/FiO2) ou l’assistance ventilatoire ; l’atteinte cardiovasculaire par la pression artérielle systolique ou le besoin de catécholamines ; l’atteinte hépatique par la bilirubinémie ; l’atteinte hématologique par le taux de plaquettes ; l’atteinte rénale par la créatininémie ou la diurèse.
Le choc septique est la forme la plus grave du sepsis. Parallèlement à la nouvelle définition du sepsis, une nouvelle définition du choc septique a également été donnée en 2016. Le choc septique correspond à l’association de trois éléments :
- une infection fortement suspectée ou prouvée ;
- une hypotension ne répondant pas au remplissage vasculaire et nécessitant la prescription de pour maintenir une pression artérielle moyenne supérieure ou égale à 65 mmHg ;
- une lactatémie supérieure à 2 mmol/L.
Physiopathologie
Le choc septique est un état de choc dit distributif. Plusieurs mécanismes sont en cause : hypovolémie efficace en lien avec une augmentation de la perméabilité capillaire, des pertes hydriques (fièvre, vomissements, diarrhées...), hypovolémie relative due à une vasoplégie secondaire à une diminution des résistances vasculaires périphériques et parfois une dysfonction cardiaque associée.
Épidémiologie et pronostic
Le sepsis peut être consécutif à une infection bactérienne, virale, parasitaire ou fongique et sa cause varie donc considérablement en fonction de la zone géographique étudiée. En France, le choc septique est très majoritairement d’origine bactérienne, avec une prédominance de bactéries à Gram négatif.
Les facteurs de risque d’infection sont essentiellement des facteurs liés à l’hôte, parmi lesquels on retrouve des facteurs génétiques, la présence d’une immunodépression, le diabète, le fait d’être porteur d’un cancer, et des facteurs « environnementaux », comme l’exposition à une épidémie, une chirurgie. Les facteurs de risque de développer un sepsis en cas d’infection sont moins bien connus : comorbidités, facteurs génétiques de l’hôte, retard thérapeutique et facteurs liés à la virulence du pathogène.
On distingue les sepsis communautaires, majoritaires, des sepsis associés aux soins ou nosocomiaux. Un cas de sepsis sur quatre serait acquis à l’hôpital et pourrait donc être théoriquement évitable. Ces sepsis liés aux soins sont importants à identifier car ils sont associés à une proportion plus importante de germes multirésistants, dont il faut tenir compte pour l’antibiothérapie initiale, et à une augmentation de la durée de séjour.
Le pronostic des patients ayant un sepsis dépend du terrain du patient (âge, comorbidités, immunodépression, etc.), de l’origine de l’infection (les sepsis urinaires ayant un meilleur pronostic), de la gravité de la présentation initiale (valeur du SOFA initial, par exemple) mais aussi de la qualité et de la rapidité de la prise en charge initiale. Le sepsis est donc une urgence médicale. Bien que dans le monde le pronostic du sepsis et du choc septique se soit amélioré au cours des vingt dernières années, leur mortalité reste très élevée, entre 20 et 60 %. Le sepsis associé aux soins a une mortalité plus importante que le sepsis communautaire, entre 24 et 50 %. Le choc septique est la première cause de mortalité en réanimation (entre 30 et 50 % en France).
En dehors du pronostic à court terme, les conséquences à moyen et long termes sont également importantes : un tiers des patients ayant survécu à un choc septique décèdent dans l’année qui suit et le risque de séquelles (limitations fonctionnelles à l’origine d’une altération de la qualité de vie, troubles cognitifs et troubles psychiatriques) est conséquent.
Manifestations cliniques et biologiques
Examen clinique
L’examen clinique commence par la prise des paramètres vitaux et la recherche de signes qui ne sont ni sensibles ni spécifiques : fièvre ou hypothermie, tachycardie, tachypnée ou diminution de la saturation artérielle en oxygène en air ambiant.
L’hypotension artérielle, un des items du score SOFA, peut être présente, mais son absence n’exclut pas le sepsis. À la phase initiale du sepsis, une pression artérielle normale ne doit donc pas rassurer le clinicien.
Des signes généraux peuvent être présents, tels qu’une altération de l’état général. Le sepsis peut se traduire par des troubles de la conscience pouvant aller jusqu’au coma. Ces troubles constituent également un des items du score SOFA.
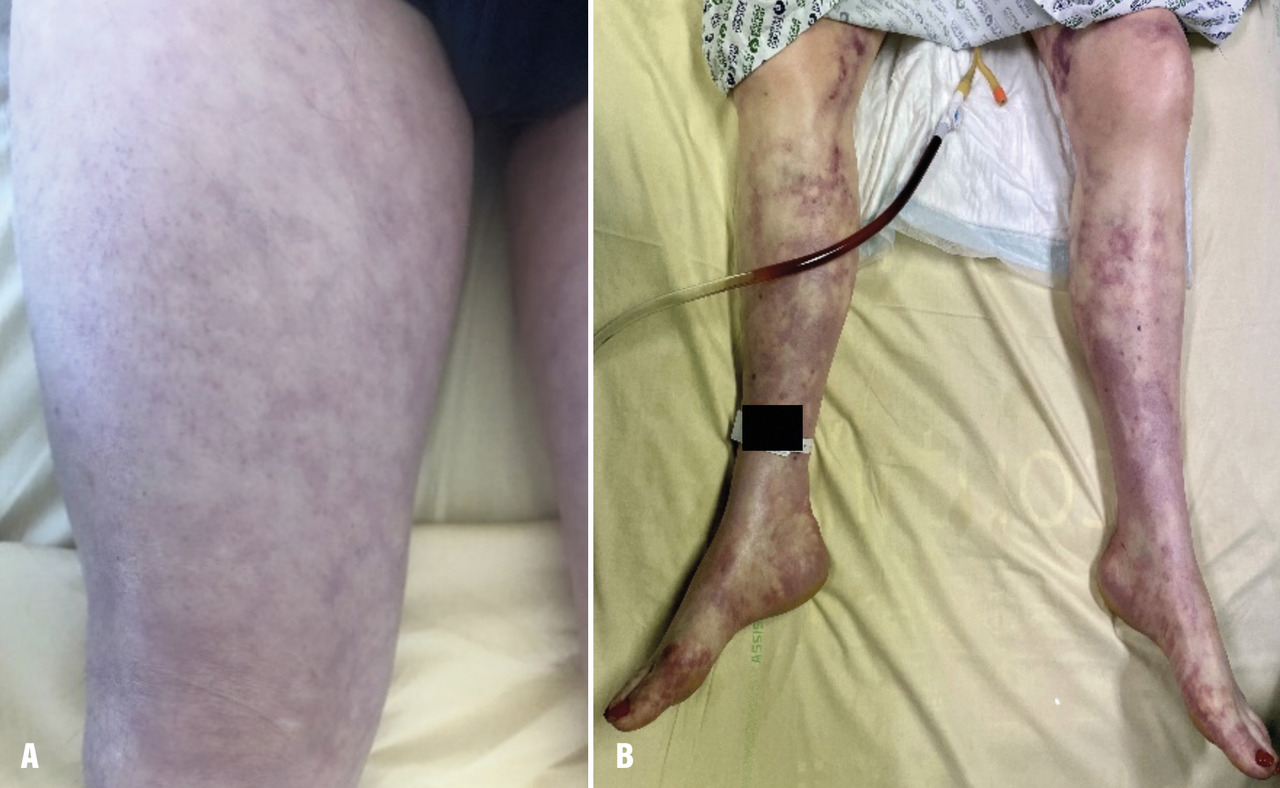
Des signes d’hypoperfusion périphérique, traduisant une vasoconstriction périphérique et une diminution locale du débit sanguin, doivent être systématiquement recherchés :
- les marbrures (fig. A), essentiellement aux membres inférieurs. Leur extension est corrélée au taux de lactate et à la sévérité du sepsis ;
- l’allongement du temps de recoloration cutanée supérieur à trois secondes ;
- des extrémités froides, cyanosées ;
- l’oligurie traduisant l’hypoperfusion rénale et faisant partie des items du score SOFA.
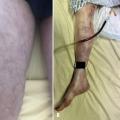
L’examen cutané peut également révéler des stigmates de CIVD, avec des manifestations soit thrombotiques traduisant la thrombose des petits vaisseaux (fig. B), soit hémorragiques avec des saignements diffus, en nappe (notamment aux points de ponction), témoignant de la consommation des éléments de la coagulation.
Examens biologiques
Examens sanguins permettant d’analyser le retentissement du sepsis
Les examens suivants sont nécessaires :- gaz du sang artériel avec mesure du lactate ; cet examen permet de préciser le retentissement respiratoire du sepsis (le rapport PaO2/FiO2 est un item du score SOFA) mais également de poser le diagnostic de choc septique (lactatémie supérieure à 2 mmol/L) et de rechercher une acidose lactique ;
- hémogramme et hémostase révélant une hyperleucocytose ou une leucopénie, une lymphopénie (élément pronostique), une thrombopénie (item du score SOFA) et les autres stigmates biologiques de CIVD (taux de prothrombine abaissé, hypofibrinogénémie) ;
- ionogramme sanguin avec urémie et créatininémie (item du score SOFA) recherchant une insuffisance rénale par hypoperfusion rénale ;
- bilan hépatique (transaminases [ASAT, ALAT], gamma GT, phosphatases alcalines et bilirubine [item du score SOFA]) ; une perturbation du bilan hépatique peut traduire une hypoperfusion hépatique secondaire à l’état de choc.
Identification du pathogène
Le prélèvement de deux paires d’hémocultures est systématique et indispensable et doit précéder toute antibiothérapie, sauf en présence d’un purpura extensif. Cet examen permet d’identifier le germe (et de déterminer sa sensibilité aux antibiotiques) dans un tiers des cas de sepsis.En fonction de la porte d’entrée évoquée, d’autres examens complémentaires doivent être prescrits (ponction lombaire, examen cytobactériologique des urines [ECBU], examen cytobactériologique des crachats [ECBC]...).
Biomarqueurs
La protéine C réactive (C-reactive protein [CRP]) n’est ni sensible ni spécifique puisqu’elle peut être élevée dans d’autres états inflammatoires. Son apport diagnostique est donc très faible dans ce contexte.La procalcitonine (PCT) est un biomarqueur plus spécifique d’infection bactérienne, mais son dosage n’est pas recommandé de façon systématique. En présence d’arguments pour un sepsis, même si la PCT est basse, une antibiothérapie doit être prescrite.
Bilan préopératoire éventuel
Lorsqu’un contrôle de la source par voie chirurgicale, endoscopique ou en radiologie interventionnelle est nécessaire, un bilan préopératoire s’impose, avec en particulier un groupage sanguin et la recherche d’agglutinines irrégulières.Autres examens complémentaires
La radiographie thoracique est systématique et permet de préciser le retentissement pulmonaire (œdème lésionnel) du sepsis. En fonction de la porte d’entrée évoquée, d’autres examens d’imagerie peuvent être nécessaires.L’électrocardiogramme (ECG) doit également être réalisé. Il permet d’objectiver d’éventuels signes en faveur d’une souffrance myocardique secondaire à l’état de choc.
Causes
L’origine dépend également du caractère communautaire ou associé aux soins du sepsis. Le sepsis à point de départ d’un cathéter est plus fréquent chez un patient hospitalisé, à l’inverse de la méningite. En contexte postopératoire, il est indispensable d’examiner le site opératoire. Tout matériel étranger implanté doit être suspecté en l’absence d’autre cause évidente.
Le
Prise en charge
Deux axes thérapeutiques sont initiés dans le même temps : le contrôle de l’infection par les anti-infectieux et le contrôle de la source si besoin, d’une part, et la prise en charge des défaillances d’organes – et notamment de la défaillance hémodynamique –, d’autre part.
Devant tout sepsis, un avis spécialisé du réanimateur est requis, afin de discuter une admission en soins critiques.
Prise en charge anti-infectieuse
Plusieurs critères orientent le choix de l’antibiothérapie :
- le site et les germes suspectés (tableau 2) ;
- le caractère communautaire ou associé aux soins de l’infection ;
- l’écologie bactérienne du patient (risque de bactérie multirésistante si voyage, hospitalisation ou antibiothérapie récente, vie en institution, colonisation connue) ;
- une allergie médicamenteuse ;
- la fonction rénale.
Contrôle de la source
- pulmonaire : drainage d’une pleurésie purulente ;
- intra-abdominale : drainage d’un abcès hépatique, drainage d’une angiocholite, chirurgie d’une péritonite ;
- urinaire : drainage d’urines infectées en amont d’une obstruction urétérale ;
- cutané : excision des tissus nécrotiques ;
- matériel : ablation d’un dispositif intravasculaire infecté (cathéter central, port-à-cath, Midline, PiCCline).
Mise en condition et stabilisation hémodynamique
- mise en place d’un scope multiparamétrique (ECG, saturation pulsée en oxygène [SpO2], pression artérielle, fréquence respiratoire) ;
- oxygénothérapie pour obtenir une SpO2 supérieure à 95 % ;
- pose de deux voies veineuses périphériques de bon calibre ;
- pose d’une sonde urinaire ou d’un dispositif de recueil urinaire (pour repérer précocement une oligurie).
Si le patient reste malgré tout hypotendu et répond transitoirement au remplissage (précharge-dépendant), ce dernier doit être poursuivi et réévalué régulièrement à l’aide de plusieurs paramètres hémodynamiques reflétant l’état de perfusion des organes (temps de recoloration cutanée, marbrures, lactatémie, monitorage hémodynamique non invasif ou invasif…).
Un support vasopresseur par la noradrénaline par voie intraveineuse à la seringue électrique (IVSE) est débuté en cas d’échec du remplissage vasculaire pour corriger l’hypotension artérielle. Le « timing » de ce support se fait au plus tard au terme des 30 mL/kg. Cependant, en cas de sepsis avec d’emblée une pression artérielle diastolique basse (PAD inférieure à 40 mmHg), la noradrénaline peut être prescrite dès la phase de remplissage initiale.
Les objectifs thérapeutiques de cette prise en charge initiale sont en premier lieu une pression artérielle moyenne de 65 mmHg. Le contrôle peut se faire par un brassard automatique, mais très rapidement un cathéter artériel permettant la mesure invasive et continue de la pression artérielle sanglante peut être mis en place.
Les autres objectifs sont une amélioration du temps de recoloration cutanée, une disparition des marbrures, une diurèse horaire d’au moins 0,5 mL/kg/h, une baisse de la lactatémie de 10 % à la 4e heure (H4).
Parallèlement, une prise en charge spécialisée des éventuelles défaillances d’organes doit être mise en place chaque fois que nécessaire, et notamment en cas de défaillance :
- respiratoire : selon le besoin, une oxygénation nasale, une oxygénation au masque ou une oxygénation à haut débit est débutée. L’objectif est d’obtenir une saturation en oxygène (SaO2) entre 92 et 95 %. L’hyperoxygénation est toxique ; elle doit être évitée. La ventilation invasive et protectrice en cas de syndrome de détresse respiratoire aiguë est du domaine spécialisé de la réanimation ;
- rénale : une épuration extrarénale, intermittente ou continue, est instaurée seulement s’il existe un critère de dialyse en urgence. Aucune étude n’a montré de bénéfice suffisant à débuter une dialyse précocement dans le sepsis ou le choc septique.
Thérapies additionnelles
- corticothérapie à faible dose et sur une courte période. Elle vise à corriger une insuffisance corticotrope présente dans le choc septique, et à exhiber un effet anti-inflammatoire. Un traitement par hydrocortisone 200 mg/j par voie intraveineuse pendant sept jours est recommandé dans le choc septique, associé à un minéralocorticoïde, la fludrocortisone ;
- vasopressine recommandée à faibles doses dès que des doses de noradrénaline supérieures à 0,25-0,5 μg/kg/min ne permettent pas de corriger l’hypotension.
Tous les patients doivent bénéficier d’une prévention antithrombotique par anticoagulation préventive, à l’exception de ceux ayant une contre-indication engendrant une balance bénéfice-risque défavorable.
La prévention anti-ulcéreuse par inhibiteurs de la pompe à protons est recommandée chez les patients avec des facteurs de risque de saignement gastro-intestinal.
La reprise de l’alimentation doit se faire dans les trois premiers jours avec, en première intention, une nutrition entérale.
Les bicarbonates peuvent être utilisés dans le choc septique en cas d’acidose métabolique sévère (pH inférieur à 7,20) associée à une insuffisance rénale aiguë KDIGO 2 ou 3 (
À noter qu’il n’y a pas de place pour les immunoglobulines intraveineuses, ni pour la vitamine C intraveineuse.
Feux rouges
Le diagnostic de sepsis ne doit pas être posé sans défaillance d’organe, même en présence d’une septicémie ou d’un foyer infectieux évident.
Le diagnostic de choc septique ne peut pas être posé en l’absence d’hyperlactatémie.
Un remplissage vasculaire est nécessaire avant l’introduction d’un traitement vasopresseur.
Toujours rechercher un foyer infectieux nécessitant un drainage chirurgical ou endoscopique ou en radiologie interventionnelle en complément d’un traitement anti-infectieux.
Devant tout sepsis, l’examen de l’ensemble du tégument est nécessaire. La présence d’un élément purpurique nécrotique ou ecchymotique de plus de 3 mm évoque un purpura fulminans et impose l’injection immédiate intraveineuse (à défaut, intramusculaire) de 2 g de ceftriaxone ou de céfotaxime.
Ne pas conclure systématiquement à une méningococcémie devant un purpura fulminans : dans 20 % des cas, il s’agit d’une pneumococcémie.
POINTS FORTS À RETENIR
Bien connaître les items du score SOFA permettant d’établir le diagnostic de sepsis.
Le bilan biologique doit absolument comprendre un dosage du lactate et la réalisation d’hémocultures (seul prélèvement infectieux impératif et systématique à réaliser avant toute antibiothérapie – sauf purpura fulminans, y compris en extrahospitalier).
L’antibiothérapie doit être initiée dans l’heure en cas d’instabilité hémodynamique, ou au plus tard dans les trois heures.
La réalisation de prélèvements infectieux et de l’imagerie ne doit pas retarder l’introduction de l’antibiothérapie.
Le sepsis est une urgence vitale. L’appel du réanimateur est indispensable.
Toujours penser au contrôle de la source (drainage chirurgical ou endoscopique ou en radiologie interventionnelle) ; en l’absence de contrôle précoce de la source, la mortalité est quasiment doublée.
En cas de sepsis ou de choc septique, il est possible de réaliser une imagerie avec injection de produit de contraste iodé, quelle que soit la valeur de la créatininémie, si celle-ci s’avère nécessaire pour le diagnostic (foyer profond, par exemple) ou pour la thérapeutique (drainage d’abcès, par exemple).
Sepsis et choc septique de l’enfant et de l’adulte
Le purpura fulminans peut faire l’objet d’un dossier aux ECN et doit absolument être connu de l’étudiant. Il est le plus souvent secondaire à une méningococcémie (bactériémie à méningocoque, qui est un diplocoque à Gram négatif). L’éventuelle atteinte méningée n’est qu’au second plan. L’antibiothérapie par ceftriaxone doit être immédiate, après prélèvement d’une paire d’hémocultures (sauf en préhospitalier). La ponction lombaire est contre-indiquée ici en présence de stigmates cliniques de coagulation intravasculaire disséminée (CIVD). La biopsie cutanée peut être réalisée après l’antibiothérapie avec examen direct et mise en culture (possibilité également de réaliser une PCR sur cette biopsie). Le patient doit bien sûr être isolé (masque chirurgical, précautions de type « gouttelettes ») en cas de suspicion de méningite à méningocoque. Au cours du dossier, le patient pourrait avoir une aggravation de sa constipation ou la présence d’un signe d’alarme. Il faudrait alors argumenter la réalisation d’une coloscopie totale pour éliminer une étiologie cancéreuse. Il faut parfaitement connaître les signes d’alarme à rechercher à l’interrogatoire et à l’examen clinique. Le dossier peut alors rebondir sur l’annonce d’un diagnostic grave et la prise en charge étiologique de cette constipation organique.
Un autre dossier qui semblerait intéressant pourrait être la prise en charge d’une pathologie douloureuse (douleur rhumatologique par exemple), avec la prescription d’opioïdes qui peut engendrer une constipation. Cette pathologie étant un vrai problème de santé publique, elle est d’actualité et peut concerner tous les types de dossiers transversaux nécessitant des antalgiques au long cours.
Surviving sepsis campaign : https://www. sccm.org/SurvivingSepsisCampaign/Guidelines/Adult-Patients
https://solidarites-sante.gouv.fr/IMG/pdf/rapport_sepsis_dgs_130919.pdf
Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA 2016;315(8):801.

 Encadrés
Encadrés