De plus en plus pratiqués, ils permettent d’éviter certaines errances diagnostiques et thérapeutiques.
Notre discipline a longtemps été considérée comme dédiée aux troubles sans substrat organique. Pourtant, nombreuses sont les études qui montrent que cette scission « corps-esprit » n’a plus lieu d’être : inflammation, microbiote, facteurs génétiques, épigénétiques, neurobiochimiques influencent les maladies psychiatriques. Par ailleurs, un grand nombre de pathologies somatiques ont une expression psychique.
Ainsi, les bilans biologiques ont une place en psychiatrie. L’objectif n’est pas de multiplier les examens complémentaires, mais de savoir quand et comment les prescrire, notamment en médecine générale. En effet, entre 50 et 80 % des patients ayant un trouble psychiatrique sont détectés par le médecin traitant.1
Ainsi, les bilans biologiques ont une place en psychiatrie. L’objectif n’est pas de multiplier les examens complémentaires, mais de savoir quand et comment les prescrire, notamment en médecine générale. En effet, entre 50 et 80 % des patients ayant un trouble psychiatrique sont détectés par le médecin traitant.1
Bilan initial
Il est indiqué lors d’un premier épisode de trouble psychiatrique, d’une rechute sévère, d’une récidive sans facteur déclenchant ou d’une atypicité clinique. L’objectif est de rechercher des patho-logies organiques sous-jacentes et des comorbidités influençant le choix des traitements ou dont la fréquence est accrue dans cette population (diabète, HTA, dyslipidémie, syndrome métabo- lique).
En pratique, il est simultané au bilan préthérapeutique afin de ne pas multiplier les prélèvements.
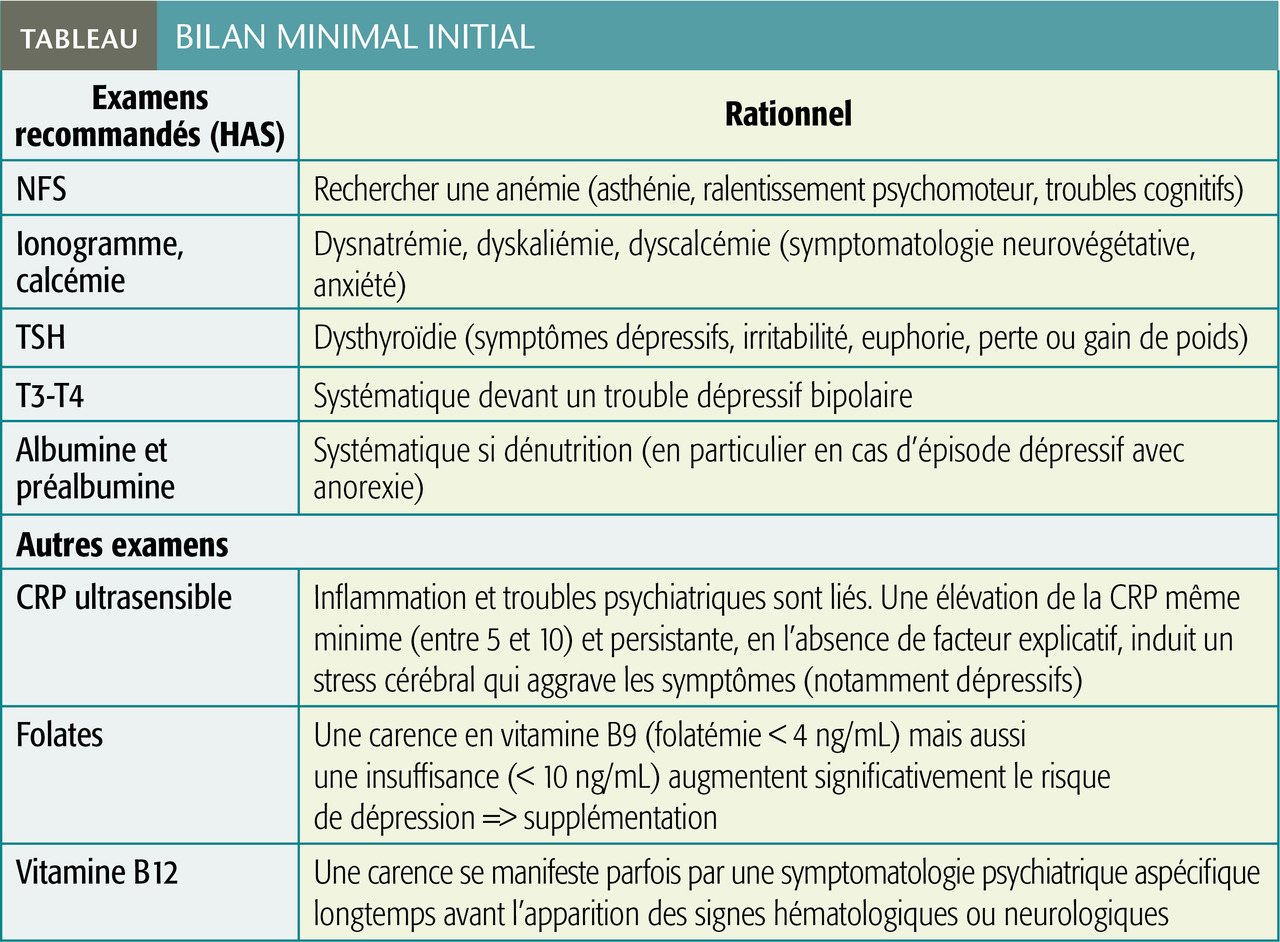
Un bilan initial a été recommandé par la HAS en cas de trouble dépressif ou anxieux sévère, bipolaire ou du spectre de la schizophrénie (tableau). Des examens supplémentaires visent à dépister certains facteurs favorisants,2 notamment les marqueurs d’inflammation3 et les carences en vitamines4 qui interviennent comme précurseurs dans la synthèse des neuromédiateurs.
Devant des symptômes atypiques, une IRM cérébrale est également indiquée, ainsi qu’un EEG.
En pratique, il est simultané au bilan préthérapeutique afin de ne pas multiplier les prélèvements.
Un bilan initial a été recommandé par la HAS en cas de trouble dépressif ou anxieux sévère, bipolaire ou du spectre de la schizophrénie (tableau). Des examens supplémentaires visent à dépister certains facteurs favorisants,2 notamment les marqueurs d’inflammation3 et les carences en vitamines4 qui interviennent comme précurseurs dans la synthèse des neuromédiateurs.
Devant des symptômes atypiques, une IRM cérébrale est également indiquée, ainsi qu’un EEG.
Bilan préthérapeutique et de suivi
La première partie est aspécifique et valable quel que soit le psychotrope envisagé :
1. fonctions rénale (ionogramme avec calcémie, urée, créatininémie et calcul du DFG) et hépatique (ASAT, ALAT, GGT, PAL, TP) ;
2. exploration lipidique et glycémie (pour avoir une valeur de référence avant traitement, afin de dépister la survenue d’un diabète ou d’une dyslipidémie) ;
3. recherche d’infections transmissibles (VIH, VHB, VHC, VDRL-TPHA), en raison du risque d’exposition dans cette population (comorbidités addictives, conduites à risque) ;
4. dosage des toxiques urinaires, notamment des opiacés (contre-indiquant certains traitements) ;
5. ECG, afin de calculer le QT corrigé qui peut s’allonger (avec un risque de torsade de pointe) sous certains antidépresseurs ou antipsychotiques ;
6. dosage bHCG : systématique chez toute femme en âge de procréer.
La seconde partie du bilan est orientée selon les molécules :
Antidépresseurs : natrémie (notammentpour les ISRS) et NFS (pour les anta- gonistes a-2 – mirtazapine, miansérine – surtout après 65 ans) quelques semaines après initiation du traitement, puis si fièvre ou signes d’infection (risque d’agranulocytose). Le dosage plasmatique est à proposer en cas d’inefficacité (pour vérifier l’observance, la zone thérapeutique) ou d’effet indésirable.
Lithium : protéinurie (rapportée à la créatininurie sur échantillon) et calcémie (risque d’hypercalcémie) avant traitement.
Une partie du bilan aspécifique préthérapeutique (cf. supra, points 1 et 2 + NFS et TSH) doit être refaite à J15, à 3 mois, puis tous les 6 mois pendant toute la durée du traitement. Anticorps antithyroïdiens (TPO, TG et TRAK) : à 3 mois.
`Dosage plasmatique (lithiémie) : 5 jours après l’instauration du traitement ou une modification de dose, à J10, à 1 mois, à 3 mois, puis tous les 6 mois ; à refaire si événement intercurrent (déshydratation, maladie infectieuse) ou introduction d’un nouveau médicament.
Anticonvulsivants (valproate de sodium, divalproate, acide valproïque, carbamazépine, utilisés dans les troubles bipolaires ou la dépression résistante) : NFS et bilan hépatique mensuels pendant 6 mois, ensuite trimestriels durant 1 an, puis tous les 6 mois (certains suggèrent de vérifier la fonction hépatique tous les 15 jours le 1er mois). Taux plasmatiques surveillés à l’initiation (après 5 T1/2), lors de modification de dose, d’effet indésirable ou de prescription d’un nouveau traitement concomitante susceptible de modifier le métabolisme hépatique (inducteurs ou inhibiteurs enzymatiques).
Antipsychotiques : surveillance trimestrielle (NFS, ionogramme, créatininémie, bilan hépatique, lipidique, glycémie à jeun) pendant 1 an, puis tous les 6 mois pendant 1 an, puis annuelle (sauf bilan lipidique : tous les 5 ans). Dosage de la prolactine en préthérapeutique et durant le suivi en cas de : signes d’hyperprolactinémie (gynécomastie, dysplasie mammaire, troubles sexuels, signes d’hypogonadisme chronique), désir de grossesse, femme < 25 ans, antécédent de cancer. Vérifier l’hémostase (TP, TCA), utile si une injection IM est prévue (risque d’agitation ou traitement retard). Pour la clozapine, une NFS hebdomadaire est obligatoire pendant 18 semaines, puis à refaire tous les mois (risque d’agranulocytose). Dosages plasmatiques : en cas d’inefficacité du traitement (observance, zone thérapeutique) ou d’effet indésirable ; pour la clozapine, ils sont indispensables pour contrôler que le patient est dans la zone thérapeutique.
1. fonctions rénale (ionogramme avec calcémie, urée, créatininémie et calcul du DFG) et hépatique (ASAT, ALAT, GGT, PAL, TP) ;
2. exploration lipidique et glycémie (pour avoir une valeur de référence avant traitement, afin de dépister la survenue d’un diabète ou d’une dyslipidémie) ;
3. recherche d’infections transmissibles (VIH, VHB, VHC, VDRL-TPHA), en raison du risque d’exposition dans cette population (comorbidités addictives, conduites à risque) ;
4. dosage des toxiques urinaires, notamment des opiacés (contre-indiquant certains traitements) ;
5. ECG, afin de calculer le QT corrigé qui peut s’allonger (avec un risque de torsade de pointe) sous certains antidépresseurs ou antipsychotiques ;
6. dosage bHCG : systématique chez toute femme en âge de procréer.
La seconde partie du bilan est orientée selon les molécules :
Antidépresseurs : natrémie (notammentpour les ISRS) et NFS (pour les anta- gonistes a-2 – mirtazapine, miansérine – surtout après 65 ans) quelques semaines après initiation du traitement, puis si fièvre ou signes d’infection (risque d’agranulocytose). Le dosage plasmatique est à proposer en cas d’inefficacité (pour vérifier l’observance, la zone thérapeutique) ou d’effet indésirable.
Lithium : protéinurie (rapportée à la créatininurie sur échantillon) et calcémie (risque d’hypercalcémie) avant traitement.
Une partie du bilan aspécifique préthérapeutique (cf. supra, points 1 et 2 + NFS et TSH) doit être refaite à J15, à 3 mois, puis tous les 6 mois pendant toute la durée du traitement. Anticorps antithyroïdiens (TPO, TG et TRAK) : à 3 mois.
`Dosage plasmatique (lithiémie) : 5 jours après l’instauration du traitement ou une modification de dose, à J10, à 1 mois, à 3 mois, puis tous les 6 mois ; à refaire si événement intercurrent (déshydratation, maladie infectieuse) ou introduction d’un nouveau médicament.
Anticonvulsivants (valproate de sodium, divalproate, acide valproïque, carbamazépine, utilisés dans les troubles bipolaires ou la dépression résistante) : NFS et bilan hépatique mensuels pendant 6 mois, ensuite trimestriels durant 1 an, puis tous les 6 mois (certains suggèrent de vérifier la fonction hépatique tous les 15 jours le 1er mois). Taux plasmatiques surveillés à l’initiation (après 5 T1/2), lors de modification de dose, d’effet indésirable ou de prescription d’un nouveau traitement concomitante susceptible de modifier le métabolisme hépatique (inducteurs ou inhibiteurs enzymatiques).
Antipsychotiques : surveillance trimestrielle (NFS, ionogramme, créatininémie, bilan hépatique, lipidique, glycémie à jeun) pendant 1 an, puis tous les 6 mois pendant 1 an, puis annuelle (sauf bilan lipidique : tous les 5 ans). Dosage de la prolactine en préthérapeutique et durant le suivi en cas de : signes d’hyperprolactinémie (gynécomastie, dysplasie mammaire, troubles sexuels, signes d’hypogonadisme chronique), désir de grossesse, femme < 25 ans, antécédent de cancer. Vérifier l’hémostase (TP, TCA), utile si une injection IM est prévue (risque d’agitation ou traitement retard). Pour la clozapine, une NFS hebdomadaire est obligatoire pendant 18 semaines, puis à refaire tous les mois (risque d’agranulocytose). Dosages plasmatiques : en cas d’inefficacité du traitement (observance, zone thérapeutique) ou d’effet indésirable ; pour la clozapine, ils sont indispensables pour contrôler que le patient est dans la zone thérapeutique.
En cas de résistance
Elle est définie comme l’absence d’amélioration des symptômes malgré une durée suffisante (en général 4 semaines) et une dose adéquate (maximale recommandée, tolérée par le patient). Plusieurs facteurs peuvent être impliqués :
– erreur thérapeutique : le traitement n’est pas adapté à la pathologie ;
– mauvais diagnostic : le patient a des symptômes typiques d’une maladie psychiatrique, mais il souffre en réalité d’une autre affection ;
– résistance pharmacocinétique : la molécule est métabolisée trop vite et ne peut s’accumuler correctement ni agir efficacement.
L’erreur diagnostique peut être d’or- dre psychiatrique (un trouble bipolaire est confondu avec une dépression unipolaire, une anxiété sévère avec une psychose) ou somatique.5 Une prise en charge spécialisée (pour bilan organo-psychiatrique) est utile en cas d’atypicités, de résistances ou d’antécédents familiaux évocateurs.
Guidés par la clinique, des examens peuvent être faits lorsqu’on constate une aggravation malgré un traitement théoriquement approprié : rechercher une ACFA paroxystique devant un trouble panique résistant, effectuer des explorations respiratoires si troubles anxieux, etc.
Enfin, la résistance pharmacocinétique6 est à évoquer uniquement si les taux plasmatiques ne sont pas concordants avec les posologies prescrites. Après avoir éliminé un défaut d’observance ou une interaction médicamenteuse (avec un inducteur enzymatique), il est possible de demander un séquençage génétique pour détecter des métaboliseurs rapides (MR) ou ultrarapides (MUR) pour les cytochromes CYP2D6 et 2C19, impliqués dans le métabolisme des antidépresseurs et antipsychotiques notamment. Chez ces patients, un avis pharmacogénétique est nécessaire avant la réintroduction de ces médicaments.
– mauvais diagnostic : le patient a des symptômes typiques d’une maladie psychiatrique, mais il souffre en réalité d’une autre affection ;
– résistance pharmacocinétique : la molécule est métabolisée trop vite et ne peut s’accumuler correctement ni agir efficacement.
- – erreur thérapeutique : le traitement n’est pas adapté à la pathologie ;
– mauvais diagnostic : le patient a des symptômes typiques d’une maladie psychiatrique, mais il souffre en réalité d’une autre affection ;
– résistance pharmacocinétique : la molécule est métabolisée trop vite et ne peut s’accumuler correctement ni agir efficacement.
L’erreur diagnostique peut être d’or- dre psychiatrique (un trouble bipolaire est confondu avec une dépression unipolaire, une anxiété sévère avec une psychose) ou somatique.5 Une prise en charge spécialisée (pour bilan organo-psychiatrique) est utile en cas d’atypicités, de résistances ou d’antécédents familiaux évocateurs.
Guidés par la clinique, des examens peuvent être faits lorsqu’on constate une aggravation malgré un traitement théoriquement approprié : rechercher une ACFA paroxystique devant un trouble panique résistant, effectuer des explorations respiratoires si troubles anxieux, etc.
Enfin, la résistance pharmacocinétique6 est à évoquer uniquement si les taux plasmatiques ne sont pas concordants avec les posologies prescrites. Après avoir éliminé un défaut d’observance ou une interaction médicamenteuse (avec un inducteur enzymatique), il est possible de demander un séquençage génétique pour détecter des métaboliseurs rapides (MR) ou ultrarapides (MUR) pour les cytochromes CYP2D6 et 2C19, impliqués dans le métabolisme des antidépresseurs et antipsychotiques notamment. Chez ces patients, un avis pharmacogénétique est nécessaire avant la réintroduction de ces médicaments.
RÉFÉRENCES
1. Norton J, De Roqueful G, David M, et al. Prévalence des troubles psychiatriques en médecine générale selon le Patient Healh Questionnaire : adéquation avec la détection par le médecin et le traitement prescrit. General Hospital Psychiatry 2007;29;285-93.
2. Fédération française de psychiatrie-Conseil national professionnel de psychiatrie. Recommandation de bonne pratique en psychiatrie. Comment améliorer la prise en charge somatique des patients ayant une pathologie psychiatrique sévère et chronique. Juin 2015.
3. Jha MK, Trivedi MH. Personalized Anti-depressant Selection and Pathway to Novel Treatments: Clinical Utility of Targeting Inflammation. Int J Mol Sci 2018;19:pii E233.
4. Coppen A, Bolander-Gouaille C. Treatment of depression: time to consider folic acid and vitamin B12. J Psychopharmacol 2005;19:59-65.
5. Bourla A, Ferreri F. Ordonnances en psychiatrie et pédopsychiatrie. 100 prescriptions courantes. Paris: Maloine; 2017: 240 p.
6. Quaranta S, Dupouey J, Colle R, Verstuyft C. Pharmacogenetics of antidepressant drugs: State of the art and clinical implementation- recommendations from the French National Network of Pharmacogenetics. Therapie 2017; 72:311-8.
2. Fédération française de psychiatrie-Conseil national professionnel de psychiatrie. Recommandation de bonne pratique en psychiatrie. Comment améliorer la prise en charge somatique des patients ayant une pathologie psychiatrique sévère et chronique. Juin 2015.
3. Jha MK, Trivedi MH. Personalized Anti-depressant Selection and Pathway to Novel Treatments: Clinical Utility of Targeting Inflammation. Int J Mol Sci 2018;19:pii E233.
4. Coppen A, Bolander-Gouaille C. Treatment of depression: time to consider folic acid and vitamin B12. J Psychopharmacol 2005;19:59-65.
5. Bourla A, Ferreri F. Ordonnances en psychiatrie et pédopsychiatrie. 100 prescriptions courantes. Paris: Maloine; 2017: 240 p.
6. Quaranta S, Dupouey J, Colle R, Verstuyft C. Pharmacogenetics of antidepressant drugs: State of the art and clinical implementation- recommendations from the French National Network of Pharmacogenetics. Therapie 2017; 72:311-8.