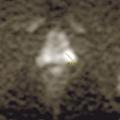
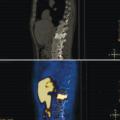
Diagnostiquer une tumeur maligne de la prostate.
Planifier le suivi du patient.
En France, le cancer de la prostate est actuellement la tumeur maligne la plus fréquente chez les hommes (environ 48 000 nouveaux cas par an) et représente plus de 25 % de tous les cancers diagnostiqués à partir de 50 ans. L’incidence du cancer de la prostate a montré une tendance à la hausse constante au cours des dernières décennies, en particulier autour des années 2000, en conjonction avec la diffusion du dosage de l’antigène spécifique de la prostate (PSA) comme outil de dépistage. Ensuite, l’incidence a diminué de façon modérée, en particulier chez les hommes entre 50 et 60 ans. Compte tenu de l’agressivité différente des diverses formes de maladie, le cancer de la prostate occupe la troisième place sur l’échelle de la mortalité corrélée aux cancers, dans presque tous les cas impliquant des hommes de plus de 70 ans (environ 8 000 décès par an). Cependant, les comorbidités qui sont généralement présentes chez les personnes âgées peuvent rendre difficile la séparation des décès pour cause de cancer de la prostate de ceux survenus avec un cancer de la prostate.
La survie des patients atteints d’un cancer de la prostate est actuellement de 91 % à 5 ans après le diagnostic, en croissance constante et sensible. Le principal facteur à la base de cette tendance est l’anticipation diagnostique, liée surtout à la diffusion progressive du dosage du PSA chez les sujets asymptomatiques, impliquant également une part non négligeable de diagnostic de tumeurs qui ne seraient pas destinées à évoluer cliniquement car, au contraire, elles se caractérisent par une histoire naturelle particulièrement indolente.
Diagnostic
- toucher rectal ;
- dosage du PSA ;
- imagerie par résonance magnétique (IRM) de la prostate ;
- biopsies prostatiques.
Toucher rectal
De toute manière, malgré l’indication à utiliser le toucher rectal dans l’évaluation initiale de chaque patient, il ne peut pas être utilisé comme la seule méthode de diagnostic, en raison des faibles niveaux de sensibilité (valeur prédictive positive) et de spécificité.
Dosage du PSA
En plus du PSA total, la concentration de la fraction libre peut également être mesurée dans le sang, ce qui représente un paramètre supplémentaire à prendre en compte dans la phase diagnostique. Cependant, les méthodes de dosage du PSA libre sont caractérisées par une variabilité analytique significative.
D’un point de vue opératif, certaines recommandations devraient être suivies :
- il est recommandé d’effectuer les dosages du PSA total et PSA libre toujours avec la même méthode et éventuellement dans le même laboratoire, pour le suivi de chaque patient ;
- le laboratoire doit toujours indiquer la méthode utilisée pour déterminer le PSA total et le PSA libre, en fournissant les informations nécessaires pour identifier exactement la méthode commerciale utilisée ;
- le laboratoire doit toujours informer quand la méthode est modifiée.
En ce qui concerne la question « quand faut-il doser le PSA ? », compte tenu de la difficulté à confirmer un impact réel, en termes de réduction de la mortalité, du dépistage organisé du cancer de la prostate (en raison du risque non négligeable de diagnostiquer des formes de cancer non cliniquement significatives), la plupart des sociétés et des organisations scientifiques ont adopté une position flexible, suggérant que le dépistage du cancer de la prostate via le dosage systématique du PSA peut être proposé aux hommes qui en font la demande, à condition qu’ils soient correctement informés des avantages mais aussi des risques possibles. La tranche d’âge pour laquelle le test peut être indiqué est celle entre 50 ans et 70/75 ans, en tenant compte d’une espérance de vie d’au moins 10 ans comme élément indispensable. Chez les hommes présentant des facteurs de risque de cancer de la prostate (par exemple, origine ethnique, antécédents familiaux), l’âge auquel une surveillance périodique du PSA chez des sujets asymptomatiques peut être envisagée pourrait plutôt être avancé à 40-45 ans.
En ce qui concerne l’utilisation « spontanée » du dosage du PSA comme test de dépistage chez les hommes asymptomatiques, il faut souligner que :
- les hommes asymptomatiques de plus de 75 ans et/ou dont l’espérance de vie est inférieure à 10 ans devraient éviter le dépistage du cancer de la prostate via dosage du PSA, car les avantages potentiels du diagnostic précoce sont marginaux par rapport aux risques ;
- le dosage du PSA peut être proposé aux hommes asymptomatiques qui le souhaitent, à condition qu’ils soient informés des risques et bénéfices liés au test et des procédures suivant le résultat du test (biopsies, IRM) ;
- le dépistage du cancer de la prostate via le PSA doit être déconseillé aux hommes de moins de 50 ans sans facteur de risque ;
- en l’absence de symptôme, le dosage du PSA ne doit pas être inclus dans les contrôles hématologiques de routine.
En réponse à la demande du patient, la conduite du médecin doit donc toujours être de maintenir les caractéristiques de prudence et veiller à ce que la personne concernée reçoive les informations les plus adéquates non seulement sur les risques et bénéfices mais aussi sur les limites diagnostiques du test.
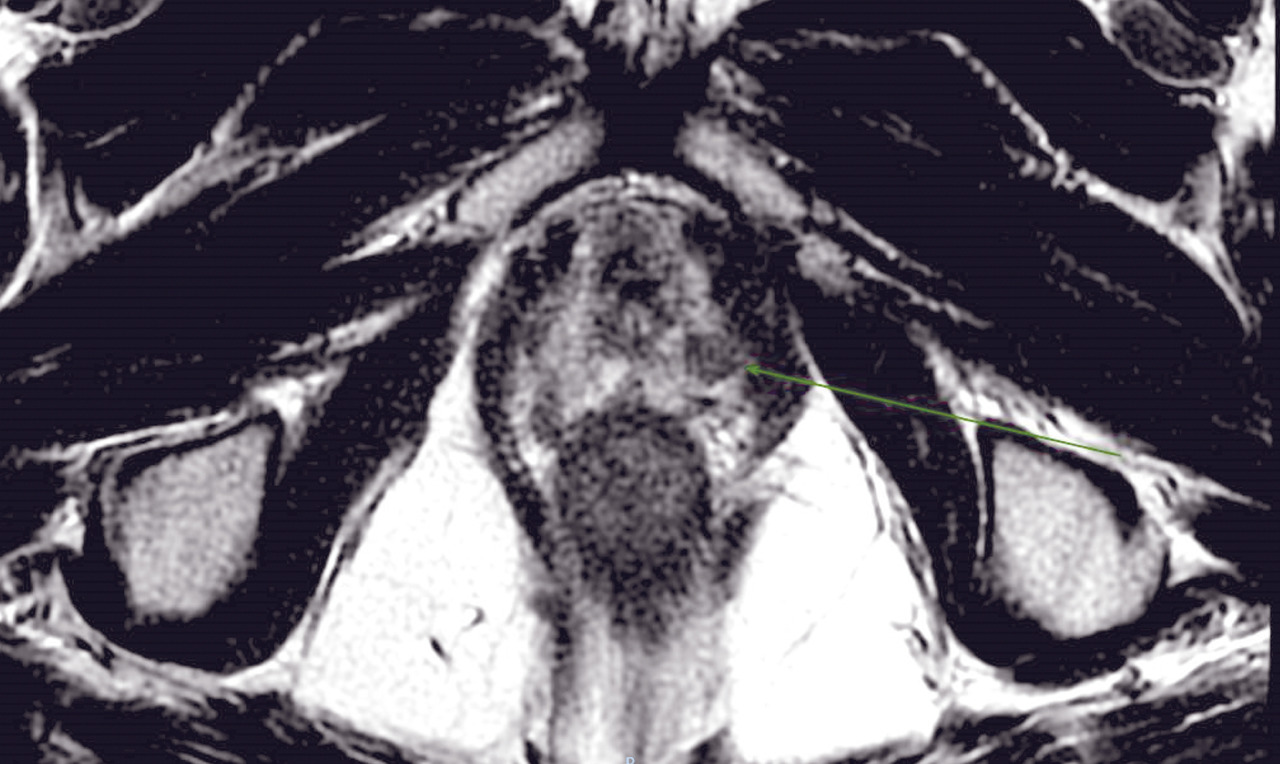
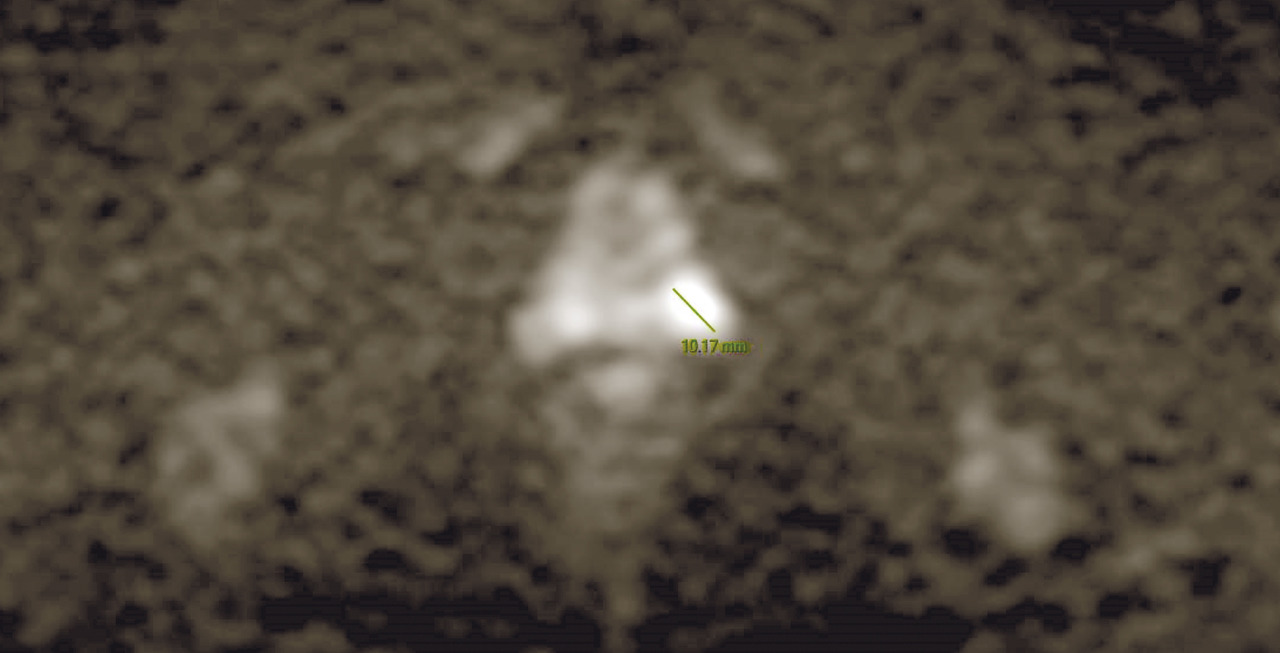
IRM de la prostate
À ce jour, avec la diffusion d’outils de plus en plus sophistiqués et précis pour effectuer des biopsies avec fusion d’images entre l’IRM multiparamétrique et l’échographie transrectale en temps réel, la biopsie avec connaissance de l’anatomie prostatique sur la base des images d’IRM réalisée sous guidage échographique est devenue une approche indispensable, permettant de faire évoluer les biopsies systématisées, réalisées « à l’aveugle», vers des biopsies ciblées. De nombreuses études ont montré que l’échantillonnage ciblé, en plus de l’approche systématique, est mieux corrélé au score de Gleason pathologique, tandis que d’autres ont montré une meilleure performance en termes de sensibilité et de spécificité de la biopsie ciblée par rapport à la réalisation des biopsies avec approche systématique, réduisant de manière significative le taux de détection des tumeurs cliniquement non significatives. Par conséquent, la réalisation de l’IRM avant de programmer les biopsies est de plus en plus recommandée afin de :
- poser l’indication à la biopsie en cas de détection de lésions significatives ;
- permettre la surveillance du patient en cas d’absence de lésions significatives ;
- guider l’échantillonnage des biopsies de la région cible.
Dans ce scénario, des limites importantes peuvent découler de l’expérience différente des radiologues dans l’interprétation du protocole multiparamétrique : en effet, la variabilité inter-observationnelle et l’hétérogénéité dans la définition de l’examen en tant que positif ou négatif restent cruciales.
Contrairement à la tomodensitométrie (TDM), la résolution spatiale de l’image garantie par l’IRM permet d’élucider l’anatomie zonale de la glande prostatique et de distinguer la portion périphérique de la glande et le tissu néoplasique, qui a un signal intrinsèque différent. De plus, pour les mêmes raisons, l’IRM est en mesure de mieux représenter toutes les structures pelviennes restantes, avec une clarification remarquable de leurs rapports (vessie, rectum, muscles, structures squelettiques, vaisseaux). Ces caractéristiques rendent désormais l’utilisation de l’IRM multiparamétrique également essentielle à des fins de planification thérapeutique (bilan d’extension locorégional avant traitement local, par exemple de chirurgie ou de radiothérapie externe).
Biopsies prostatiques
La biopsie est réalisée aujourd’hui sous guidage échographique.
La biopsie par schéma en sextant n’étant plus adéquate, un nombre plus élevé d’échantillons est considéré comme nécessaire, généralement entre 8 et 12, en plus de toute biopsie ciblée des lésions visibles identifiées à l’IRM. Le choix de la voie d’accès ne semble pas affecter la sensibilité et la spécificité de la méthode, même si la voie transpérinéale est connue pour avoir une sensibilité majeure par rapport à la voie transrectale. En cas de suspicion clinique d’extension extracapsulaire (extraprostatique), la cartographie peut être étendue aux vésicules séminales et au tissu périprostatique. Cependant, au-delà de ces indications spécifiques, il faut souligner qu’aucune preuve scientifique ne montre que l’augmentation du diagnostic de carcinome attribuable à l’augmentation de l’échantillonnage offre un réel avantage au patient : il n’est pas prouvé, en fait, que l’augmentation du nombre des biopsies ait une meilleure capacité à diagnostiquer des cancers agressifs autrement non diagnostiqués. En revanche, il est très probable qu’une bonne partie des cancers « supplémentaires », diagnostiqués en augmentant le nombre de biopsies, soit, en fait, non agressive et destinée à ne pas évoluer. En ce sens, l’information fournie au préalable par l’IRM, par rapport à sa capacité à identifier des zones plus à risque de contenir des cancers réellement significatifs, semble être le seul outil pour remédier à ce problème.
La valeur de PSA au-dessus de laquelle la biopsie de la prostate doit être effectuée (en l’absence d’autres éléments de suspicion clinique, notamment en présence d’une IRM « normale ») est toujours en discussion. De principe, les concentrations sériques de PSA supérieures à 10 ng/mL nécessitent un examen plus approfondi. Pour des valeurs comprises entre 2,5 et 10 ng/mL, d’autres paramètres doivent également être pris en compte, tels que l’âge du patient, la fraction de PSA libre par rapport au PSA total, le volume prostatique (densité) et l’évolution du PSA dans le temps.
Par ailleurs, il convient de rappeler qu’une biopsie négative ne signifie pas nécessairement « absence » de tumeur. Dans les cas suivants, il est en effet nécessaire de répéter la biopsie :
- en cas de première biopsie négative et forte suspicion clinique, la manœuvre devrait être répétée en augmentant l’échantillonnage, notamment de la cible ;
- en cas de première manœuvre négative avec un nombre limité de biopsies, en réalisant une cartographie plus étendue ;
- en cas d’augmentation significative du PSA.
Bilan d’extension
L’outil idéal pour réaliser un bilan d’extension de la maladie devrait :
- avoir une faible variabilité dans l’interprétation ;
- avoir une capacité prédictive élevée, à la fois dans l’évaluation de l’extension locale et dans l’évaluation des ganglions locaux et de l’extension à distance de la maladie (TNM).
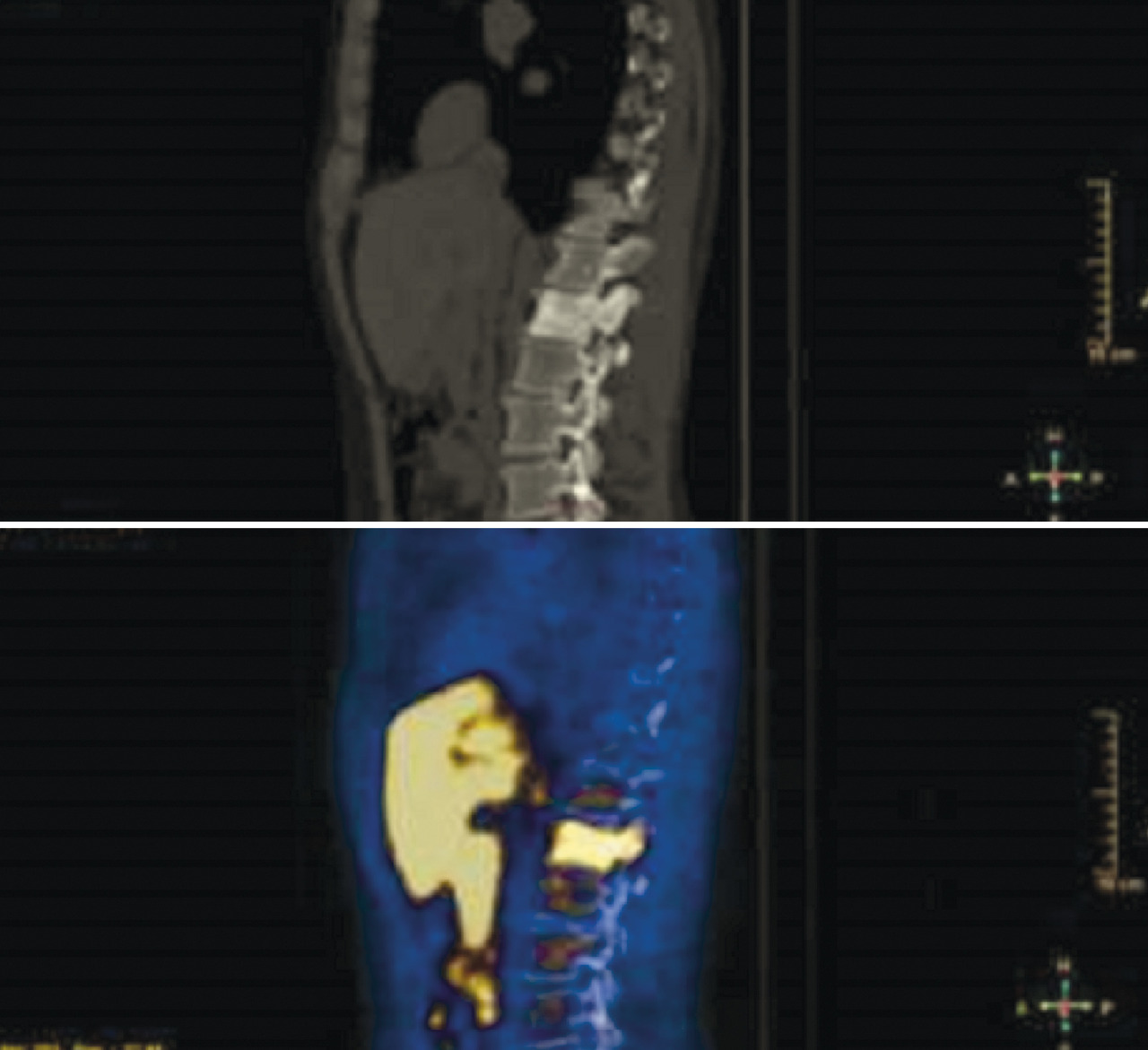
Plus récemment, d’autres méthodes d’imagerie ont permis d’améliorer la précision du bilan d’extension, notamment la tomographie par émission de positons (TEP), avec différents traceurs. La TEP est un examen d’imagerie fonctionnelle qui permet de mesurer en trois dimensions l’activité métabolique des tissus. Elle est couplée à un scanner classique, qui permet de préciser les zones d’hypermétabolisme par superposition des deux iconographies. La TEP repose sur le principe général de la scintigraphie, qui consiste à obtenir des images après l’injection d’un « traceur » faiblement radioactif : pour l’étude des cancers de prostate, le plus largement utilisé est le [18F]fluorocholine (
De multiples paramètres cliniques et anatomopathologiques peuvent contribuer au bilan d’extension de la maladie, en particulier s’ils sont insérés dans des nomogrammes spécifiques ou via des modèles prédictifs. Il faut aussi souligner que l’exécution des examens d’imagerie doit être recommandée en fonction de la classe de risque spécifique de chaque patient, selon la nécessité d’avoir un bilan plus précis, qui peut modifier la procédure thérapeutique (
Principes de thérapie
Pour cette raison, chez les patients ayant une courte espérance de vie (généralement inférieure à 10 ans), en raison de l’âge avancé ou de la présence de comorbidités avec une létalité plus élevée que celle du cancer de prostate lui-même, une conduite de surveillance peut être indiquée. De même, les patients souffrant d’une maladie à très faible risque, même en présence d’une bonne espérance de vie, peuvent être orientés vers une surveillance « active ». En réalité, les deux concepts diffèrent profondément. La surveillance (en l’absence de contrôle systématique) des patients dont le traitement immédiat de la tumeur ne peut pas avoir d’impact sur l’espérance de vie a des finalités presque exclusivement palliatives. Cette stratégie est généralement appliquée aux patients atteints d’une maladie confinée à la prostate ou extraprostatique, mais dans certains cas très sélectionnés, elle peut également être appliquée à des situations de maladie plus avancée. La surveillance « active », en revanche, est plutôt une stratégie de traitement différé, avec l’objectif spécifique d’éviter de surtraiter des cancers non cliniquement significatifs, destinés à ne pas évoluer : elle est proposée aux patients ayant une espérance de vie « normale », atteints d’une maladie localisée à très faible risque au moment du diagnostic. Au lieu d’être adressé à un traitement immédiat, le patient entre dans un protocole de contrôles, via la répétition périodique des biopsies, de l’examen clinique, du PSA (et dans certains cas spécifiques de l’IRM multiparamétrique), afin de détecter rapidement l’éventuelle progression de la maladie, et seulement dans ce cas le patient est adressé au traitement local plus adapté.
En ce qui concerne les patients présentant une maladie apparemment intraprostatique et à risque faible/très faible, candidats à des thérapies locorégionales à visée curative, il convient de rappeler que le choix thérapeutique repose principalement sur des études qui ont permis de confirmer l’équivalence substantielle des stratégies disponibles et que, par conséquent, le choix des différentes approches (la surveillance active, la prostatectomie radicale, la radiothérapie externe, la curiethérapie) doit se fonder sur les préférences du patient (compte tenu également des différentes séquelles liées aux traitements), sur la compétence professionnelle de l’équipe médicale et sur les possibilités techniques disponibles (à appliquer surtout aux options chirurgicales et de radiothérapie). Ces considérations s’appliquent également aux patients à risque intermédiaire-élevé ou très élevé : bien qu’ils puissent aspirer qu’en moindre mesure à la guérison, il est nécessaire que tous les efforts soient faits pour poursuivre un contrôle adéquat de la maladie, à la fois local et systémique, ce qui est plus facilement réalisé via l’utilisation de traitements multimodaux, notamment l’association de la radiothérapie et de l’hormonothérapie.
Chez les patients atteints d’une maladie métastatique, la palliation reste l’objectif le plus concrètement réalisable, surtout en présence de symptômes liés à la maladie. Pour ces patients, il existe actuellement différentes options d’hormonothérapie et de chimiothérapie qui, associées au traitement local de la maladie (notamment la radiothérapie), qui même en situation métastatique peut avoir une importance, et aux formes les plus récentes de thérapie métabolique (des radio-isotopes à but thérapeutique) et de thérapie ciblée, peuvent avoir un impact significatif sur la qualité et l’espérance de vie. De plus, même pour les patients avec maladie métastatique, il y a parfois des situations (par exemple en cas de progression biochimique isolée, avec stabilité clinique et radiologique de la maladie), dans lesquelles l’absence de symptômes peut autoriser une conduite d’attente et de surveillance, retardant tout nouveau traitement jusqu’à l’apparition des symptômes. Le choix du traitement sera fondé encore sur les données des essais cliniques disponibles et les principaux facteurs pronostiques, sur les préférences du patient et de sa famille et sur la compatibilité des options thérapeutiques disponibles avec l’état de santé du patient, ses comorbidités et son âge. Dans tous les cas, il convient que le choix thérapeutique, à tout moment de la prise en charge d’un patient atteint d’un cancer de prostate, découle de la collaboration active entre les différents spécialistes, via une évaluation multidisciplinaire. Les groupes multidisciplinaires de pathologie et les réunions de concertation pluridisciplinaire (RCP) sont des outils opérationnels déjà actifs dans la plupart des centres, pour garantir l’accès aux thérapies les plus innovantes pour tous les patients et de la meilleure qualité possible.
POINTS FORTS À RETENIR
En France, le cancer de la prostate est actuellement la tumeur maligne la plus fréquente chez les hommes (environ 48 000 nouveaux cas par an) et occupe la troisième place sur l’échelle de la mortalité corrélée aux cancers (environ 8 000 décès par an).
Le diagnostic définitif de cancer de la prostate n’est obtenu que par les biopsies. L’indication à effectuer les biopsies peut résulter de la découverte d’une consistance anormale de la glande au toucher rectal, de la détection de zones suspectes à l’IRM, ou de l’élévation des valeurs de PSA.
Un bilan d’extension correct, c’est-à-dire une définition précise de l’étendue de la maladie via des examens d’imagerie appropriés, représente le point de départ pour établir la meilleure stratégie thérapeutique, obtenir des informations sur le pronostic et comparer les résultats des différentes options thérapeutiques.
La thérapie du cancer de la prostate a des objectifs différents, en fonction de l’étendue anatomique et de l’agressivité de la maladie mais aussi de l’espérance de vie du patient et de la présence de comorbidités qui peuvent représenter un risque de décès supérieur à celui représenté par le cancer de la prostate.
Tumeurs de la prostate
Le cancer de la prostate est la tumeur maligne la plus fréquente chez les hommes : il a montré une tendance à la hausse constante au cours des dernières décennies, en conjonction avec la diffusion du PSA comme outil de dépistage. Cependant, les résultats des études disponibles conduisent à la conclusion qu’un dépistage organisé du cancer de la prostate, fondé sur l’utilisation systématique du PSA simplement à partir d’un certain âge, est peu susceptible de produire un impact significatif sur la mortalité spécifique, alors qu’il peut provoquer des effets secondaires négatifs, en raison du risque de diagnostiquer des cancers indolents, destinés à ne pas évoluer cliniquement. Un possible cas clinique pourrait faire débattre autour des indications recommandées à la réalisation du dosage du PSA, en fonction des caractéristiques du patient. En dehors de ce type de cas clinique, les principales questions peuvent concerner les démarches diagnostiques initiales, par exemple devant une valeur anormale du PSA, ou la discussion de la conduite à tenir devant un cancer détecté via la biopsie, selon des scénarios différents, éventuellement en fonction des résultats du bilan d’extension.
National Comprehensive Cancer Network (NCCN). Clinical practice guidelines in oncology. Prostate Cancer. Version 4.2019.

 Encadrés
Encadrés