Les mécanismes à l’origine des rythmes circadiens honorés par le prix Nobel de physiologie ou médecine 2017 récompensent ainsi trois chercheurs américains : Jeffrey Hall, Michael Rosbash et Michael Young. Ce prix est le premier récompensant les travaux portant sur la chronobiologie dans l’histoire des prix Nobel de médecine.
La rythmicité circadienne est une propriété presque universelle rapportée chez les organismes unicellulaires, les plantes et les animaux, permettant la vie sur terre et la synchronisation avec la rotation de notre planète. Notre système circadien est composé d’oscillateurs centraux et périphériques hiérarchiquement organisés. Jeffrey Hall, Michael Rosbash et Michael Young (fig. 1 ) ont décortiqué les mécanismes moléculaires générant et contrôlant les rythmes circadiens. Au niveau molé- culaire, l’horloge centrale et les oscillateurs périphériques impliquent de nombreux facteurs génétiques et consistent en un réseau de boucles d’autorégulation transcriptionnelle et traductionnelle négative.
Les découvertes
L’influence des rythmes biologiques sur les organismes vivants est connue depuis l’Antiquité. Le plus connu et le plus déterminant est certainement le rythme circadien, circa en latin signifie « autour de » et dies « jour », d’environ 24 heures, correspondant à la durée d’une journée terrestre. L’astronome fran- çais, Jean-Jacques d’Ortous de Mairan, avait déjà au xviiie siècle mis en évidence que les feuilles du mimosa se fermaient à la tombée du jour et constataient que les feuilles continuaient à s’ouvrir et se fermer dans l’obscurité complète pendant plusieurs jours avec une cyclicité proche de 24 heures. Ces résultats suggéraient ainsi l’existence d’une « horloge » interne qui réglait ces mouvements. Dans les années 1970, Seymour Benzer et Ronald Konopka ont démontré qu’une mutation génétique perturbait le rythme circadien chez la dro- sophile, un gène inconnu appelé period. Deux des trois Prix Nobel, Jeffrey Hall et Michael Rosbash, ont iden- tifié ce gène en 1984 et expliqué son fonctionnement : le gène period déclenche la synthèse d’une protéine PER qui s’accumule la nuit et se dégrade le jour suivant un rythme circadien. En 1994, Michael Young a découvert un deuxième gène de l’horloge interne, appelé timeless qui code la protéine TIM, qui se lie à la protéine PER, pénètre dans le noyau de la cellule et bloque l’activité du gène period le jour.
Fonctionnement de la rythmicité circadienne
PER et TIM contrôlent la rythmicité circadienne
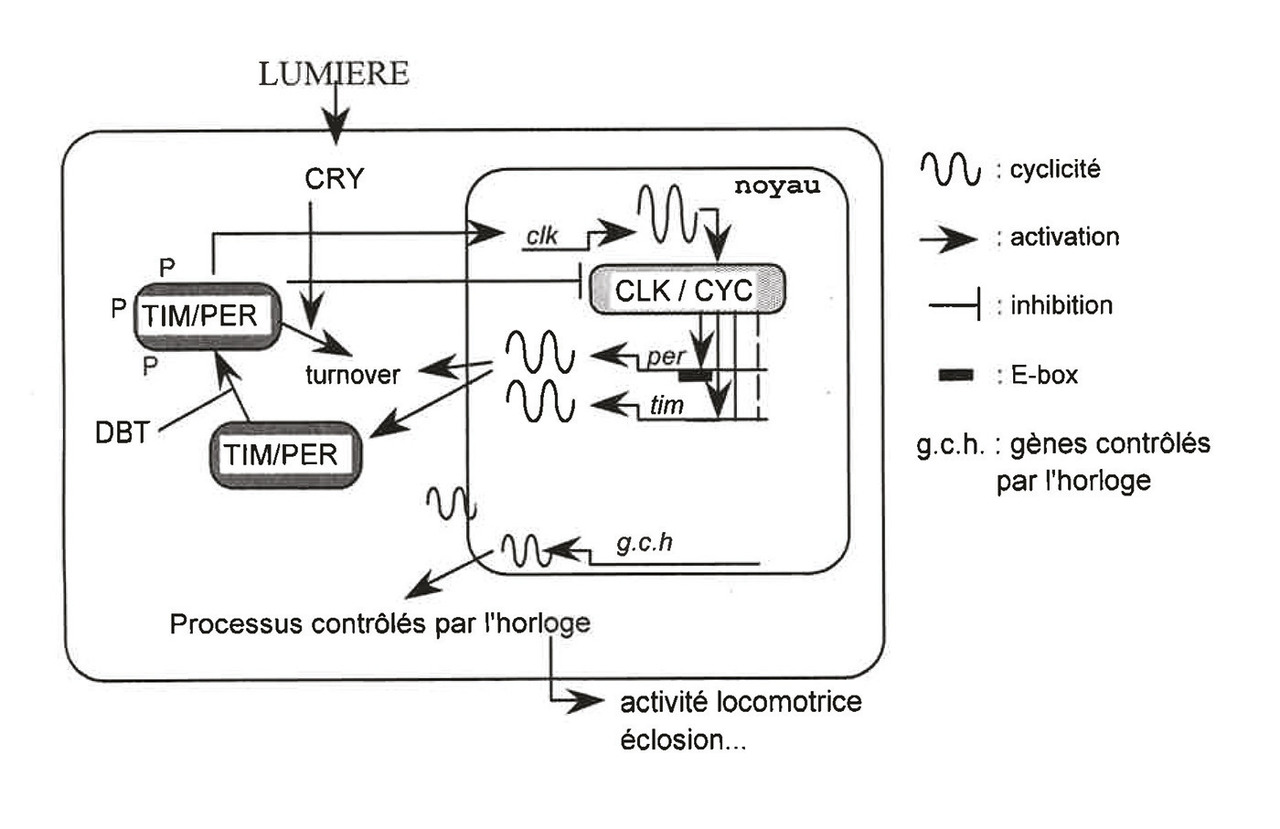
Plusieurs mutations altérant la rythmicité circadienne ont ainsi été initialement découvertes chez la mouche Drosophila. Le gène per produit une protéine PER que l’on trouve dans les noyaux des cellules de l’œil et du cerveau avec des taux plus importants la nuit que le jour, témoignant d’une rythmicité circadienne. En cas de destruction de ce gène, il n’y a plus de protéine PER synthétisée et la mouche devient arythmique ; si le gène est seulement muté, les taux de production de la protéine PER qui en résultent expliquent les différences de longueur des périodes circadiennes de ces animaux. La localisation nucléaire de PER suggérait que cette protéine contrôle elle-même la transcription d’autres gènes. Le rythme de production de PER découle en fait d’un feedback de la protéine PER sur l’expression de son propre gène, provoquant une oscil- lation de la production de PER qui engendre la ryth- micité finale. Une autre souche mutante de drosophile responsable d’une perturbation du rythme circadien a permis d’isoler le gène tim. L’activité des gènes per et tim est coordonnée et les taux d’ARNm sont toujours corrélés, aussi bien dans leur amplitude que dans leur période. De plus, la protéine TIM est physiquement associée à la protéine PER, l’ensemble formant un hétérodimère nécessaire pour sa translocation dans le noyau (fig. 2 ). La localisation nucléaire de cet hétérodimère est indispensable pour la régulation de l’expression de leurs propres gènes. Du fait d’un délai entre transcription et régulation négative, ces boucles d’autorégulation conduisent à l’expression rythmique de gènes spécifiques dits gènes-horloge, dont les protéines respectives sont nécessaires à la génération et la régulation des rythmes circadiens.
Mais d’autres gènes interviennent aussi
D’autres gènes affectant la rythmicité circadienne ont ensuite été localisés chez la drosophile, un homologue du gène clock(circadian locomotor output cycles kaput) de la souris et un gène cyc codant une protéine CYCLE (ou CYC). Ces deux gènes clock et cyc codent des pro- téines activatrices de la transcription des gènes per et tim. Une mutation d’un de ces deux gènes chez la drosophile est responsable de l’absence de toute rythmicité circadienne. Un homologue de la protéine CYC a aussi été trouvé chez les mammifères, la protéine BMAL1 (brain and muscle aryl hydrocarbon receptor nuclar translocator-like protein1). À la suite du clonage du gène clock, trois homologues du gène per de la drosophile ont été isolés chez la souris et chez l’homme, mPer1, mPer2 et mPer3. Ces gènes per sont exprimés dans plusieurs régions cérébrales, mais les fluctuations journalières ne sont retrouvées de manière importante et rythmique qu’au niveau du noyau suprachiasmatique, confirmant leur implication dans la genèse des rythmes circadiens. Toutefois, l’activité de ces gènes est différente entre les deux espèces. Chez la drosophile, l’expression du gène clock suit une rythmicité circadienne avec une oscillation régulée par le complexe protéique PER-TIM en inhibant sa propre synthèse d’ARNm. Chez la souris, l’activité transcriptionnelle du gène clock n’est pas rythmique, à l’inverse du gène bmal 1 dont la régulation serait effectuée par le gène mPer2. En effet, seul mPer2 semble impliqué de façon importante, les souris knock-out développant une rythmicité circadienne anormale ; à l’inverse, les gènes mPer1 et 3 n’ont que des effets additionnels. La boucle d’autorégulation principale chez le mammifère fait intervenir les facteurs de transcription positifs CLOCK et BMAL1. Les protéines BMAL1 et CLOCK forment ainsi, comme TIM et PER, un hétérodimère qui semble être soumis à un processus de régulation semblable (fig. 2 ). Plus précisément, le complexe protéique PER-TIM, une fois transloqué dans le noyau et secondairement désassemblé, inhibe fortement l’activité du complexe CLOCK-BMAL1 et influe finalement sur l’activité transcriptionnelle des gènes per et tim.
Les noyaux suprachiasmatiques : au cœur de la rythmicité circadienne
La recherche fondamentale sur les rythmes circadiens est l’une des plus avancée en biologie. Celle-ci est grandement facilitée par le fait que la plupart, si ce n’est la totalité, des rythmes circadiens de l’organisme des mammifères sont générés ou synchronisés par une région bien délimitée de l’hypothalamus, les noyaux suprachiasmatiques, qui contient environ 10 000 neurones. Une lésion de ces noyaux abolit toute rythmicité, et la transplantation de tissu hypothalamique fœtal chez les animaux lésés restaure les fluctuations circadiennes. Cela est en faveur du caractère nécessaire et suffisant des noyaux suprachiasmatiques dans la genèse des rythmes circadiens. De plus, une rythmicité circadienne a été mise en évidence dans des cultures de cellules isolées provenant du noyau suprachias- matique. Lorsque l’activité de plusieurs de ces neurones est enregistrée simultanément, on observe que chaque cellule présente une rythmicité circadienne témoignant de l’activité et de l’expression de certains gènes. Toutefois, la rythmicité circadienne existe aussi en dehors du système nerveux central, trouvée dans différents organes (cœur, rein, foie, testicule…) sous l’influence du noyau suprachiasmatique et d’autres signaux humoraux comme ceux dérivant de la prise alimentaire.
Rôle et interaction avec l’environnement
Alternance lumière-obscurité
L’implication de l’environnement et plus précisément de l’alternance lumière-obscurité dans la régulation de la rythmicité circadienne est bien connue avec un mécanisme d’action qui commence à être appréhendé. Il semble en effet que la lumière influe directement sur la protéine TIM via une phosphorylation, une ubiquitinisation et enfin une dégradation. Le turn-over lumière-dépendant de TIM est toutefois indirect et dépend de flavoprotéines photoréceptrices, les cryptochromes (CRY), la lumière associant les protéines CRY et TIM entre elles. L’activité transcriptionelle des gènes per et tim n’est pas modifiée par la lumière, cependant la formation du complexe protéique PER-TIM et sa translocation nucléaire sont affectées par l’alternance lumière-obscurité. Toutefois, la présence intermittente de lumière n’est pas indispensable pour la genèse d’une activité rythmique. La durée de formation du complexe PER-TIM une fois dans le noyau semble déterminée par deux processus endogènes différents : tout d’abord un phénomène d’autorégulation, et ensuite la présence de la protéine DOUBLE-TIME (DBT) dont le gène a été identifié par un des trois Prix Nobel (Michael Young). Cette protéine DBT se lie à PER pour la détruire, régulant ainsi son accumulation aussi bien dans le cytoplasme que dans le noyau.Deux homologues du gène cry, mcry1 et mcry2, ont été isolés chez les mammifères, avec une activité oscillatoire démontrée. Ces gènes semblent avoir une activité rythmique plus forte chez la souris que chez la drosophile, les souris knock-out de ces gènes ont une périodicité circadienne très altérée. Les protéines mCRY1 et 2 sont des inhibiteurs de la transcription de leurs propres gènes mcry1 et 2, mais aussi des gènes mPer1, 2 et 3 via le complexe protéique CLOCK-BMAL1. Un seul gène mtim a été isolé chez l’homme et la souris mais sa fonction, différente de son homologue tim chez la drosophile, reste inconnue. En effet, les souris knock-out de ce gène meurent à l’état embryonnaire, et aucune activité rythmique transcriptionnelle n’a donc pu être mise en évidence. La lumière ne semble exercer aucun effet sur la protéine mTIM et la translocation nucléaire de mPER dépendrait de l’hétérodimérisation entre les protéines mPER et mCRY et non mTIM. Le rôle de la protéine TIM chez la drosophile semble être l’équivalent de CRY chez les mammifères.
Rôle synchronisateUr de la rétine
Plus récemment, les cellules de la rétine responsables de la détection de l’intensité lumineuse ont été identifiées : ce ne sont ni les cônes ni les bâtonnets, mais certaines cellules ganglionnaires produisant de la mélanopsine. Ces cellules envoient des informations aux noyaux suprachiasmatiques, ce qui permet la synchronisation avec l’environnement. En effet, la période de l’horloge biologique étant de plus ou moins 24 heures, l’horloge centrale a tendance à se décaler spontanément. Les informations lumineuses permettent justement de la régler précisément sur 24 heures quotidiennement.
Des mécanismes de régulation de plus en plus complexes
Chez le mammifère, CLOCK et BMAL1 s’hétérodimérisent et initient la transcription des gènes cibles, per1 et per2, et cry1 et cry2. L’autorégulation négative est réalisée par les hétérodimères PER:CRY. Trans- loqués dans le noyau, ils répriment leur propre transcription en agissant sur le complexe protéique CLOCK:BMAL1. Pour compliquer ce système, une autre boucle d’autorégulation dite secondaire fait intervenir des facteurs de transcription appartenant à la famille des récepteurs nucléaires orphelins apparentés au récepteur des rétinoïdes, REV-ERBα et RORα. Cette boucle stabilise les oscillations circadiennes en modulant la transcription de BMAL1, le rythme circadien de BMAL1 étant à la fois négativement et positivement contrôlé par les récepteurs REV-ERB et ROR. D’autres molécules intervenant dans la régulation de la rythmicité circadienne viennent s’ajouter aux acteurs principaux et secondaires évoqués ci-dessus. Ainsi, les protéines CK1ε (caséine kinase 1ε) et CK1δ agissent au niveau post-traductionnel en phosphorylant PER1 et PER2 et contribuent à l’ajustement de l’horloge circadienne chez les mammifères. Une dizaine de « gènes-horloge » ont été découverts chez les mammifères à ce jour. Ensemble, ils réguleraient entre 10 et 20 % de l’ensemble du génome.
Implication dans la physiologie humaine et perspectives
Les travaux sur la chronobiologie ont ouvert les portes d’un monde fascinant dont l’exploration peut déboucher sur une meilleure compréhension de la physiologie humaine, son intégration et sa synchronisation, mais aussi de certaines pathologies et de nouvelles voies thérapeutiques (synchronisateurs, agonistes de la mélatonine…).
Quelle que soit l’espèce étudiée, drosophile ou souris, les gènes per et clock sont au centre de la machinerie cellulaire pour produire la rythmicité de 24 heures au sein des noyaux suprachiasmatiques. Toutefois, d’autres boucles de régulation interviennent, avec la mise en évidence de plusieurs facteurs de transcription qui exercent un lien entre les différentes composantes de cette machinerie cellulaire, et leur relation avec l’environnement influençant au final la durée de la période circadienne. La synchronisation avec notre environnement est essentielle, notre horloge centrale commandant de nombreuses fonctions physiologiques comme le sommeil, la température corporelle, la pression artérielle, le rythme cardiaque, la pro- duction de certaines hormones, l’appétit, l’humeur, le système immunitaire…
L’ensemble de ces connaissances concernant les bases moléculaires du système circadien permettent de rechercher des gènes à l’origine d’une dysrégulation de ces rythmes biologiques, notamment des troubles du sommeil et des rythmes circadiens, mais aussi de préciser les associations entre gènes cibles et phénotypes de sommeil (longs et courts dormeurs, insomniaques…) et circadiens (sujets du soir ou du matin, maladaptation aux horaires décalés) chez des sujets sains ou chez des sujets non voyants. Les troubles des rythmes biologiques pourraient aussi engendrer des dérèglements métaboliques, des troubles cardiovasculaires, gastro-intestinaux, psychiques, voire certains risques de cancer.
Quelle que soit l’espèce étudiée, drosophile ou souris, les gènes per et clock sont au centre de la machinerie cellulaire pour produire la rythmicité de 24 heures au sein des noyaux suprachiasmatiques. Toutefois, d’autres boucles de régulation interviennent, avec la mise en évidence de plusieurs facteurs de transcription qui exercent un lien entre les différentes composantes de cette machinerie cellulaire, et leur relation avec l’environnement influençant au final la durée de la période circadienne. La synchronisation avec notre environnement est essentielle, notre horloge centrale commandant de nombreuses fonctions physiologiques comme le sommeil, la température corporelle, la pression artérielle, le rythme cardiaque, la pro- duction de certaines hormones, l’appétit, l’humeur, le système immunitaire…
L’ensemble de ces connaissances concernant les bases moléculaires du système circadien permettent de rechercher des gènes à l’origine d’une dysrégulation de ces rythmes biologiques, notamment des troubles du sommeil et des rythmes circadiens, mais aussi de préciser les associations entre gènes cibles et phénotypes de sommeil (longs et courts dormeurs, insomniaques…) et circadiens (sujets du soir ou du matin, maladaptation aux horaires décalés) chez des sujets sains ou chez des sujets non voyants. Les troubles des rythmes biologiques pourraient aussi engendrer des dérèglements métaboliques, des troubles cardiovasculaires, gastro-intestinaux, psychiques, voire certains risques de cancer.
Références
1. Zehring WA, Wheeler DA, Reddy P, et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell 1984;39:369-76.
2. Hardin PE, Hall JC, Rosbash M. Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 1990;343:536-40.
3. Liu X, Zwiebel LJ, Hinton D, Benzer S, Hall JC, Rosbash M. The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 1992;12:2735-44.
4. Bargiello TA, Jackson FR, Young MW. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 1984;312:2752-4.
5. Price JL, Blau J, Rothenfluh A, Abodeely M, Kloss B, Young MW. double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation. Cell 1998;94:83-95.
6. Vosshall LB, Price JL, Sehgal A, Saez L, Young MW. Block in nuclear localization of period protein by a second clock mutation, timeless. Science 1994;263:1606-9.
7. Dauvilliers Y, Maret S, Tafti M. Genetics of normal and pathological sleep in humans. Sleep Med Rev 2005;9:91-100.
8. Quera Salva MA, Hartley S, Léger D, Dauvilliers Y. Non-24-hour sleep–wake rhythm disorder in the totally blind: diagnosis and management. Front Neurol, 18 December 2017 (Epub)
2. Hardin PE, Hall JC, Rosbash M. Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 1990;343:536-40.
3. Liu X, Zwiebel LJ, Hinton D, Benzer S, Hall JC, Rosbash M. The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 1992;12:2735-44.
4. Bargiello TA, Jackson FR, Young MW. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 1984;312:2752-4.
5. Price JL, Blau J, Rothenfluh A, Abodeely M, Kloss B, Young MW. double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation. Cell 1998;94:83-95.
6. Vosshall LB, Price JL, Sehgal A, Saez L, Young MW. Block in nuclear localization of period protein by a second clock mutation, timeless. Science 1994;263:1606-9.
7. Dauvilliers Y, Maret S, Tafti M. Genetics of normal and pathological sleep in humans. Sleep Med Rev 2005;9:91-100.
8. Quera Salva MA, Hartley S, Léger D, Dauvilliers Y. Non-24-hour sleep–wake rhythm disorder in the totally blind: diagnosis and management. Front Neurol, 18 December 2017 (Epub)