Observation. Madame B, âgée de 40 ans, originaire d’Afrique subsaharienne, se présentait aux urgences en mai 2017 pour une dyspnée de stade NYHA III (classification de la New York Heart Association) et une toux nocturne. Elle avait comme antécédents un carcinome canalaire infiltrant mammaire gauche de grade III et une hypertension artérielle essentielle connue depuis plusieurs années sans traitement. Le cancer du sein découvert en octobre 2016 avait d’abord été traité par 4 cycles de chimiothérapie débutés en décembre 2016 associant épirubicine (anthracycline) à 75 mg/m² (dose totale cumulée de 300 mg/m²) et cyclophosphamide à 750 mg/m², puis 12 injections de paclitaxel (taxane). La patiente avait reçu une injection de 8 mg/kg de trastuzumab en février, et en avril elle avait eu une mastectomie avec curage ganglionnaire gauche.
Quelles sont les hypothèses diagnostiques à ce stade ?
Plusieurs diagnostics sont à évoquer devant ce tableau de dyspnée. Tout d’abord, des causes cardiaques :
– un œdème pulmonaire cardiogénique en rapport soit avec une cardiopathie hypertensive (hypertension artérielle déséquilibrée par la chimiothérapie), soit avec une cardiopathie toxique (anthracyclines et/ou trastuzumab) ;
– une embolie pulmonaire dans un contexte de cancer augmentant le risque thromboembolique.
Ensuite, des causes pulmonaires, parmi lesquelles :
– une pneumopathie infectieuse dans un contexte d’immunodé- pression induite par les chimiothérapies ;
– un épanchement pleural métas- tatique, voire une lymphangite carcinomateuse ;
– une atteinte pulmonaire toxique liée aux chimiothérapies de type pneumopathie interstitielle diffuse.
On peut également penser à une anémie sévère pouvant entraîner un retentissement fonctionnel à type de dyspnée. Les premiers examens à réaliser sont donc : un hémogramme, un ionogramme sanguin, le dosage des biomarqueurs cardiaques (BNP et troponines), de la protéine C-réactive, des D-dimères, une radiographie de thorax, voire une angiotomodensitométrie (angio-TDM) thoracique.
– un œdème pulmonaire cardiogénique en rapport soit avec une cardiopathie hypertensive (hypertension artérielle déséquilibrée par la chimiothérapie), soit avec une cardiopathie toxique (anthracyclines et/ou trastuzumab) ;
– une embolie pulmonaire dans un contexte de cancer augmentant le risque thromboembolique.
Ensuite, des causes pulmonaires, parmi lesquelles :
– une pneumopathie infectieuse dans un contexte d’immunodé- pression induite par les chimiothérapies ;
– un épanchement pleural métas- tatique, voire une lymphangite carcinomateuse ;
– une atteinte pulmonaire toxique liée aux chimiothérapies de type pneumopathie interstitielle diffuse.
On peut également penser à une anémie sévère pouvant entraîner un retentissement fonctionnel à type de dyspnée. Les premiers examens à réaliser sont donc : un hémogramme, un ionogramme sanguin, le dosage des biomarqueurs cardiaques (BNP et troponines), de la protéine C-réactive, des D-dimères, une radiographie de thorax, voire une angiotomodensitométrie (angio-TDM) thoracique.
Pourquoi le trastuzumab est-il potentiellement cardiotoxique ?
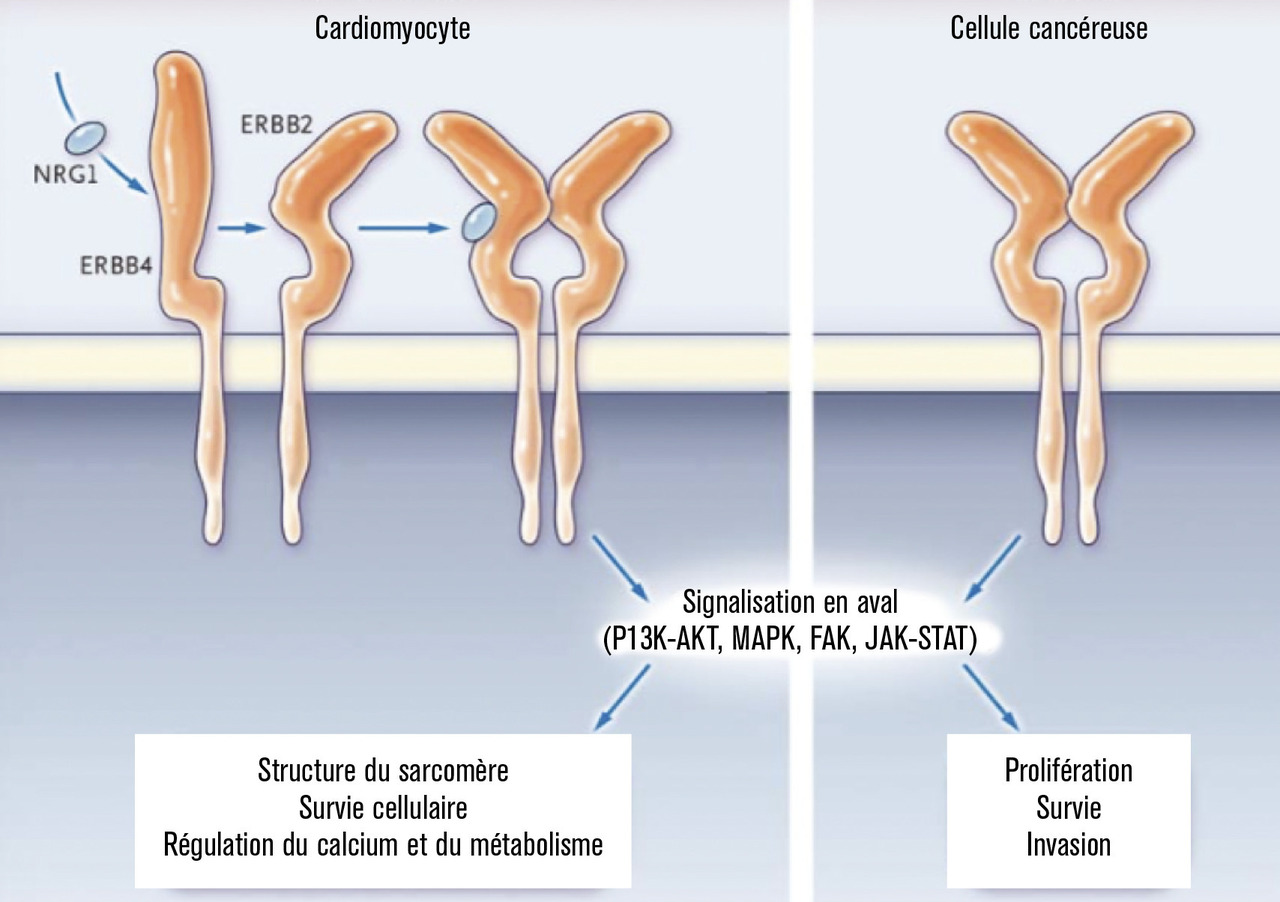
Le trastuzumab est une thérapie ciblée. Cet anticorps monoclonal humanisé anti-HER2 est utilisé dans les cancers du sein surexprimant HER2 ; il a permis d’améliorer le pronostic en association aux chimiothérapies.1 L’inhibition de l’activité ligand/récepteur HER2 bloque la phosphorylation de kinases intracellulaires qui sont des régulateurs de la survie du cardiomyocyte (fig. 1 ).2
Quel outil utiliser pour évaluer la fonction ventriculaire gauche ?
Lors du bilan préthérapeutique (octobre 2016) réalisé avant sa chimiothérapie, une ventriculographie isotopique avait montré chez cette patiente une fraction d’éjection du ventricule gauche (FEVG) à 76 %.
Cette méthode d’évaluation de la fonction ventriculaire gauche est validée selon les recommandations européennes.3 Ses avantages sont sa précision et sa reproductibilité. Cependant, elle augmente l’irradiation et ne permet pas l’analyse structurelle cardiaque (tableau ).
Cette méthode d’évaluation de la fonction ventriculaire gauche est validée selon les recommandations européennes.3 Ses avantages sont sa précision et sa reproductibilité. Cependant, elle augmente l’irradiation et ne permet pas l’analyse structurelle cardiaque (
Fallait-il prescrire un traitement cardio- protecteur chez cette patiente hypertendue qui allait bénéficier d’un traitement par anthracyclines et trastuzumab ?
Il est très important de dépister et de traiter les facteurs de risque cardiovasculaires préexistants. En effet, de nombreuses études révèlent que les facteurs de risque (hyper- tension artérielle, dyslipidémie, diabète, tabagisme) augmentent le risque de cardiotoxicité.3 Si la dose d’anthracyclines dépasse les 300 mg/m² (équivalent doxorubicine), on peut envisager un traitement cardioprotecteur4, mais il n’y a pas, à ce jour, de recommandations claires. L’étude récente PRADA5 comparant le métoprolol (bêtaloquant) au candésartan (antagoniste des récepteurs de l’angiotensine) et à l’association métoprolol-can- désartan pour la prévention de la diminution de la FEVG dans une population atteinte d’un cancer du sein ne montre pas de bénéfice du métoprolol seul et un bénéfice très modéré du candésartan sur le déclin de la FEVG.
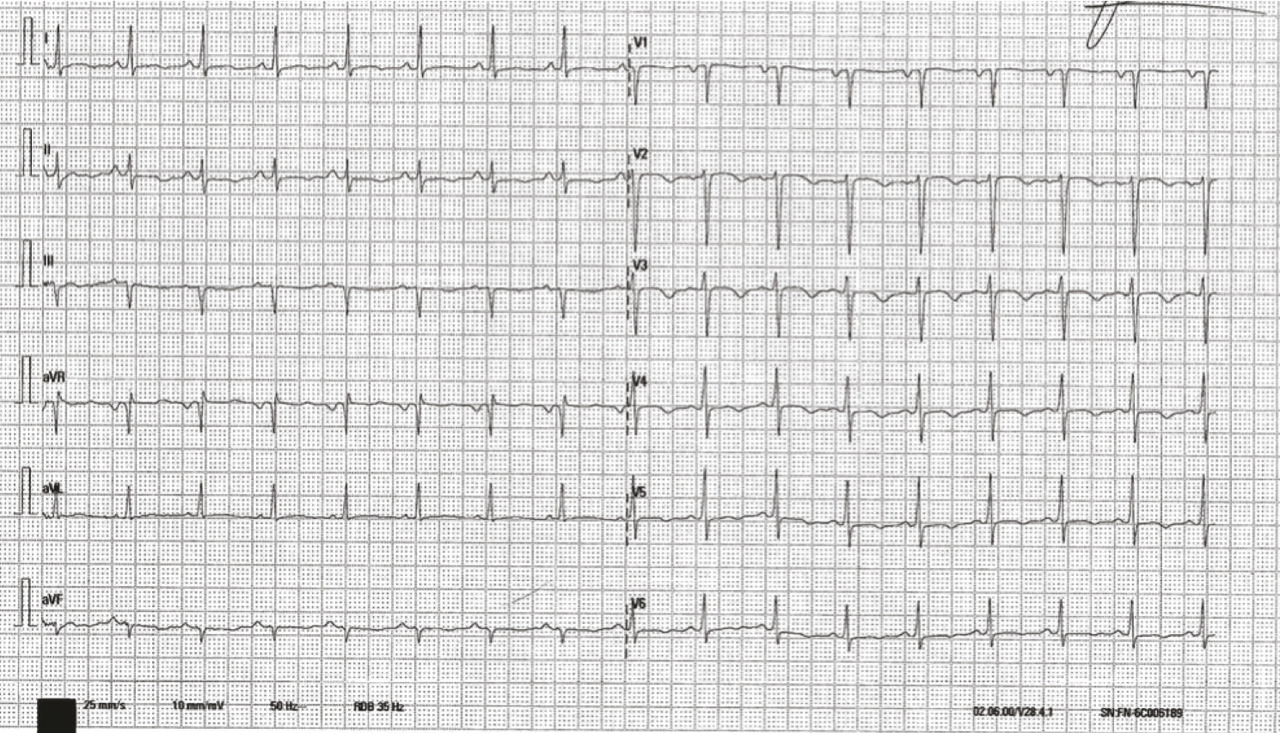
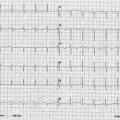
La patiente était adressée en cardiologie. Dans le contexte de son antécédent de cancer, d’une dyspnée aiguë et d’une élévation des D-dimères (3 120 ng/L), une angio-tomodensitométrie thoracique avait été prescrite, qui n’avait pas montré d’embolie pulmonaire mais des opacités bilatérales pseudo-nodulaires compatibles avec une surcharge vasculaire. À son arrivée, la patiente était cliniquement stable. Sa pression artérielle était mesurée à 116/94 mmHg, sa fréquence cardiaque à 100 batt/min, une saturation à 99 % sous 2 L d’O2, sa température était mesurée à 37,1 °C. L’électrocardiogramme (ECG) [fig. 2 ] montrait des ondes T négatives dans le précordium.
Les résultats des examens biologiques étaient les suivants : hémoglobine 12 g/dL ; leucocytes 5,6 x 109/L, plaquettes 203 x 109/L ; Na+ 137 mmol/L ; K+ 3,6 mmol/L ; créatinine 95 µmol/L ; aspartate aminotransférase 78 (N < 34) ; alanine aminotransférase 169 (N < 50) ; phosphatases alcalines 124 (N < 115) ; gamma glutamyltransférase 208 (N < 36) ; cytolyse à 2-3 N et cholestase à 3N ; troponine Ic HS 55,4 ng/L ; et peptide natriurétique de type B (BNP) 781 ng/L. L’écho- cardiographie révélait une FEVG très altérée à 20 %, une hypokinésie globale, un ventricule gauche non dilaté, un débit cardiaque abaissé à 1,9 L/min/m², une élévation des pressions de remplissage, l’absence de valvulopathie et une pression artérielle pulmonaire systolique (PAPs) à 25 mmHg.
La patiente était adressée en cardiologie. Dans le contexte de son antécédent de cancer, d’une dyspnée aiguë et d’une élévation des D-dimères (3 120 ng/L), une angio-tomodensitométrie thoracique avait été prescrite, qui n’avait pas montré d’embolie pulmonaire mais des opacités bilatérales pseudo-nodulaires compatibles avec une surcharge vasculaire. À son arrivée, la patiente était cliniquement stable. Sa pression artérielle était mesurée à 116/94 mmHg, sa fréquence cardiaque à 100 batt/min, une saturation à 99 % sous 2 L d’O2, sa température était mesurée à 37,1 °C. L’électrocardiogramme (ECG) [
Les résultats des examens biologiques étaient les suivants : hémoglobine 12 g/dL ; leucocytes 5,6 x 109/L, plaquettes 203 x 109/L ; Na+ 137 mmol/L ; K+ 3,6 mmol/L ; créatinine 95 µmol/L ; aspartate aminotransférase 78 (N < 34) ; alanine aminotransférase 169 (N < 50) ; phosphatases alcalines 124 (N < 115) ; gamma glutamyltransférase 208 (N < 36) ; cytolyse à 2-3 N et cholestase à 3N ; troponine Ic HS 55,4 ng/L ; et peptide natriurétique de type B (BNP) 781 ng/L. L’écho- cardiographie révélait une FEVG très altérée à 20 %, une hypokinésie globale, un ventricule gauche non dilaté, un débit cardiaque abaissé à 1,9 L/min/m², une élévation des pressions de remplissage, l’absence de valvulopathie et une pression artérielle pulmonaire systolique (PAPs) à 25 mmHg.
Quel est le diagnostic ?
Il s’agit très vraisemblablement d’une cardiotoxicité liée au tras- tuzumab. En effet, l’imputabilité intrinsèque est compatible (délai temporel et sémiologie) ; la dysfonction ventriculaire gauche apparaît 3 mois après le début du traitement chez une patiente encore sous thérapie anti-HER2, et le diagnostic de cardiotoxicité est d’autant plus probable que la fonction cardiaque était normale avant le début du traitement (FEVG > 70 % en ventriculographie isotopique).
Que disent les recommandations sur le traitement d’une insuffisance cardiaque symptomatique dans le cadre d’une cardiotoxicité associée au trastuzumab ?
Selon l’Institut national de recherche sur le cancer :6
– si la FEVG est inférieure à 45 % ou chute de plus de 10 % par rapport à la FEVG de base, avec une FEVG entre 45 et 49 %, il est recommandé d’arrêter l’anti-HER2 et d’introduire un traitement par inhibiteur de l’enzyme de conversion. On peut dans ce cas réintroduire le traitement lors- que la FEVG est supérieure à 49 % ;
– si la FEVG est comprise entre 44 et 50 %, la thérapie anti-HER2 peut être poursuivie en introduisant un inhibiteur de l’enzyme de conversion.
Devant un épisode de décompensation cardiaque à prédominance gauche révélant une dysfonction ventriculaire gauche sévère, nous avions décidé d’introduire un traitement associant un inhibiteur de l’enzyme de conversion (ramipril), un bêtabloquant (bisoprolol) et un antialdostérone (spironolactone) selon les recommandations de l’European Society of Cardiology sur l’insuffisance cardiaque.7
Après discussion avec les oncologues, le traitement par anti-HER2 avait été arrêté du fait de la dysfonction ventriculaire gauche très sévère, symptomatique, avec risque de mort subite par défaillance hémodynamique ou trouble du rythme.
Nous avions également proposé une réadaptation cardiaque à la patiente. En effet, le rôle du réentraînement physique semble particulièrement bénéfique dans l’insuffisance cardiaque induite par des thérapies anticancéreuses.8
– si la FEVG est inférieure à 45 % ou chute de plus de 10 % par rapport à la FEVG de base, avec une FEVG entre 45 et 49 %, il est recommandé d’arrêter l’anti-HER2 et d’introduire un traitement par inhibiteur de l’enzyme de conversion. On peut dans ce cas réintroduire le traitement lors- que la FEVG est supérieure à 49 % ;
– si la FEVG est comprise entre 44 et 50 %, la thérapie anti-HER2 peut être poursuivie en introduisant un inhibiteur de l’enzyme de conversion.
Devant un épisode de décompensation cardiaque à prédominance gauche révélant une dysfonction ventriculaire gauche sévère, nous avions décidé d’introduire un traitement associant un inhibiteur de l’enzyme de conversion (ramipril), un bêtabloquant (bisoprolol) et un antialdostérone (spironolactone) selon les recommandations de l’European Society of Cardiology sur l’insuffisance cardiaque.7
Après discussion avec les oncologues, le traitement par anti-HER2 avait été arrêté du fait de la dysfonction ventriculaire gauche très sévère, symptomatique, avec risque de mort subite par défaillance hémodynamique ou trouble du rythme.
Nous avions également proposé une réadaptation cardiaque à la patiente. En effet, le rôle du réentraînement physique semble particulièrement bénéfique dans l’insuffisance cardiaque induite par des thérapies anticancéreuses.8
En pratique clinique, comment éliminer une autre cause de dysfonction ventriculaire gauche ?
Les patients qui développent une cardiotoxicité ont également souvent des facteurs de risque cardiovasculaires (hypertension artérielle, diabète type 2, dyslipidémie). Il ne faut jamais perdre de vue que la première cause de dysfonction ventriculaire gauche reste la maladie coronarien. Il faut donc savoir l’éliminer.
Nous avions réalisé chez cette patiente une tomodensitométrie coronarienne montrant un score calcique coronaire d’Agatston mesuré à 0. Les artères coronaires étaient bien visualisées, et aucune sténose n’était notée.
Il n’y a pas de recommandations précises à ce jour sur l’examen à réaliser dans ce contexte (tomodensitométrie coronarienne, imagerie par résonance magnétique (IRM) cardiaque ou coronarographie).
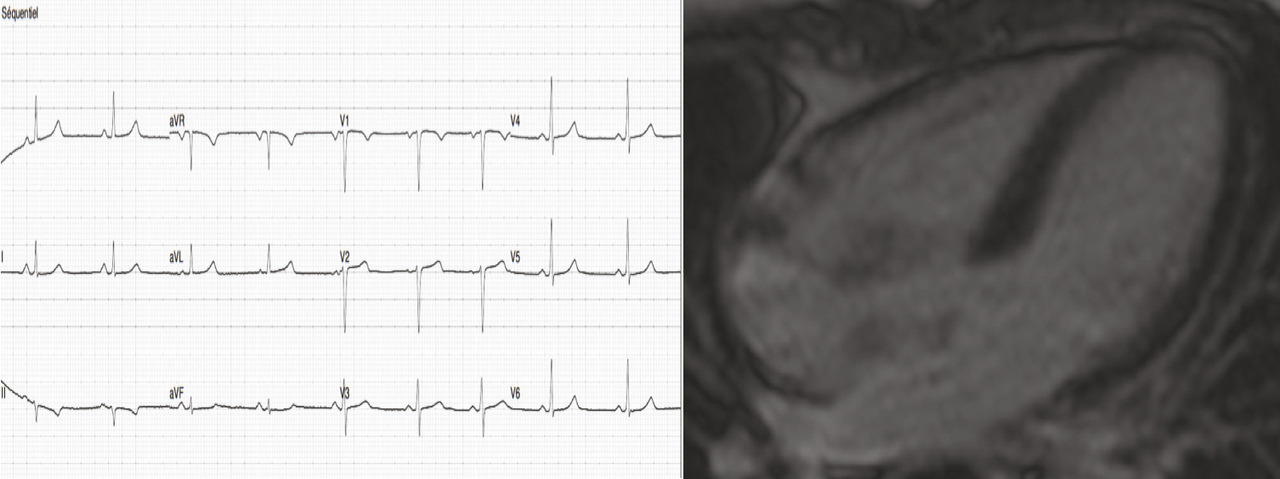
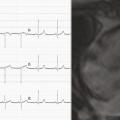
En juillet 2017, la patiente était revue en consultation de cardio- logie. Sa pression artérielle était mesurée à 100/68 mmHg, sa fréquence cardiaque à 54 batt/min, l’ECG s’était normalisé (fig. 3 ). Son traitement avait été majoré quelques semaines après sa sortie d’hospitalisation en cardio- logie, comprenant actuellement : bisoprolol 7,5 mg/j, ramipril 10 mg/j et spironolactone 25 mg/j.
L’échocardiographie montrait une amélioration de la FEVG à 42 %, le ventricule gauche n’était pas dilaté, la fonction ventriculaire droite était normale et la PAPs à 26 mmHg.
Après une réévaluation, les oncologues et les radiothé- rapeutes préconisaient une irradiation de la paroi thoracique gauche jusqu’en sus- claviculaire à une dose totale de 41,6 grays. L’amélioration de la FEVG rendait possible la radiothérapie pour cette tumeur de stade T4b.
La patiente était revue en consultation de cardiologie en septembre 2017 : sa pression artérielle était de 125/84 mmHg, sa fréquence cardiaque était mesurée à 86 batt/min, le BNP était à 35 ng/L, l’ECG était normal. L’échographie cardiaque montrait une FEVG à 52 % et un ventricule gauche non dilaté. L’IRM cardiaque montrait un ventricule gauche non dilaté, une FEVG à 56 %, sans réhaussement tardif ni séquelle d’infarctus. On maintenait le traitement par ramipril 10 mg et bisoprolol 7,5 mg. La spironolactone et le furosémide étaient arrêtés.
Nous avions réalisé chez cette patiente une tomodensitométrie coronarienne montrant un score calcique coronaire d’Agatston mesuré à 0. Les artères coronaires étaient bien visualisées, et aucune sténose n’était notée.
Il n’y a pas de recommandations précises à ce jour sur l’examen à réaliser dans ce contexte (tomodensitométrie coronarienne, imagerie par résonance magnétique (IRM) cardiaque ou coronarographie).
En juillet 2017, la patiente était revue en consultation de cardio- logie. Sa pression artérielle était mesurée à 100/68 mmHg, sa fréquence cardiaque à 54 batt/min, l’ECG s’était normalisé (
L’échocardiographie montrait une amélioration de la FEVG à 42 %, le ventricule gauche n’était pas dilaté, la fonction ventriculaire droite était normale et la PAPs à 26 mmHg.
Après une réévaluation, les oncologues et les radiothé- rapeutes préconisaient une irradiation de la paroi thoracique gauche jusqu’en sus- claviculaire à une dose totale de 41,6 grays. L’amélioration de la FEVG rendait possible la radiothérapie pour cette tumeur de stade T4b.
La patiente était revue en consultation de cardiologie en septembre 2017 : sa pression artérielle était de 125/84 mmHg, sa fréquence cardiaque était mesurée à 86 batt/min, le BNP était à 35 ng/L, l’ECG était normal. L’échographie cardiaque montrait une FEVG à 52 % et un ventricule gauche non dilaté. L’IRM cardiaque montrait un ventricule gauche non dilaté, une FEVG à 56 %, sans réhaussement tardif ni séquelle d’infarctus. On maintenait le traitement par ramipril 10 mg et bisoprolol 7,5 mg. La spironolactone et le furosémide étaient arrêtés.
Quel doit être le suivi ?
Le suivi doit avoir lieu tous les 3 mois pendant l’administration du trastuzumab et 3 mois après la fin du traitement. Il comprend un examen clinique et une évaluation de la FEVG. Le dosage de troponine à chaque cycle pourrait permettre d’identifier plus précocement une dysfonction ventriculaire gauche.9
Le trastuzumab en association aux anthracyclines améliore le pronostic des patientes ayant un cancer du sein surexprimant HER2. Toutefois, le taux de dysfonction ventriculaire gauche lorsque anthracyclines et trastuzumab sont associés peut atteindre 20 %.10 L’un des arguments diagnostiques d’une cardiotoxicité au trastuzumab est la réversibilité de la dysfonction à l’arrêt du traitement.11 En effet, à la différence des anthracyclines, les thérapies anti-HER2 induisent des modifications structurelles et fonctionnelles des protéines contractiles cardiaques, mais il n’y a pas de mort cellulaire. Les principaux facteurs de risque de cardiotoxicité en cas d’administration de trastuzumab sont la prescription concomitante d’anthracyclines, l’hypertension artérielle, la dimi- nution préalable de la FEVG et l’âge élevé de la patiente.12
Le trastuzumab en association aux anthracyclines améliore le pronostic des patientes ayant un cancer du sein surexprimant HER2. Toutefois, le taux de dysfonction ventriculaire gauche lorsque anthracyclines et trastuzumab sont associés peut atteindre 20 %.10 L’un des arguments diagnostiques d’une cardiotoxicité au trastuzumab est la réversibilité de la dysfonction à l’arrêt du traitement.11 En effet, à la différence des anthracyclines, les thérapies anti-HER2 induisent des modifications structurelles et fonctionnelles des protéines contractiles cardiaques, mais il n’y a pas de mort cellulaire. Les principaux facteurs de risque de cardiotoxicité en cas d’administration de trastuzumab sont la prescription concomitante d’anthracyclines, l’hypertension artérielle, la dimi- nution préalable de la FEVG et l’âge élevé de la patiente.12
Dans cet article
- Quelles sont les hypothèses diagnostiques à ce stade ?
- Pourquoi le trastuzumab est-il potentiellement cardiotoxique ?
- Quel outil utiliser pour évaluer la fonction ventriculaire gauche ?
- Fallait-il prescrire un traitement cardio- protecteur chez cette patiente hypertendue qui allait bénéficier d’un traitement par anthracyclines et trastuzumab ?
- Quel est le diagnostic ?
- Que disent les recommandations sur le traitement d’une insuffisance cardiaque symptomatique dans le cadre d’une cardiotoxicité associée au trastuzumab ?
- En pratique clinique, comment éliminer une autre cause de dysfonction ventriculaire gauche ?
- Quel doit être le suivi ?