Diagnostiquer une insuffisance mitrale, un rétrécissement aortique, une insuffisance aortique. Argumenter l'attitude thérapeutique et planifier le suivi du patient. Connaître les principes de suivi des patients avec prothèses valvulaires.
Le
Rétrécissement aortique
Définition
Étiologie
Acquise
Dégénérative, ou maladie de Mönckeberg. C’est la cause la plus fréquente. On la retrouve chez les sujets âgés, généralement de plus de 70 ans. Elle correspond à la calcification progressive de la valve, en lien avec le temps, qui devient donc trop rigide pour bien s’ouvrir.Post-rhumatismale : cette cause est dorénavant plus rare, en particulier en France. S’y associe souvent alors une autre valvulopathie de même origine. La lésion typique est une fusion des commissures associée à une rétraction.
Autres causes : plus rares. Le rétrécissement aortique lié à la maladie de Paget ou l’atteinte de la polyarthrite rhumatoïde est anecdotique.
Congénitale
La valve aortique est normalement formée de 3 sigmoïdes (appelées aussi feuillets ou « cusp ») et 3 commissures. Parfois, il peut exister une anomalie malformative de la valve qui va précipiter vers une dégénérescence accélérée de celle-ci et entraîner ainsi un rétrécissement aortique (et parfois une insuffisance aortique) à un âge plus jeune. Il peut s’agir d’une bicuspidie (cause la plus fréquente de RAo entre 30 et 65 ans et touchant environ 1 % de la population générale), d’une unicuspidie (très rare), ou d’une quadricuspidie. La malformation peut rester silencieuse pendant de longues années et n’être dépistée que par une imagerie. À noter qu’il existe un caractère héréditaire à cette malformation, et la découverte chez un cas doit conduire au dépistage chez les apparentés du premier degré. Une anomalie de l’aorte ascendante (anévrisme, coarctation) devra toujours être recherchée car souvent associée.Physiopathologie
Retentissement en amont du rétrécissement aortique
Du fait de l’obstacle que constitue la valve aortique, la pression dans le ventricule gauche tout au long de la systole augmente de façon importante et devient très supérieure à celle dans l’aorte ascendante. Cette différence de pression représente ce que l’on appelle le gradient de pression transvalvulaire entre le ventricule gauche et l’aorte. En l’absence de rétrécissement aortique, ce gradient est négligeable, de l’ordre de 2 à 5 mmHg. Plus la valve aortique impose une résistance à l’éjection, c’est-à-dire plus la sténose est serrée, plus le gradient transvalvulaire augmente et plus la vitesse maximale du sang à travers la valve (Vmax) augmente. Ainsi, les contraintes exercées sur les parois du ventricule gauche à l’éjection augmentent, il s’agit d’une augmentation de la post-charge. Les pressions dans le ventricule gauche augmentent, les parois vont alors s’hypertrophier en compensation. L’hypertrophie pariétale concentrique (c’est-à-dire aux dépens de la cavité) compense l’élévation des pressions et normalise ainsi les contraintes pariétales. C’est pourquoi les performances systoliques du ventricule gauche sont longtemps conservées (fraction d’éjection du ventricule gauche [FEVG] longtemps préservée). En revanche, l’hypertrophie pariétale va entraîner un trouble de relaxation et de compliance (élasticité) du ventricule gauche, générant ainsi une anomalie du remplissage. Il s’agit d’une dysfonction diastolique. Cette hypertrophie du ventricule gauche peut donc être à l’origine d’une insuffisance cardiaque (dyspnée, œdème pulmonaire) par augmentation des pressions de remplissage mais aussi d’une ischémie myocardique (angor d’effort) par augmentation des besoins en oxygène du myocarde et diminution de la réserve coronaire (anomalie de la microcirculation) même en l’absence de lésion sténosante coronaire associée. Très tardivement, les fibres myocardiques hypertrophiées dégénèrent, fibrosent, et la FEVG sera alors elle aussi altérée. Les anomalies myocardiques peuvent être à l’origine de troubles du rythme ventriculaire et supraventriculaire.Retentissement en aval du rétrécissement aortique
En cas de rétrécissement aortique serré, le débit sanguin cérébral peut diminuer à l’effort en raison de l’augmentation des besoins en oxygène des muscles périphériques. Cette anomalie peut être responsable de syncopes ou de lipothymies à l’effort. Enfin, dans de rares cas, des embolies calcaires peuvent survenir.Complications du rétrécissement aortique
Les complications possibles de cette valvulopathie sont donc :- l’insuffisance cardiaque ;
- la mort subite par troubles du rythme ventriculaire ;
- les troubles du rythme supraventriculaire ;
- les embolies systémiques ;
- les endocardites infectieuses.
Diagnostic clinique
Signes fonctionnels
Le rétrécissement aortique peut rester longtemps asymptomatique et être découvert à l’occasion de l’auscultation d’un souffle cardiaque. Ce n’est que lorsqu’il atteint le stade de sténose serrée que les symptômes apparaissent.Les symptômes s’expriment avant tout à l’effort. Ainsi on peut constater alors une dyspnée, un angor et/ou des syncopes ou lipothymies à l’effort.
Dès l’apparition des symptômes, le pronostic vital du patient est mauvais, faisant discuter le remplacement valvulaire. Ainsi, en moyenne le décès survient dans les 5 ans après angor, dans les 3 ans après syncope et dans les 6 mois en cas d’insuffisance cardiaque, indiquant ainsi une prise en charge rapide. Le rétrécissement aortique peut aussi se manifester par une mort subite.
Signes physiques
Ce sont :- le souffle mésosystolique, de timbre rude et râpeux, maximum au foyer aortique (2e espace intercostal droit), irradiant vers les carotides ;
- l’abolition du B2 en cas de rétrécissement aortique serré. En effet, la valve est si rigide qu’on n’entend plus son bruit de fermeture ;
- le frémissement à la palpation du foyer aortique avec le plat de la main témoignant d’un rétrécissement aortique très serré ;
- les signes d’insuffisance cardiaque dans les formes avancées.
Présentations atypiques
On note :- les embolies systémiques calcaires sur calcification massives de la valve aortique sont très rares, ainsi que les troubles de la conduction atrioventriculaire (par atteinte des voies de conduction par la calcification) ;
- un passage en fibrillation atriale est en général mal toléré par perte de la systole atriale ;
- parfois, un rétrécissement aortique peut être découvert dans un bilan d’anémie. En effet, le syndrome de Heyde associe rétrécissement aortique serré et saignements digestifs par angiodysplasies, le plus souvent coliques. Ces saignements sont aussi favorisés par une détérioration fonctionnelle du facteur de von Willebrand lors du passage à travers le rétrécissement aortique. La correction du rétrécissement aortique peut alors faire régresser les saignements.
Diagnostic paraclinique
Électrocardiogramme (ECG)
L’ECG peut rester longtemps sans anomalie.À un stade évolué, quand il existe un retentissement ventriculaire gauche, on peut retrouver une surcharge ventriculaire gauche (augmentation de l’indice de Sokolow) de type systolique (négativation des ondes T en V5, V6), voire une surcharge de l’oreillette gauche.
Les troubles de la conduction atrioventriculaire en lien avec des calcifications de la valve aortique vers les voies nodales sont possibles mais rares.
Des troubles du rythme supraventriculaire et ventriculaire peuvent être observés.
Radiographie du thorax
Elle est le plus souvent sans anomalie, en dehors des complications telles que l’œdème pulmonaire. On peut voir parfois les calcifications de la valve aortique ou du bouton aortique lorsqu’elles sont importantes. Lors d’un rétrécissement aortique très évolué, avec dilatation ventriculaire gauche (rare), il peut exister un élargissement de la silhouette cardiaque aux dépens de l’arc inférieur gauche.Échographie-Doppler cardiaque transthoracique (ETT)
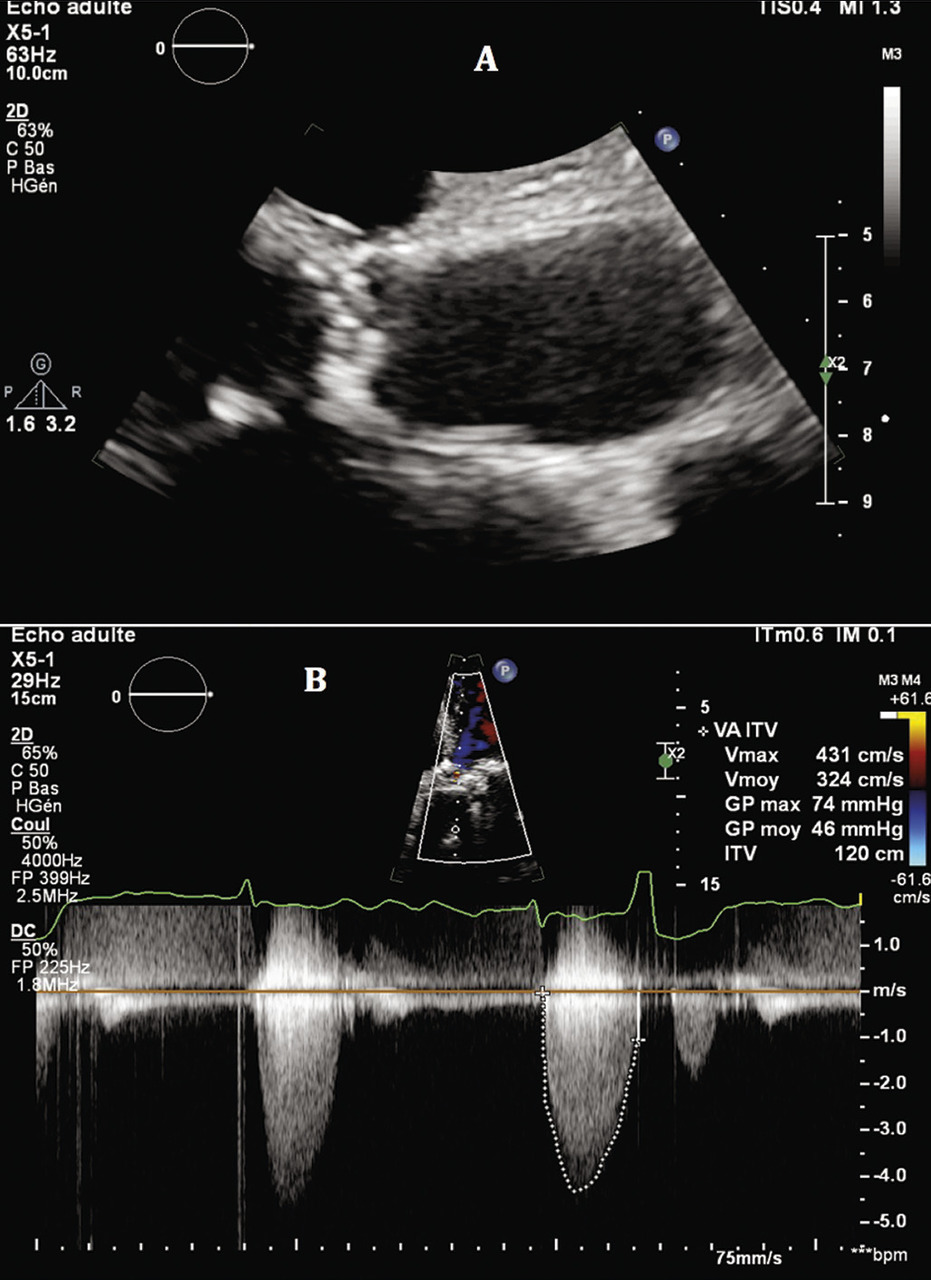
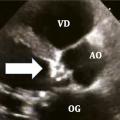
L’ETT est l’examen clé pour le diagnostic des valvulopathies.Diagnostic positif : on observe une valve aortique calcifiée dont l’ouverture est limitée, avec une accélération des flux en Doppler couleur (aliasing). Les vitesses sanguines à travers la valve sont augmentées (Vmax > 2,5 m/s) en Doppler continu (
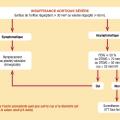
Diagnostic de sévérité, quantification : un rétrécissement aortique est considéré comme serré, en présence d’un des critères suivants :
- Vmax ≥ 4 m/s (extrême si > 5,5 m/s) ;
- ou gradient moyen transvalvulaire ≥ 40 mmHg ;
- ou surface valvulaire aortique ≤ 0,6 cm2/m2 (ou < 1 cm2, mais la valeur indexée à la surface corporelle est préférée). Sachant qu’une surface valvulaire aortique normale est de l’ordre de 2 à 3 cm2.
Diagnostic étiologique : l’étude de la valve et de ses anomalies permet de déterminer l’origine dégénérative, post-rhumatismale, et/ou congénitale du rétrécissement aortique.
Évaluation du retentissement : l’hypertrophie ventriculaire gauche est le premier signe de retentissement du rétrécissement aortique. Plus tardivement, on note une dilatation atriale gauche, une dilatation ventriculaire gauche et une altération de la FEVG, voire une hypertension pulmonaire postcapillaire. Il faut également calculer le volume d’éjection ventriculaire gauche et le débit cardiaque pour s’assurer de sa normalité et ainsi de l’interprétabilité des paramètres de sévérité, en particulier de la Vmax et du gradient transvalvulaire (paramètres dépendant du volume d’éjection). Le diamètre de l’aorte ascendante doit être mesuré, particulièrement en cas de bicuspidie.
Recherche d’une atteinte des autres valves ou de l’aorte : elle complète le bilan de toute valvulopathie.
Autres examens
L’échographie cardiaque transœsophagienne est rarement nécessaire pour évaluer un rétrécissement aortique. Elle peut parfois être réalisée si le patient est vraiment anéchogène en transthoracique ou avant une procédure de remplacement valvulaire percutané (TAVI) pour mesurer la taille de l’anneau aortique de façon plus précise et ainsi choisir avec exactitude le type de prothèse à implanter. Cependant, de nos jours, c’est le scanner avec reconstruction 3D qui est le plus précis.Le cathétérisme cardiaque gauche pour mesure direct du gradient transvalvulaire n’est proposé qu’en cas de discordance entre les différents critères de sévérité et une échographie non contributive.
Épreuve d’effort : en cas de rétrécissement aortique serré chez un patient se disant asymptomatique cet examen est indiqué (contre-indiqué en revanche en cas de rétrécissement aortique serré symptomatique, par crainte de la mort subite à l’effort). On parle de positivité si le patient développe des symptômes d’effort (qu’il minorait en fait) ou s’il n’y a pas d’adaptation de la tension artérielle à l’effort (stagnation, voire diminution).
Échocardiographie transthoracique (ETT) sous dobutamine : si la FEVG est altérée (< 40 %) avec un débit cardiaque abaissé, le gradient transvalvulaire peut rester en dessous du seuil de 40 mmHg alors même que la surface valvulaire est pourtant < 0,6 cm2/m2. Il y a donc discordance. La baisse du débit peut non seulement expliquer un gradient abaissé (voir plus haut) mais aussi une surface d’ouverture valvulaire non optimale en raison d’une diminution des forces d’ouverture. Ainsi, il est alors important de distinguer deux situations différentes. La première est celle d’un authentique rétrécissement aortique serré évolué ayant entraîné une baisse de la FEVG et du débit (indication de remplacement valvulaire). La seconde est celle d’un rétrécissement aortique non serré associé à une autre cardiopathie (ex : ischémique) qui, elle, est responsable de la baisse de la FEVG et du débit. La dobutamine (inotrope positif) permettra d’augmenter artificiellement le débit cardiaque, et d’analyser l’évolution de la surface et du gradient transvalvulaire. Si la surface augmente peu, le gradient va rapidement s’élever et dépasser 40 mmHg, confirmant le caractère serré du rétrécissement aortique (RAo dit « serré-bas débit-bas gradient »). En revanche, si l’augmentation du débit permet une meilleure ouverture de la valve, le gradient ne va pas augmenter, confirmant le caractère non serré du rétrécissement aortique. Si sous dobutamine, on ne parvient pas à faire augmenter le débit cardiaque, c’est qu’il n’existe plus de « réserve contractile », et la forme clinique est plus grave.
Scanner valvulaire pour quantification du degré de calcification : il s’agit d’un scanner non injecté permettant de calculer un « score calcique » de la valve aortique qui est corrélé au degré de sévérité du rétrécissement aortique et au pronostic. Il est utilisé dans les situations de quantifications difficiles et de discordances à l’ETT.
Le BNP (brain natriuretic peptid) peut parfois être utile pour juger du retentissement du rétrécissement aortique chez un patient asymptomatique. Néanmoins, il ne fait pas partie des critères de sévérité, il peut parfois « aider » à la prise de décisions.
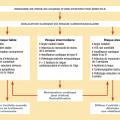
Indications de remplacement valvulaire (chirurgical ou percutané) (fig. 2)
- rétrécissement aortique serré symptomatique ;
- rétrécissement aortique serré asymptomatique si présence d’un des critères suivants :
. épreuve d’effort positive révélant des symptômes ou inadaptation tensionnelle ;
. épreuve d’effort normale, rétrécissement aortique extrême (Vmax > 5,5 m/s) ou s’aggravant rapidement (Vmax augmentant de plus de 0,3 m/s/an) en cas de faible risque chirurgical.
En l’absence d’indication de remplacement valvulaire, le patient sera réévalué régulièrement.
Bilan préthérapeutique et moyens thérapeutiques
Bilan préopératoire
Dès que l’indication chirurgicale est posée, un bilan préopératoire préalable doit être réalisé. Il comprend :- une coronarographie réalisée systématiquement à la recherche de lésions coronaires associées en cas d’antécédents cardiovasculaires préalables, d’ischémie myocardique suspectée (angor par exemple, qui peut être en lien avec le rétrécissement aortique mais aussi avec une coronaropathie, en particulier chez des patients le plus souvent âgés), d’altération de la FEVG < 50 %, en présence d’au moins un facteur de risque cardiovasculaire, chez l’homme de plus de 40 ans et chez la femme en post-ménopause ;
- une échographie Doppler des troncs supra-aortiques à la recherche d’une sténose critique, qui si elle existe devra être traitée avant la chirurgie (sinon risque de bas débit cérébral lors de la circulation extracorporelle) ;
- un bilan respiratoire avec épreuves fonctionnelles respiratoires et gazométrie, pour juger de l’opérabilité et prédire la bonne tolérance de la sternotomie ;
- un scanner thoracique sans injection à la recherche de calcifications aortiques circonférentielles qui contre-indiqueraient le clampage de l’aorte, nécessaire pour une circulation extracorporelle ;
- un angioscanner aortique et des membres inférieurs, avant TAVI pour déterminer la taille de la prothèse à implanter et la voie d’abord ;
- une consultation stomatologique et panoramique dentaire pour éliminer un foyer dentaire infectieux patent, à risque d’engendrer en postopératoire une endocardite infectieuse chez un patient porteur d’une valve ;
- une consultation anesthésiste qui conclura sur l’opérabilité du patient par voie conventionnelle.
Remplacement valvulaire chirurgical
À l’heure actuelle, c’est la méthode à proposer en première intention. C’est donc celle que l’on retiendra en l’absence de comorbidités importantes pouvant constituer une contre-indication à l’anesthésie et à la circulation extracorporelle. Il existe deux possibilités de prothèse :- mécanique : elle ne dégénère pas et a donc une durée de vie longue, mais elle impose un traitement anticoagulant à vie par antivitamine-K (car à risque de thrombose). On la propose plutôt aux sujets jeunes (< 60 ans) ;
- biologique : elle ne nécessite pas d’anticoagulation au long cours (sauf 3 premiers mois postopératoires) mais a une durée de vie limitée et dégénère systématiquement dans les 10 à 15 ans. On la propose donc volontiers aux sujets âgés (> 65 ans).
Implantation percutanée d’une valve aortique (transcatheter aortic valve implantation – TAVI)
Elle est proposée en cas de risque opératoire élevé après discussion médico-chirurgicale (notion d’équipe pluridisciplinaire) si l’espérance de vie est supérieure à 1 an. La valve native n’est pas retirée. La prothèse est insérée par voie percutanée à travers une voie artérielle : fémorale le plus souvent, mais aussi sous-clavière, carotidienne, transaortique par mini-sternotomie ou apicale (trans-ventriculaire gauche). La prothèse biologique est déployée, tel un stent qui vient écraser la valve native.Valvuloplastie percutanée au ballonnet
Il s’agit de réaliser une dilatation de la valve aortique à l’aide d’un ballonnet inséré par voie artérielle percutanée. Cette technique est palliative en raison d’un taux très élevé de resténose. Elle peut être proposée aux patients inéligibles à la chirurgie ou au TAVI pour améliorer transitoirement les symptômes. Elle peut être indiquée également dans les situations hémodynamiques précaires en « préparation » à la chirurgie ou au TAVI.Prévention de l’endocardite infectieuse
Elle est systématique.Insuffisance aortique
Définition
Étiologie
On peut distinguer des formes aiguës (d’apparition brutale) et des formes chroniques.
Insuffisances aortiques aiguës
Insuffisance aortique de l’endocardite (Insuffisance aortique de la dissection aortique : la fuite peut être provoquée par une invagination du flap intimal entre les sigmoïdes empêchant leur fermeture, une dissection s’étendant aux sigmoïdes et/ou une dilatation de l’aorte ascendante.
Insuffisance aortique post-traumatique : elle est rare et liée parfois à un traumatisme fermé du thorax ou acte interventionnel intracardiaque.
Insuffisance aortique dystrophique par dysplasie valvulaire isolée : elles sont responsables le plus souvent d’insuffisances aortiques chroniques mais un prolapsus d’une sigmoïde peut apparaître brutalement.
Insuffisances aortiques chroniques
Les causes chroniques restent les plus fréquentes.Insuffisances aortiques dystrophiques : c’est la cause la plus fréquente dans les pays occidentaux. On les nomme parfois dégénératives. Certaines ont une origine génétique. Associées à d’autres signes extracardiaques, ces anomalies peuvent entrer ou non dans le cadre d’un syndrome de Marfan ou d’Ehlers-Danlos (maladies génétiques du tissu élastique). Elles sont liées soit à une dilatation de l’aorte ascendante, soit à une dysplasie (syndrome des valves flasques) des sigmoïdes aortiques.
Dilatation de l’aorte ascendante. Lorsque cette dilatation touche la racine aortique, et surtout la zone sino-tubulaire, une insuffisance aortique peut apparaître alors même que les sigmoïdes sont normales. On parle de maladie annulo-ectasiante liée à une anomalie du tissu élastique de la paroi aortique.
Dysplasie des sigmoïdes aortiques. Là encore, une anomalie du tissu explique le caractère « flasque » des sigmoïdes qui peuvent prolaber vers le ventricule gauche.
Biscuspidie aortique : il s’agit alors d’une étiologie congénitale. Il faut toujours rechercher une dilatation de l’aorte ascendante associée (50 % des cas) ou une coarcation de l’aorte. Un dépistage familial doit également être organisé compte tenu du caractère héréditaire de cette anomalie.
Insuffisance aortique post-rhumatismale : c’est une cause rare dans les pays occidentaux, mais elle peut encore être observée notamment chez les patients originaires d’Afrique. L’atteinte est souvent plurivalvulaire avec rétraction et fusion commissurale.
Insuffisance aortique secondaire à une endocardite ancienne guérie.
Autres causes : parmi les causes plus rares, on retrouve l’origine médicamenteuse (dérivés de l’ergot de seigle, anorexigènes comme benfluorex ou fenfluramine), maladies inflammatoires (spondylarthrite ankylosante) ou auto-immunes (lupus).
Physiopathologie
Retentissement en amont
La régurgitation de l’aorte vers le ventricule gauche va entraîner une surcharge volumétrique (augmentation de la précharge du VG). Plus le volume régurgité est important, et donc l’insuffisance aortique sévère, plus cette surcharge sera importante. Ainsi, progressivement, en cas d’insuffisance aortique chronique, le ventricule gauche va se dilater pour accueillir cette surcharge de volume. Avec le temps, selon la loi de Laplace, les contraintes pariétales vont augmenter du fait de cette surcharge, entraînant une hypertrophie de façon adaptée à la dilatation. Cette hypertrophie va également s’aggraver en raison d’une augmentation de la post-charge du ventricule gauche associée. En effet, Le ventricule gauche doit éjecter en systole un volume de sang plus important (volume habituel + volume régurgité) à travers un orifice aortique inextensible et donc créant un obstacle fonctionnel (augmentation de la post-charge). La fonction systolique du ventricule gauche (FEVG) est longtemps conservée grâce à ces mécanismes compensatoires. Le volume télédiastolique étant majoré du volume de la régurgitation, le volume d’éjection systolique est lui aussi augmenté. Il existe alors un débit cardiaque augmenté. Les insuffisances aortiques chroniques peuvent donc rester longtemps asymptomatiques. Mais, à terme, les fibres myocardiques étirées et hypertrophiées dégénèrent, fibrosent et la FEVG peut s’altérer. C’est à ce stade que les pressions de remplissage du ventricule gauche vont alors augmenter et les symptômes d’insuffisance cardiaque apparaître. Ces anomalies myocardiques peuvent entraîner des troubles du rythme. De plus, l’augmentation des besoins en oxygène du myocarde hypertrophié associée à une diminution de la perfusion coronaire (les coronaires se remplissant en diastole) peut être responsable d’une ischémie myocardique à l’effort et donc d’un angor d’effort.Dans les insuffisances aortiques aiguës, le ventricule gauche n’a pas le temps de s’adapter (peu de dilatation compensatrice) et les pressions de remplissage augmentent subitement, pouvant conduire à un œdème aigu pulmonaire brutal.
Retentissement en aval
L’augmentation du volume d’éjection en systole peut être responsable d’une hyperpulsatilité artérielle. De plus, lorsque le volume régurgité est important, la pression artérielle diastolique peut baisser de façon importante et être responsable d’un élargissement de la pression artérielle différentielle (pression systolique – pression diastolique). Enfin, l’insuffisance aortique peut créer, comme nous l’avons vu plus haut, une diminution de la perfusion coronaire.Complications de l’insuffisance aortique
Les complications possibles de cette valvulopathie sont donc :- l’insuffisance cardiaque ;
- l’ischémie myocardique ;
- les troubles du rythme supraventriculaire ;
- la mort subite par troubles du rythme ventriculaire ;
- les endocardites infectieuses.
Diagnostic clinique
Signes fonctionnels
Une insuffisance aortique peut rester longtemps asymptomatique et découverte à l’occasion de l’auscultation d’un souffle cardiaque.La survenue de symptômes tels qu’une dyspnée et/ou d’un angor d’effort ou de repos signe généralement le caractère sévère de la fuite.
Signes physiques
Le souffle protodiastolique, doux, humé, aspiratif, maximum au foyer aortique (2e espace intercostal droit près du sternum), irradiant le long du bord gauche du sternum (dit 2e foyer aortique) ou vers la pointe du cœur. La position penchée en avant et en expiration profonde favorisera son écoute. Si l’insuffisance aortique est très sévère, le souffle sera volontiers holodiastolique et accompagné d’un souffle systolique éjectionnel (« sténose » fonctionnelle par augmentation du volume d’éjection systolique alors que la surface d’ouverture aortique reste la même).Dans les insuffisances aortiques très sévères, on peut rencontrer un « roulement diastolique de Flint » au foyer mitral (rencontre du flux d’insuffisance aortique avec le flux de remplissage diastolique de l’oreillette gauche vers le VG).
Il existe un élargissement de la pression artérielle différentielle par diminution de la pression artérielle diastolique (inférieure à 50 mmHg) dans les insuffisances aortiques sévères.
Par ailleurs, on note :
- hyperpulsatilité artérielle lors de la palpation des pouls ou visible au niveau du cou ;
- déviation et abaissement du choc de pointe en cas de dilatation ventriculaire gauche ;
- signes d’insuffisance cardiaque gauche puis droite dans les formes avancées.
Diagnostic paraclinique
Électrocardiogramme (ECG)
L’ECG peut rester longtemps sans anomalie.La surcharge ventriculaire gauche (augmentation de l’indice de Sokolow) peut ensuite apparaître. Elle est de type diastolique (ondes T positives en V5, V6) ou systolique (ondes T négatives en V5, V6).
La surcharge atriale gauche peut apparaître en fonction du retentissement.
À un stade évolué, des troubles du rythme atriaux ou ventriculaires peuvent apparaître.
Radiographie du thorax
Elle peut être longtemps normale.Un débord de l’arc inférieur gauche sous le diaphragme témoigne d’une dilation du ventricule gauche.
Des signes d’œdème pulmonaire peuvent être observés.
En cas d’association à une dilatation de l’aorte ascendante, on peut retrouver un débord de l’arc supérieur droit.
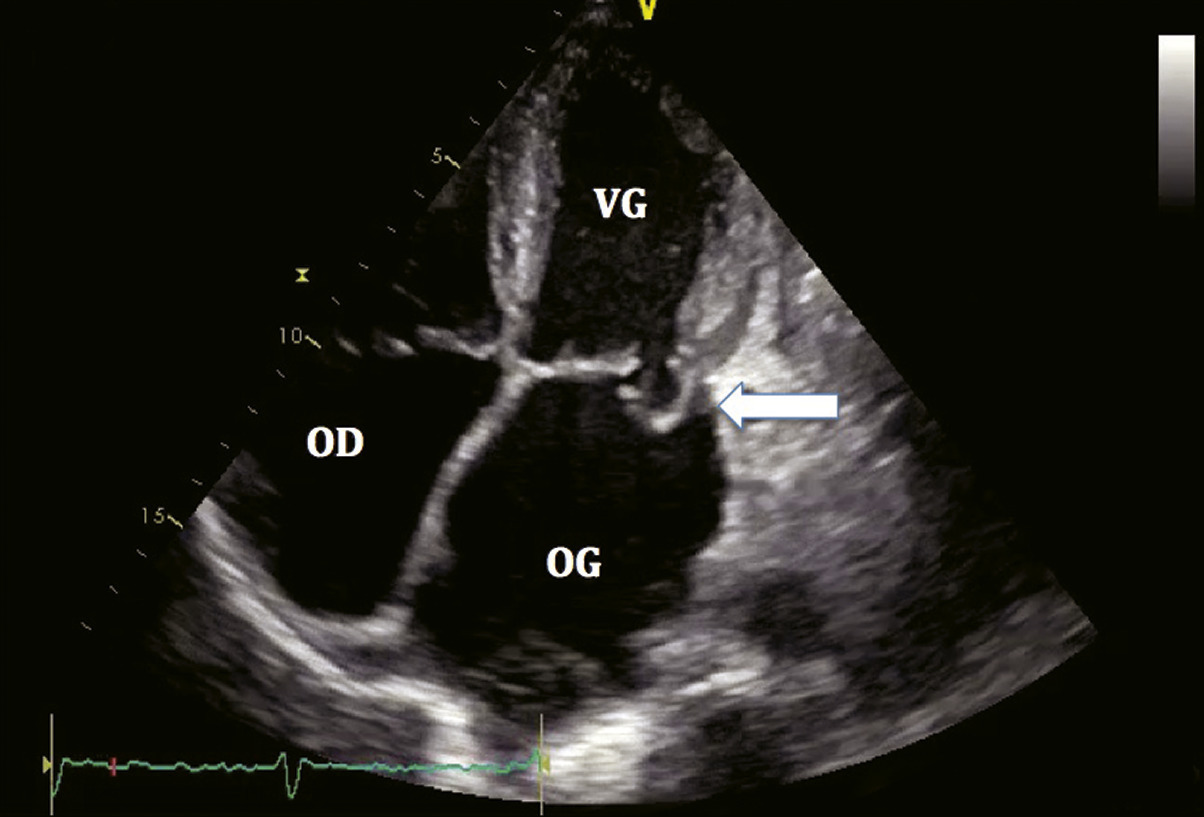
Échographie-Doppler cardiaque transthoracique (ETT)
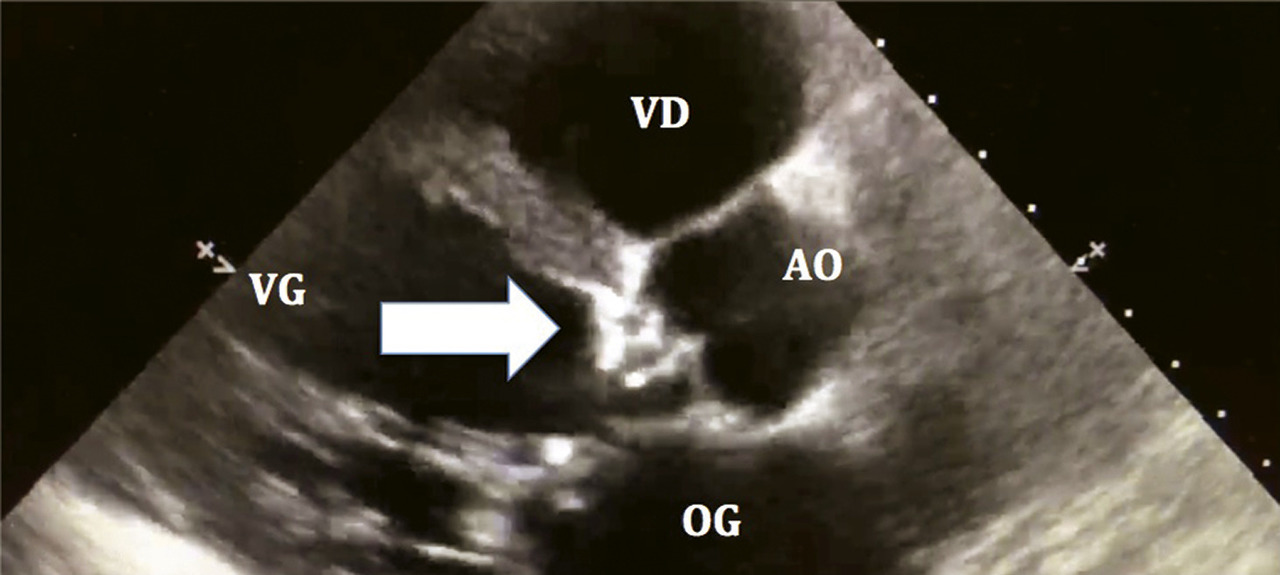
L’ETT est l’examen clé pour le diagnostic des valvulopathies.Diagnostic positif : on observe un défaut de fermeture des sigmoïdes aortiques et la régurgitation en Doppler couleur.
Diagnostic de sévérité, quantification : l’évaluation de la sévérité d’une régurgitation est fondée essentiellement sur la méthode de la zone de convergence ou PISA (proximal iso-velocity surface area), qui permet le calcul d’une surface de l’orifice régurgitant (SOR) et d’un volume régurgité (VR). Plus le SOR et le VR sont importants, plus la fuite est sévère. Une insuffisance aortique sera considérée comme sévère si SOR ≥ 30 mm2 et/ou VR ≥ 60 mL.
Diagnostic étiologique : l’étude de la valve et de ses anomalies donne l’origine de la fuite. La dystrophie engendre des sigmoïdes flasques (prolapsus) et/ou une dilatation de l’aorte ascendante et de l’anneau aortique. La bicuspidie aortique est diagnostiquée en cas de présence de seulement 2 sigmoïdes (2 commissures). L’origine post-rhumatismale est évoquée en cas de rétraction des sigmoïdes et de fusion commissurale. La présence de végétations, mutilations, perforations, abcès permet le diagnostic d’endocardite infectieuse. Enfin, la présence d’un flap intimal évoque la dissection de l’aorte.
Évaluation du retentissement : on recherche systématiquement :
- une dilatation ventriculaire gauche (mesure des diamètres et volumes) ;
- une altération de la FEVG ;
- une hypertrophie ventriculaire gauche ;
- une dilatation de l’oreillette gauche
- une hypertension pulmonaire ;
- un retentissement sur les cavités droites
Échographie-Doppler cardiaque transœsophagienne (ETO)
Elle est rarement nécessaire pour évaluer une insuffisance aortique. Elle peut parfois être réalisée si le patient est anéchogène en ETT ou pour préciser un mécanisme étiologique. Elle est en revanche indispensable s’il s’agit d’une suspicion d’endocardite infectieuse.Autres examens
Le cathétérisme cardiaque gauche n’est plus que très rarement réalisé de nos jours, pour effectuer une angiographie aortique sus-sigmoïdienne et évaluer visuellement la fraction de régurgitation de l’insuffisance aortique.Une imagerie par résonance magnétique (IRM) cardiaque : elle n’est pas systématique et peut être réalisée en cas de discordance des résultats de l’échographie ou de patient anéchogène afin de quantifier la fuite en calculant la fraction de régurgitation. Elle permet également une mesure précise de l’aorte ascendante, des volumes ventriculaires gauche et de la FEVG.
L’angioscanner aortique permet la mesure précise des diamètres aortiques en cas d’anévrisme et le diagnostic de dissection aortique.
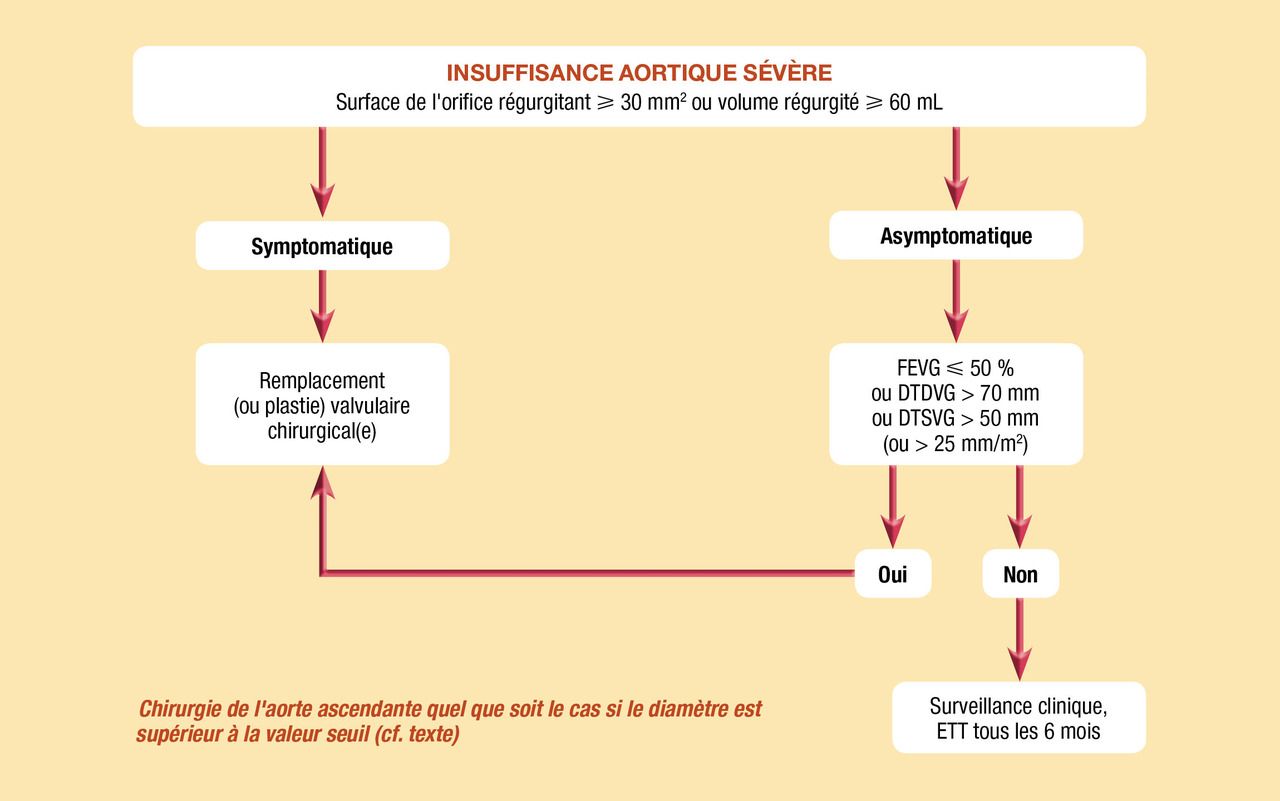
Indications chirurgicales (fig. 4)
- insuffisance aortique sévère symptomatique ;
- insuffisance aortique sévère asymptomatique si présence d’un des critères de retentissement ventriculaire gauche : FEVG ≤ 50 % ou dilatation ventriculaire gauche avec diamètre télésystolique > 50 mm (ou > 25 mm/m2) ou diamètre télédiastolique > 70 mm ;
- insuffisance aortique sévère aiguë : une chirurgie urgente est indiquée.
Un remplacement de l’aorte ascendante doit également être posé quelle que soit la sévérité de l’insuffisance aortique dans les situations suivantes :
- ≥ 50 mm en cas de syndrome de Marfan (≥ 45 mm si association à d’autres risques de rupture comme des antécédents familiaux de dissection) ;
- ≥ 55 mm en cas de bicuspidie aortique (≥ 50 mm si association à d’autres risques de rupture comme des antécédents familiaux de dissection) ;
- ≥ 55 mm pour tous les autres cas.
Bilan préthérapeutique et moyens thérapeutiques
Bilan préopératoire
Dès que l’indication chirurgicale est posée, un bilan préopératoire préalable doit être réalisé. Il comprend :- une coronarographie : elle est réalisée systématiquement, à la recherche de lésions coronaires associées en cas d’antécédents cardiovasculaires préalables, d’ischémie myocardique suspectée, d’altération de la FEVG < 50 %, en présence d’au moins un facteur de risque cardiovasculaire, chez l’homme de plus de 40 ans et chez la femme en post-ménopause ;
- une échographie Doppler des troncs supra-aortiques, à la recherche d’une sténose critique, qui si elle existe devra être traitée avant la chirurgie (sinon risque de bas débit cérébral lors de la circulation extracorporelle) ;
- un bilan respiratoire avec épreuves fonctionnelles respiratoires et gazométrie, pour juger de l’opérabilité et prédire la bonne tolérance de la sternotomie ;
- un scanner thoracique sans injection, à la recherche de calcifications aortiques circonférentielles qui contre-indiqueraient le clampage de l’aorte, nécessaire pour une circulation extracorporelle ;
- une consultation stomatologique et panoramique dentaire pour éliminer un foyer dentaire infectieux patent, à risque d’engendrer en postopératoire une endocardite infectieuse chez un patient porteur d’une valve ;
- une consultation anesthésiste qui conclura sur l’opérabilité du patient par voie conventionnelle.
Traitement chirurgical
En cas d’indication chirurgicale formelle liée à l’insuffisance aortique, un remplacement valvulaire est réalisé en l’absence de comorbidités importantes pouvant constituer une contre-indication à l’anesthésie et à la circulation extracorporelle. Il existe deux possibilités de prothèse : mécanique ou biologique.La prothèse mécanique ne dégénérera pas et a donc une durée de vie longue, mais elle impose un traitement anticoagulant à vie par antivitamine-K (car à risque de thrombose). On la propose plutôt aux sujets jeunes (< 60 ans). La prothèse biologique ne nécessite pas d’anticoagulation au long court (à l’exception des 3 premiers mois postopératoires) mais a une durée de vie limitée puisqu’elle dégénèrera systématiquement dans les 10 à 15 ans. On la propose donc volontiers aux sujets âgés (> 65 ans).
Certaines équipes effectuent une plastie (réparation valvulaire) dans des cas bien précis. Enfin, s’il existe, de façon associée ou isolée, une dilatation de l’aorte ascendante, deux types de chirurgie peuvent être proposés :
- l’intervention de Bentall : un tube aortique équipée d’une prothèse valvulaire est mis en place avec réimplantation des coronaires ;
- l’intervention de Tirone David : un tube aortique simple est mis en place avec réimplantation de la valve aortique et des coronaires. Elle est effectuée lorsque la valve aortique est saine.
Traitement médical
En cas de syndrome de Marfan, les bêtabloquants et le losartan (antagoniste des récepteurs à l’angiotensine 2) peuvent être prescrits afin de ralentir l’évolution de la dilatation.Prévention de l’endocardite infectieuse
Elle est systématique.Insuffisance mitrale
Définition et classification
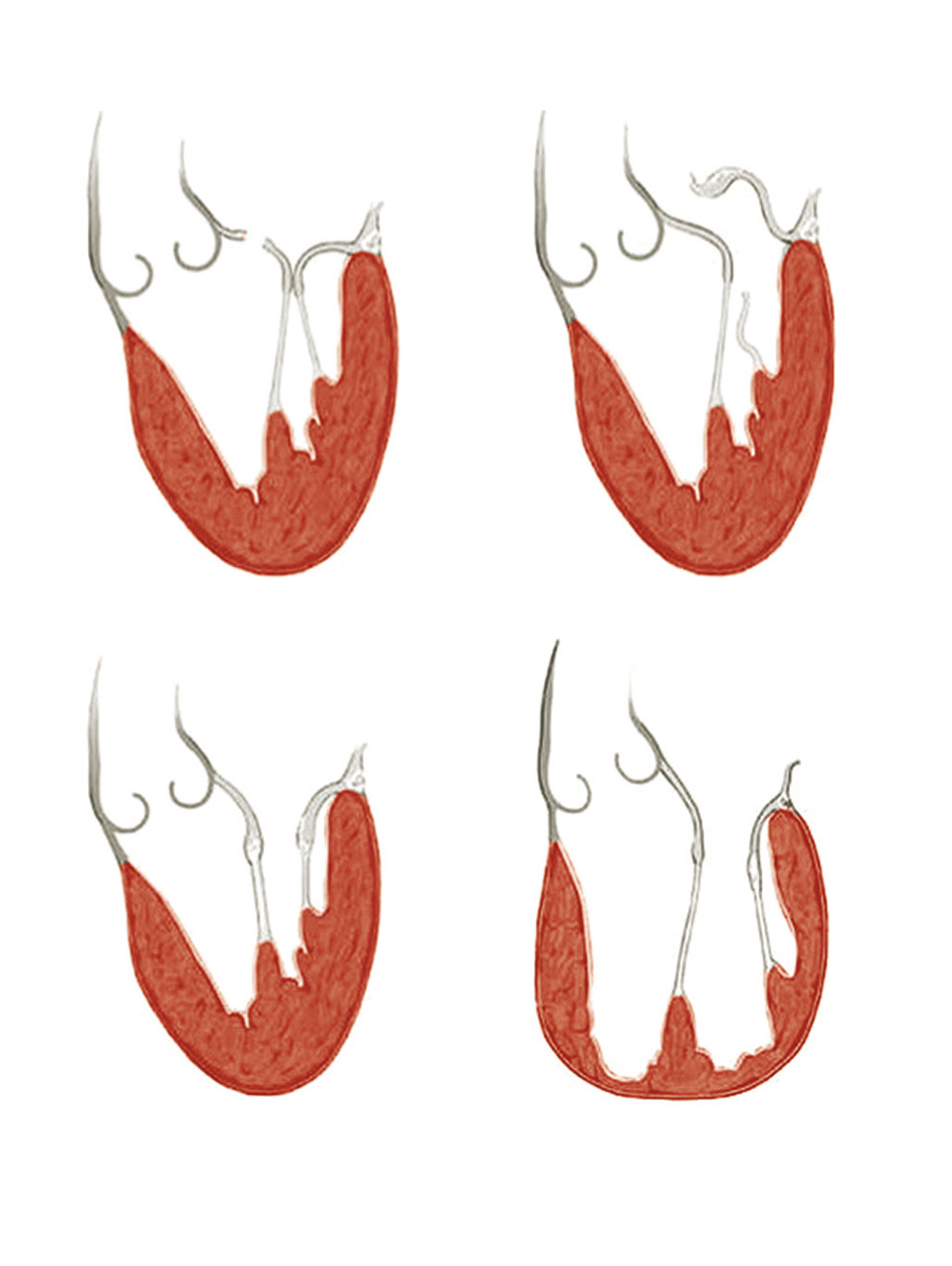
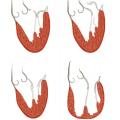
Par ailleurs, la classification de Carpentier classe les insuffisances mitrales en trois types en fonction de la position des feuillets en systole, c’est-à-dire lorsqu’ils sont censés être fermés (
- type I : les valves restent dans le plan de l’anneau, le jeu valvulaire est normal. La fuite peut être en lien avec une perforation d’un des feuillets (endocardite infectieuse) ou de dilatation annulaire pure (dilatation atriale gauche) ;
- type II : au moins un des feuillets dépasse le plan de l’anneau vers l’oreillette gauche, le jeu valvulaire est exagéré. On parle alors de prolapsus d’un ou des deux feuillets. Cet excès de mouvement peut être lié à une rupture de cordages (dégénérative, infectieuse), un allongement de cordages (dégénérative), une rupture de pilier (ischémique), ou un excès de tissu sur les feuillets valvulaires (dégénérative) ;
- type III : au contraire, le mouvement des feuillets valvulaires est restreint et ainsi l’apposition des 2 feuillets en fermeture se fait mal. Cette restriction de mouvement peut être la conséquence d’une rétraction des feuillets et de l’appareil sous-valvulaire (type IIIa : IM organiques post-rhumatismales, post-radiques ou médicamenteuses) ou d’une traction des cordages sur les feuillets liée à une dilatation du ventricule gauche (type IIIb : IM fonctionnelles dans les cardiopathies ischémiques ou les cardiomyopathies dilatées).
Étiologie
Insuffisance mitrale organique chronique
L’IM dégénérative est la cause la plus fréquente. Il s’agit d’une dégénérescence accélérée des feuillets entraînant un prolapsus valvulaire (type II de Carpentier) soit par élongation ou rupture de cordages, soit par excès de tissu des feuillets (qui se gonflent alors comme un parachute). On distingue (i) les dégénérescences dites myxoïdes ou dystrophiques (feuillets épaissis avec élongation des cordages qui finissent par rompre) que l’on observe le plus souvent chez la femme jeune (30-40 ans), on parle alors de maladie de Barlow ; (ii) les dégénérescences dites fibro-élastiques (les feuillets sont le plus souvent normaux et il s’agit d’une rupture de cordage), plus volontiers chez les personnes plus âgées (60-70 ans). Dans les deux cas, il peut exister une fuite chronique qui peut s’aggraver de façon aiguë lors d’une rupture de cordage.L’insuffisance mitrale post-rhumatismale est plus rare dorénavant dans les pays développés. On retrouve alors volontiers une atteinte plurivalvulaire, avec fusion des commissures et feuillets mitraux épaissis et rétractés. L’appareil sous-valvulaire peut aussi être atteint et rétracté. Le côté sténosant est souvent prédominant. S’il existe une fuite et une sténose, on parle de maladie mitrale.
Autres causes : il existe des causes plus rares comme les causes médicamenteuses (anorexigènes type benfluorex ou fenfluramine, dérivés de l’ergot de seigle), congénitale (fente mitrale isolée ou associée à d’autres anomalies), lupus, calcifications, cardiomyopathies hypertrophiques obstructives.
Insuffisances mitrales organiques aiguës
Insuffisance mitrale dégénérative par rupture de cordage.Insuffisance mitrale de l’endocardite : la fuite peut être en lien avec une volumineuse végétation limitant la fermeture, une mutilation valvulaire ou une perforation d’un des feuillets, ou encore du fait d’une rupture de cordage.
Insuffisance mitrale ischémique à la phase aiguë de l’infarctus par rupture de pilier partielle ou complète. Il s’agit d’une complication mécanique particulièrement grave de l’infarctus du myocarde, très mal tolérée, à l’origine le plus souvent d’un œdème aigu pulmonaire massif qui conduira au décès si une opération n’est pas réalisée rapidement.
Insuffisance mitrale post-traumatique : elle est rare et liée parfois à un traumatisme fermé du thorax ou acte interventionnel intracardiaque.
Insuffisances mitrales fonctionnelles
Elles sont liées à une dilatation (remodelage) progressive ou brutale du ventricule gauche entraînant une traction des feuillets par les cordages qui sont inextensibles. On peut les observer dans les cardiomyopathies dilatées ou dans les cardiopathies ischémiques (IM fonctionnelle ischémique liée au déplacement d’un ou des piliers en regard de la paroi soumise à l’ischémie ou nécrosée).Physiopathologie
Retentissement en amont
La régurgitation de sang du ventricule gauche vers l’oreillette gauche va progressivement entraîner une dilatation de cette dernière. La compliance des fibres atriales va permettre de limiter l’augmentation des pressions pendant un temps. Mais lorsque le volume régurgité devient trop important, et donc l’insuffisance mitrale sévère, la compliance de l’oreillette gauche est dépassée, les pressions augmentent dans l’oreillette gauche puis dans les veines pulmonaires, puis dans les capillaires pulmonaires, pouvant être responsables alors d’insuffisance cardiaque gauche. Cette augmentation de pression peut se propager vers l’artère pulmonaire, créant ainsi une hypertension pulmonaire postcapillaire, qui elle-même peut conduire à l’insuffisance cardiaque droite. La dilatation de l’oreillette gauche peut être à l’origine de l’apparition d’une fibrillation atriale et de toutes les conséquences qui en découlent. À noter qu’en cas d’insuffisance mitrale aiguë, l’oreillette gauche ne peut s’adapter, et les pressions dans l’oreillette gauche et l’artère pulmonaire augmentent rapidement, d’où la mauvaise tolérance clinique rapide.Retentissement en aval
Après la régurgitation de sang vers l’oreillette gauche en systole, ce volume va être restitué en diastole au ventricule gauche en plus du volume de sang habituel reçu par ce dernier. Cela peut aboutir alors à une dilatation progressive du ventricule gauche dont l’étirement des fibres peut conduire à une diminution de la force de contraction et donc une baisse de la fraction d'éjection du ventricule gauche. Des troubles du rythme ventriculaire peuvent naître de ce myocarde soumis à ces anomalies.Complications de l’insuffisance mitrale
Les complications possibles de cette valvulopathie sont donc :- l’insuffisance cardiaque ;
- les troubles du rythme supraventriculaire ;
- la mort subite par troubles du rythme ventriculaire ;
- les embolies systémiques (par fibrillation atriale) ;
- les endocardites infectieuses.
Diagnostic clinique
Signes fonctionnels
Une insuffisance mitrale peut rester longtemps asymptomatique et être découverte à l’occasion de l’auscultation d’un souffle cardiaque.La survenue de symptômes tels qu’une dyspnée d’effort ou de repos signe généralement le caractère sévère de la fuite. Le passage en fibrillation atriale (ressentie par des palpitations) est souvent le signe d’une insuffisance mitrale sévère et elle est considérée comme le tournant évolutif de la maladie. Une insuffisance mitrale aiguë est le plus souvent découverte à l’occasion d’un œdème aigu pulmonaire brutal et mal toléré. Si celui-ci est précédé d’une douleur thoracique associée à un « claquement » ressenti dans la poitrine, cela peut correspondre à une rupture de cordage.
Signes physiques
Ce sont :- souffle holosystolique, doux, en jet de vapeur, maximum au foyer mitral (apex), irradiant vers l’aisselle. Si l’insuffisance mitrale est massive, le souffle devient alors rude et peut être confondu avec un rétrécissement aortique. C’est l’irradiation de ce souffle qui permettra de distinguer les deux valvulopathies. En cas de prolapsus, on peut entendre un « clic » (mise en tension des cordages après B1) et un souffle à prédominance télésystolique ;
- frémissement à la palpation du foyer mitral avec le plat de la main témoignant d’une insuffisance mitrale très sévère ;
- déviation et abaissement du choc de pointe en cas de dilatation ventriculaire gauche ;
- éclat du B2 en cas d’hypertension pulmonaire ;
- signes d’insuffisance cardiaque gauche puis droite dans les formes avancées.
Diagnostic paraclinique
Électrocardiogramme (ECG)
L’ECG peut rester longtemps sans anomalie.La surcharge OG est souvent le premier signe de retentissement de l’insuffisance mitrale.
Une fibrillation atriale peut être présente ou un autre trouble du rythme supraventriculaire.
La surcharge ventriculaire gauche (augmentation de l’indice de Sokolow) peut ensuite apparaître.
La surcharge atriale et ventriculaire droite peut apparaître dans les formes très évoluées avec hypertension pulmonaire.
Des troubles du rythme ventriculaire peuvent être observés en cas de maladie de Barlow et/ou de formes avancées d’insuffisance mitrale.
Radiographie du thorax
Elle est peut être longtemps normale. Un débord de l’arc inférieur droit avec un aspect en double contour témoigne de la dilatation de l’OG. Un débord de l’arc inférieur gauche sous le diaphragme témoigne d’une dilation du ventricule gauche. Un aspect convexe de l’arc moyen gauche témoigne d’une dilatation du tronc de l’artère pulmonaire et donc d’une hypertension pulmonaire. Des signes d’œdème pulmonaire peuvent être observés.Échographie-Doppler cardiaque transthoracique (ETT)
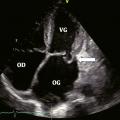
L’ETT est l’examen clé pour le diagnostic des valvulopathies (Diagnostic positif : on observe le défaut de fermeture des feuillets mitraux et la régurgitation en Doppler couleur.
Diagnostic de sévérité, quantification : l’évaluation de la sévérité d’une régurgitation est fondée essentiellement sur la méthode de la zone de convergence ou PISA (proximal iso-velocity surface area), qui permet le calcul d’une surface de l’orifice régurgitant et d’un volume régurgité. Plus la SOR et le VR sont importants, plus la fuite est sévère. Une insuffisance mitrale sera considérée comme sévère si SOR ≥ 40 mm2 et/ou VR ≥ 60 mL pour une insuffisance mitrale organique ; SOR ≥ 20 mm2 et/ou VR ≥ 30 mL pour une insuffisance mitrale fonctionnelle.
Diagnostic étiologique : l’aspect de l’appareil valvulaire et sous- valvulaire ainsi que l’appréciation du mécanisme de la fuite (classification de Carpentier) permettront, avec les données cliniques, de déterminer la cause de l’insuffisance mitrale.
Évaluation du retentissement : on recherche systématiquement :
- une dilatation de l’OG ;
- une dilatation du ventricule gauche (mesure des diamètres et volumes) ;
- une altération de la FEVG ;
- une hypertension pulmonaire ;
- un retentissement sur les cavités droites.
Échographie-Doppler cardiaque transœsophagienne (ETO)
Elle est nécessaire pour l’évaluation des insuffisances mitrales, en particulier lorsque le mécanisme est complexe afin d’apprécier la réparabilité de la valve. L’ETO est indispensable en cas d’endocardite infectieuse.Autres examens
Le cathétérisme gauche n’est plus utilisé dans cette indication.Le BNP (brain natriuretic peptid) peut parfois être utile pour juger du retentissement de l’insuffisance mitrale chez un patient asymptomatique. Néanmoins, il ne fait pas partie des critères de sévérité, il peut parfois « aider » à la prise de décision.
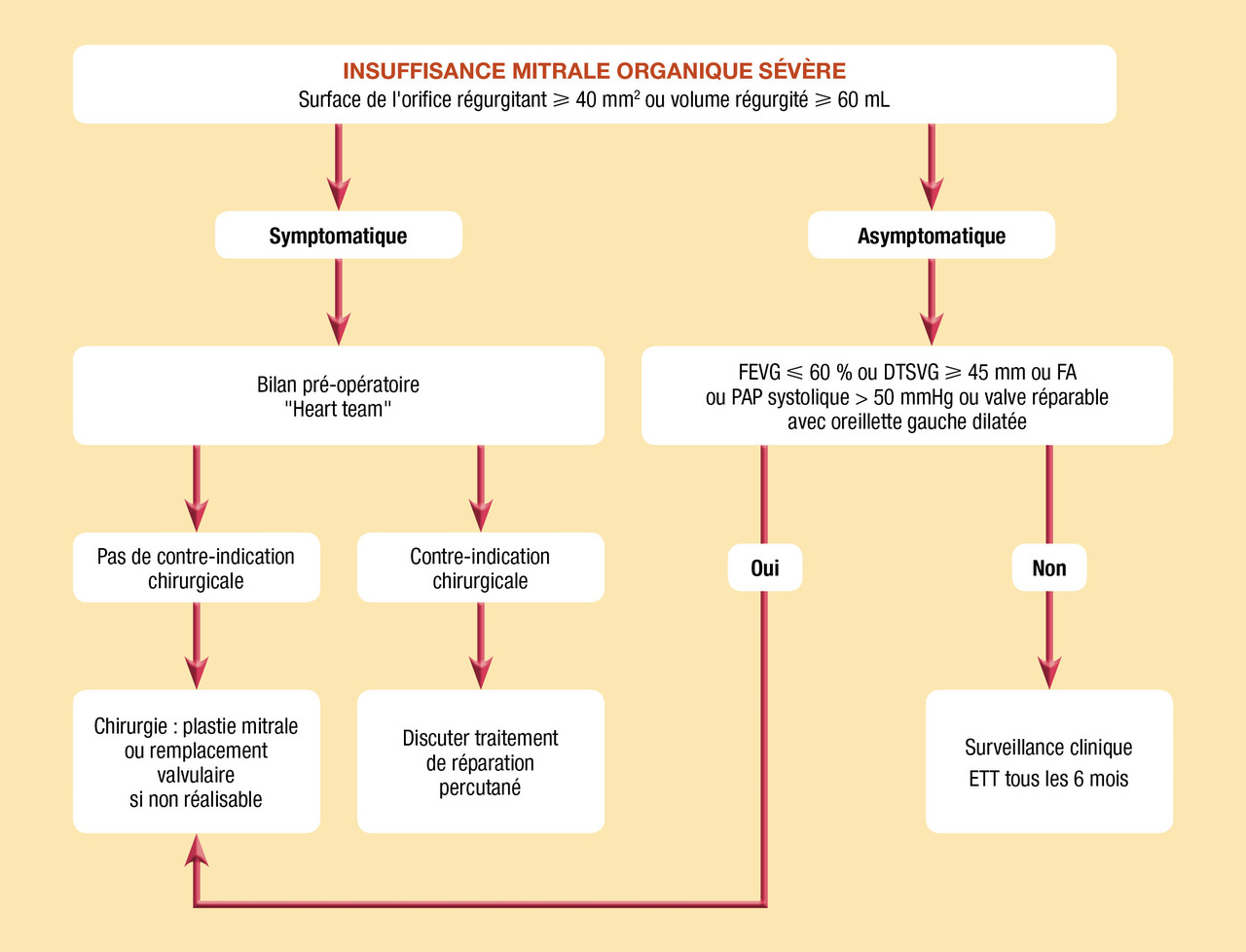
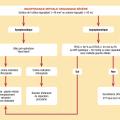
Indications chirurgicales (fig. 7)
Les principales indications sont les suivantes :
- insuffisance mitrale sévère symptomatique ;
- insuffisance mitrale sévère asymptomatique en présence d’un des critères de retentissement suivants :
. FA ou ;
. hypertension pulmonaire ou ;
. valve réparable associée à un faible risque opératoire si dilatation de l'oreillette gauche (≥ 60 mL/m2). Pour certains dans ce cas, la dilatation de l'oreillette gauche n’est pas obligatoire ;
- insuffisance mitrale sévère aiguë : une chirurgie urgente est indiquée.
Bilan préthérapeutique et moyens thérapeutiques
Bilan préopératoire
Dès que l’indication chirurgicale est posée, un bilan préopératoire préalable doit être réalisé.Il comprend :
- une coronarographie : elle est réalisée systématiquement à la recherche de lésions coronaires associées en cas d’antécédents cardiovasculaires préalables, d’ischémie myocardique suspectée, d’altération de la FEVG < 50 %, en présence d’au moins un facteur de risque cardiovasculaire, chez l’homme de plus de 40 ans et chez la femme en post-ménopause ;
- une échographie Doppler des troncs supra-aortiques à la recherche d’une sténose critique, qui si elle existe devra être traitée avant la chirurgie (sinon risque de bas débit cérébral lors de la circulation extracorporelle) ;
- un bilan respiratoire avec épreuves fonctionnelles respiratoires et gazométrie, pour juger de l’opérabilité et prédire la bonne tolérance de la sternotomie ;
- un scanner thoracique sans injection à la recherche de calcifications aortiques circonférentielles qui contre-indiqueraient le clampage de l’aorte, nécessaire pour une circulation extracorporelle ;
- une consultation stomatologique et panoramique dentaire pour éliminer un foyer dentaire infectieux patent, à risque d’engendrer en postopératoire une endocardite infectieuse chez un patient porteur d’une valve ;
- une consultation anesthésiste qui conclut sur l’opérabilité du patient par voie conventionnelle.
Plastie mitrale
C’est l’option chirurgicale à privilégier car elle évite les complications liées aux prothèses valvulaires (anticoagulation des prothèses mécaniques et dégénérescence des prothèses biologiques notamment) et permet de mieux préserver la fonction ventriculaire gauche postopératoire. La réparabilité est guidée par l’échographie cardiaque (type 2-prolapsus plus réparables que les types 3). Néanmoins, le résultat reste dépendant de l’expérience du chirurgien.Remplacement valvulaire chirurgical
En cas de plastie impossible (trop complexe à réparer ou feuillets trop abîmés), c’est la méthode de seconde intention. C’est donc celle que l’on retient en l’absence de comorbidités importantes pouvant constituer une contre-indication à l’anesthésie et à la circulation extracorporelle. Il existe deux possibilités de prothèse :- mécanique : elle ne dégénère pas et a donc une durée de vie longue, mais elle impose un traitement anticoagulant à vie par antivitamine-K (car à risque de thrombose). On la propose plutôt aux sujets jeunes (< 60 ans) ;
- biologique : elle ne nécessite pas d’anticoagulation au long court (à l’exception des 3 premiers mois postopératoires) mais a une durée de vie limitée puisqu’elle dégénère systématiquement dans les 10 à 15 ans. On la propose donc volontiers aux sujets âgés (> 65 ans).
Techniques percutanées
Actuellement, les techniques de plastie percutanées se développent (clip mitral) et peuvent être proposées à des groupes très restreints de patients présentant un risque opératoire important.Prévention de l’endocardite infectieuse
Elle est systématique.•POINTS FORTS À RETENIR
Rétrécissement aortique
Dégénératif chez le sujet âgé (le plus souvent), bicuspidie chez le sujet jeune
Retentissement : hypertrophie ventriculaire gauche, dysfonction diastolique
Symptomatologie d’effort : dyspnée, angor, syncopes/lipothymies
Rétrécissement aortique serré si : vitesse maximale ≥ 4 m/s ; ou gradient moyen ≥ 40 mmHg ; ou surface ≤ 0,6 cm2/m2.
Indication de remplacement valvulaire si rétrécissement aortique serré symptomatique ou asymptomatique associé à des critères supplémentaires
Traitement par remplacement valvulaire chirurgical en première intention et procédure de remplacement valvulaire percutané, si récusé devant un risque opératoire élevé.
POINTS FORTS À RETENIR
Insuffisance aortique
Le plus souvent chronique : maladie annulo-ectasiante ou dystrophie de valve.
Parfois aiguë : endocardite infectieuse ou dissection aortique.
Retentissement : dilatation puis hypertrophie ventriculaire gauche.
Longtemps asymptomatique, puis dyspnée et insuffisance cardiaque.
Insuffisance aortique sévère si surface de l’orifice régurgitant ≥ 30 mm2 ou volume régurgité ≥ 60 mL.
Indication chirurgicale si insuffisance aortique sévère symptomatique ou insuffisance aortique sévère asymptomatique et retentissement ventriculaire gauche ou dilatation importante de l’aorte ascendante.
Chirurgie en urgence si insuffisance aortique aiguë mal tolérée.
POINTS FORTS À RETENIR
Insuffisance mitrale
Organique ou fonctionnelle
Aiguë ou chronique
Retentissement : dilatation de l’oreillette gauche, puis du ventricule gauche
Longtemps asymptomatique, puis dyspnée et insuffisance cardiaque
œdème aigu du poumon en cas d’insuffisance mitrale aiguë
IM organique sévère si : surface de l’orifice régurgitant ≥ 40 mm2 ou volume régurgité ≥ 60 mL
Indication chirurgicale si insuffisance mitrale sévère symptomatique ou insuffisance mitrale sévère asymptomatique et retentissement sur le ventricule gauche et/ou l’oreillette gauche
Chirurgie en urgence si l’insuffisance mitrale aiguë est mal tolérée
Plastie mitrale à privilégier
Message de l'auteur
L’item « Valvulopathies » est source de nombreux sujets potentiels. En effet, il comprend notamment 3 pathologies différentes (RAO, IM, IA), elles-mêmes pouvant revêtir de nombreux aspects (étiologies différentes, révélation aiguë ou chronique, plusieurs prises en charge possibles…). De plus, une valvulopathie est une comorbidité fréquente qui peut donc s’intégrer dans de nombreux dossiers transversaux. Si on ne devait retenir que des dossiers « caricaturaux » pour chaque valvulopathie, les voici.
• Un rétrécissement aortique pourrait être retrouvé dans un dossier d’anémie. Le syndrome de Heyde associe rétrécissement aortique et angiodysplasie colique. Ainsi, un bilan d’anémie pourrait aboutir sur la découverte d’un rétrécissement aortique et la discussion de sa prise en charge. Il pourrait également s’agir d’un dossier explorant une syncope chez une personne âgée où l’on discuterait les différents diagnostics possibles : rétrécissement aortique serré, troubles conductifs de haut degré paroxystiques, hypotension orthostatique.
• Une insuffisance aortique aiguë avec fièvre fera discuter une endocardite infectieuse, alors qu’une insuffisance aortique aiguë associée à une douleur thoracique évoquera une dissection aortique.
• Une insuffisance mitrale sera volontiers évoquée chez la femme jeune qui se plaint d’une dyspnée d’aggravation progressive depuis « le jour où elle a entendu crac dans sa poitrine accompagné d’une douleur » : insuffisance mitrale par rupture de cordage chez une patiente porteuse d’une IM préalablement non sévère sur maladie de Barlow.
• Enfin, la mise en place d’une prothèse valvulaire peut ouvrir le champ à d’autres items : endocardite infectieuse, accident des anticoagulants, surveillance de prothèses.

 Encadrés
Encadrés