Environ 7 à 10 % de la population française présente une atteinte rénale. Une partie évolue vers une maladie rénale avancée, dite terminale, et nécessite un traitement de suppléance (dialyse ou greffe). Au 31 décembre 2022, en France, 93 000 patients étaient dans cette situation (44,5 % étaient porteurs d’un greffon rénal, 55,5 % étaient en dialyse), dont plus de la moitié en lien avec une hypertension artérielle ou un diabète.
La néphroprotection vise à ralentir la progression de la maladie rénale chronique (MRC), non seulement pour éviter l’évolution vers l’insuffisance rénale terminale mais également pour réduire le risque cardiovasculaire des patients (qui augmente avec le niveau d’insuffisance rénale). Ces dernières décennies ont été marquées par un élargissement des traitements disponibles et efficaces. En complément des stratégies conventionnelles, telles que les mesures hygiénodiététiques, le contrôle des facteurs de risque cardiovasculaire et les inhibiteurs du système rénine-angiotensine-aldostérone, l’arsenal thérapeutique comporte à présent également les inhibiteurs du cotransporteur sodium-glucose de type 2 (iSGLT2, également appelés gliflozines), les analogues du glucagon-like peptide- 1 (GLP- 1) et les antagonistes du récepteur aux minéralocorticoïdes non stéroïdiens (non commercialisés en France à la date de publication). Cet article propose une vue d’ensemble des thérapeutiques néphroprotectrices à destination des patients adultes porteurs d’une maladie rénale chronique.
Les prises de position relatives aux iSGLT2 rapportées dans cet article correspondent à celles du consensus proposé par la Société francophone du diabète (SFD), la Société française de cardiologie (SFC), le Collège national des cardiologues français (CNCF) et la Société francophone de néphrologie, dialyse et transplantation (SFNDT), publié dans la revue Néphrologie & Thérapeutique en août 2023 (librement téléchargeable sur le site de la SFD).1 Ce consensus est lui-même fondé sur les données de la littérature, les recommandations des sociétés savantes ainsi que les autorisations administratives de prescription de ces molécules. Les positions proposées sont également en accord avec les recommandations internationales de néphrologie KDIGO 2024.2
Les éventuelles restrictions de remboursement sont précisées, bien que celles-ci soient amenées à évoluer.
Mesures hygiénodiététiques et blocage du système rénine-angiotensine-aldostérone
La prise en charge du patient porteur de MRC comporte systématiquement des mesures hygiénodiététiques, telles que la restriction sodée (moins de 6 g/j de sel, ce qui correspond à une natriurèse des 24 heures inférieure ou égale à 102 mmol) et protidique (inférieure ou égale à 0,8 g/kg/j, soit une urée urinaire inférieure ou égale à 4 mmol/kg/24 heures), le contrôle des facteurs de risque cardiovasculaire (en particulier l’équilibre du diabète, de l’hypertension artérielle, l’arrêt du tabac et la lutte contre l’obésité) et l’activité physique.
Les inhibiteurs du système rénine-angiotensine-aldostérone, à savoir les inhibiteurs de l’enzyme de conversion (IEC) ou les antagonistes des récepteurs de l’angiotensine II (ARA2), gardent une place centrale. Ils sont systématiquement introduits en cas d’hypertension artérielle ou d’albuminurie, et dès le stade de microalbuminurie chez le patient diabétique. L’administration progressive respecte des paliers de doses (trois paliers le plus souvent), avec une surveillance biologique (ionogramme et créatininémie) et tensionnelle deux semaines après chaque augmentation. Les inhibiteurs du système rénine-angiotensine-aldostérone induisent souvent une baisse du débit de filtration glomérulaire (DFG), tolérée si elle ne dépasse pas 25 %. Ils sont un prérequis à l’introduction d’un iSGLT2 et d’un antagoniste du récepteur aux minéralocorticoïdes non stéroïdiens chez les patients MRC, sauf en cas d’intolérance.
Inhibiteurs du SGLT2 dans la maladie rénale chronique
Mécanisme d’action encore mal élucidé
Le mécanisme prédominant dans l’effet néphroprotecteur des iSGLT2 fait l’objet de nombreuses discussions.
Le bénéfice rénal s’explique au moins partiellement par la combinaison de modifications hémodynamiques intrarénales, un effet antifibrosant et la baisse modérée du poids et de la pression artérielle.
L’effet antihyperglycémiant pourrait y contribuer chez les patients porteurs d’un diabète de type 2 avec un DFG supérieur à 60 mL/min/1,73 m2. Cependant, l’effet néphroprotecteur des iSGLT2 est similaire que les patients soient diabétiques ou non et qu’ils soient porteurs d’une maladie rénale avancée ou non, ce qui ne plaide pas en faveur d’une forte responsabilité de cet effet.
L’effet glycosurique diminue avec la baisse du débit de filtration glomérulaire, devenant très réduit en cas de DFG inférieur à 45 mL/min/1,73 m2, et négligeable en dessous de 30 mL/min/1,73 m2. Les iSGLT2 n’ont donc classiquement pas d’effet sur l’équilibre glycémique des patients diabétiques porteurs d’une insuffisance rénale chronique avancée.
Preuves scientifiques de leur efficacité
Trois essais thérapeutiques randomisés ont ciblé les patients porteurs de MRC, avec pour objectif principal de démontrer le bénéfice rénal des iSGLT2 : CREDENCE (canagliflozine, patients diabétiques uniquement),3 DAPA-CKD (dapagliflozine, patients diabétiques et non diabétiques)4 et EMPA-KIDNEY (empagliflozine, patients diabétiques et non diabétiques)5 [tableau 1]. De nombreux autres essais (non décrits ici) ont démontré, d’une part, le bénéfice cardiovasculaire des iSGLT2 dans la population MRC et, d’autre part, le bénéfice rénal de ce traitement dans d’autres populations (diabète de type 2 ; insuffisance cardiaque à fraction d’éjection du ventricule gauche [FEVG] altérée ou préservée).
Ces essais de néphroprotection ont inclus des patients traités par une dose maximale tolérée d’inhibiteur du système rénine-angiotensine-aldostérone (IEC ou ARA2).
De nombreuses études observationnelles post-autorisation de mise sur le marché (AMM) corroborent leurs résultats extrêmement favorables.
Dans ces études, les iSGLT2 retardent de façon significative l’arrivée au stade d’insuffisance rénale terminale, diminuent le risque de décès d’origine cardiovasculaire ou rénale, réduisent la baisse de plus de 40 ou 50 % du DFG ou le doublement de créatininémie (réduction relative du risque de 28 à 39 % ; p < 0,05), avec seulement environ 20 patients à traiter pour éviter un événement rénal.
Une méta-analyse publiée en 2022 dans la revue The Lancet6 combine les données d’essais randomisés de forte puissance et montre que les iSGLT2 diminuent en moyenne le risque de progression de la MRC de 37 % (RR : 0,63 ; IC à 95 % : 0,58 - 0,69), d’insuffisance rénale aiguë de 23 % (RR : 0,77 ; IC à 95 % : 0,70 - 0,84), de décès cardiovasculaire ou d’hospitalisation pour insuffisance cardiaque de 23 % (RR : 0,77 ; IC à 95 % : 0,74 - 0,81) et de décès cardiovasculaire de 14 % (RR : 0,86 ; IC à 95 % : 0,81 - 0,92). L’albuminurie diminue également significativement.
Ces bénéfices cardiovasculaires et rénaux sont indépendants du statut diabétique, du DFG, du niveau d’albuminurie et de la néphropathie causale (néphropathie diabétique et glomérulonéphrite notamment).
Les essais cliniques n’ont pas inclus de patients ayant un diabète de type 1, une néphropathie lupique, une vascularite, une polykystose rénale ou une greffe rénale ; le bénéfice dans ces populations n’est donc pas démontré.
Il semble exister un effet de classe des iSGLT2, avec des bénéfices comparables d’une molécule à l’autre. Cependant, puisque les études cliniques n’ont pas ciblé les mêmes populations, les diverses molécules n’ont pas strictement les mêmes conditions de remboursement (tableau 2).
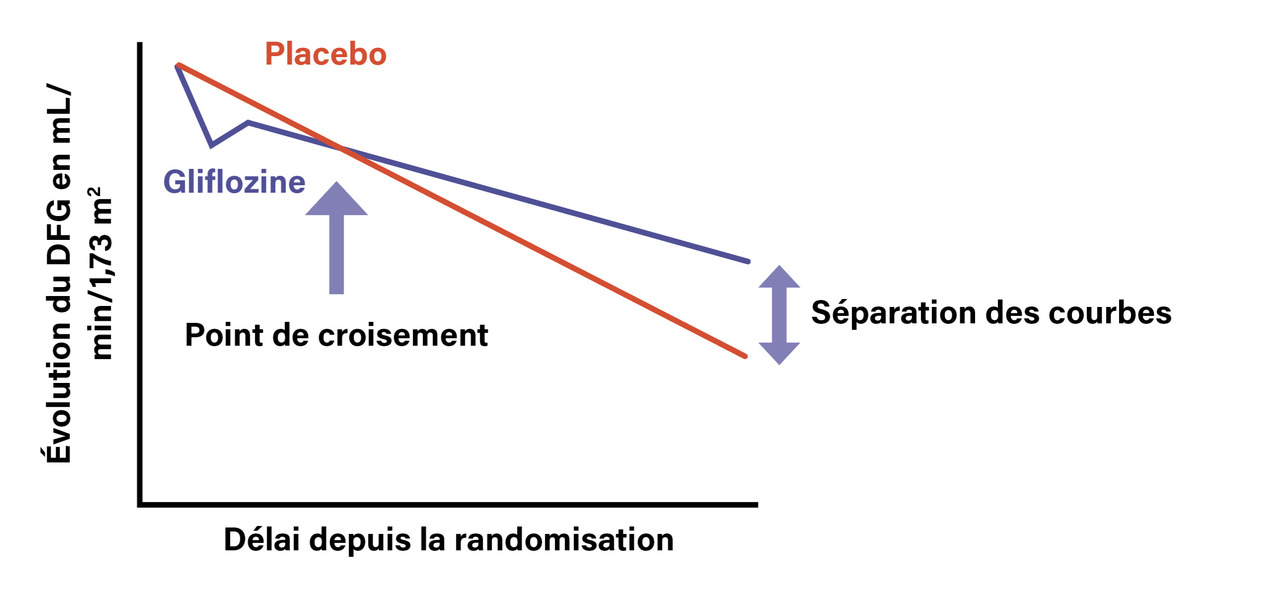
Impact de la prescription d’un iSGLT2 sur le DFG
Le DFG diminue le plus souvent à l’introduction des iSGLT2, que le patient soit diabétique ou non. La baisse est en moyenne de 2 à 4 mL/min/1,73 m2 ; elle peut être nettement plus importante, parfois au-delà de 30 %. Quel que soit le profil de variation initiale du DFG (baisse modérée, sévère ou absence de baisse), le bénéfice rénal des iSGLT2 persiste : après cette baisse initiale (d’origine hémodynamique, entièrement réversible à l’arrêt), les iSGLT2 diminuent la vitesse de baisse du DFG, avec des courbes qui croisent celle du placebo en six à dix-huit mois (fig. 1). On constate donc un effet sur le DFG d’allure similaire à celui des IEC/ARA2, mais une ampleur d’efficacité plus marquée.
Indication des iSGLT2 chez les patients porteurs d’une maladie rénale chronique
Au vu des données scientifiques, le consensus SFD-SFC-CNCF-SFNDT1 retient les indications suivantes chez les patients porteurs de MRC (fig. 2) :
- DFG < 45 mL/min/1,73 m2 (indépendamment de l’albuminurie) ;
- et/ou rapport albumine/créatinine urinaire (RAC) > 200 mg/g (20 mg/mmol) [quel que soit le DFG] ;
- et/ou, en cas d’évolutivité de la MRC ou de risque cardiovasculaire élevé, DFG entre 45 et 60 mL/min/1,73 m2 et RAC > 30 mg/g (3 mg/mmol).
Les études ont inclus des patients avec un DFG > 20 mL/min/1,73 m2 ; les iSGLT2 ne doivent à ce jour pas être introduits en cas de DFG < 20 mL/min/1,73 m2. Une fois introduits, ils peuvent cependant être maintenus jusqu’à la prise en charge en dialyse ou en greffe rénale.
À ces indications « MRC » s’ajoutent celles liées au diabète de type 2 ou à l’insuffisance cardiaque, qui ne sont pas l’objet de cet article.
Molécules sur le marché en France
Trois iSGLT2 disposent d’une AMM et d’un remboursement dans l’indication MRC en France (tableau 2). Les associations fixes avec la metformine ne sont pas adaptées en cas de DFG inférieur à 45 mL/min/1,73 m2, puisqu’elles impliquent 2 g/j de metformine (dapagliflozine/metformine 5/1 000 mg et empagliflozine/metformine 5/1 000 mg et 12,5/1 000 mg).
Conditions d’utilisation et de remboursement par l’Assurance maladie en France
Les conditions d’utilisation et de remboursement des iSGLT2 dans l’indication MRC sont spécifiques à chaque molécule et amenées à évoluer. Les données valables à la date de mise à jour de cet article (février 2025) sont résumées dans le tableau 2.
L’empagliflozine est la molécule pour laquelle le remboursement dans l’indication MRC couvre la population la plus large, très proche du consensus SFD-SFC-CNCF-SFNDT.1 Elle est la seule qui cible également les patients non protéinuriques.
Précautions d’usage
Le rôle des médecins, généralistes ou d’une autre spécialité, est de prescrire un iSGLT2 chez les patients qui relèvent de ce traitement et d’éviter de l’interrompre sans raisons justifiées.
La prescription doit s’accompagner d’une information et d’une vigilance particulières, en particulier chez les patients diabétiques (tableau 3).
Analogues du GLP- 1 dans la néphroprotection du patient diabétique de type 2
Ce paragraphe n’évoque volontairement pas l’indication « obésité » des analogues du GLP- 1, du fait de leur prescription initiale obligatoire par un médecin spécialiste en endocrinologie-diabétologie-nutrition ou compétent en nutrition, de leur indication restreinte (IMC ≥ 35 kg/m2 et échec de prise en charge nutritionnelle) et de leur absence de remboursement à ce jour en France.
Chez les patients diabétiques de type 2 et porteurs d’une MRC, la prescription d’un analogue du GLP- 1 doit être systématiquement envisagée. Les analogues du GLP- 1, qui avaient déjà apporté la preuve de leur bénéfice métabolique et cardiovasculaire, ont récemment démontré leur effet néphroprotecteur grâce aux études LEADER (liraglutide 1,8 mg/j), REWIND (dulaglutide 1,5 mg/semaine), et SUSTAIN 6 et FLOW (sémaglutide 1 mg/semaine). Le bénéfice est retrouvé que les patients soient ou non porteurs d’une MRC et/ou d’une maladie cardiovasculaire. Par exemple, dans l’étude FLOW (seule de ces quatre études dont le critère rénal était le critère de jugement principal),7 des patients diabétiques atteints de MRC et déjà traités par IEC ou ARA2 ont été inclus ; le traitement par sémaglutide s’accompagne d’une réduction des événements rénaux de 24 % (RR : 0,76 ; IC à 95 % : 0,66 - 0,88), de la mortalité d’origine cardiovasculaire de 29 % (RR : 0,71 ; IC à 95 % : 0,56 - 0,89) et de la mortalité toute cause de 20 % (RR : 0,8 ; IC à 95 % : 0,67 - 0,95). Cet effet est identique que les patients soient ou non traités par iSGLT2.8
Les mécanismes de l’effet néphroprotecteur des analogues du GLP- 1 sont multiples. Ils comprennent, entre autres, la réduction de la pression artérielle et du poids, l’amélioration de la fonction endothéliale, des effets anti-inflammatoires et une réduction de l’albuminurie.
Les recommandations nationales et internationales récentes, à savoir celles proposées conjointement par l’American Diabetes Association (ADA) et l’European Association for the Study of Diabetes (EASD) en septembre 2022,9 la prise de position de la SFD de 202310 et les recommandations KDIGO2 et HAS11 en 2024, placent les analogues du GLP- 1 comme traitement antidiabétique à privilégier en cas d’équilibre insuffisant avec les iSGLT2 chez les patients diabétiques de type 2 porteurs d’une MRC.
Les analogues du GLP- 1 utilisables chez les patients porteurs d’une MRC sévère sont le liragludide, le sémaglutide et le dulaglutide, prescriptibles si le DFG est ≥ 15 mL/min/1,73 m2. L’association liraglutide-insuline degludec est également utilisable. Pour les DFG inférieurs à 15 mL/min/1,73m2, les analogues du GLP- 1 ne sont pas recommandés, faute de données suffisantes.
Malheureusement, à ce jour, les critères de remboursement en France ne permettent pas d’associer un iSGLT2 et un analogue du GLP- 1 dans l’indication diabète de type 2. Il faut donc cibler un remboursement de l’iSGLT2 dans l’indication MRC et de l’analogue du GLP- 1 dans l’indication diabète de type 2.
Un dispositif d’accompagnement à la prescription des analogues du GLP- 1 s’applique depuis le 1er février 2025. Les médecins qui prescrivent ces traitements doivent remplir un formulaire à trois volets, accessible soit sur le site amelipro, soit via https ://www.ameli.fr/rhone/medecin/exercice-liberal/regles-de-prescription-et-formalites/accompagnement-prescription. L’objectif est de s’assurer que la prescription s’inscrit dans le cadre de l’AMM et des indications thérapeutiques de remboursement du médicament. Ce formulaire est à renseigner une seule fois par patient. Il doit être présenté par le patient à chaque dispensation, sauf s’il est enregistré dans son dossier médical partagé ou dans Mon espace santé. Il est, à ce jour, valable sans limite de durée, donc il ne doit pas être renouvelé. En l’absence de formulaire, le pharmacien peut dispenser le médicament, mais le patient ne sera pas remboursé. Ces mesures récentes pourraient évoluer dans les prochains mois, au vu de la demande d’assouplissement de la Société francophone du diabète.
L’introduction (ou l’augmentation de dose) d’un analogue du GLP- 1 chez un patient sous iSGLT2 nécessite une vigilance sur l’impact des troubles digestifs potentiellement favorisés par l’analogue du GLP- 1 sur l’état d’hydratation.
Antagonistes des récepteurs aux minéralocorticoïdes non stéroïdiens dans la néphropathie diabétique
Le traitement présenté dans ce paragraphe n’est pas commercialisé en France à ce jour, mais est disponible dans de nombreux pays européens. Comme les analogues du GLP- 1, il ne cible que les patients porteurs d’un diabète de type 2.
Les antagonistes des récepteurs aux minéralocorticoïdes non stéroïdiens, parmi lesquels on trouve la finérénone, ciblent les effets délétères de l’aldostérone sur les reins, à savoir l’inflammation et la fibrose ; ils réduisent ainsi la progression de la néphropathie diabétique. Ils ont démontré leurs effets cardio- et néphroprotecteurs chez les patients porteurs d’une MRC associée à un diabète de type 2 dans les études FIDELIO-DKD12 et FIGARO-DKD,13 ainsi que dans l’analyse poolée FIDELITY.14
Les recommandations internationales de néphrologie KDIGO 20242 recommandent l’utilisation de la finérénone chez les patients diabétiques de type 2 porteurs d’une maladie rénale chronique avec albuminurie et traités par la dose maximale tolérée d’IEC ou ARA2 (DFG > 25 mL/min/1,73 m2 + RAC > 3 mg/mmol), en l’absence d’hyperkaliémie. Cette indication est indépendante de la présence ou non d’un iSGLT2.
La posologie cible de finérénone est de 20 mg/j, en respectant un palier initial à 10 mg en cas de DFG inférieur à 60 mL/min/1,73 m2.
Malgré un avis favorable de la Haute Autorité de santé pour les patients diabétiques de type 2 porteurs d’une MRC de stades 1 à 4 avec albuminurie, ce traitement n’est pas encore commercialisé en France.
Nouvelles molécules pour préserver la fonction rénale
Les progrès récents dans le domaine de la néphroprotection ouvrent de nouvelles options thérapeutiques, complémentaires les unes des autres, pour préserver la fonction rénale des patients atteints de maladie rénale chronique et réduire le risque d’insuffisance rénale terminale. Les patients porteurs d’une néphropathie diabétique sont particulièrement concernés. Une utilisation judicieuse de ces traitements, combinée à une approche multifactorielle incluant des mesures hygiénodiététiques, une éducation thérapeutique individualisée et un suivi régulier, permettent d’optimiser le bénéfice de ces thérapeutiques.
2. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2024 Clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int 2024;105(4S):S117-S314.
3. Perkovic V, Jardine MJ, Neal B, et al.; CREDENCE Trial Investigators. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med 2019;380(24):2295-306.
4. Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al.; DAPA-CKD Trial Committees and Investigators. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020;383(15):1436-46.
5. The EMPA-KIDNEY Collaborative Group; Herrington WG, Staplin N, Wanner C, et al. Empagliflozin in patients with chronic kidney disease. N Engl J Med 2023;388(2):117-27.
6. Nuffield Department of Population Health Renal Studies Group; SGLT2 inhibitor Meta-Analysis Cardio-Renal Trialists’ Consortium. Impact of diabetes on the effects of sodium glucose co-transporter-2 inhibitors on kidney outcomes: Collaborative meta-analysis of large placebo-controlled trials. Lancet 2022;400(10365):1788-801.
7. Perkovic V, Tuttle KR, Rossing P, et al; FLOW Trial Committees and Investigators. Effects of semaglutide on chronic kidney disease in patients with type 2 diabetes. N Engl J Med 2024;391(2):109-21.
8. Mann JFE, Rossing P, Bakris G, et al. Effects of semaglutide with and without concomitant SGLT2 inhibitor use in participants with type 2 diabetes and chronic kidney disease in the FLOW trial. Nat Med 2024;30(10):2849-56.
9. Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2022;45(11):2753-86.
10. Darmon P, Bauduceau B, Bordier L, et al. Prise de position de la Société francophone du diabète (SFD) sur les stratégies d’utilisation des traitements anti-hyperglycémiants dans le diabète de type 2 - 2023. Med Mal Metab 2023;17(8):664-93.
11. Haute Autorité de santé. Recommandation de bonne pratique. Stratégie thérapeutique du patient vivant avec un diabète de type 2. Juin 2024. https://urls.fr/AIyVH4
12. Bakris GL, Agarwal R, Anker SD, et al.; FIDELIO-DKD Investigators. Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. N Engl J Med 2020;383(23):2219-29.
13. Pitt B, Filippatos G, Agarwal R, et al.; FIGARO-DKD Investigators. Cardiovascular events with finerenone in kidney disease and type 2 diabetes. N Engl J Med 2021;385(24):2252-63.
14. Agarwal R, Filippatos G, Pitt B, et al.; FIDELIO-DKD and FIGARO-DKD investigators. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: The FIDELITY pooled analysis. Eur Heart J 2022;43(6):474-84. Erratum in: Eur Heart J 2022;43(20):1989.
Dans cet article
- Mesures hygiénodiététiques et blocage du système rénine-angiotensine-aldostérone
- Inhibiteurs du SGLT2 dans la maladie rénale chronique
- Analogues du GLP- 1 dans la néphroprotection du patient diabétique de type 2
- Antagonistes des récepteurs aux minéralocorticoïdes non stéroïdiens dans la néphropathie diabétique
- Nouvelles molécules pour préserver la fonction rénale