Définition (rang A)
L’aménorrhée est définie par l’absence de règles. Elle est dite primaire en l’absence de tout antécédent de saignement dès l’âge de 15 ans, ou secondaire en cas d’arrêt des saignements pendant au moins trois mois chez une adolescente/femme préalablement réglée.
L’aménorrhée peut être précédée d’une période d’oligo-/spanioménorrhée, qui correspond respectivement à des cycles irréguliers/rallongés. L’intervalle normal entre deux cycles est globalement de vingt-six à trente et un jours (des variations peuvent exister ; définition de l’Organisation mondiale de la santé : de vingt-cinq à trente-cinq jours), avec une moyenne de vingt-huit jours. Une spanioménorrhée est définie par des cycles de plus de quarante-cinq jours.
Une enquête étiologique est nécessaire après avoir caractérisé le type d’aménorrhée (primaire ou secondaire).
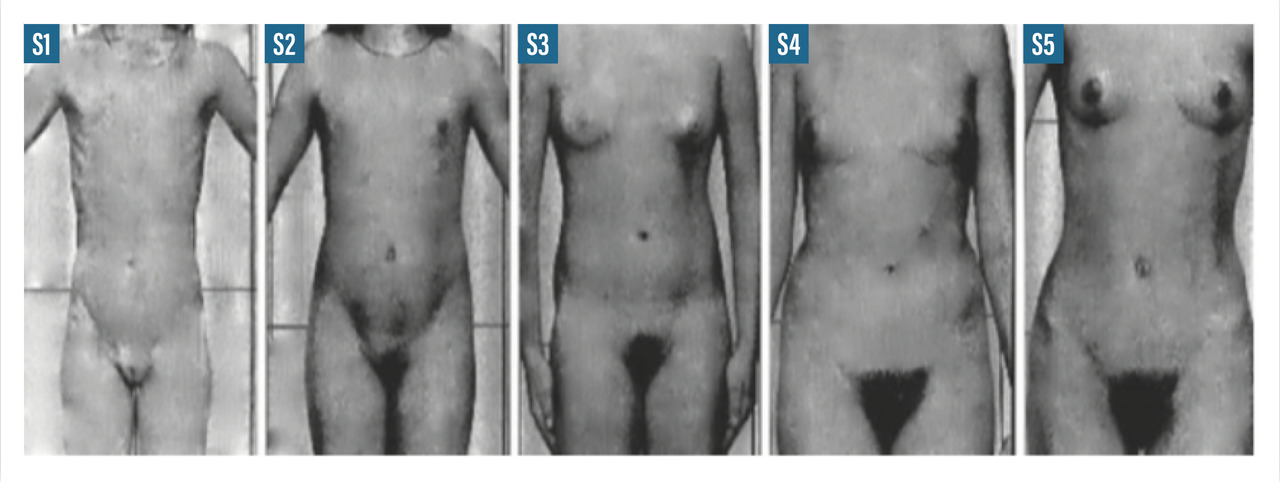
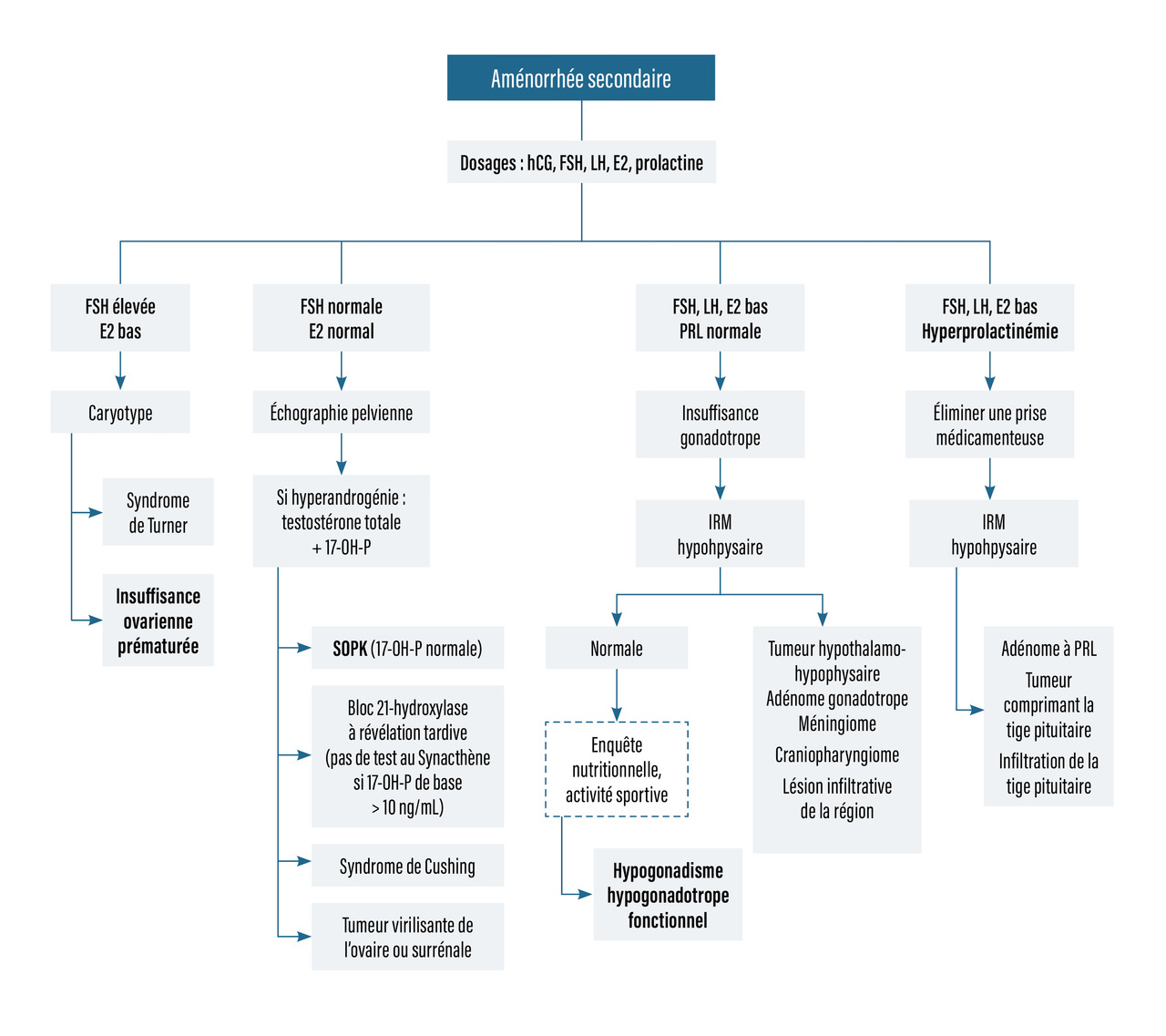
L’exploration d’une aménorrhée primaire débute par l’évaluation du stade pubertaire selon les stades de Tanner, classés de 1 à 5 (fig. 1).
La première manifestation de la puberté chez la fille est le développement des seins. Il est considéré comme physiologique s’il survient entre 8 et 13 ans. Les règles apparaissent en moyenne deux ans après le développement mammaire. Le retard pubertaire est défini par l’absence de développement des seins à 13 ans, ou l’absence de règles à 15 ans.
Plusieurs causes sont à l’origine d’une aménorrhée. Elles peuvent être « centrales », en lien avec une affection de l’axe hypothalamo-hypophysaire, ou « périphériques », en lien avec une pathologie ovarienne/utérine. L’aménorrhée peut survenir dans le cadre soit d’un retard pubertaire complet, soit d’une puberté débutée puis arrêtée, soit d’un développement pubertaire normal.
Régulation de l’axe hypothalamo-hypophyso-ovarien
L’axe gonadotrope implique certaines régions hypothalamiques, l’hypophyse et les ovaires. L’hypothalamus est à l’origine d’une sécrétion pulsatile de l’hormone appelée gonadolibérine, ou gonadotropin-releasing hormone (GnRH), qui induit la sécrétion hypophysaire de deux hormones gonadotropes : l’hormone folliculo-stimulante (FSH) et l’hormone lutéostimulante (LH). Ces gonadotrophines, libérées dans la circulation sanguine, se lient sur leurs propres récepteurs localisés dans les follicules ovariens et induisent la sécrétion des stéroïdes sexuels, essentiellement l’estradiol (E2) et la progestérone (P). E2 et P exercent un rétrocontrôle sur l’hypothalamus et l’hypophyse. Ce rétrocontrôle est essentiellement négatif, car les stéroïdes ralentissent la sécrétion de GnRH, sauf au moment du pic préovulatoire de LH où le rétrocontrôle est positif. En effet, une montée d’E2 est nécessaire pour déclencher le pic préovulatoire de GnRH et de LH. La survenue des règles nécessite plusieurs étapes :
- la montée de l'E2 en première partie du cycle menstruel, appelée phase folliculaire ;
- le pic préovulatoire de LH, qui induit l’ovulation ;
- la montée de la progestérone lors de la deuxième partie du cycle menstruel, appelée phase lutéale ;
- la chute de l'E2 et de la P, induisant la desquamation de l’endomètre utérin.
Démarche diagnostique devant une aménorrhée (rang A)
Le bilan initial à réaliser devant une aménorrhée comporte le dosage de la gonadotrophine chorionique humaine (hCG) pour éliminer de manière systématique une grossesse, ainsi que les dosages sanguins de FSH, LH, E2 et prolactine. La testostérone est mesurée en cas d’hyperandrogénie clinique.
Ce bilan initial hormonal oriente la suite de la prise en charge. Une échographie pelvienne peut également être réalisée, à la recherche d'une anomalie de la filière génitale.
Un test aux progestatifs peut être utile dans la démarche étiologique. Il consiste en l’administration de comprimés de progestérone pendant dix jours. Ce test est dit positif s’il induit des règles dans les quinze jours suivant l’arrêt du progestatif.
Il est négatif s’il n’y a pas de règles à l’arrêt du progestatif. Un test positif est le témoin d’une bonne imprégnation utérine d’E2. Un test est négatif en l’absence d’utérus, en présence d’une grossesse ou lorsque la sécrétion endogène d’E2 est trop basse.
Estradiol abaissé et FSH-LH normales ou basses
Il s’agit d’un hypogonadisme hypogonadotrope, en lien avec une dysfonction de l’axe hypothalamo-hypophysaire. La réalisation d’une imagerie par résonance magnétique (IRM) hypothalamo-hypophysaire est indispensable.
Quatre causes principales se distinguent (rang B).
L’hypogonadisme hypogonadotrope congénital (HHC) doit être évoqué face à une aménorrhée primaire avec absence de développement pubertaire ou une puberté arrêtée. Il s’agit d’une maladie rare. Parmi les causes d’HHC, il existe le syndrome de Kallmann-de Morsier, qui associe un HHC et des troubles olfactifs, à type d’anosmie ou d’hyposmie. Ce syndrome est secondaire à une anomalie de la migration des neurones à GnRH de la placode olfactive vers le noyau arqué, pendant la vie embryonnaire. Il induit un défaut de GnRH et une absence de stimulation des gonadotrophines hypophysaires LH et FSH (responsable de l’absence de développement pubertaire et de l’aménorrhée primaire). Un HHC peut survenir chez une adolescente avec une olfaction normale. Des variants génétiques pathogènes (plus d’une trentaine de gènes) ont été mis en évidence dans les HHC. Selon le type de variant, le développement pubertaire est plus ou moins complet. Une enquête familiale est nécessaire, à la recherche d’autres cas d’hypogonadisme.
Une tumeur de la région hypothalamo-hypophysaire doit être écartée avant de poser le diagnostic d’HHC. Ce type de tumeur peut réaliser une compression mécanique des cellules hypophysaires et ainsi induire une insuffisance gonadotrope, associée ou non à d’autres déficits antéhypophysaires (corticotrope, somatotrope, thyréotrope).
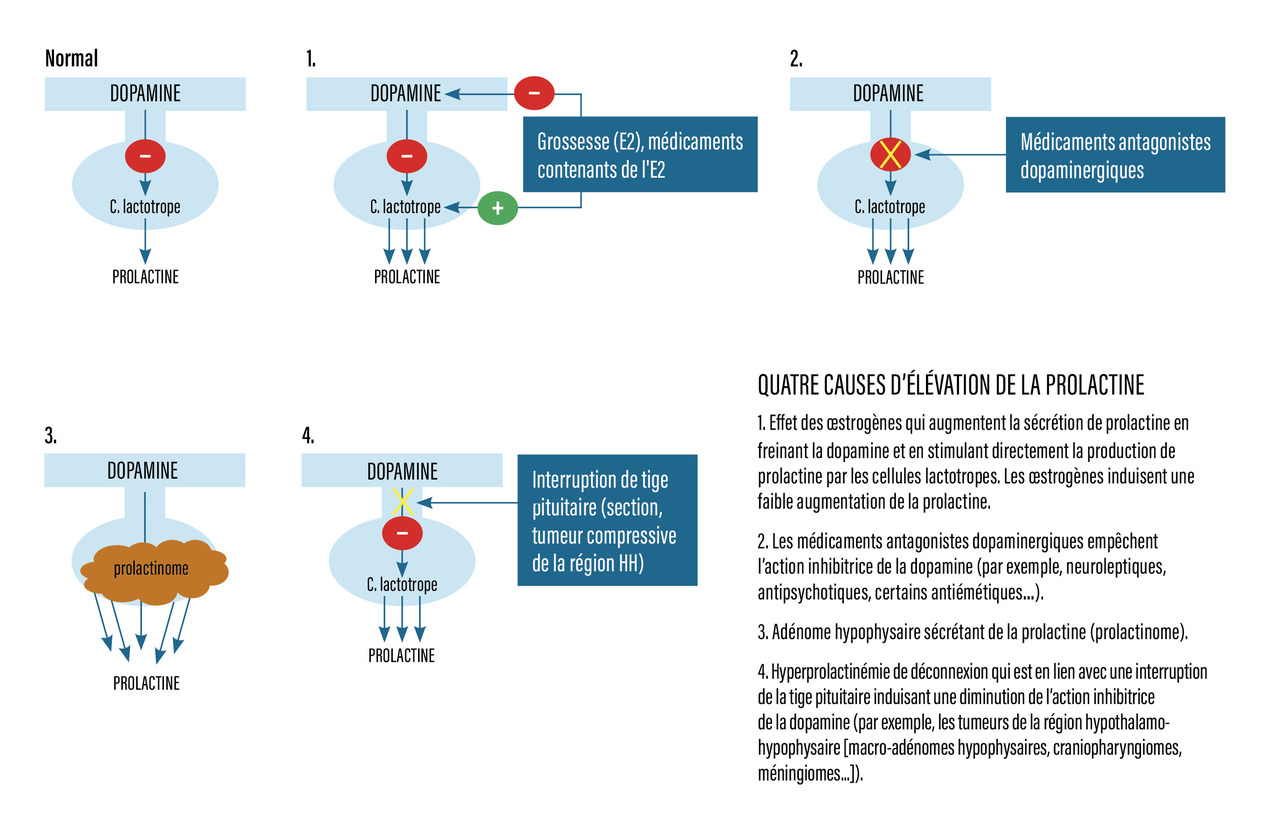
Parmi les tumeurs possibles, il peut s’agir d’un craniopharyngiome (tumeur épithéliale bénigne rare qui se développe au niveau de la tige pituitaire ou dans la région suprasellaire), d’un macro-adénome hypophysaire ou d’une tumeur compressive de la région, comme un méningiome ou un germinome. Un autre mécanisme responsable d’une insuffisance gonadotrope est l’hyperprolactinémie de déconnexion. En effet, la tumeur comprimant la tige pituitaire inhibe la sécrétion de dopamine, et la prolactine augmente. L’hyperprolactinémie de déconnexion ou l’hyperprolactinémie secondaire à un micro- ou un macro-adénome à prolactine diminuent la pulsatilité de la GnRH et induisent un déficit gonadotrope (fig. 2).
Les principales causes d’hyperprolactinémie sont expliquées dans la figure 2.
L’hypogonadisme hypogonadotrope fonctionnel est une autre cause fréquente d’hypogonadisme hypogonadotrope. Il survient à la suite d’une carence d’apports caloriques et/ou d’une activité physique excessive. La balance énergétique négative induit un défaut de pulsatilité de la GnRH, et donc un défaut de stimulation de FSH-LH, qui peut être responsable d’une aménorrhée primaire ou secondaire. Il concerne davantage les aménorrhées secondaires que les aménorrhées primaires. Un interrogatoire détaillé est indispensable ; il recherche un indice de masse corporelle inférieur à 20 kg/m2, une perte de poids récente, une restriction calorique, en particulier de la consommation de matières grasses, une dépense énergétique excessive par rapport aux apports. Il existe souvent un profil psychologique particulier, avec une anxiété et une maîtrise de soi. Le diagnostic d’aménorrhée hypothalamique fonctionnelle est un diagnostic d’élimination qui doit être établi après avoir éliminé une cause organique.
La nécrose hypophysaire du post-partum (syndrome de Sheehan) est une cause exceptionnelle survenant
dans un contexte d’accouchement hémorragique avec collapsus vasculaire. Elle est responsable d’une insuffisance antéhypophysaire avec déficit gonadotrope responsable de l’aménorrhée secondaire (rang B).
D’autres causes sont possibles, telles l’hypophysite auto-immune ou lymphocytaire, l’infiltration de la tige pituitaire (sarcoïdose, histiocytose, lymphome), l’hémochromatose. Il est toujours nécessaire de rechercher une prise médicamenteuse susceptible d’induire une hyperprolactinémie.
Estradiol abaissé avec taux de FSH augmenté (supérieur à 25 UI/L)
Il s’agit d’un hypogonadisme hypergonadotrope. Il est le reflet d’une dysfonction ovarienne. Selon le moment de survenue de cette dysfonction ovarienne, l’adolescente ou la femme peut avoir un impubérisme complet, une puberté partielle ou une puberté complète avec une aménorrhée secondaire. Il s’agit d’une insuffisance ovarienne précoce (IOP) si l’hypogonadisme hypergonadotrophique survient avant l’âge de 40 ans.
Les causes principales sont les suivantes (rang B).
Le syndrome de Turner (ST) constitue l’une des principales causes d’hypogonadisme hypergonadotrope. L’aménorrhée survient à la suite d’une atrésie folliculaire accélérée. Le ST doit systématiquement être évoqué devant une petite taille. Le diagnostic est confirmé par un caryotype sanguin à la recherche d’un caryotype 45,X ou d’une mosaïque 45,X/46,XX.
La ménopause doit être évoquée en premier lieu à partir de l’âge de 50 ans, devant un hypogonadisme hypergonadotrope. Elle ne nécessite pas de bilan sanguin pour affirmer le diagnostic.
D’autres causes sont possibles en cas d’IOP.
Les principales sont un antécédent de chirurgie ovarienne bilatérale, une chimiothérapie/radiothérapie, une prémutation du gène FMR1 (fragile X mental retardation) ou une atteinte auto-immune (polyendocrinopathie auto-immune).
Bilan hormonal de première intention normal
Devant une aménorrhée primaire avec un développement pubertaire normal et un bilan hormonal (FSH-LH, E2) normal, il faut évoquer une pathologie utérine (imperforation de l’hymen, absence d’utérus (syndrome de Mayer-Rokitansky-Küster-Hauser [encadré]).
Devant une aménorrhée secondaire avec un bilan hormonal normal, il faut évoquer une cause utérine mécanique, à la suite de synéchies utérines (très rare).
Testostéronémie élevée (rang B)
Sans signes d’hyperandrogénie clinique
Il existe un cas particulier d’aménorrhée primaire avec développement pubertaire normal, associant une hyperandrogénie biologique (élévation très importante de la testostéronémie à des taux masculins) à une élévation de la LH, mais sans signe de virilisation ni d’hyperandrogénie clinique : il s’agit du syndrome d’insensibilité complète aux androgènes.
Survenant chez des femmes ayant un caryotype 46,XY, il est secondaire à une perte de fonction du récepteur des androgènes. Les organes génitaux externes sont féminins. L’utérus est absent en raison de la sécrétion d’AMH par la gonade de type testiculaire, ce qui explique l’aménorrhée primaire. La prévalence de ce syndrome est très rare.
Avec signes d’hyperandrogénie clinique
Certaines patientes en aménorrhée primaire ou secondaire et avec un développement pubertaire normal ont des signes cliniques d’hyperandrogénie et une testostérone élevée. Il faut, dans ce cas, réaliser une imagerie ovarienne (échographie ou IRM si impossibilité de faire une échographie) et un dosage de la 17 -OH-progestérone (17 -OH-P) en phase folliculaire.
Quatre causes principales se distinguent (rang B) .
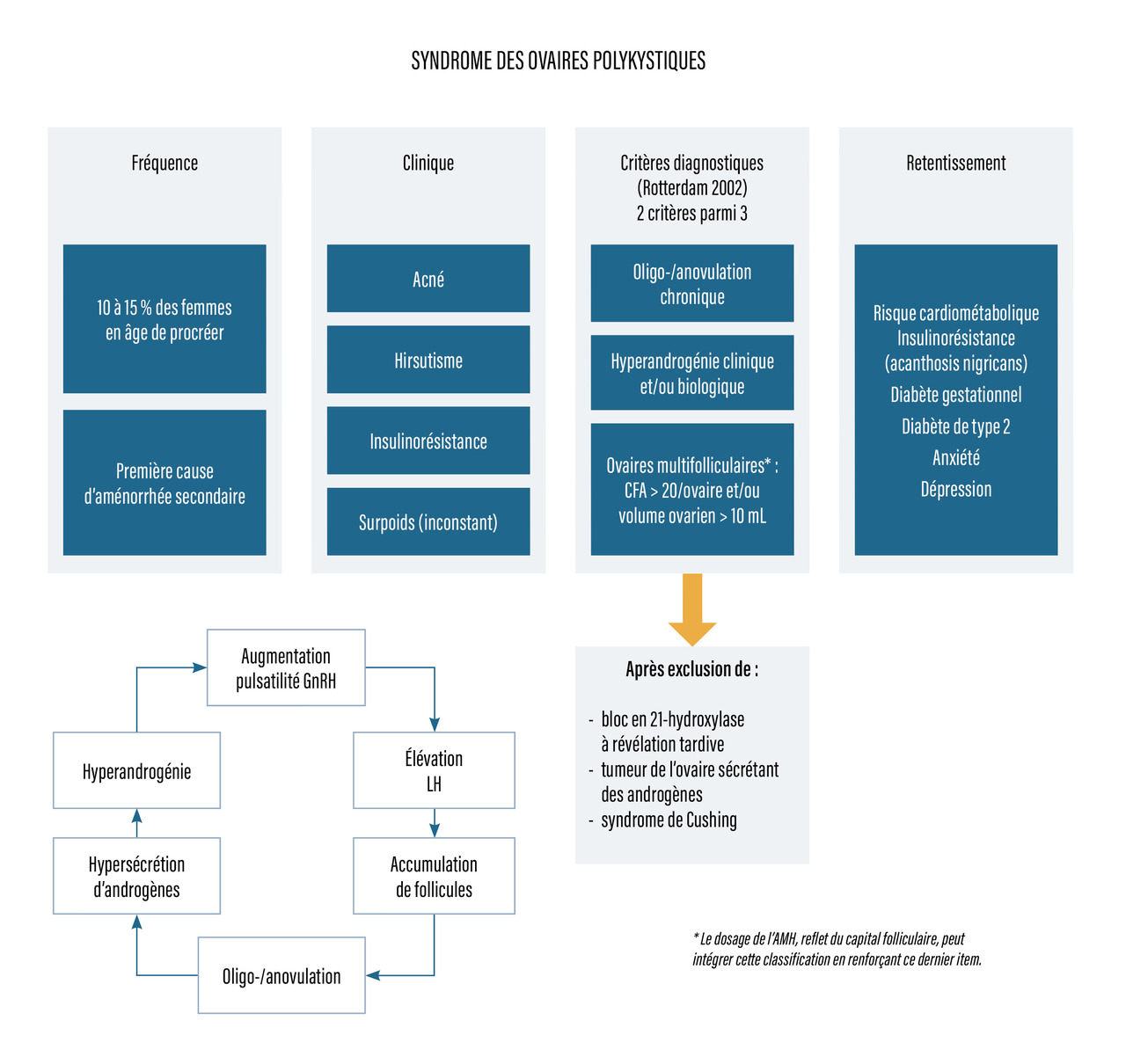
Le syndrome des ovaires polykystiques (SOPK) est une affection chronique se révélant souvent à l’âge de la puberté par l’association d’une spanioménorrhée à des signes cliniques d’hyperandrogénie comme l’acné, la séborrhée (voire l’hirsutisme)[fig. 3]. Ce syndrome concerne 10 à 15 % des femmes en âge de procréer, et son diagnostic repose sur la présence d’au moins deux de ces trois critères :
- oligo-/anovulation chronique, c’est-à-dire cycles longs ou aménorrhée ;
- hyperandrogénie clinique (séborrhée, acné, hirsutisme) et/ou biologique évaluée par le dosage de testostérone totale ;
- hypertrophie ovarienne à l’échographie (volume supérieur à 10 mL) ou ovaires multifolliculaires (compte folliculaire antral avec au moins 20 follicules sur au moins un ovaire). Le terme polykystique est un mauvais terme car il s’agit en réalité d’une accumulation de petits follicules.
Avant d’affirmer le diagnostic de SOPK, il est nécessaire d’éliminer les diagnostics différentiels, comme le bloc enzymatique en 21 -hydroxylase dans une forme non classique ou à révélation tardive, les tumeurs ovariennes ou surrénaliennes et le syndrome de Cushing.
Un bloc en 21 -hydroxylase incomplet, forme « non classique », induit par une mutation « perte de fonction » du gène CYP21A2, provoque une accumulation des précurseurs stéroïdiens en amont du bloc, notamment de la 17 -OH-P et des androgènes surrénaliens. Si la 17 -OH-P de base est inférieure à 2 ng/mL, le diagnostic est très peu probable. Si la 17 -OH-P est entre 2 et 10 ng/mL, il faut réaliser un test au Synacthène sur la 17 -OH-P.
Si la 17 -OH-P est de base ou lors du test au-dessus de 10 ng/mL, le diagnostic est très probable, et une confirmation génétique est nécessaire par le séquençage du gène codant pour la 21 -hydroxylase (CYP21A2).
Une tumeur de l’ovaire ou surrénale sécrétant des androgènes provoque l’apparition rapide des signes de virilisation (raucité de la voix, alopécie, hypertrophie musculaire et clitoridienne), le plus souvent en quelques mois, et la testostéronémie est élevée à plus de deux fois la normale.
Le syndrome de Cushing, hypercortisolisme, est dépisté devant les signes cliniques (faciès érythrosique, prise de poids, vergetures, amyotrophie, fragilité cutanée et hypertension artérielle) par un test de freinage minute sur le cortisol et/ou un cortisol urinaire des vingt-quatre heures sur le recueil urinaire des vingt-quatre heures.
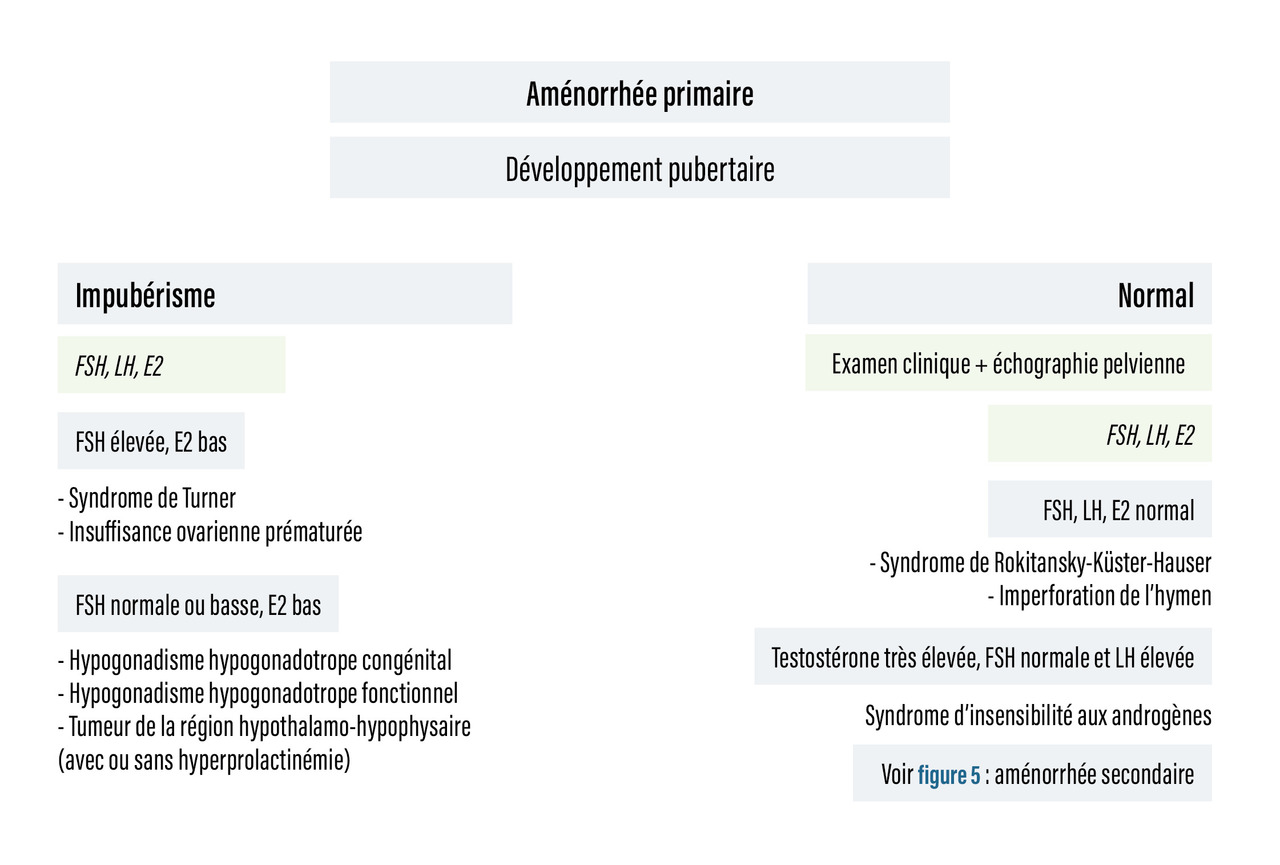
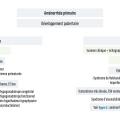
Les arbres diagnostiques devant une aménorrhée primaire et secondaire, synthétisant ces éléments, sont représentés respectivement dans les figures 4 et 5.
Conclusion
Certains motifs de consultation comme le retard pubertaire, l’hyperandrogénie, des troubles du comportement alimentaire ou une infertilité peuvent révéler un diagnostic d’aménorrhée.
En dehors de la grossesse, de la lactation et de la ménopause, l’aménorrhée est toujours pathologique. Elle est le témoin de l’existence d’une pathologie ovarienne, utérine ou de la région hypothalamo-hypophysaire. Son exploration est donc indispensable pour une bonne prise en charge.
Un hypogonadisme hypogonadotrope doit faire rechercher une hyperprolactinémie et faire réaliser une IRM hypophysaire. Une cause fréquente d’aménorrhée est l’aménorrhée d’origine hypothalamique, surtout chez l’adolescente, le plus souvent liée à une restriction alimentaire inappropriée (surtout en matières grasses), souvent associée à une activité physique excessive.
Des signes cliniques d’hyperandrogénie doivent faire doser la testostéronémie et faire évoquer le syndrome des ovaires polykystiques, qui concerne 10 à 15 % des femmes en âge de procréer.
Enfin, face à une aménorrhée, primaire ou secondaire, une petite taille doit faire penser au syndrome de Turner.
Deux principaux diagnostics en cas d’absence d’utérus à l’échographie
Le syndrome de Mayer-Rokitansky-Küster-Hauser (MRKH) est très rare (1/4 500 femmes). Les taux hormonaux (FSH, LH, estradiol) sont normaux car le fonctionnement ovarien est normal. Le syndrome MRKH est le plus souvent diagnostiqué à l’adolescence, lors de l’exploration d’une aménorrhée primaire chez des jeunes femmes ayant par ailleurs des caractères sexuels secondaires et des organes génitaux externes de type féminin. Dans ce syndrome, on observe une absence d’utérus et des deux tiers supérieurs du vagin. Le caryotype des patientes atteintes est 46,XX.
Le syndrome d’insensibilité complète aux androgènes est très rare. Il survient chez des femmes ayant un caryotype 46,XY. Il est secondaire à une perte de fonction du récepteur des androgènes. Cliniquement, les organes génitaux externes sont féminins, avec un développement mammaire normal. L’utérus est absent en raison de la sécrétion d’AMH par les gonades de type testiculaire. La pilosité est souvent faible. Il existe une hyperandrogénie biologique (élévation très importante de la testostéronémie supérieure à des taux masculins), une élévation de la LH, mais sans signes de virilisation ni d’hyperandrogénie clinique.
Drapeaux rouges et erreurs à ne pas commettre
Toujours penser à une grossesse en cours devant une aménorrhée.
La « pilule » œstroprogestative ne doit pas être prescrite chez une femme en aménorrhée sans exploration étiologique.
L’aménorrhée après un arrêt de pilule n’est pas un diagnostic, elle nécessite un bilan étiologique.
• Toute interruption du cycle menstruel au-delà d’un mois, même après arrêt d’une contraception orale, est anormale et justifie une enquête étiologique.
• L’exploration hormonale de première intention comprend le dosage de l’hCG plasmatique, l’estradiol (E2), la FSH, la LH et la prolactine. La testostérone est mesurée en cas d’hyperandrogénie clinique.
• La majorité des cas d’aménorrhée secondaire est liée, en dehors de la grossesse, à un syndrome des ovaires polykystiques.
• La cause la plus fréquente d’aménorrhée hypothalamo-hypophysaire est l’aménorrhée fonctionnelle. Il s’agit cependant d’un diagnostic d’élimination qui nécessite d’exclure une pathologie tumorale par la réalisation d’une IRM hypothalamo-hypophysaire.
Joham AE, Norman RJ, Stener-Victorin E, et al. Polycystic ovary syndrome. Lancet Diabetes Endocrinol 2022;10:668-80.
Seppä S, Kuiri-Hänninen T, Holopainen E et al. Diagnosis and management of primary amenorrhea and female delayed puberty. EJE 2021;184(6):225-42.
Klein DA, Paradise SL, Reeder RM. Amenorrhea: A systematic approach to diagnosis and management. Am Fam Physician 2019;100(1):39-48.
Gordon C, Ackerman KE, Berga SL et al. Functional hypothalamic amenorrhea: An endocrine society clinical practice guideline. JCEM 2017;102(5):1413-39.

 Encadrés
Encadrés