Avec plus de 47 000 nouveaux cas en 2023 et plus de 17 000 décès en 2018 en France, le cancer colorectal (CCR) est le troisième cancer le plus fréquent et la deuxième cause de mortalité par cancer. Bon nombre de ces décès sont évitables. Les facteurs de risque du CCR et ses modalités de dépistage ont déjà été développés dans un article paru dans La Revue du Praticien en 2022.1,2 Selon le type d’antécédents familiaux, il existe schématiquement deux situations qui induisent un risque très différent de CCR.
Dans moins de 5 % des CCR, un syndrome de prédisposition héréditaire est en cause, lié à une mutation constitutionnelle d’un des quatorze gènes identifiés (polyposes et syndrome de Lynch, par exemple) ; ces syndromes confèrent un risque très élevé de CCR, relèvent de mesures très spécifiques de prévention et de dépistage, en particulier d’une consultation d’oncogénétique, et ne sont pas l’objet de cet article.1,2
Dans 20 à 30 % des CCR, des antécédents familiaux de CCR sont présents, sans syndrome de prédisposition héréditaire connu.1 La plupart entraînent un sur-risque de CCR relativement faible, autrefois surévalué.3 Pour ces personnes, il n’y a pas moins de quatre sources contradictoires de recommandations françaises concernant le dépistage du CCR (tableau).4 - 7 Comment les médecins généralistes et gastroentérologues peuvent-ils s’y retrouver ?
Cet article fait le point sur le risque de CCR en cas d’antécédents familiaux de néoplasie colorectale sans syndrome de prédisposition héréditaire connu et sur le mode de dépistage adapté à chaque situation.
Place de la génétique et des facteurs environnementaux et comportementaux dans la carcinogenèse colorectale
Globalement, le rôle des facteurs génétiques est nettement minoritaire dans la carcinogenèse colorectale par rapport aux facteurs environnementaux et comportementaux associés au mode de vie occidental (malbouffe, sédentarité, surpoids et obésité). La moitié des CCR est attribuable à ces derniers, modifiables, et pourrait donc être évitée.1
Néanmoins, l’existence d’antécédents familiaux de CCR est une situation fréquente : en Europe, 7 à 11 % de la population générale a au moins un parent au premier degré atteint de CCR (de 22 à 29 % si l’on inclut les antécédents au deuxième degré). Cette proportion augmente avec l’âge, de 7,5 % chez les 40 - 44 ans à 10,9 % chez les 50 - 54 ans dans une série allemande.8 Dans cette série, 3,2 % des personnes avaient un parent au premier degré atteint de CCR avant 60 ans et 0,3 % deux parents au premier degré atteints.
La part de la génétique, bien que restant minoritaire, est plus importante dans la genèse des CCR précoces, diagnostiqués avant 50 ans, d’autant plus que l’âge au diagnostic est plus jeune.9 Avant 50 ans, environ 35 % des patients atteints ont des antécédents familiaux de CCR, 15 % un antécédent familial au premier degré sans syndrome de prédisposition et près de 20 % un syndrome de prédisposition héréditaire.9
Antécédents familiaux néoplasiques encore imparfaitement repérés
Toutes les études convergent pour constater que la recherche d’antécédents familiaux néoplasiques (colorectaux et autres) est imparfaite, tant en médecine générale que dans les autres spécialités. Si l’existence d’antécédents familiaux de cancer est souvent notée dans le dossier médical, certaines précisions, essentielles pour la prise en charge, sont fréquemment manquantes, en particulier l’âge de survenue du cancer chez le parent atteint.10 Par ailleurs, cette enquête doit être régulièrement actualisée.
Un antécédent familial confère-t-il un risque de CCR réellement élevé ?
Hors syndrome de prédisposition héréditaire, les antécédents familiaux de CCR confèrent un sur-risque de CCR relativement faible, corrélé au nombre, à la proximité et à l’âge du (ou des) parent(s) atteint(s), sans seuil précis défini.1,3 Le sur-risque de CCR en cas d’antécédent familial a été surévalué dans toutes les anciennes recommandations.3 Les divergences observées dans les recommandations récentes témoignent de leur faible niveau de preuve (tableau).11 - 17 Comme en France, il n’y a pas moins de quatre recommandations publiées aux États-Unis, sensiblement différentes les unes des autres.14 - 17
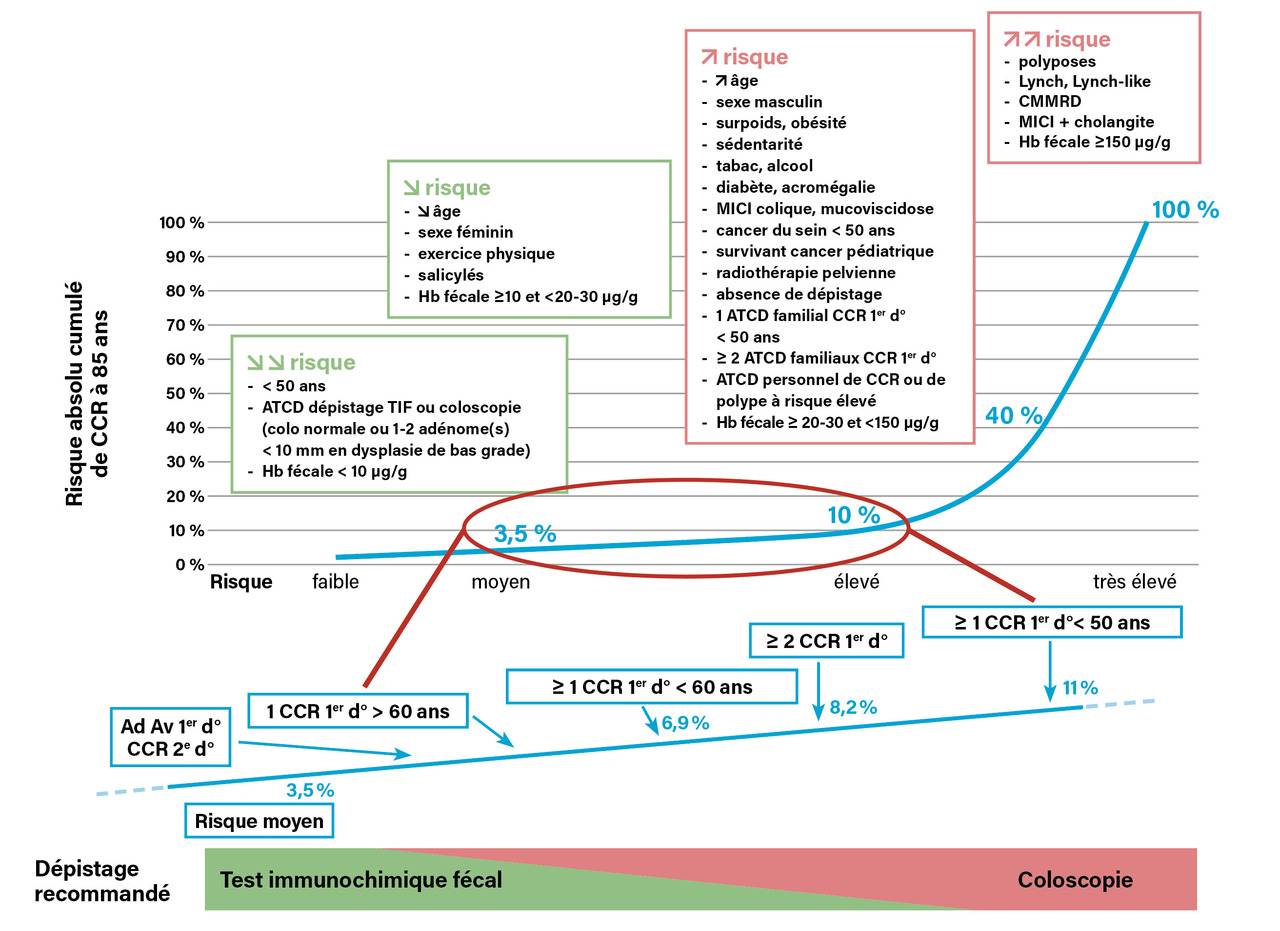
Le sur-risque de CCR lié à un antécédent familial est relatif, sa significativité statistique ayant été établie sur de grands effectifs en population. Ce sur-risque relatif collectif n’induit pas toujours un risque absolu individuel élevé, en particulier chez les moins de 50 ans.1,3 En Europe de l’Ouest, le risque absolu de développer un CCR dans les dix ans chez les personnes ayant au moins un parent au premier degré atteint avant 50 ans a été évalué à moins de 1 % jusqu’à l’âge de 40 ans et à 1,8 % à 50 ans dans la méta-analyse la plus récente.3 Le risque de CCR induit par des antécédents familiaux est maximal avant 60 ans et s’amenuise avec l’âge : un individu avec un seul parent au premier degré atteint de CCR quel que soit son âge, indemne de CCR à 55 - 60 ans, rejoint le niveau de risque de la population générale (ce n’est pas vrai en cas de deux parents au premier degré atteints).18,19 Le risque cumulé de CCR à 85 ans a été évalué à 3,5 % en population générale, 4,8 % en cas d’un parent au premier degré atteint de CCR (6,9 % si au moins un parent au premier degré atteint avant 60 ans, 11 % si atteint avant 50 ans), 8,2 % si au moins deux parents au premier degré sont atteints (figure).3
Au total, le risque de CCR n’est significativement élevé (multiplié par 3) que dans deux situations :
- un parent au premierdegré atteint de CCR avant 50 ans ;
- deux parents au premier degré atteints quel que soit leur âge.3
Les autres antécédents familiaux ne confèrent qu’unsur-risque relatif faible, évalué à 1,83 dans les études de cohortes pour un parent au premier degré atteint après 50 ans et à 1,09 en cas de parent au deuxième degré ou plus atteint.3 Des antécédents familiaux au premier degré de polype adénomateux, quel que soit leur âge de survenue, n’entraînent un sur-risque relatif, très faible, qu’en cas d’adénome avancé (taille supérieure ou égale à 10 mm ou dysplasie de haut grade).15 Il n’y a pas de sur-risque de CCR chez les apparentés d’une personne ayant des polypes adénomateux non avancés ou des polypes non adénomateux (hyperplasiques).15
Somme toute, un antécédent familial de CCR ne fait qu’avancer de cinq à quinze ans l’âge auquel le risque moyen est atteint.20 Le risque d’un individu de 50 ans à risque moyen d’avoir un CCR dans les dix ans (0,44 %) est atteint à 37 ans s’il a un seul parent au premier degré atteint de CCR à 45 - 49 ans, à 41 ans si le parent est atteint à 50 - 54 ans, à 35 ans en cas de deux parents au premier degré atteints (le plus jeune à 50 - 59 ans), à 43 ans si le plus jeune avait 60 ans ou plus.20
Test immunochimique fécal ou coloscopie en cas d’antécédent familial ?
En cas d’antécédent familial, la coloscopie de dépistage a deux inconvénients : adhésion limitée et faibles rapports bénéfice-risque et coût-efficacité. Quel que soit le pays, seule une minorité de personnes ayant des antécédents familiaux de CCR est dépistée par coloscopie (de 31 à 47 % selon les études ; 35,4 % dans une étude française, proportion moindre encore chez les 40 - 49 ans).8,21,22 Le rendement des coloscopies de dépistage effectuées pour antécédents familiaux est médiocre, tout particulièrement avant 50 ans.23 Lorsqu’un parent au premier degré était atteint de CCR, la coloscopie révélait une néoplasie avancée (CCR ou adénome avancé) chez 4,8 % des 30 - 39 ans et 5,9 % des 40 - 49 ans dans un essai espagnol (respectivement 25 % et 11,8 % si deux parents étaient atteints).24 Une méta-analyse a évalué le taux de néoplasie avancée des coloscopies de dépistage réalisées chez des individus sans antécédent familial à 0,07 % chez les moins de 40 ans, 1,41 % chez les 40 - 44 ans et 3,2 % chez les 45 - 49 ans.25 Ces rendements, fussent-ils multipliés par un facteur 3 en raison d’antécédents familiaux significatifs, restent faibles, imposant la réalisation d’un grand nombre de coloscopies normales, inutiles, voire délétères.
Dès lors qu’un antécédent familial de CCR ne fait qu’avancer de cinq à quinze ans l’âge auquel le risque moyen est atteint, il est licite de proposer à la population concernée d’avancer de cinq à quinze ans le mode de dépistage adapté au risque moyen, à savoir la réalisation périodique d’un test immunochimique fécal quantitatif (TIFqnt).20 Un essai contrôlé randomisé a démontré l’équivalence des dépistages par coloscopie et par TIFqnt annuel pendant trois ans au seuil de 10 µg d’hémoglobine par gramme de selles (µg/g) chez des apparentés au premier degré.26 Une méta-analyse a estimé à 91 % la sensibilité du TIFqnt (un seul test avec un seuil < 25 µg/g) pour le diagnostic de CCR en cas d’antécédents familiaux, équivalente à celle observée en population à risque moyen.27
Choix entre coloscopie et test immunochimique fécal : recommandations internationales
Il existe un relatif consensus dans les recommandations pour estimer cliniquement significatif le sur-risque lié à l’existence de deux parents au premier degré atteints de CCR quel que soit leur âge et d’un parent au premier degré atteint avant l’âge de 50 ans (Europe) ou avant 60 ans (Amérique du Nord).11,12,14,16 Ces antécédents relèvent préférentiellement d’une coloscopie de dépistage. L’âge de la première coloscopie est de 40 ans pour les recommandations européennes, et de 40 ans ou dix ans avant l’âge du plus jeune parent atteint pour les recommandations nord-américaines.11,14 - 16 Ensuite, l’intervalle entre deux coloscopies de surveillance est dicté par le résultat de la coloscopie en cas de polype, et de cinq ans en cas de coloscopie normale.11,14,16,17 Cependant, en respectant de tels intervalles de cinq ans, un individu avec antécédents familiaux devrait subir pas moins de huit coloscopies normales entre 40 et 75 ans, ce qui est parfaitement abusif. Aussi, certaines recommandations laissent-elles la place à un allongement progressif de l’intervalle après 60 ans en cas de coloscopies normales itératives.14,17
La plupart des recommandations récentes s’accordent en outre pour proposer un dépistage par TIFqnt dans deux situations :
- en alternative à une coloscopie préférentielle en cas de refus de celle-ci ;
- comme mode de dépistage préférentiel en cas de CCR au premier degré après 50 - 60 ans, d’adénomes au premier degré quel que soit l’âge, fussent-ils avancés, de CCR à partir du deuxième degré (tableau).11 - 16 Seules les recommandations nord-américaines retiennent la notion d’adénome avancé chez un parent au premier degré, à condition qu’il soit dûment documenté, pour un dépistage précoce dès 40 ans.14 - 17 Une telle recommandation est cependant difficilement applicable en pratique courante, l’information « adénome avancé » étant rarement accessible.
Choix entre coloscopie et test immunochimique fécal dans la vraie vie
Dans la vraie vie, une seule certitude, dépister, sous quelque forme que ce soit, vaut mieux que de ne pas dépister.15 Il n’y a pas UN mode de dépistage meilleur qu’un autre : le meilleur dépistage est celui qui est effectivement réalisé, quel qu’il soit.2,28 D’où le rôle fondamental du médecin généraliste qui s’enquiert, outre des antécédents personnels et familiaux, des facteurs de risque de l’individu (tabac, alcool, surpoids et obésité, sédentarité, etc.) et propose le mode de dépistage recommandé ET son alternative.1,2,28 Informé des avantages et inconvénients des deux modes de dépistage, coloscopie et TIFqnt, l’individu peut faire un choix éclairé entre les deux. Il est démontré qu’offrir une alternative, soit d’emblée (choix entre deux tests), soit de façon séquentielle (offrir une alternative en cas de refus d’un test), augmente significativement le taux de personnes dépistées.29 Il n’y a pas d’erreur à proposer un TIFqnt comme alternative à une coloscopie théoriquement recommandée, de même qu’il n’y a pas d’erreur à proposer une coloscopie comme alternative à un TIFqnt théoriquement recommandé. Ne rien proposer serait, en revanche, fautif. Fixer un âge seuil à 50 ans (Europe) ou 60 ans (Amérique du Nord) est relativement arbitraire et reflète mal le continuum de risque de CCR qui augmente à mesure que l’âge du parent atteint diminue. Le risque relatif de CCR d’un individu augmente à mesure que l’âge de son parent atteint diminue, sans seuil précis : d’un sur-risque modeste, cliniquement non significatif, quand le parent est atteint après 65 ans, à un risque multiplié par 3 s’il est atteint avant 50 ans.
En pratique, comment dépister le CCR en France en cas d’antécédent familial ?
En cas d’antécédent familial, le cœur de cible pour le dépistage du CCR est la tranche d’âge 40 - 60 ans.19 Nous proposons de distinguer deux populations : les 50 - 74 ans et les moins de 50 ans.
Personnes âgées de 50 à 74 ans
En France, la majorité des cinquantenaires ayant des antécédents familiaux de CCR échappent à tout dépistage puisqu’ils sont exclus du programme de dépistage organisé (DO) du CCR et que seule une minorité adhère au dépistage par coloscopie.7,21 L’exclusion des personnes à risque élevé ou soi-disant élevé du programme de DO est une exception française : la quasi-totalité des autres programmes invitent toute la population de la tranche d’âge. Le cahier des charges du programme français de DO du CCR est obsolète et devrait réintégrer les 50 à 74 ans à risque élevé ou soi-disant élevé, y compris ceux ayant des antécédents familiaux, sans exclusion.1,2,7,28 Le courrier d’invitation au DO du CCR envoyé par l’Assurance maladie stipule : « (…) Vous n’êtes pas concerné par cette invitation (…) si dans votre famille au 1er degré (père, mère, frère, sœur, enfant) il y a eu un ou plusieurs cas de CCR ou d’adénome avancé (polype adénomateux). Un suivi régulier par coloscopie est en général recommandé dans ce cas. Parlez-en avec votre médecin. » Ces invitations et relances périodiques, si elles ne sont pas jetées directement à la poubelle, sont l’occasion de discuter dépistage avec le médecin traitant, qui saura conseiller ou réfèrera au gastroentérologue pour avis. Dans l’attente d’une éventuelle évolution du cahier des charges du programme de DO du CCR, le médecin généraliste peut/doit délivrer tous les deux ans un TIFqnt du programme aux 50 - 74 ans avec antécédents familiaux qui ne relèvent pas d’une coloscopie préférentielle ou la refusent.
Personnes âgées de moins de 50 ans
En l’état actuel, les moins de 50 ans avec antécédent familial de CCR sont « condamnés » à la coloscopie de dépistage… avec toutes les réserves mentionnées plus haut (faibles adhésion, bénéfice-risque et coût-efficacité). Pouvoir proposer un dépistage biennal par TIFqnt dès l’âge de 40 ans (ou dix ans avant l’âge de survenue du CCR chez l’apparenté) serait une alternative mieux-disante et conforme à certaines recommandations internationales.13 - 15
Il y a deux solutions :
- soit le cahier des charges du programme de DO du CCR évolue et permet de proposer aux 40 - 50 ans le même TIFqnt que celui des 50 - 74 ans sous strictes conditions (un parent au premier degré atteint de CCR avant 50 - 60 ans ou deux parents au premier degré atteints de CCR quel que soit leur âge) ;
- soit la mise à disposition d’un TIFqnt est accessible sur prescription du médecin généraliste ou du gastroentérologue, offrant une alternative mieux-disante à la coloscopie. Les TIF qualitatifs (TIFql), tels que réalisés dans la plupart des laboratoires de biologie médicale, n’ont aucune place dans ce contexte, leurs performances étant trop hétérogènes.30,31
Depuis peu, certains laboratoires de biologie médicale, hospitaliers et de ville, ont remplacé les TIFql par des TIFqnt réalisés sur prescription médicale.32 Les performances des TIFqnt pour le dépistage du CCR sont parfaitement évaluées, variant selon le seuil de positivité choisi.28,31 Chez les moins de 50 ans avec antécédents familiaux de CCR, il faudrait probablement un seuil de positivité inférieur à 30 µg/g (seuil actuel du programme de DO du CCR français), de 20 µg/g par exemple, voire moins, mais la littérature existante ne permet pas de conclure.32 La plupart des études faites dans ce contexte ont utilisé des seuils de positivité de 10 à 20 µg/g.27 Un seul prélèvement suffit.32
Actions possibles du gastroentérologue
Le gastroentérologue peut-il améliorer la couverture du dépistage du CCR chez les individus ayant des antécédents familiaux de CCR ?
En premier lieu, le gastroentérologue ne doit plus dénigrer le dépistage par TIFqnt pour faire la promotion de la coloscopie de dépistage, ce qui est encore trop souvent le cas.28 Tous les modes de dépistage se valent, pourvu qu’ils soient effectivement réalisés. Comment le gastroentérologue peut-il mieux faire la promotion du TIFqnt qu’en le distribuant lui-même, comme il en a la possibilité depuis quelques années ? Ensuite, le gastroentérologue devrait ajouter des instructions précises de dépistage chez les apparentés d’un patient auquel il a diagnostiqué un CCR, dans le compte-rendu de coloscopie et/ou celui de réunion de concertation pluridisciplinaire de cancérologie digestive. Encore faudrait-il qu’il n’y ait plus qu’UNE seule recommandation française, établie sur les données les plus récentes de la littérature.
Faire évoluer les recommandations
En France, aujourd’hui, les recommandations de dépistage chez les personnes ayant des antécédents familiaux de CCR sont plurielles, contradictoires, excessives et reposent exclusivement sur la coloscopie. En conséquence, seules sont dépistées les personnes favorisées, éduquées, soucieuses de leur santé, citadines, résidant en zone à forte densité médicale (généralistes et gastroentérologues), tous critères éminemment subjectifs et inégalitaires.
Ce constat doit conduire les autorités sanitaires à :
- élaborer une recommandation française unique s’appuyant sur les données scientifiques les plus récentes ;
- modifier le cahier des charges du programme de DO du CCR pour y réintégrer les personnes à risque élevé ou soi-disant élevé (et éventuellement y intégrer les 35 - 50 ans à risque réellement élevé) ;
- promouvoir l’utilisation des TIFqnt en lieu et place des TIFql, obsolètes, à la fois pour le dépistage du CCR et pour l’exploration de patients symptomatiques.32
Enfin, le rôle du médecin généraliste est fondamental pour évaluer le risque de CCR de sa patientèle, promouvoir son dépistage sous quelque forme que ce soit et sa prévention (arrêt du tabac, modération de la consommation d’alcool, de viandes rouges et de charcuteries, exercice physique…).
2. Denis B. Médecine de précision et dépistage du cancer colorecta : une utopie ? Rev Prat 2022;72(8):829-37.
3. Roos VH, Mangas-Sanjuan C, Rodriguez-Girondo M, et al. Effects of family history on relative and absolute risks for colorectal cancer: A systematic review and meta-analysis. Clin Gastroenterol Hepatol 2019;17:2657-67.
4. Haute Autorité de santé. Recommandations pour la pratique clinique. Endoscopie digestive basse : indications en dehors du dépistage en population. Avril 2004. https://urls.fr/K3DO1F
5. Heresbach D, Pienkowski P, Chaussade S, et al. Prévention du cancer colorectal par coloscopie, en dehors du dépistage en population. Consensus et position de la SFED. Acta Endosc 2016;46:68-73.
6. Haute Autorité de santé. Cancer colorectal : modalités de dépistage et de prévention chez les sujets à risque élevé et très élevé. 2017. https://urls.fr/MMeQ1z
7. Arrêté du 19 mars 2018 modifiant l’arrêté du 29 septembre 2006 relatif aux programmes de dépistage organisé des cancers et portant modification du cahier des charges du dépistage organisé du cancer colorectal. https://urls.fr/MrMK7E
8. Weigl K, Tikk K, Hoffmeister M, et al Prevalence of a first-degree relative with colorectal cancer and uptake of screening among persons 40 to 54 years old. Clin Gastroenterol Hepatol 2020;18:2535-43.
9. Darrius R, Denis B, Ben Abdelghani M. Cancer colorectal avant 50 ans : c’est comment qu’on freine ? Hépato-Gastro & Oncologie Digestive 2023;30(2):180-94.
10. Murff HJ, Byrne D, Syngal S. Cancer risk assessment: Quality and impact of the family history interview. Am J Prev Med 2004;27:239-45.
11. van Leerdam ME, Roos VH, van Hooft JE, et al. Endoscopic management of Lynch syndrome and of familial risk of colorectal cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2019;51:1082-93.
12. Monahan KJ, Bradshaw N, Dolwani S, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut 2020;69:411-44.
13. Jenkins MA, Ait Ouakrim D, Boussioutas A, et al. Revised Australian national guidelines for colorectal cancer screening: Family history. Med J Aust 2018;209:455-60.
14. Rex DK, Boland CR, Dominitz JA, et al. Colorectal cancer screening: Recommendations for physicians and patients from the U.S. Multi-Society task force on colorectal cancer. Gastroenterology 2017;153:307-23.
15. Leddin D, Lieberman DA, Tse F, et al. Clinical practice guideline on screening for colorectal cancer in individuals with a family history of nonhereditary colorectal cancer or adenoma: The Canadian Association of Gastroenterology Banff Consensus. Gastroenterology 2018;155:1325-47.
16. Shaukat A, Kahi CJ, Burke CA, et al. ACG clinical guidelines: Colorectal Cancer Screening 2021. Am J Gastroenterol 2021;116:458-79.
17. Ness RM, Llor X, Abbass MA, et al. NCCN guidelines insights: Colorectal Cancer Screening. Version 1.2024. J Natl Compr Canc Netw 2024;22:438-46.
18. Schoen RE, Razzak A, Yu KJ, et al. Incidence and mortality of colorectal cancer in individuals with a family history of colorectal cancer. Gastroenterology 2015;149:1438-45.
19. Wong MCS, Chan CH, Lin J, et al. Lower relative contribution of positive family history to colorectal cancer risk with increasing age: A systematic review and meta-analysis of 9.28 million individuals. Am J Gastroenterol 2018;113:1819-27.
20. Tian Y, Kharazmi E, Brenner H, et al. Calculating the starting age for screening in relatives of patients with colorectal cancer based on data from large nationwide data sets. Gastroenterology 2020;159:159-68.
21. Ingrand I, Defossez G, Richer JP, et al. Colonoscopy uptake for high-risk individuals with a family history of colorectal neoplasia: A multicenter, randomized trial of tailored counseling versus standard information. Medicine (Baltimore) 2016;95:e4303.
22. Lowery JT, Ahnen DJ, Schroy PC 3rd, et al. Understanding the contribution of family history to colorectal cancer risk and its clinical implications: A state-of-the-science review. Cancer 2016;122:2633-45.
23. Trivedi PD, Mohapatra A, Morris MK, et al. Prevalence and predictors of young-onset colorectal neoplasia: Insights from a nationally representative colonoscopy registry. Gastroenterology 2022;162:1136-46.
24. Quintero E, Carrillo M, Leoz ML, et al. Risk of advanced neoplasia in first-degree relatives with colorectal cancer: A large multicenter cross-sectional study. PLoS Med 2016;13(5):e1002008.
25. Kolb JM, Hu J, DeSanto K, et al. Early-age onset colorectal neoplasia in average-risk individuals undergoing screening colonoscopy: A systematic review and meta-analysis. Gastroenterology 2021;161:1145-55.
26. Quintero E, Carrillo M, Gimeno-García AZ, et al. Equivalency of fecal immunochemical tests and colonoscopy in familial colorectal cancer screening. Gastroenterology 2014;147:1021-30.
27. Katsoula A, Paschos P, Haidich AB, et al. Diagnostic accuracy of fecal immunochemical test in patients at increased risk for colorectal cancer: A meta-analysis. JAMA Intern Med 2017;177:1110-8.
28. Denis B. Prévention et dépistage du cancer colorectal par test immunochimique fécal : efficacité, égalité, sobriété. Hépato-Gastro et Oncologie Digestive 2023;30:271-81.
29. Pilonis ND, Bugajski M, Wieszczy P, et al. Participation in competing strategies for colorectal cancer screening: A randomized health services study (PICCOLINO Study). Gastroenterology 2021;160:1097-105.
30. Brenner H, Haug U, Hundt S. Inter-test agreement and quantitative cross-validation of immunochromatographical fecal occult blood tests. Int J Cancer 2010;127:1643-9.
31. Denis B, Fraser CG. En pratique courante, quel est le meilleur test pour rechercher du sang dans les selles ? Rev Prat 2021;71:543-50.
32. Denis B, Tabard L, Guillon C, et al. Quand et comment prescrire une recherche de sang dans les selles ? Rev Prat 2025;75(1):13-8.
Dans cet article
- Place de la génétique et des facteurs environnementaux et comportementaux dans la carcinogenèse colorectale
- Antécédents familiaux néoplasiques encore imparfaitement repérés
- Un antécédent familial confère-t-il un risque de CCR réellement élevé ?
- Test immunochimique fécal ou coloscopie en cas d’antécédent familial ?
- En pratique, comment dépister le CCR en France en cas d’antécédent familial ?
- Actions possibles du gastroentérologue
- Faire évoluer les recommandations