Les anticorps bispécifiques (AcBi) constituent un nouvel outil dans l’arsenal thérapeutique des hémopathies malignes dans lesquelles ils connaissent actuellement un large développement. Cette immunothérapie prometteuse permet d’établir une communication essentielle entre les cellules tumorales et les cellules effectrices du système immunitaire. Leur mise au point est rendue possible grâce, d’une part, aux progrès en biotechnologie permettant la fabrication d’anticorps monoclonaux « à façon » et, d’autre part, à une compréhension toujours plus précise du rôle de chaque acteur du système immunitaire et surtout de la place primordiale des interactions entre ces différents acteurs. En cas d’hémopathie maligne, ces interactions sont mises à mal par les cellules tumorales et par le dérèglement de leur micro-environnement. Il s’agit d’une étape bien connue de la cancérogenèse que les AcBi visent à corriger.1
Mode d’action des anticorps bispécifiques
Les AcBi sont le plus souvent des immunoglobulines G dont la structure est connue et qu’il est donc plus facile de reproduire. Ces anticorps sont construits pour reconnaître deux antigènes différents via leurs fragments variables. Le plus souvent, leur portion Fc est modifiée pour préserver une pharmacologie favorable (longue demi-vie) mais empêcher son interaction avec certaines cellules du système immunitaire dont l’action serait contre-productive (macrophages, polynucléaires neutrophiles, cellules natural killer [NK]).
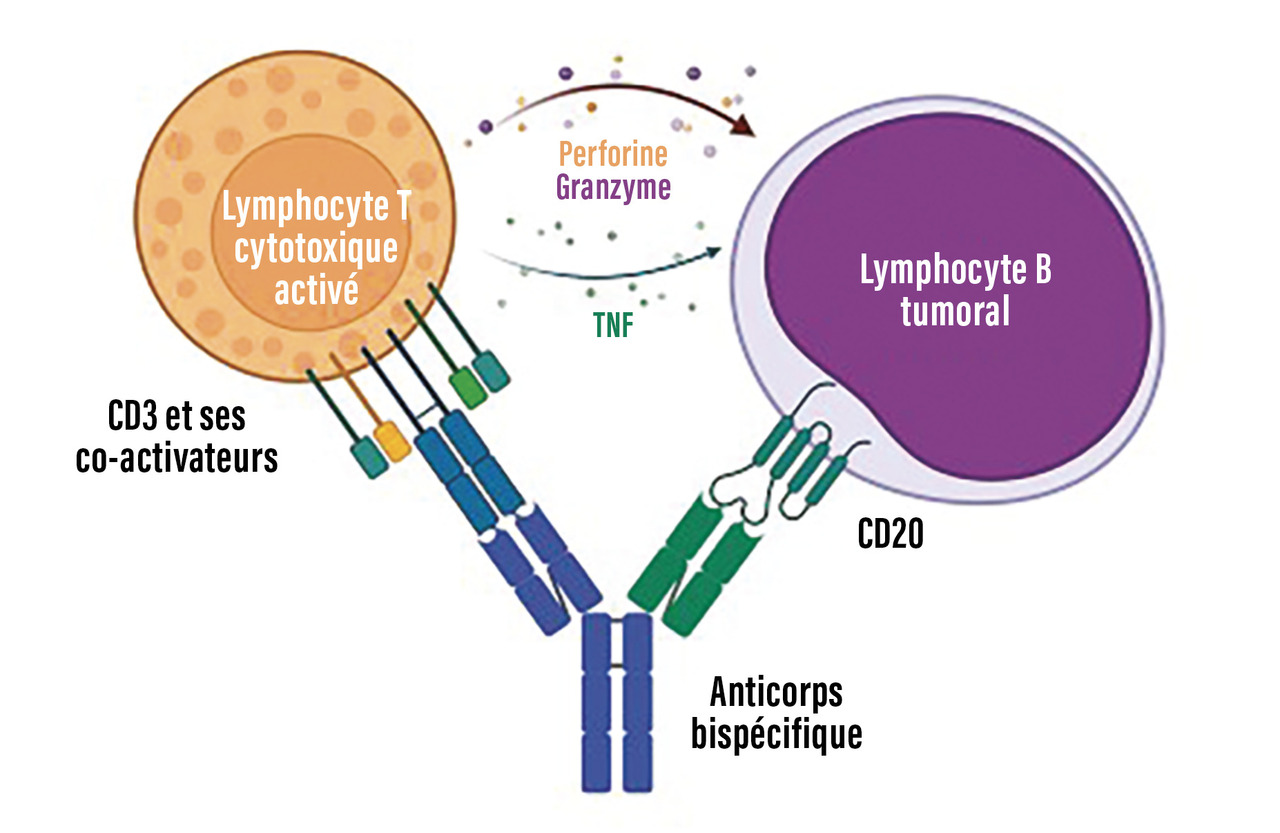
Les AcBi actuellement utilisés ou en développement en onco-hématologie sont ceux qui visent à réaliser un pont entre la cellule tumorale (via la reconnaissance d’un antigène tumoral tel que le CD20 ou le BCMA [B-cell maturation antigen] pour les hémopathies B, par exemple) et les lymphocytes T (via la reconnaissance de l’antigène CD3). On parle alors d’AcBi engageant le lymphocyte T ou bispecific T-cell engagers. La synapse immunologique ainsi créée a pour objectif d’activer les fonctions cytotoxiques des lymphocytes T du patient contre les cellules tumorales (figure). La liaison de l’AcBi à l’antigène tumoral (CD20, BCMA par exemple) est de plus forte affinité qu’au CD3, de sorte qu’il n’y a pas de fixation de l’AcBi au CD3 sans fixation à l’antigène tumoral. Cette différence d’affinités permettrait de limiter une activation T non spécifique et le syndrome de relargage cytokinique qui lui est souvent associé.
Indications et modalités d’administration des anticorps bispécifiques engageant les lymphocytes T
Ces AcBi engageant les lymphocytes T via CD3 sont actuellement utilisés en clinique dans les leucémies aiguës lymphoblastiques, les lymphomes B diffus à grandes cellules et le myélome multiple (tableau).
Le premier AcBi à avoir été développé en clinique est le blinatumomab. Il s’agit d’un AcBi de format particulier, résultant de la combinaison d’un anticorps anti-CD19 (VH et VL) et d’un anticorps anti-CD3, fusionnés en un polypeptide unique de 50 kDa. Sa demi-vie est très courte car il n’a pas de portion Fc. Une injection intraveineuse continue délivrée à débit constant pendant vingt-huit jours est donc nécessaire, suivie de quatorze jours de pause, complexifiant la réalisation du traitement. L’initiation se fait en hospitalisation complète, puis le traitement est poursuivi à domicile à l’aide d’une pompe à perfusion et de cassettes changées en hôpital de jour deux fois par semaine. Les patients peuvent recevoir jusqu’à quatre cycles de traitement. Il est indiqué dans les leucémies aiguës lymphoblastiques B sans chromosome de Philadelphie en rechute ou réfractaire. Son efficacité est illustrée par un allongement significatif de la durée de vie comparé à la reprise de la chimiothérapie standard chez des patients lourdement prétraités.2 L’objectif est d’obtenir une seconde rémission et de permettre au patient d’accéder à une allogreffe de cellules souches hématopoïétiques allogénique dans les meilleures conditions.
Dans les lymphomes B diffus à grandes cellules, lymphome B non hodgkinien le plus fréquent, deux AcBi sont aujourd’hui autorisés en accès précoce :
- l’épcoritamab (AcBi IgG1 ciblant le CD3 et le CD20) est administré par voie sous-cutanée. L’initiation nécessite une escalade de dose (pour les trois premières injections) et peut se faire lors d’une hospitalisation complète ou en hôpital de jour selon le risque estimé de complication initiale. Le traitement se poursuit ensuite en hôpital de jour, avec des injections hebdomadaires durant les trois premiers mois de traitement, puis tous les quinze jours pendant les six mois suivants, puis une fois par mois ;
- le glofitamab (présentant une liaison bivalente au CD20 et une liaison monovalente au CD3) s’administre par voie intraveineuse après une perfusion préalable d’obinutuzumab (anticorps monoclonal anti-CD20), permettant de diminuer le risque de toxicité. L’initiation nécessite également trois paliers de doses hebdomadaires qui peuvent se faire en hôpital de jour ou en hospitalisation complète avec une durée de perfusion initiale de quatre heures, puis le traitement se poursuit en hôpital de jour toutes les trois semaines avec des perfusions d’une durée de deux heures pour douze cycles au maximum.
Ces deux AcBi sont indiqués dans les lymphomes diffus à grandes cellules B en rechute après au moins deux lignes de traitements dont un traitement par des lymphocytes T exprimant un récepteur chimérique à l’antigène (CAR-T cells) ou en cas d’inéligibilité à ce traitement. Leur efficacité est comparable, avec environ 60 % de réponse globale (dont 35 à 40 % de réponse complète) et une durée de réponse prolongée jusqu’à près de deux ans.3 - 5
Les AcBi ont également montré leur efficacité dans le myélome multiple, pour lequel deux AcBi ont actuellement une autorisation d’accès précoce en France : le téclistamab et l’élranatamab. Les deux ciblent, d’une part, le BCMA (B-cell maturation antigen), antigène tumoral plasmocytaire, et, d’autre part, le CD3. Ils sont indiqués dans le traitement des patients adultes atteints d’un myélome multiple en rechute et réfractaire, ayant reçu au moins trois traitements antérieurs, incluant un agent immunomodulateur, un inhibiteur du protéasome et un anticorps anti-CD38 (soit les trois classes thérapeutiques principales de cette pathologie). Ils peuvent être envisagés en cas d’inéligibilité ou de progression après un traitement par CAR-T cells. Après une escalade de dose sur une semaine, ces deux AcBi s’administrent de manière hebdomadaire, par voie sous-cutanée, en hôpital de jour, et ce jusqu’à progression. Un espacement de quinze jours peut s’envisager après six mois en cas d’obtention d’une rémission complète. L’efficacité est importante chez ces patients déjà multitraités : 60 % de réponse globale et 35 à 40 % de réponse complète avec une durée médiane de réponse d’environ un an.6,7 D’autres AcBi, ciblant la protéine GPRC5D (talquétamab) exprimée par les cellules du myélome, sont actuellement en développement.
Effets indésirables des AcBi
Le développement de ces nouveaux médicaments apprend à faire face à de nouvelles toxicités, qu’il convient de reconnaître et maîtriser. Ces toxicités particulières sont les mêmes que celles rencontrées avec les CAR-T cells, avec des incidences et une gravité moindres. Cette analogie de toxicité s’explique par des mécanismes d’action semblables aboutissant à l’activation et à la stimulation des lymphocytes T.
Syndrome de relargage cytokinique
La première toxicité observée est le syndrome de relargage cytokinique (SRC) lié à l’activation du système immunitaire par les AcBi au cours de l’administration des premières doses. Ce syndrome se manifeste par de la fièvre et, dans les cas plus sévères, peut entraîner des chutes tensionnelles ou une désaturation justifiant parfois un transfert en service de soins intensifs afin d’assurer un suivi hémodynamique précis. Les SRC graves sont rares avec les AcBi, et les situations les plus à risque sont maintenant connues. Il s’agit essentiellement des patients présentant une maladie d’évolution agressive avec une forte masse tumorale, un syndrome inflammatoire et/ou des cytopénies déjà présentes avant l’initiation du traitement. Dans ces cas-là, ainsi que pour les patients les plus âgés et fragiles, l’initiation du traitement est réalisée préférentiellement en hospitalisation complète pour une surveillance rapprochée. En l’absence de facteur de risque défavorable et après éducation thérapeutique du patient, l’initiation peut être effectuée en hôpital de jour, avec un suivi ambulatoire optimal, souvent aidé par un infirmier de coordination ou en pratique avancée.
Toxicités neurologiques
Plus rarement (moins de 10 % des cas) peuvent être observées des toxicités neurologiques, allant de la simple céphalée à des tableaux plus complexes de confusion ou d’événement épileptique, voire de signe neurologique focal. Il s’agit également d’une toxicité précoce observée lors des premières administrations et chez des patients particulièrement à risque (maladie agressive et en progression, atteinte du système nerveux central, patient comorbide).
Précautions pour limiter les effets indésirables
L’augmentation progressive de la dose d’AcBi ainsi que l’usage prophylactique de dexaméthasone sont des moyens efficaces de réduire l’incidence des SRC et des événements neurologiques. Ces traitements doivent être réalisés dans un environnement disposant de l’expertise de l’usage de ces médicaments et des moyens adaptés. Dans les situations jugées à risque, les premières doses sont administrées sous surveillance hospitalière. Lorsqu’elles sont réalisées en hôpital de jour, la mise en place d’un dispositif de surveillance à domicile et surtout d’interactions entre les professionnels à domicile et l’établissement de soins doit avoir été anticipée.
Il n’y a pas de recommandations spécifiques concernant la gestion des effets indésirables des anticorps bispécifiques, mais les recommandations françaises établies par la Société francophone de greffe de moelle et de thérapie cellulaire (SFGM-TC) pour les CAR-T cells peuvent être utilisées. Il s’agit, en effet, du même type de mécanisme et de prise en charge, à des degrés de fréquence et de gravité moindres.8,9
À l’issue de cette phase d’escalade de doses, la suite des traitements est effectuée en ambulatoire, avec des administrations par voie sous-cutanée ou intraveineuse, le plus souvent hebdomadaires. Il s’agit à ce jour d’un traitement au long cours qui, sauf dans certains cas, est maintenu jusqu’à ce que la maladie échappe au traitement.
Risque infectieux
Le risque infectieux associé est sans doute non négligeable et souvent sous-estimé. Il est particulièrement important chez les patients atteints d’un myélome pour lesquels l’usage d’AcBi induit une hypogammaglobulinémie profonde et systématique. Dans cette situation, un traitement substitutif est requis et doit être instauré rapidement après l’initiation du traitement. Outre ce traitement, une prophylaxie antizostérienne/herpès (valaciclovir et vaccination) et anti-Pneumocystis carinii est recommandée.
Risque de cytopénie
D’autres toxicités plus classiques des traitements hématologiques peuvent être rencontrées, parmi lesquelles le risque de cytopénie. Ce risque est moindre qu’avec les chimiothérapies et requiert rarement un suivi biologique intense ou un support transfusionnel.
Perspectives thérapeutiques
Les AcBi cités dans cet article sont ceux utilisés couramment en France. De nombreuses études sont en cours afin de développer de nouveaux AcBi ou de les proposer à des stades moins avancés de la maladie, ouvrant ainsi la perspective de les utiliser dès la première ligne de traitement et éviter ainsi l’usage de la chimiothérapie. Les AcBi sont également évalués dans d’autres hémopathies malignes, notamment dans les autres lymphomes non hodgkiniens B, comme le lymphome folliculaire ou le lymphome à cellules du manteau. Certains ont déjà des autorisations aux États-Unis comme le mosunétuzumab dans le lymphome folliculaire ou le téclistamab dans le myélome multiple, et ne sauraient tarder à pouvoir être utilisés en France. Leur association avec d’autres thérapeutiques telles que des chimiothérapies ou d’autres immunothérapies (inhibiteurs de check-point, par exemple) est également une piste intéressante en cours d’évaluation. En effet, l’association de plusieurs mécanismes d’action permettrait de limiter les risques de résistance bien que le profil de toxicité reste à évaluer.
Les progrès en biotechnologie permettent aujourd’hui d’améliorer la pharmacocinétique et la pharmacodynamie des AcBi afin d’allonger leur demi-vie, améliorer leur spécificité et diminuer leur toxicité. Si, aujourd’hui, les AcBi engagent essentiellement les lymphocytes T vers les cellules tumorales, il est possible d’imaginer des AcBi qui pourraient recruter d’autres cellules (macrophages, cellules NK par exemple) vers les cellules tumorales. De même, les progrès dans la technologie de fabrication des anticorps monoclonaux permettent d’ores et déjà le développement de molécules trispécifiques. Par exemple, un anticorps quadrispécifique (CD16 -NKp46 -IL- 2 -Rb) engageant les cellules NK vers les cellules tumorales est en développement.
L’utilisation des AcBi en oncologie solide reste plus complexe du fait d’un micro-environnement tumoral moins favorable. Ainsi, de nouvelles générations d’AcBi, notamment d’AcBi conjugués à des molécules de chimiothérapie, sont en cours de développement pour contourner ces obstacles et atteindre plus efficacement les cellules tumorales.
Révolution technologique
La construction d’anticorps monoclonaux « à façon » permet aujourd’hui d’envisager de nombreux progrès thérapeutiques. Les anticorps bispécifiques (ici recrutant les lymphocytes T) ne sont que l’une des facettes de cette révolution technologique, qui devrait bénéficier à d’autres disciplines. Comme souvent, l’onco-hématologie est pionnière dans le développement de nouveaux médicaments. De nouvelles indications, dans les maladies auto-immunes par exemple, sont déjà à l’étude.
2. Kantarjian H, Stein A, Gökbuget N, et al. Blinatumomab versus chemotherapy for advanced acute lymphoblastic leukemia. N Engl J Med 2017;376(9):836‑47.
3. Thieblemont C, Phillips T, Ghesquieres H, et al. Epcoritamab, a novel, subcutaneous CD3xCD20 bispecific t-cell-engaging antibody, in relapsed or refractory large b-cell lymphoma: Dose expansion in a phase I/II trial. J Clin Oncol 2023;41(12):2238‑47.
4. Dickinson MJ, Carlo-Stella C, Morschhauser F, et al. Glofitamab for relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med 2022;387(24):2220‑31.
5. Sesques P, Houot R, Al Tabaa Y, et al. Glofitamab monotherapy in patients with non-hodgkin B-cell lymphoma after failing CAR T-cell infusion: Primary analysis of the bicar study, a phase II lysa study. Blood 2023;142(Supplement 1):893.
6. Moreau P, Garfall AL, van de Donk NWCJ, et al. Teclistamab in relapsed or refractory multiple myeloma. N Engl J Med 2022;387(6):495‑505.
7. Lesokhin AM, Tomasson MH, Arnulf B, et al. Elranatamab in relapsed or refractory multiple myeloma: Phase 2 magnetisMM-3 trial results. Nat Med 2023;29(9):2259‑67.
8. Yakoub-Agha I, Moreau AS, Ahmad I, et al. Prise en charge pratique du syndrome de relargage des cytokines (CRS) post-CAR-T cells chez l’adulte et l’enfant : recommandation de la Société francophone de greffe de moelle et de thérapie cellulaire (SFGM-TC). Bulletin du cancer 2019;106(1):S102‑9.
9. Picard M, Sterin A, Bay JO, et al. Prise en charge du syndrome de neurotoxicité associée au traitement par cellules CAR-T chez l’adulte et l’enfant : recommandations de la SFGM-TC. Bulletin du cancer 2023;110(2, Supplement):S123‑31.