Connaître les principes de la prise en charge pharmacologique et non pharmacologique
Les rhumatismes microcristallins se caractérisent par des dépôts intra-articulaires ou péri-articulaires de microcristaux. Ces dépôts peuvent être asymptomatiques ou se manifester par des réactions inflammatoires articulaires ou péri-articulaires pouvant parfois mener à des arthropathies chroniques. Les arthropathies microcristallines constituent la cause la plus fréquente d’arthrite aiguë. Elles peuvent être classées en quatre catégories selon les cristaux impliqués, se différenciant surtout par le terrain et les sites articulaires touchés :
- cristaux d’urate monosodique responsables de la goutte ;
- cristaux de pyrophosphate de calcium (PPC) responsables du rhumatisme à cristaux de pyrophosphate de calcium (pouvant se manifester par une chondrocalcinose radiologique) ;
- cristaux d’apatite responsables du rhumatisme apatitique ;
- cristaux rares (oxalate de calcium, cholestérol, cystine…).
La prise en charge de la goutte s’appuie sur les recommandations de 2020 de la Société française de rhumatologie et sur celles de la Société européenne de rhumatologie (EULAR) actualisées en 2018. Concernant le rhumatisme à pyrophosphate de calcium, les recommandations EULAR ont été établies en 2011 et des critères diagnostiques mis au point en 2023.
Diagnostic clinique d’un accès inflammatoire microcristallin
Il repose sur les caractéristiques cliniques d’un accès inflammatoire aigu lié à la présence de microcristaux (tableau 1). Des signes inflammatoires généraux (fièvre) et biologiques (syndrome inflammatoire) sont fréquents. La certitude du diagnostic étiologique est fondée sur la mise en évidence de microcristaux dans l’épanchement articulaire (ou dans un tophus).
Le liquide synovial est de type inflammatoire (cellularité supérieure à 2 000 cellules nucléées par mm3, avec une prédominance de polynucléaires neutrophiles). Les cristaux sont recherchés avec un microscope à lumière polarisée, notamment au sein des polynucléaires. Leur morphologie est différente selon la nature du cristal (tableau 2). La mise en évidence de cristaux d’urate dans le liquide synovial ou dans un tophus permet un diagnostic certain. Une recherche de microcristaux est recommandée sur tout liquide articulaire d’arthrite. Le diagnostic de certitude de rhumatisme à PPC nécessite la mise en évidence de cristaux de pyrophosphate de calcium (parallélépipèdes, le plus souvent intracellulaires, peu biréfringents) dans le liquide synovial, rarement dans une biopsie tissulaire. La recherche de cristaux de pyrophosphate de calcium (et d’urate) doit être faite de façon systématique dans tous les liquides synoviaux provenant d’une articulation siège d’une arthrite non étiquetée, en particulier lorsqu’il s’agit d’une arthrite du genou ou d’un poignet chez un sujet âgé. L’absence de mise en évidence de cristaux n’élimine pas le diagnostic d’arthrite microcristalline (sensibilité imparfaite de l’examen microscopique).
Devant une monoarthrite aiguë, il faut aussi éliminer une arthrite septique, d’où la nécessité d’une ponction articulaire avec numération cellulaire et examen bactériologique. Goutte, rhumatisme à PPC et arthrite septique peuvent coexister, ce qui justifie un examen direct et une mise en culture, même en présence de microcristaux.
Goutte
Définition de l’hyperuricémie
Il est fréquent, pour les laboratoires, de définir l’hyperuricémie comme un taux d’acide urique supérieur à deux écarts types au-dessus de la moyenne d’une population saine appariée selon le sexe et l’âge.
Cette méthode statistique est inappropriée pour l’uricémie, puisque tout individu avec une uricémie supérieure à 60 mg/L est à risque de goutte, 60 mg (360 μmol/L) [dosage méthode uricase] étant la valeur « pathogénique » correspondant au seuil de solubilité de l’urate de sodium dans le plasma à 35 °C.
L’hyperuricémie est une cause nécessaire mais non suffisante de goutte (seuls 10 à 15 % des sujets hyperuricémiques développent une goutte). Le risque de goutte augmente d’autant plus que l’uricémie est élevée : 0,5 % pour une uricémie < 90 mg/L, 5 % pour une uricémie > 90 mg/L. Le terme d’hyperuricémie asymptomatique définit un état où l’uricémie est élevée sans qu’aucun symptôme ne soit apparu. L’hyperuricémie est due le plus souvent à un défaut d’élimination d’acide urique par le rein. S’y associent d’autres facteurs de risque de goutte, que l’on recherche en pratique clinique.
La goutte se définit par une précipitation des cristaux d’urate dans les articulations, le tissu sous-cutané (tophus) et le rein.
Épidémiologie
Prévalence de la goutte
La goutte est une maladie chronique de surcharge en urate. Il s’agit du rhumatisme inflammatoire intermittent le plus fréquent en France, dont la prévalence dépasse celle de la polyarthrite rhumatoïde ou des spondylarthropathies. La prévalence de la maladie goutteuse a augmenté dans le monde entier et est estimée à 1,4 % en Europe (0,9 % en France).
Cette augmentation peut être expliquée par une augmentation de l’espérance de vie, des comorbidités (maladies cardiovasculaires, hypertension artérielle, syndrome métabolique), de l’utilisation de diurétiques et par une modification de l’alimentation.
Chez l’homme, l’hyperuricémie primitive apparaît à la puberté, alors que chez la femme, elle apparaît le plus souvent après la ménopause, compte tenu de l’effet uricosurique des estrogènes, avec une prévalence globalement plus faible que chez l’homme. Le ratio homme/femme varie entre 4/1 et 9/1.
Facteurs de risque de la goutte
Les principaux facteurs qui augmentent le risque de goutte sont liés à l’hyperuricémie (le plus souvent par diminution de la clairance ou, moins fréquemment, par augmentation de la production de l’acide urique) ; ils comprennent :
- l’âge ;
- le sexe masculin ;
- les antécédents familiaux de goutte ;
- la ménopause ;
- le syndrome métabolique (obésité avec augmentation du périmètre abdominal supérieur à 102 cm chez l’homme et 88 cm chez la femme, troubles de la glycorégulation, hypertension artérielle, dyslipidémie) ;
- les maladies cardiovasculaires (insuffisance coronarienne, infarctus du myocarde), qui augmentent le risque de mortalité chez le goutteux ;
- l’insuffisance rénale chronique qui aggrave l’hyperuricémie et rend difficile l’utilisation des hypo-uricémiants ;
- l’utilisation de diurétiques qui augmentent la réabsorption de l’urate ;
- les habitudes alimentaires et la consommation d’alcool.
Les facteurs de risque de goutte et les comorbidités associées doivent être évalués, y compris le syndrome métabolique (obésité, hyperglycémie, hyperlipidémie et hypertension artérielle).
Étiophysiopathologie
Métabolisme de l’acide urique
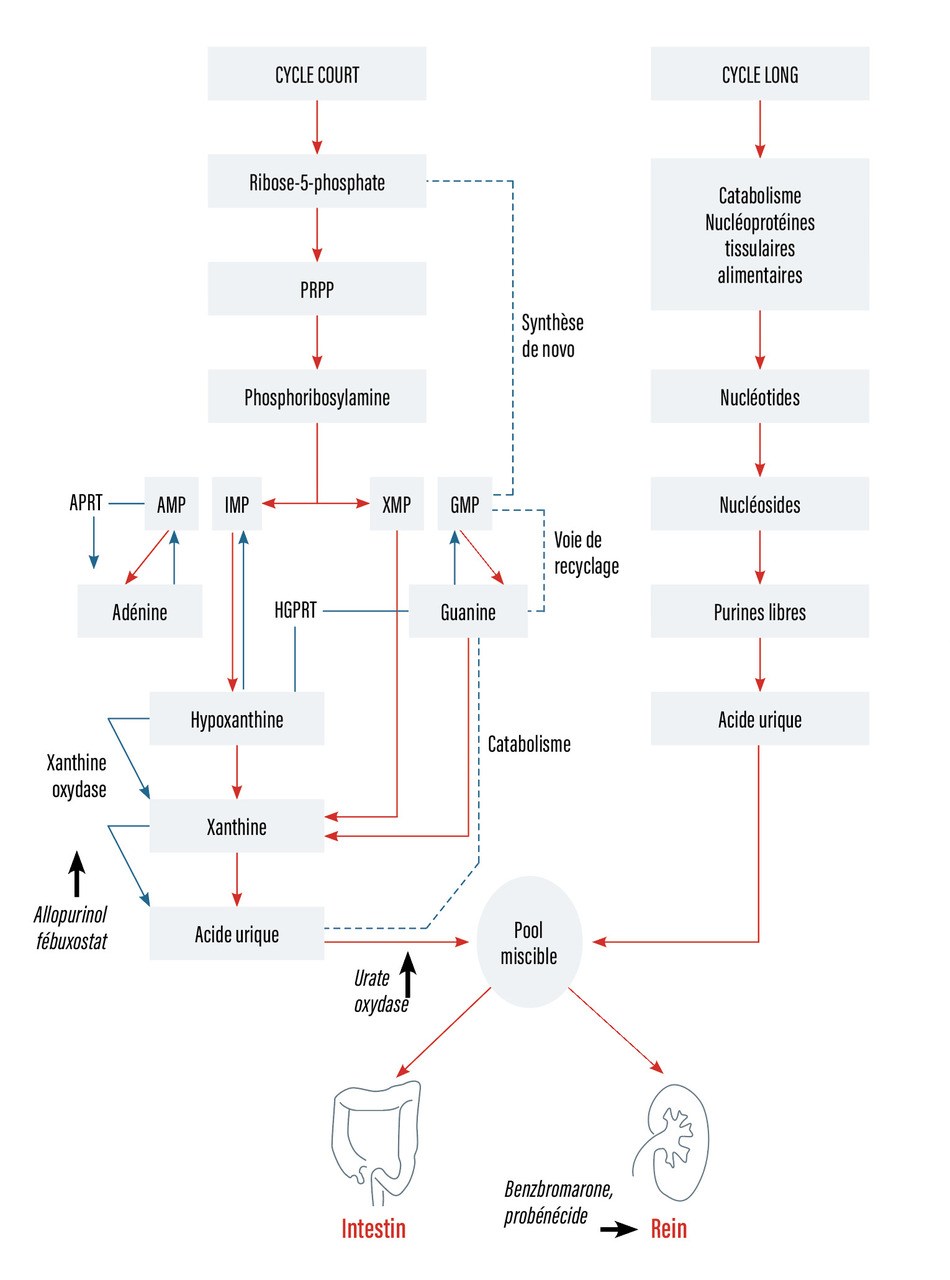
L’acide urique est le produit final de la voie métabolique des purines. L’adénine et la guanine sont des éléments essentiels pour la synthèse de l’acide nucléique quand ils sont convertis en ribonucléosides et ribonucléotides, précurseurs de l’ARN, l’ADN et l’AMP cyclique. La voie métabolique est résumée dans la fig. 1 et montre que :
- la contribution au pool miscible de l’acide urique est assurée seulement par l’ingestion des purines d’origine alimentaire (source exogène) et la synthèse endogène des nucléotides puriques dans le processus de biosynthèse de novo en deux temps, consommateur d’énergie (6 moles d’ATP pour chaque mole d'inosine [IMP] générée). L’enzyme clé est la phosphoribosyl pyrophosphate transférase ;
- la biosynthèse des ribonucléotides puriques selon la voie d’épargne ou de recyclage peut se faire en un seul temps (épargne d’énergie) grâce à deux enzymes : l’adénine phosphoribosyl transférase (APRT) convertissant l’adénine en AMP ; l’hypoxanthine guanine phosphoribosyl transférase (HGPRT) convertissant l’hypoxanthine et la guanine en respectivement IMP et GMP. Cette voie d’épargne est efficace (récupération de 90 % des purines libres) ;
- la xanthine oxydase joue un rôle clé dans cette voie métabolique. Elle est responsable de la conversion de la xanthine en acide urique ;
- il existe deux voies d’élimination de l’acide urique, l’une intestinale (dégradation de l’acide urique en allantoïne par les bactéries), l’autre rénale (filtration glomérulaire presque complète, réabsorption presque complète dans le tube proximal, sécrétion dans le tube distal dont 80 % de la quantité est réabsorbée : l’uraturie ou uricurie des 24 heures est normalement inférieure à 700 mg).
Physiopathologie de l’accès goutteux
L’accès goutteux (ou crise de goutte) est dû à une réaction inflammatoire en rapport avec un dépôt de cristaux d’acide urique dans l’articulation ; elle est induite par les composants du système immunitaire inné.
Les macrophages phagocytent les cristaux d’urate de sodium qui, une fois internalisés, stimulent la formation d’un complexe protéique (inflammasome), transformant la pro-interleukine (IL) 1 -bêta inactive en IL- 1 -bêta active, médiateur inflammatoire qui régule la prolifération, la différenciation cellulaire et l’apoptose dans l’accès goutteux. Ce médiateur est costimulé par la présence d’acides gras libres (deuxième messager) favorisée par la consommation d’alcool et de repas riches en graisses.
Gouttes primitives
La goutte primitive n’est pas liée à un mécanisme enzymatique ; elle est souvent familiale (40 % des cas), due à un défaut d’élimination de l’acide urique (90 % des cas) lié génétiquement à des mutations des transporteurs d’urate ou de l’uromoduline. La suralimentation et l’obésité aggravent cette hyperuricémie idiopathique en raison de l’hyperinsulinisme qui augmente la réabsorption tubulaire des urates.
Les gouttes enzymopathiques sont rares (moins de 1 % des gouttes primitives), touchent l’homme, sont caractérisées par une apparition précoce, une hyperuricémie et une hyperuricurie élevées (lithiase révélatrice), liées soit à une hyperactivité de la PRPP synthétase (exceptionnel), soit à un déficit en HGPRT complet (syndrome de Lesch-Nyhan avec encéphalopathie chez le jeune garçon) ou incomplet (à évoquer chez l’homme jeune) [fig. 1].
Gouttes secondaires
Deux mécanismes sont possibles :
- un défaut d’élimination rénale de l’acide urique (le plus fréquent) lors de l’insuffisance rénale, la néphropathie uratique familiale (rare, à évoquer chez un sujet jeune développant une insuffisance rénale avant 40 ans), l’hypothyroïdie, la prise de médicaments (diurétiques+++, notamment chez la femme âgée, ciclosporine et tacrolimus chez les transplantés, aspirine à faible dose) ;
- une hyperproduction d’acide urique (rare), liée à une augmentation du catabolisme cellulaire (hémopathies, anémies hémolytiques, chimiothérapie avec risque de lithiase urique) ou une augmentation de production de l’AMP (glycogénose hépatique de type 1 par déficit en glucose- 6 -phosphate, intolérance au fructose).
Accès goutteux aigu
Arguments cliniques
La goutte aiguë débute le plus souvent par :
- une monoarthrite aiguë, touchant de façon privilégiée les articulations distales des membres inférieurs, en particulier la première métatarso-phalangienne ;
- une tendinite ou une tendinobursite aiguë.
La crise de goutte se caractérise par une douleur importante, un gonflement, une douleur à la palpation qui atteint son maximum en six à douze heures, avec un érythème évocateur quoique non spécifique. En cas de présentation typique de goutte, un diagnostic clinique seul est possible mais pas formel en l’absence de confirmation de la présence de cristaux. Il est vrai qu’en pratique de ville la ponction articulaire n’est pas toujours possible, notamment en cas d’atteinte de la première articulation métatarso-phalangienne, d’où l’intérêt d’un score validé sans résultat d’analyse du liquide synovial pour le diagnostic de goutte en médecine générale (score de Nijmegen) [tableau 3]. L’accès non traité dure de cinq à dix jours ; l’accès traité régresse habituellement sous anti-inflammatoires non stéroïdiens (AINS) ou sous colchicine. Les facteurs déclenchant un accès goutteux sont ceux qui entraînent une fluctuation du pool de l’acide urique : traumatisme, acte chirurgical, prise d’alcool ou de certains médicaments (diurétiques, aspirine à faible dose, etc.), surconsommation d’aliments riches en purines et en graisses, infection, déshydratation.
Arguments biologiques
Il existe des signes inflammatoires non spécifiques (syndrome inflammatoire biologique, forte cellularité dans le liquide synovial).
La surcharge uratique se traduit par :
- une hyperuricémie non constante durant l’accès goutteux (effet uricosurique de l’inflammation qui tend de manière contre-intuitive à faire diminuer l’uricémie pendant les accès goutteux ; il faut savoir doser à nouveau l’uricémie quinze jours après la crise) ;
- la présence de microcristaux d’urate monosodique dans le liquide synovial ou dans les tissus (fragments prélevés à fixer dans l’alcool absolu).
L’identification de cristaux dans une articulation asymptomatique peut permettre un diagnostic en période intercritique.
L’uricémie ne confirme ou n’exclut pas une crise de goutte : certains patients hyperuricémiques n’ont jamais de crise de goutte alors que certains patients peuvent avoir une uricémie normale durant une crise de goutte.
L’uraturie doit être évaluée chez certains patients, notamment en cas d’histoire familiale, de début précoce, de calcul rénal.
Arguments radiographiques
Même si la radiographie est utile au diagnostic différentiel et peut montrer des aspects typiques de goutte chronique, elle n’est pas utile pour confirmer le diagnostic de goutte aiguë ou récente. Une radiographie normale n’élimine pas le diagnostic.
Arthropathies chroniques
Arguments cliniques
Le patient non traité par hypo-uricémiant peut développer une goutte polyarticulaire chronique dans laquelle il existe davantage de périodes douloureuses entre les crises, en général après dix ans ou plus de goutte aiguë intermittente, parfois plus rapidement en cas de goutte secondaire aux diurétiques chez les femmes.
Cette phase est caractérisée par :
- des articulations douloureuses et gonflées en permanence, l’intensité de la symptomatologie étant moins importante que lors des accès goutteux ;
- la possibilité de survenue d’accès goutteux surajoutés ;
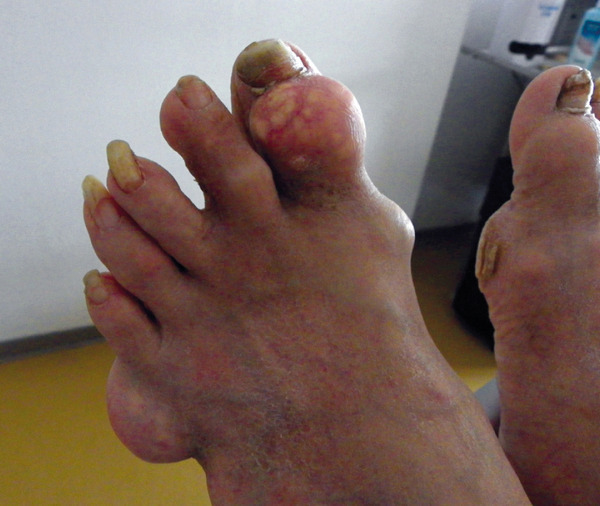
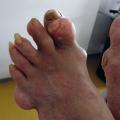
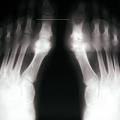
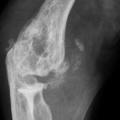
- l’apparition de tophus sous-cutanés, décelables ou non cliniquement, lésions les plus caractéristiques de cette phase de goutte articulaire chronique, fonction de la durée et de la sévérité de l’hyperuricémie, touchant le plus fréquemment les doigts, les poignets, les oreilles, les genoux, les pieds (fig. 2), l’olécrane et les points de pression (face ulnaire de l’avant-bras, tendon d’Achille) ;
- des manifestations rénales, à type de lithiase rénale, le plus souvent uratique, fonction de l’importance de l’uraturie (50 % si uraturie des 24 heures > 1 100 mg) ou de néphropathie interstitielle (dépôts de cristaux d’urate dans l’interstitium rénal), tubulaire (syndrome de lyse tumorale) ou globale multifactorielle (hypertension artérielle, diabète, alcool, médicaments néphrotoxiques).
Arguments tirés de l’imagerie
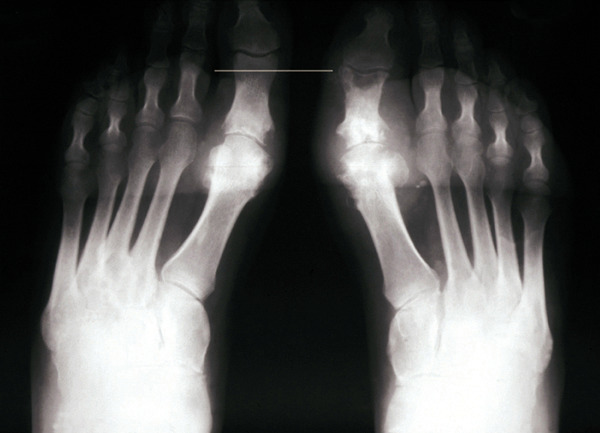
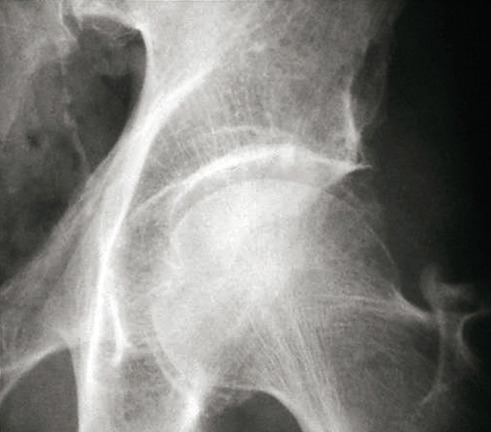
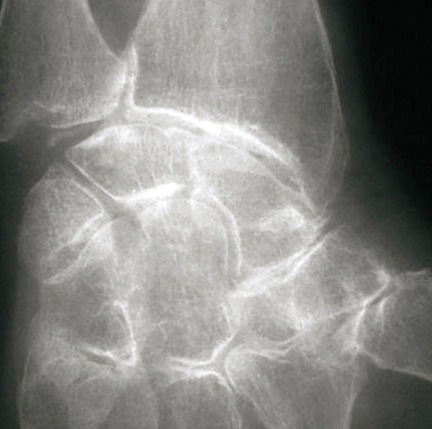
Les radiographies permettent de déceler des modifications ostéocartilagineuses asymétriques (mains, pieds, poignets, coudes, genoux), secondaires à la réaction inflammatoire autour des tophus, comportant :
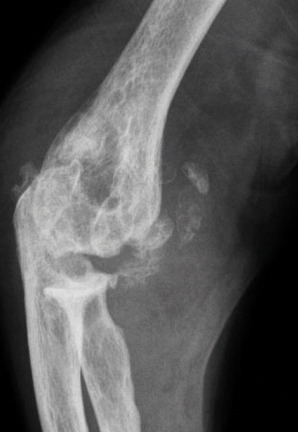
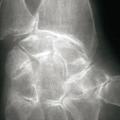
- des érosions osseuses initiales caractéristiques : encoche épiphysaire (fig. 3) avec un éperon osseux (aspect en hallebarde) ;
- une image d’empreinte dans les parties molles (augmentation de la densité des parties molles dues au tophus) très évocatrice (fig. 4) ;
- un interligne longtemps conservé (contrairement aux autres rhumatismes destructeurs) [fig. 3] jusqu’au stade de goutte chronique et l’absence de raréfaction osseuse périarticulaire permettant de différencier la goutte d’autres arthropathies ; à un stade avancé, la goutte tophacée peut avoir un potentiel destructeur à la fois articulaire et osseux (fig. 4).
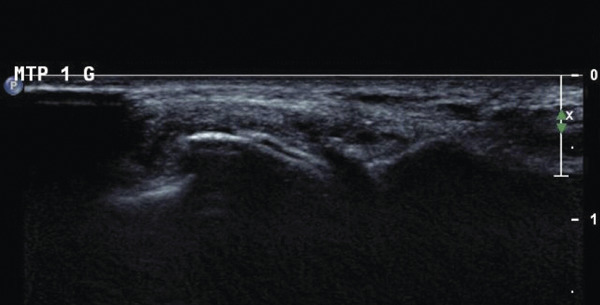
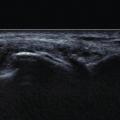
L’échographie peut montrer un aspect dit en « double contour » (fig. 5), correspondant à des dépôts uratiques à la surface des cartilages hyalins et un aspect de synovite en « tempête de neige » chargée en cristaux d’urate.
Il s'agit d'un examen très performant, et plus sensible pour détecter des dépôts que la radiographie qui ne montre que des signes indirects à un stade évolué. De plus l'échographie semble être un outil de choix pour monitorer la dissolution des cristaux sous traitement hypouricémiant (disparition des doubles contours, réduction puis disparition des tophus). Enfin le le scanner double énergie, disponible dans certains centres, permet parfois de mettre en évidence avec une très bonne spécificité, des dépôts d'urate de sodium dans des localisations plus difficiles à explorer en échographie comme le rachis. Il s'agit d'un outil permettant aussi de quantifier le volume des dépôts.
Stades évolutifs de la goutte classique
L’hyperuricémie demeure asymptomatique pendant de nombreuses années (sauf en cas de goutte enzymatique). L’épisode initial de goutte peut survenir plusieurs dizaines d’années (de 20 à 30 ans) après le stade d’hyperuricémie asymptomatique ; chez l’homme, il survient entre la 4e et la 6e décennie. Entre la première crise aiguë et la deuxième crise, plusieurs années peuvent s’écouler. Ensuite, les crises deviennent plus longues et plus sévères : c’est la « phase intercritique » ou « phase de crises aiguës récurrentes ». Enfin, l’intervalle entre deux crises se raccourcit et on passe au stade de goutte chronique.
Traitement de la goutte
Il faut dissocier le traitement des accès goutteux de celui de l’hyperuricémie et bien l’expliquer au patient pour obtenir son adhésion et éviter qu’il n’arrête les traitements, particulièrement si des crises de goutte surviennent à l’initiation du traitement hypo-uricémiant (crises paradoxales).
Principes généraux
Le traitement optimal de la goutte associe des mesures pharmacologiques et non pharmacologiques.
La maladie peut guérir sous réserve d’un abaissement suffisant et durable de l’uricémie. Le traitement de la goutte est indispensable dès le premier accès goutteux ; il permet de réduire de façon significative le risque de mortalité (notamment cardiovasculaire) des patients.
Un traitement de fond hypo-uricémiant est indispensable en parallèle du traitement de la crise pour obtenir la guérison.
Le choix des traitements est personnalisé en fonction de la sévérité de la crise de goutte, du terrain (comorbidités, notamment cardiovasculaires), des autres traitements au long cours, des intolérances médicamenteuses, de la sévérité de la goutte (uricémie élevée, arthropathies, présence de tophus). Le taux d’uricémie et l'estimation de la fonction rénale sont indispensables pour les choix thérapeutiques.
Des mesures non pharmacologiques (repos articulaire, glaçage en cas de crise) et un ajustement de l’hygiène de vie sont également primordiaux.
Hygiène de vie
L’éducation thérapeutique tient une place de choix dans la goutte, pathologie souvent mal comprise des patients, avec une mauvaise observance des traitements.
Le patient doit savoir reconnaître une crise, savoir s’autotraiter rapidement dans ce cas, comprendre l’intérêt d'un traitement de fond et la notion d’uricémie cible à atteindre.
Les conseils diététiques et d’hygiène de vie sont incontournables. Il faut éviter la consommation d’alcools forts (spiritueux) et la bière (avec ou sans alcool), les sodas sucrés (cola) et les jus de fruits riches en fructose. Le reste est affaire de modération (viandes, produits de la mer) et repose essentiellement sur un régime équilibré. La consommation de lait et de vitamine C (jus d’orange) a un effet uricosurique et est à encourager. Il faut veiller à ne pas adopter un message trop culpabilisateur vis-à-vis du régime alimentaire, une part génétique importante expliquant le plus souvent la maladie.
Comorbidités
Les comorbidités et les facteurs de risque tels que l'hyperlipidémie, l’hypertension artérielle, l’hyperglycémie, l’obésité et le tabagisme font partie des éléments à prendre en charge. Quand la goutte est associée à un traitement par diurétique, son arrêt est préférable si cela est possible (sauf en cas d’insuffisance cardiaque de stades III et IV de la NYHA). Pour l’hypertension artérielle et l'hyperlipidémie, si cela est indiqué, il s’agit de préférer l’utilisation des molécules ayant un faible effet uricosurique comme le losartan, l’amlodipine, le fénofibrate ou l’atorvastatine. La correction d’une obésité est l’un des objectifs prioritaires du traitement. Cette correction permet de réduire l’hyperuricémie et d’agir sur les facteurs de risque cardiovasculaire associés à la goutte.
Traitement de la crise (accès) de goutte
Le choix doit être guidé par le terrain du patient (comorbidités cardiovasculaires et fonction rénale surtout) et le caractère mono-, oligo- ou polyarticulaire de la crise.
La colchicine est efficace à condition d’être administrée le plus précocement possible (dans les 12 heures), dès le début de la crise de goutte, à la dose de 1 mg (1 cp). Une deuxième prise est possible à 0,5 mg (1/2 cp) une heure après, et éventuellement répétée (sans dépasser 1,5 mg le premier jour). Les fortes doses de colchicine ont des effets indésirables : la diarrhée est le plus fréquent. Il s’agit d’un signe de toxicité qui doit conduire à diminuer, voire arrêter, la colchicine. À partir du deuxième jour, la colchicine est poursuivie, à la dose de 0,5 mg, 2 ou 3 fois par jour jusqu’à cessation des signes locaux.
Les effets indésirables les plus fréquents (10 %) sont gastro-intestinaux, dose-dépendants (disparaissant le plus souvent à des doses de 0,5 mg/j), cutanés, sanguins et neuromusculaires.
Chez le sujet âgé ou en cas d’insuffisance rénale, les doses sont réduites : 0,5 mg/j pour une clairance de la créatinine entre 35 et 49 mL/min (recommandation du Guide de prescription et rein [GPR]). La liste des interactions médicamenteuses avec la colchicine est impressionnante (consulter impérativement le résumé des caractéristiques du produit [RCP]) : macrolides, ciclosporine, kétoconazole, diltiazem, vérapamil, statines et jus de pamplemousse. La colchicine peut potentialiser l’action des antivitamine-K (AVK) : surveiller l’international normalized ratio (INR).
Tous les anti-inflammatoires non stéroïdiens (AINS) peuvent être utilisés, sous réserve de respecter leurs contre-indications (digestives, rénales et cardiovasculaires), d’où l’intérêt de faire la liste des comorbidités. Les AINS sont proscrits en cas d’accès goutteux chez le transplanté rénal, en cas d’insuffisance rénale et chez la personne âgée.
Les gestes locaux tels que l’immobilisation de l’articulation et son glaçage avec protection cutanée peuvent permettre de raccourcir la durée de l’accès goutteux. Si l’infection a été écartée, les infiltrations intra-articulaires de corticoïdes sont généralement très efficaces et bien tolérées dans la crise de goutte.
La corticothérapie orale est une alternative à la colchicine ou aux AINS. Elle doit être prescrite précocement, à la dose de 30 à 35 mg/j durant trois à cinq jours (prednisone). Les infiltrations doivent être privilégiées en cas de mono- ou biarthrite.
Les inhibiteurs de l’interleukine 1 doivent être réservés aux échecs ou aux contre-indications des traitements de la crise sus-cités. Leur initiation doit être réalisée en milieu hospitalier. Un bilan préthérapeutique est nécessaire. Les risques principaux sont l’infection et la neutropénie.
Traitement hypo-uricémiant ou traitement de fond de la goutte
Il est indispensable dès la première crise de goutte et est le seul permettant une guérison durable de la maladie. Il réduit de façon significative le risque de récidive articulaire et de mortalité cardiovasculaire lorsque l’uricémie cible est atteinte. Le débit de filtration glomérulaire (DFG) guide le choix de la molécule.
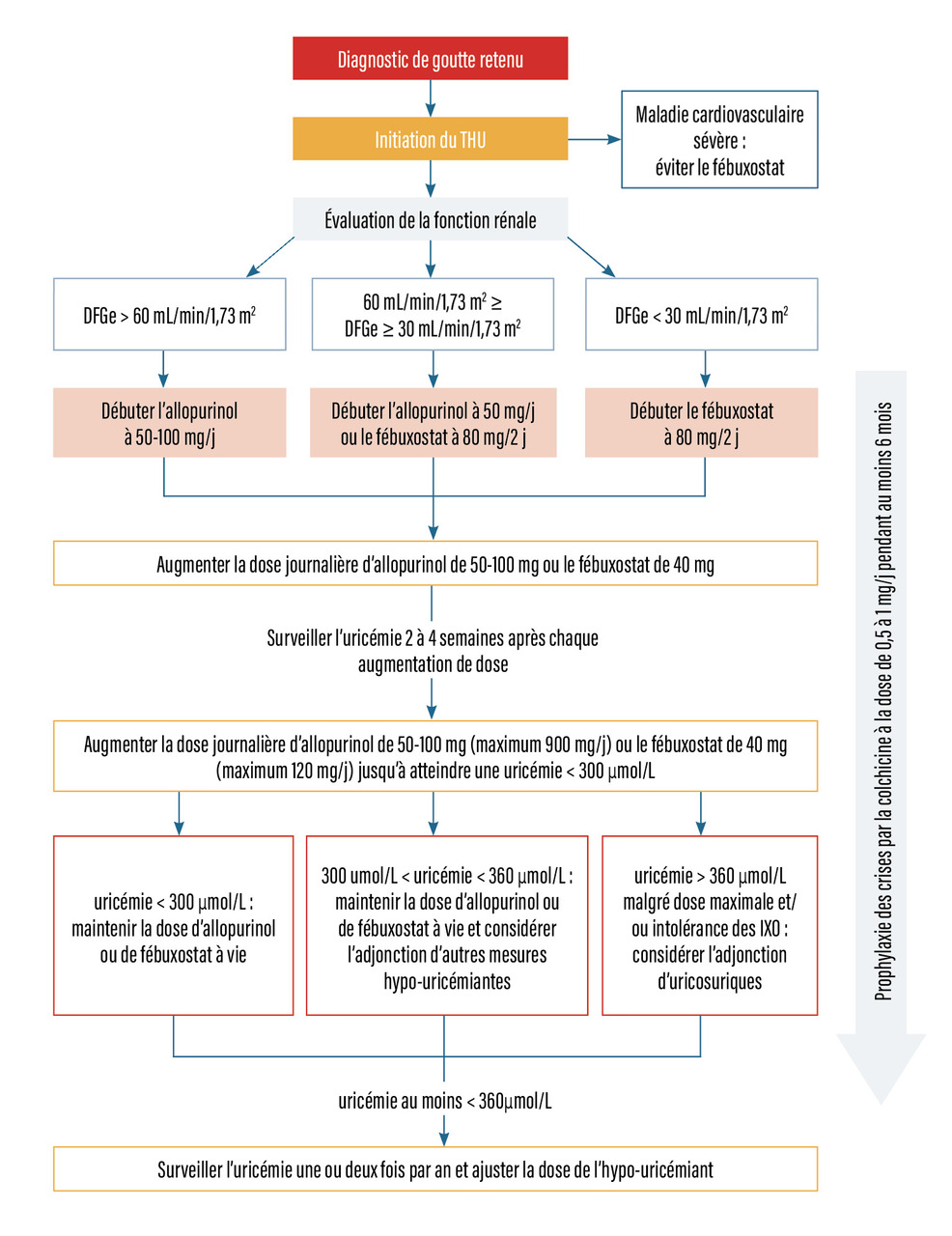
Le but du traitement hypo-uricémiant est de dissoudre les cristaux et d’empêcher leur formation. La valeur cible (uricémie) du traitement hypo-uricémiant doit être inférieure à 60 mg/L ou 360 mmol/L, voire, si possible, inférieure à 50 mg/L (300 mmol/L), chez tous les goutteux (a fortiori en cas de tophus). Une fois l’uricémie cible atteinte, l’observance du traitement doit être maintenue et l'uricémie contrôlée une ou deux fois par an. Le patient doit être informé du risque de crise de goutte paradoxale à l’instauration du traitement hypo-uricémiant ; une titration progressive des hypo-uricémiants et une prophylaxie de la crise permettent de limiter ce risque. La prophylaxie des crises repose sur la colchicine (de 0,5 à 1 mg) ou un AINS (avec gastroprotection si nécessaire). Cette chimioprophylaxie doit être poursuivie pendant environ six mois (idéalement jusqu’à l’atteinte de l’uricémie cible), et la colchicine doit être privilégiée par rapport aux AINS si elle est bien supportée et qu’il n’y a pas de contre-indication (fig. 6).
L’hyperuricémie asymptomatique ne doit pas être traitée par des hypo-uricémiants. En effet, il n’existe pas d’études d’intervention le justifiant et les traitements ont des effets indésirables. Cependant, il faut prendre en charge les comorbidités associées (syndrome métabolique) et arrêter ou remplacer, si cela est possible, les médicaments hyperuricémiants.
Inhibiteurs de la xanthine oxydase
L’allopurinol est la molécule à privilégier si le DFG est supérieur à 60 mL/min. Il permet de diminuer au long cours l’uricémie. Initié à 50 ou 100 mg, il est augmenté de 50 à 100 mg progressivement tous les 1 à 2 mois, en ajustant la posologie à la fonction rénale. D’après l’autorisation de mise sur le marché (AMM), lorsque la clairance de la créatinine est inférieure à 90 mL/min, on ne peut théoriquement pas dépasser la dose de 300 mg/j, ce qui est probablement une recommandation trop stricte dans certains cas. Les recommandations de la Société Française de Rhumatologie (SFR) stipulent en effet qu’il est possible de dépasser les limitations de posologie du Vidal, si la fonction rénale est strictement normale et sous réserve d'une surveillance clinique et biologique rapprochée, jusqu’à une dose maximale de 900 mg/j.
L’allopurinol peut provoquer des toxidermies graves, incluant des syndromes de Lyell ou de Stevens-Johnson et des DRESS (drug rash with eosinophilia and systemic syndroms). Leur survenue est rare (1 cas pour 2 000 nouveaux patients traités), mais l’issue peut être fatale. Elles peuvent se manifester par des éruptions cutanées et survenir à n’importe quel moment du traitement mais le plus souvent dans les deux mois qui suivent son instauration. Il convient de rappeler aux patients traités par l’allopurinol qu’en cas de survenue d’une éruption cutanée ou d’autres signes d’hypersensibilité (atteinte des muqueuses [oculaire, buccale ou génitale], fièvre, adénopathies, éruption cutanée), l’allopurinol doit être immédiatement arrêté et un avis médical doit être pris. La reprise de l’allopurinol est alors formellement contre-indiquée.
Des manifestations d’intolérance digestive (nausées, vomissements, diarrhée) sont signalées dans 5 % des cas, mais le plus souvent ne contre-indiquent pas la poursuite du traitement. En cas d’association à la colchicine, il est parfois difficile de déterminer l’origine des symptômes. Certaines interactions médicamenteuses contre-indiquent l’utilisation de l’allopurinol (azathioprine). L’association aux AVK doit être prudente (surveiller plus fréquemment l’INR du fait d’un sur-risque hémorragique).
Le fébuxostat est un inhibiteur de la xanthine oxydase, non purinique, sélectif (il n’inhibe pas les autres enzymes impliquées dans le métabolisme purique ou pyrimidique). Il doit être privilégié en cas de DFG inférieur à 30 mL/min. La posologie initiale recommandée est de 40 à 80 mg/j, puis une augmentation progressive des dosages de 40 mg tous les 1 à 2 mois (max 120 mg/j) est à proposer jusqu'à atteindre l'uricémie cible. La pharmacocinétique n’est pas modifiée en cas d’insuffisance hépatique légère à modérée (Child-Pugh A et B). Il n’y a pas d’adaptation posologique en cas d’insuffisance rénale légère à modérée (clairance de la créatinine entre 30 et 90 mL/min), notamment chez le sujet âgé. Les effets indésirables les plus fréquents sont des anomalies du bilan hépatique, des diarrhées, des nausées, des céphalées et des œdèmes. Le fébuxostat peut aussi provoquer des toxidermies graves, et les mêmes précautions doivent être prises qu’en cas de prescription de l’allopurinol. La prescription de fébuxostat doit aussi être prudente chez les patients atteints de cardiopathie ischémique ou insuffisance cardiaque congestive ; et dans ces contextes le cardiologue doit être consulté en amont de la prescription. L'association à l'azathioprine ou mercaptopurine est formellement déconseillée ; l'association aux AVK doit aussi être prudente (surveiller plus fréquemment l’INR du fait d’un sur-risque hémorragique).
Uricosuriques
Les uricosuriques sont utilisés comme alternative à l’allopurinol ou au fébuxostat (échec thérapeutique ou allergie) ou en association avec ces derniers. Des précautions sont à respecter :
- vérifier que l’uricosurie est normale (< 600 mg/24 h en régime libre) ;
- s’assurer de l’absence d’antécédent lithiasique urinaire.
Deux uricosuriques sont disponibles : le probénécide (la posologie de 500 mg/j est progressivement augmentée toutes les deux à trois semaines jusqu’à 1 g/j au maximum) et la benzbromarone (disponible en autorisation d'accès compassionnel en cas d’échec des inhibiteurs de la xanthine oxydase et du probénécide) à une posologie de 100 à 300 mg/j, sous contrôle biologique hépatique, efficace même en cas d’insuffisance rénale modérée.Tous deux induisent un risque de lithiase urique, qu’il faut prévenir en assurant une diurèse suffisante et par le contrôle du pH urinaire qu’il faut maintenir au-dessus de 6, en alcalinisant si nécessaire les urines.
La surveillance doit être clinique et biologique (tableau 4).
Rhumatisme à cristaux de pyrophosphate de calcium (PPC)
Le rhumatisme à PPC est une arthropathie métabolique caractérisée par la présence de dépôts intra-articulaires ou péri-articulaires de cristaux de pyrophosphate de calcium. Il peut revêtir quatre phénotypes :
- la forme asymptomatique (la plus fréquente) qui se limite à la mise en évidence de dépôts calciques radiologiques (à la surface des cartilages ou dans les fibrocartilages) que l’on appelle la chondrocalcinose ;
- l’arthrite aiguë microcristalline (appelée autrefois pseudogoutte) ;
- les arthrites chroniques à PPC (pouvant mimer une polyarthrite rhumatoïde à début tardif ou une pseudopolyarthrite rhizomélique) ;
- les arthropathies destructrices et liées à l’arthrose.
Épidémiologie
- La fréquence des dépôts de PPC visibles radiologiquement augmente avec l’âge. Les sujets âgés représentent plus de 80 % des patients atteints d’arthropathie à PPC. Le rhumatisme à PPC, dans sa forme la plus fréquente (sporadique ou idiopathique), est rare avant 55 ans. Chez les sujets jeunes (< 55 ans) ou dans les formes sévères, il faut chercher :
- une forme familiale (génétique) ;
- une forme secondaire à une hyperparathyroïdie, une hémochromatose génétique, une hypomagnésémie ou une hypophosphatasie génétique (tableau 5).
Un antécédent de traumatisme ou une chirurgie articulaires sont également une cause classique de dépôts de PPC.
Physiopathologie
La formation de cristaux de PPC est favorisée par l’augmentation de la concentration de pyrophosphate inorganique dans le liquide synovial. Ce pyrophosphate extracellulaire provient :
- soit d’une hydrolyse des nucléotides triphosphates (ATP) par la glycoprotéine PC- 1 ;
- soit du transport du pyrophosphate par la protéine transmembranaire ANK (ankylosis protein) du milieu intracellulaire vers le milieu extracellulaire. Le pyrophosphate inorganique est aussi hydrolysé par la phosphatase alcaline.
Plusieurs mutations, dont celles du gène humain ANK (ANKH), sont à l’origine des formes familiales de chondrocalcinose articulaire et peut-être de certaines formes sporadiques. La physiopathologie de l’arthrite aiguë à PPC est identique à celle de l’accès goutteux (v. supra, physiopathologie de l'accès goutteux).
Formes cliniques
Le rhumatisme à PPC est un grand simulateur, prenant le masque d’une mono- ou polyarthropathie périphérique et/ou axiale, mécanique ou inflammatoire, aiguë ou chronique, d’une arthropathie rapidement destructrice, d’une hémarthrose ou d’affections abarticulaires. La mise en évidence de cristaux de pyrophosphate de calcium dans le liquide synovial ou les tissus est donc essentielle pour confirmer le diagnostic.
Arthrite aiguë à PPC
L’arthrite à PPC reste la cause la plus fréquente d’arthrite aiguë chez le sujet âgé. Sa survenue est souvent inexpliquée mais peut intervenir après un traumatisme, une maladie aiguë (accident vasculaire cérébral, infarctus du myocarde), une intervention chirurgicale (10 %) et notamment une parathyroïdectomie, une prise médicamenteuse (diurétiques, bisphosphonates).
Elle se manifeste par une monoarthrite (le plus souvent du genou ou du poignet) ou par une oligoarthrite volontiers additive en quelques jours. Une arthrite de début soudain, atteignant son maximum en six à vingt-quatre heures, avec rougeur cutanée en regard, est évocatrice d’une arthrite d’origine microcristalline mais n’est pas spécifique d’une arthrite aiguë à PPC. Une arthrite ayant les caractéristiques d’une origine microcristalline et touchant les genoux, les poignets ou les épaules chez un patient de plus de 65 ans peut tout à fait être une arthrite aiguë à PPC. La mise en évidence d’une chondrocalcinose et un âge élevé augmentent cette probabilité, mais un diagnostic de certitude requiert une mise en évidence des cristaux de PPC.
De nouveaux critères diagnostiques ont été établis en 2023. Ils sont fondés sur un score composite de probabilité diagnostique lorsque la mise en évidence de cristaux de PPC n’est pas possible. Il s’agit de critères cliniques, biologiques et radiologiques (mise en évidence de dépôts calciques sur radiographie, échographie ou scanner). Les diagnostics alternatifs, notamment infectieux, doivent être systématiquement recherchés (tableau 6).
Arthrites chroniques
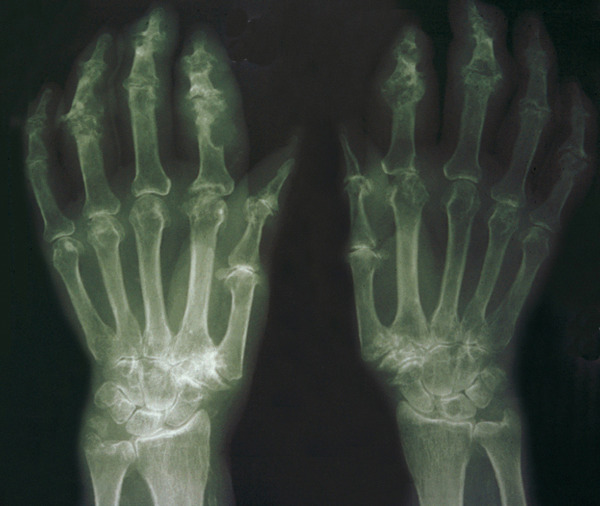
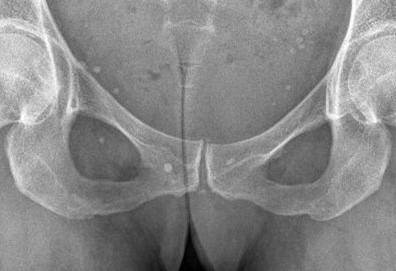
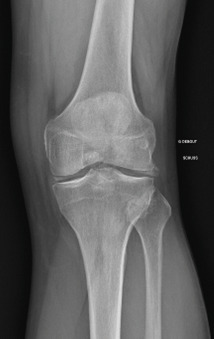
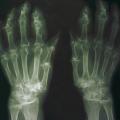
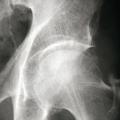
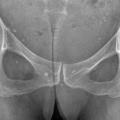
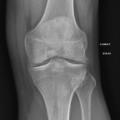
La forme pseudorhumatoïde est rare (5 %), simulant une polyarthrite rhumatoïde. L’arthrite chronique à PPC se présente comme une oligo- ou une polyarthrite, avec parfois des signes systémiques d’inflammation (élévation de la vitesse de sédimentation et de la protéine C-réactive [CRP]). La superposition d’accès aigus microcristallins est évocatrice de ce diagnostic. Il s’agit d’un diagnostic différentiel de polyarthrite rhumatoïde du sujet âgé ou de pseudopolyarthrite rhizomélique. Le diagnostic repose sur la mise en évidence des cristaux de PPC, même si les radiographies standard sont évocatrices. L’atteinte radiographique associe des calcifications des cartilages articulaires (fig. 7) et des fibrocartilages (fig. 8, 9, 10 et 11) [à rechercher systématiquement sur les radiographies de poignets, genoux et symphyse pubienne]. La mise en évidence d’une chondrocalcinose sur des radiographies standard renforce le diagnostic de rhumatisme à PPC mais l’absence de dépôts calciques ne l’élimine pas (la sensibilité de la radiographie standard étant imparfaite). L’échographie peut mettre en évidence des dépôts de PPC, qui apparaissent comme une fine bande hyperéchogène au sein des cartilages hyalins et comme des points scintillants dans les fibrocartilages ou dans la membrane synoviale. La sensibilité de l’échographie est bien supérieure à celle de la radiographie standard. Le scanner peut également mettre en évidence des dépôts calciques évocateurs, notamment au niveau du rachis ou du bassin qui sont plus difficilement explorés par les radiographies et l’échographie.
Les arthropathies liées à l’arthrose ou destructrices ont une fréquence qui augmente avec l’âge. L’arthrose associée aux dépôts de PPC touche en particulier les genoux, avec une symptomatologie chronique et/ou des accès aigus cristallins. Par comparaison avec l’arthrose idiopathique, l’arthrose avec dépôt de PPC serait à l’origine d’une symptomatologie plus inflammatoire, toucherait des articulations inhabituelles (radiocarpienne, carpienne, gléno-humérale, médio-pied et arrière-pied, cheville) et serait associée à plus d’ostéophytes et de géodes. Cette arthropathie dégénérative peut s’accompagner de lésions structurales sévères avec disparition rapide de l’interligne (arthropathies destructrices : hanches, genoux, poignets, coudes) mimant une ostéoarthropathie nerveuse.
La forme hémarthrosique complique parfois les arthropathies dégénératives et destructrices, s’observant au niveau de l’épaule et du genou.
Formes diverses
Les calcifications peuvent intéresser non seulement le cartilage hyalin et le fibrocartilage mais aussi la membrane synoviale, la capsule, les tendons (ténosynovite, syndrome du canal carpien). Les calcifications peuvent concerner le rachis, touchant :
- les disques, typiquement situées à la périphérie de l’annulus fibrosus, associées ou non à des discopathies dégénératives pluri-étagées, parfois destructrices (responsables de scoliose, notamment lombaire ou de pseudospondylodiscite) ;
- les ligaments (ligaments jaune, longitudinal, péri-odontoïdien, donnant la classique dent couronnée) inter- et supra-épineux ;
- les articulations zygapophysaires, source de spondylolisthésis. Il y a une constellation variable de signes et de symptômes liée à ce type d’arthropathie cristalline, souvent à début brutal (rachialgie, raideur cervicale, fièvre), parfois à début progressif (radiculalgie, myélopathie), simulant de très nombreuses maladies (méningite, spondylodiscite infectieuse, rhumatisme inflammatoire, tumeurs vertébrales).
Traitement
Le traitement du rhumatisme à PPC associe des mesures pharmacologiques et non pharmacologiques, adaptées aux signes cliniques, aux facteurs de risque généraux et à la présence de maladies métaboliques associées. Une maladie associée (hyperparathyroïdie, hémochromatose, hypomagnésémie) doit être prise en charge même si ce traitement n’aura le plus souvent pas d’impact sur l’évolution du rhumatisme à PPC.
Dans les arthrites aiguës inflammatoires, l’utilisation des infiltrations cortisoniques, de la colchicine, des AINS et de la corticothérapie générale est possible.
Traitement de l’arthrite aiguë à pyrophosphate de calcium
Il inclut :
- la mise au repos de l’articulation, l’application de glace ainsi qu’une ponction-évacuation de l’articulation, puis une infiltration cortisonée de l’articulation (synoviorthèse) ;
- les AINS per os (en associant un protecteur gastrique si nécessaire) ou de petites doses de colchicine (0,5 mg, 2 ou 3 fois par jour), traitements efficaces bien que leur utilisation puisse être limitée par leurs effets indésirables et la présence de comorbidités, en particulier chez les sujets âgés ;
- l’administration de cortisone per os sur une courte durée (prednisone 30 mg/j pendant 48 heures). Son efficacité est similaire à celle de la colchicine (étude COLCHICORT 2022) dans le traitement de l’arthrite aiguë à PPC et sa tolérance semble meilleure (évite les diarrhées pouvant survenir sous colchicine).
Traitement prophylactique de la récidive des accès aigus à PPC
Il repose sur de petites doses de colchicine (de 0,5 à 1 mg/j) ou d’AINS.
Traitement de l’arthrite chronique à PPC
Les possibilités thérapeutiques sont, par ordre de préférence : de manière empirique la colchicine (de 0,5 à 1 mg/j), de petites doses de cortisone, parfois les AINS per os (mais leur prescription est souvent limitée par les comorbidités chez les patients âgés), plus rarement dans les formes résistantes, le méthotrexate et l’hydroxychloroquine. Le niveau de preuve pour ces deux derniers médicaments est cependant faible (il n’y a pas aujourd’hui de traitement « de fond » de la chondrocalcinose articulaire).
Des séries de cas rapportent l'efficacité de biothérapies anti interleukine 1 ou 6 mais leur utilisation reste hors AMM. Un programme hospitalier de recherche clinique (PHRC) devrait débuter très prochainement pour tester l'efficacité du tocilizumab.
Les objectifs et les modalités thérapeutiques pour une arthrose associée à une chondrocalcinose articulaire sont identiques à ceux d’une arthrose idiopathique. Aucun traitement ne permet la dissolution des cristaux de PPC. La chondrocalcinose articulaire asymptomatique ne requiert aucun traitement. Le traitement des arthropathies dégénératives et destructrices, des hémarthroses récidivantes malgré les synoviorthèses passe par le remplacement prothétique.
Rhumatisme apatitique
Le rhumatisme apatitique est lié à des dépôts de phosphate de calcium basique. L’apatite est un minéral contenant du calcium et appartient à la famille des cristaux calciques de phosphate de calcium basique. Normalement présents dans l’os et la dentine, ces cristaux peuvent se déposer dans et autour des articulations (tendons, bourses séreuses).
Épidémiologie
La prévalence radiographique est de 2 à 3 % au niveau de l’épaule, maximale chez les femmes d’âge moyen (20 % entre 30 et 40 ans), les calcifications étant le plus souvent asymptomatiques. L’épaule est la localisation la plus fréquente (60 %), suivie de la hanche, du coude et du poignet.
Physiopathologie
La formation de dépôts de phosphate de calcium basique peut être favorisée par :
- une élévation du produit phosphocalcique comme dans l’insuffisance rénale terminale et l’intoxication à la vitamine D ;
- des facteurs généraux (génétiques) lorsque les calcifications sont multiples ;
- des facteurs locaux (microtraumatismes, hypovascularisation), expliquant la dégénérescence calcique de l’insertion des tendons de la coiffe des rotateurs, en particulier le supra-épineux.
Formes cliniques
Tendinopathies calcifiantes
Les calcifications apatitiques, typiquement denses, arrondies, homogènes, peuvent induire une réaction inflammatoire responsable d’un accès aigu (épaule ou hanche hyperalgique) entraînant une impotence fonctionnelle à début brutal, parfois dans un contexte fébrile simulant une arthrite septique. Elles peuvent disparaître après l’accès aigu et devenir polylobées et hétérogènes sur la radiographie. Enfin, les douleurs peuvent être aussi chroniques (tendinopathie calcifiante de la coiffe des rotateurs).
Il existe des formes profuses récidivantes : on parle alors de maladie des calcifications tendineuses multiples.
Arthrites à phosphate de calcium basique
Elles sont rares, de diagnostic difficile, car les cristaux ne sont pas visibles en microscopie optique, nécessitant une coloration spéciale (rouge alizarine, non spécifique cependant des cristaux de phosphate de calcium basique). Les arthrites aiguës ressemblent à la goutte et aux arthrites à PPC, parfois destructrices dans la forme d’épaule sénile hémorragique (arthrite gléno-humérale) survenant chez les femmes autour de 70 ans, caractérisée par une tuméfaction ecchymotique de l’épaule révélant une hémarthrose.
Traitement
Les crises aiguës sont traitées par AINS, corticothérapie en cure courte (de 20 à 30 mg/j) ou encore par injections locales de corticoïdes. La colchicine peut être utile pour réduire la fréquence des crises. La persistance de calcifications symptomatiques peut nécessiter, notamment au niveau de l’épaule, une ponction-trituration-lavage, une exérèse arthroscopique ou des séances d’ondes de choc extracorporelles.
• Une recherche de microcristaux est recommandée sur tout liquide articulaire d’arthrite indifférenciée.
• Arthrite septique et microcristalline peuvent coexister.
• L’échographie permet parfois un diagnostic de goutte ou de chondrocalcinose articulaire.
• Tout individu avec une uricémie supérieure à 60 mg/L est à risque de goutte.
• L’hyperuricémie est une cause nécessaire mais non suffisante de goutte.
• Les facteurs de risque de goutte et les comorbidités (y compris le syndrome métabolique) doivent être évalués et traités.
• La goutte primitive est due dans 90 % des cas à un défaut d’élimination de l’acide urique.
• L’hyperuricémie n’est pas constante durant l’accès goutteux.
• L’éducation et les conseils d’hygiène de vie sont au centre de la prise en charge du patient atteint de goutte.
• Les petites doses de colchicine (0,5 mg 3 fois/j) sont aussi efficaces et moins toxiques que les fortes doses dans la goutte et dans le rhumatisme à PPC.
• La valeur cible de l’uricémie sous traitement hypo-uricémiant doit être inférieure à 60 mg/L, voire idéalement à 50 mg/L.
• L’hyperuricémie asymptomatique ne doit pas être traitée par traitements hypo-uricémiants.
• L’allopurinol doit être débuté à 50 ou 100 mg, et augmenté très progressivement tous les un à deux mois, en ajustant chez l’insuffisant rénal.
• La survenue d’une éruption cutanée ou d’autres signes d’hypersensibilité sous inhibiteurs de la xanthine oxydase doit faire arrêter le traitement.
• Avant 55 ans ou devant une forme sévère,, il faut rechercher une forme familiale de rhumatisme à PPC et surtout une forme secondaire (hémochromatose, hyperparathyroïdie, hypomagnésémie, hypophosphatasie génétique).
• Le rhumatisme à cristaux de PPC est un grand simulateur (forme pseudorhumatoïde, pseudo-arthrosique).
• Le rhumatisme à cristaux de PPC peut se compliquer d’arthropathie destructrice.
• Les tendinopathies calcifiantes sont l’expression la plus fréquente du rhumatisme apatitique.
• L’avis du rhumatologue est nécessaire devant toute goutte précoce ou sévère (tophus, arthropathie), devant un rhumatisme à dépôts de PPC polyarticulaire ou du sujet jeune, un rhumatisme apatitique récidivant ou disséminé ou lorsque le traitement de première intention est inefficace ou compliqué (comorbidités, intolérance médicamenteuse, insuffisance rénale).

 Encadrés
Encadrés