L’insuffisance cardiaque pose, par sa fréquence et sa gravité, un problème majeur de santé publi–que.1 Entre 1 et 2 % de la population totale souffre d’insuffisance cardiaque et cette incidence atteint 10 % chez les patients de plus de 70 ans.2 Dix pour cent des insuffisants cardiaques présentent un stade avancé de la maladie et leur taux de survie à un an ne dépasse pas 50 %, malgré un traitement pharmacologique optimal.2 Au stade d’insuffisance cardiaque avancée, seule la transplantation cardiaque peut, sous certaines conditions, permettre une survie prolongée avec une excellente qualité de vie. Les techniques d’assistance et de suppléance cardiaque mécaniques élargissent, en complément à la transplantation cardiaque, les possibilités thérapeutiques pour faciliter l’accès à la transplantation ou représenter une dernière alternative lorsque la greffe est impossible.3 Depuis soixante-dix ans, de nombreux dispositifs ont été testés et utilisés. Beaucoup ont été abandonnés. Le rêve du cœur artificiel, véritable alternative à la transplantation, reste à réaliser.4,5
L’Académie nationale de médecine a émis des recommandations en mars 2023 (encadré).
Dispositifs disponibles
Ils peuvent être classés en fonction de leur durée potentielle d’utilisation.
Dispositifs d’assistance circulatoire de courte durée
Les techniques d’assistance de courte durée sont mises en œuvre en urgence, chez un malade sur le point de mourir. Elles ne sont utilisables que pendant quelques jours à quelques semaines. Elles permettent de gagner du temps et de surveiller l’évolution, qui peut se faire selon trois modes : sevrage avec récupération d’une fonction cardiaque acceptable, escalade thérapeutique (transplantation cardiaque et/ou assistance circulatoire de longue durée) ou arrêt des soins.
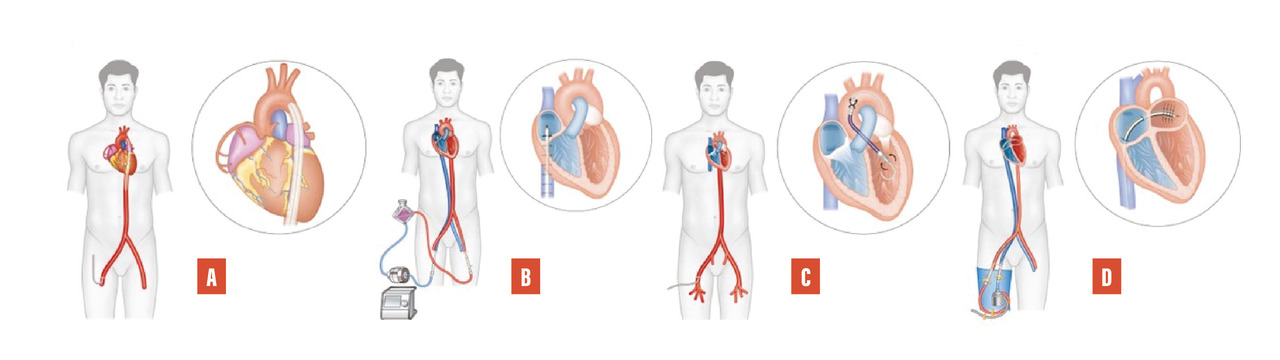
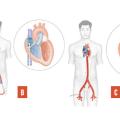
Quatre types de dispositif sont disponibles (fig. 1) :
- la contrepulsion diastolique par ballonnet intra-aortique, dont l’utilisation est devenue anecdotique ;
- l’ECMO (extracorporeal membrane oxygenation). C’est, de très loin, le dispositif le plus utilisé. Un circuit de circulation extracorporelle classique (comportant une pompe centrifuge et un oxygénateur à membranes) est installé entre deux canules, veineuse et artérielle, introduites par abord percutané des vaisseaux périphériques (ou parfois par sternotomie). La mise en place est rapide et facile. L’ensemble est autonome et mobilisable. Le principal inconvénient est représenté par la nécessité de décharger le cœur gauche si l’assistance se prolonge. Longtemps réservée aux difficultés de sevrage après chirurgie cardiaque, l’ECMO est devenue un outil indispensable de réanimation dans les unités de soins intensifs, les Samu, voire en dehors de l’hôpital ;
- la minipompe intracardiaque,introduite dans le ventricule gauche par voie percutanée, qui aspire le sang dans le ventricule et le réinjecte dans l’aorte ascendante. La plus utilisée est la pompe Impella ;
- les dérivations ventriculaires percutanées. Une pompe extracorporelle reçoit le sang de l’oreillette gauche par une canule introduite par voie veineuse percutanée puis par voie transseptale. Le sang est réinjecté dans une canule artérielle percutanée. Le système actuellement disponible s’appelle TandemHeart.
Dispositifs d’assistance circulatoire prolongée
Conçus pour assurer une suppléance cardiaque pendant plusieurs mois, voire plusieurs années, les dispositifs d’assistance de longue durée sont implantés, en règle générale, dans l’attente d’une transplantation cardiaque (bridge to transplantation). Cependant, ils deviennent parfois, de façon délibérée ou de facto, faute de transplantation, une thérapeutique définitive (destination therapy).
Beaucoup de dispositifs ont été testés. Cependant, peu restent actuellement disponibles et couramment utilisés.
Ventricules paracorporels
Les systèmes d’assistance ventri–culaire paracorporels pneumatiques (dont le modèle emblématique est Excor de Berlin Heart) ont été largement utilisés dans les années 1980 - 1990, avec une grande efficacité hémodynamique mais une qualité de vie médiocre. Ils ne sont plus implantés chez l’adulte que de manière tout à fait exceptionnelle, mais ils restent la seule modalité d’assistance prolongée uni- ou biventriculaire chez l’enfant.
Dérivations ventriculaires implantées
Destinés essentiellement à assister un ventricule gauche, ces dispositifs peuvent aussi être utilisés pour suppléer un ventricule droit ou un ventricule unique. Un circuit de dérivation, incluant une pompe, est implanté dans le thorax entre la pointe du ventricule gauche et l’aorte. Depuis le début des années 1990, diverses pompes ont été utilisées, à débit continu (axiales ou centrifuges) ou à débit pulsatile.
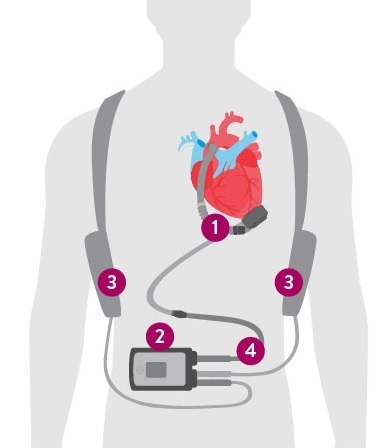
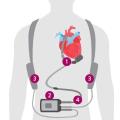
En pratique, le seul dispositif actuellement disponible en France est la pompe HeartMate 3. Il s’agit d’une pompe centrifuge à débit continu connectée à un système de contrôle par un câble transcutané et alimentée en électricité par des batteries portées à la ceinture ou en bandoulière, conférant une autonomie de quelques heures (fig. 2).
Cœurs artificiels
Stricto sensu, le terme « cœur artificiel total » doit être réservé aux dispositifs implantés en position orthotopique, à la place du cœur natif.
L’intérêt du cœur artificiel, déjà évoqué par Carrel et Lindbergh dans les années 1920, a suscité un engouement considérable depuis les années 1960. Au total, dix-neuf programmes de cœur artificiel ont été menés dans le monde. Seuls huit d’entre eux ont abouti à des implantations humaines : la première à Houston, en 1969, avec le cœur de Liotta et la première « semi-réussite » (survie de 112 jours) à Salt Lake City en 1982 avec le cœur de Jarvik appelé aujourd’hui SynCardia.
Les deux seuls systèmes actuellement disponibles utilisent une pompe à déplacement : l’éjection sanguine est assurée dans chaque chambre ventriculaire par le déplacement d’une membrane sous l’effet de l’augmentation de pression d’un fluide (air ou liquide).
Le cœur SynCardia a été implanté chez plus de 1 700 malades ; il utilise une technologie déjà ancienne (le cœur de Jarvik) et expose à un taux élevé de complications infectieuses.
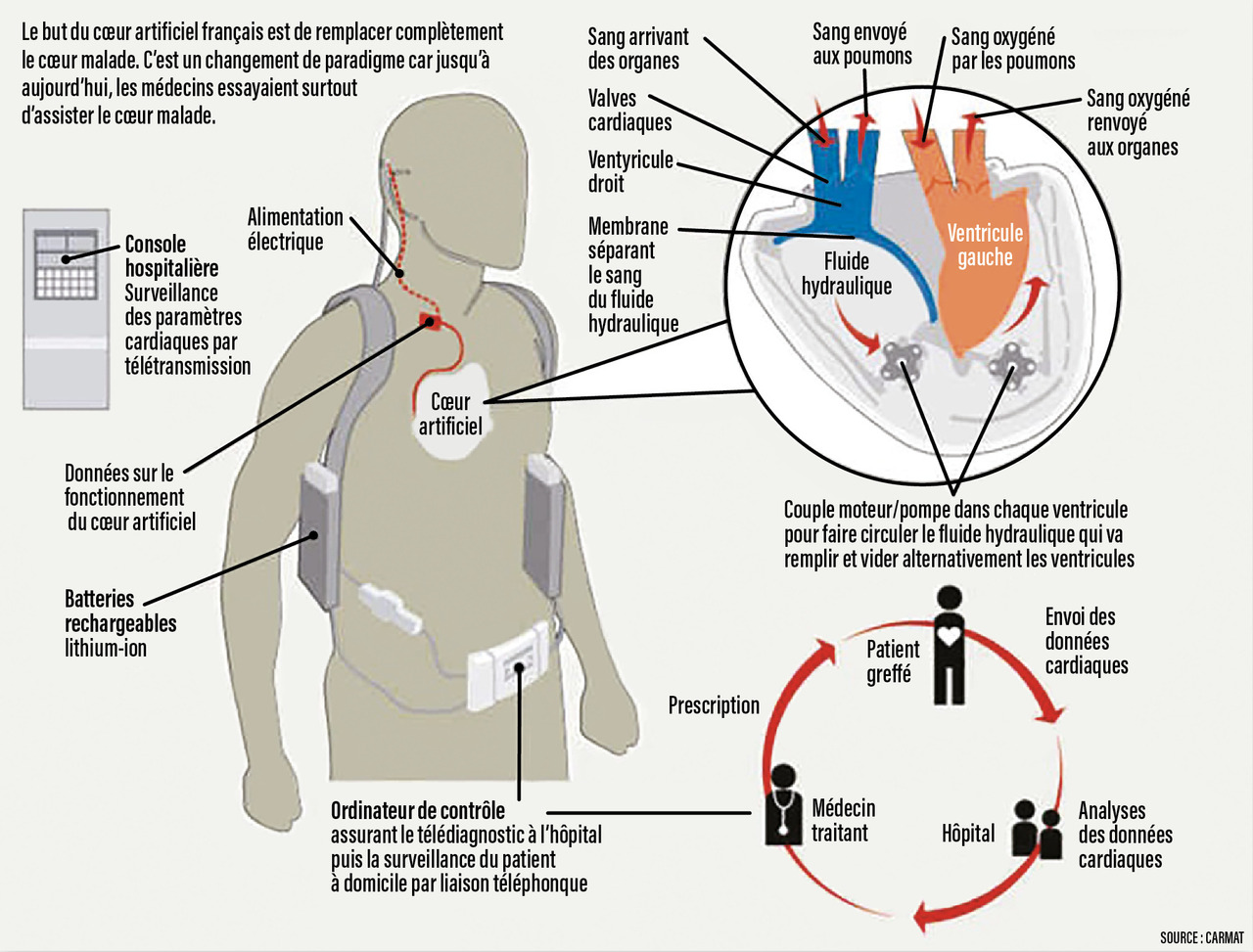
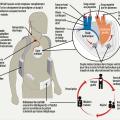
Le cœur Aeson de la société Carmat, qui a reçu récemment le marquage CE, est, après plusieurs périodes de suspension, de nouveau autorisé, exclusivement dans l’indication d’une implantation temporaire. L’utilisation de matériaux d’origine biologique, un système complexe de régulation adaptant le fonctionnement de la pompe aux besoins du malade sont les deux grandes originalités de ce dispositif (fig. 3).
Dans l’immédiat, l’implantation d’un cœur artificiel n’est autorisée, en France, que dans l’attente d’une transplantation.
Dispositifs d’assistance circulatoire en cours de développement
De très nombreux programmes de recherche sont en cours visant à produire des systèmes plus compacts, moins consommateurs en énergie, moins agressifs vis-à-vis du sang et surtout totalement implantables. Libérer le malade de la contrainte du câble percutané est en effet l’objectif essentiel ; ceci suppose de maîtriser la technologie de la batterie implantée et surtout du transfert percutané de l’énergie pour en assurer la recharge. Plusieurs de ces programmes sont français.
Un dispositif très original, Icoms Flowmaker, est en cours de développement par la société FineHeart. Une pompe est placée dans le ventricule gauche par voie transapicale. Elle est asservie à l’électrocardiogramme (ECG) et son fonctionnement intermittent assure un supplément d’éjection systolique au ventricule gauche défaillant. Elle est conçue pour être utilisée chez les patients avec insuffisance cardiaque modérément sévère.
Un autre programme très disruptif est en cours de développement par la société CorWave. La force propulsive est générée par l’ondulation d’une membrane souple, mimant le mouvement de la queue d’un poisson, permettant une réduction du traumatisme sanguin.
Enfin, divers projets de cœur artificiel sont en cours de développement, à un stade encore peu avancé (SoftHeart en Suisse, BivaCor en Australie et aux États-Unis, RealHeart en Suède).
Indications de l’assistance et de la suppléance cardiaques mécaniques
Les indications de l’assistance et de la suppléance cardiaques mécaniques ont fait l’objet de plusieurs recommandations internationales.6 - 8 Elles sont fondées sur une évaluation précise de la situation clinique suivant la classification INTERMACS (tableau). Deux situations très différentes doivent être envisagées.
Indications en urgence
Lorsque le pronostic vital d’un patient est engagé à très court terme (quelques heures), correspondant au stade INTERMACS 1 (choc cardiogénique ou crash and burn), la mise en place d’un système d’assistance de courte durée est indiquée (recommandation de classe I, niveau de preuve B). Chez un patient répondant aux critères du stade INTERMACS 2 (détérioration rapide sous inotropes ou sliding on inotropes), l’assistance doit être considérée (recommandation de classe IIa, niveau de preuve C).
Dans les deux cas, le but immédiat est de préserver la fonction cérébrale, de rétablir une perfusion tissulaire normale, d’éviter l’apparition d’une défaillance multiviscérale, et finalement de se donner du temps pour prendre une décision adaptée à l’évolution du patient (bridge to decision). Cette évolution est variable, pouvant se faire soit vers la récupération d’une fonction cardiaque acceptable (bridge to recovery), soit vers une escalade thérapeutique, transplantation cardiaque en urgence ou mise en place d’un système d’assistance circulatoire de longue durée (bridge to bridge).
Le choix du moment idéal de l’implantation du système d’assistance temporaire est crucial. Trop précoce, elle expose le patient à un risque inutile d’incidents iatrogènes ; trop tardive, elle intervient dans un contexte dégradé, avec des lésions d’organes (notamment cérébrales) devenues irréversibles.
La technique, de très loin la plus utilisée, est l’ECMO. Les autres dispositifs (Impella ou TandemHeart), qui ont l’avantage de permettre une décharge du ventricule gauche mais sont de maniement plus complexe, n’apportent pas de gain thérapeutique évident.9 Plusieurs études récentes ont clairement montré que l’implantation précoce d’une assistance temporaire améliorait la survie des patients en classe INTERMACS 1 et 2, avec un taux de survie passant de 40 à 70 %.10
Dans les situations d’urgence extrême, la mise en place d’une ECMO chez les patients en arrêt cardiorespiratoire et sous massage cardiaque, en milieu hospitalier ou extrahospitalier, permet d’obtenir une augmentation significative du taux de survie sans séquelles ; elle doit être considérée devant tout arrêt cardiorespiratoire (recommandation de classe IIa, niveau de preuve C).11
Indications dans l’insuffisance cardiaque avancée
La transplantation cardiaque reste le traitement idéal de l’insuffisance cardiaque terminale. En complément, les dispositifs d’assistance circulatoire de longue durée sont indiqués lorsque le traitement médical est inefficace ou lorsqu’une assistance mécanique de courte durée n’a pas permis la restauration d’une fonction cardiaque suffisante.
Les indications sont de trois types :
- permettre la survie sans détérioration multiviscérale dans l’attente d’une transplantation (bridge to transplantation) ;
- autoriser la disparition d’une contre-indication temporaire à la transplantation, essentiellement hypertension artérielle pulmonaire avec ou sans insuffisance cardiaque droite (bridge to candidacy) ;
- traitement définitif si la transplantation est définitivement contre-indiquée (destination therapy).
L’assistance de longue durée se discute chez les patients de classe INTERMACS 3 et 4 mais également chez des patients de classe 5 ou 6 avec des facteurs de risque associés (dénutrition, défaillance d’organes, activité très limitée).
L’assistance ventriculaire gauche par dérivation ventriculaire implantée (essentiellement HeartMate 3) donne des résultats très encourageants, proches de ceux de la transplantation cardiaque (survie supérieure à 80 % à un an et supérieure à 50 % à cinq ans), avec une qualité de vie acceptable et un risque infectieux et thromboembolique réduit. Plusieurs milliers de patients ont bénéficié de ce traitement.12 - 14
Pour obtenir ces résultats, l’indication d’assistance mécanique doit être portée suffisamment tôt, avant l’apparition d’une insuffisance cardiaque droite patente. Dans certains cas, la mise en place d’une assistance ventriculaire droite temporaire (par exemple par ECMO) peut permettre la disparition d’une insuffisance droite réversible.
La grande question est de comprendre pourquoi, en France, si peu de malades bénéficient de ce traitement, alors que les sociétés savantes ont formulé des recommandations claires (classe IIa, niveau de preuve A). Le défaut d’information des cardiologues et des médecins généralistes sur ces progrès récents fait que cette option de traitement n’est que rarement évoquée. Par ailleurs, le malade lui-même, qui surestime toujours la durée réelle de sa survie, est effrayé par la vision d’une intervention jugée lourde et ignore le bénéfice que celle-ci pourrait lui apporter.15
Au stade d’insuffisance biventriculaire avec insuffisance droite irréversible, seule l’implantation d’un cœur artificiel est envisageable. Les résultats du cœur SynCardia sont acceptables (70 % de survie jusqu’à la greffe) mais la qualité de vie est médiocre. L’avenir proche devrait confirmer ou infirmer les espoirs mis dans le cœur Aeson de Carmat.
Organisation des soins
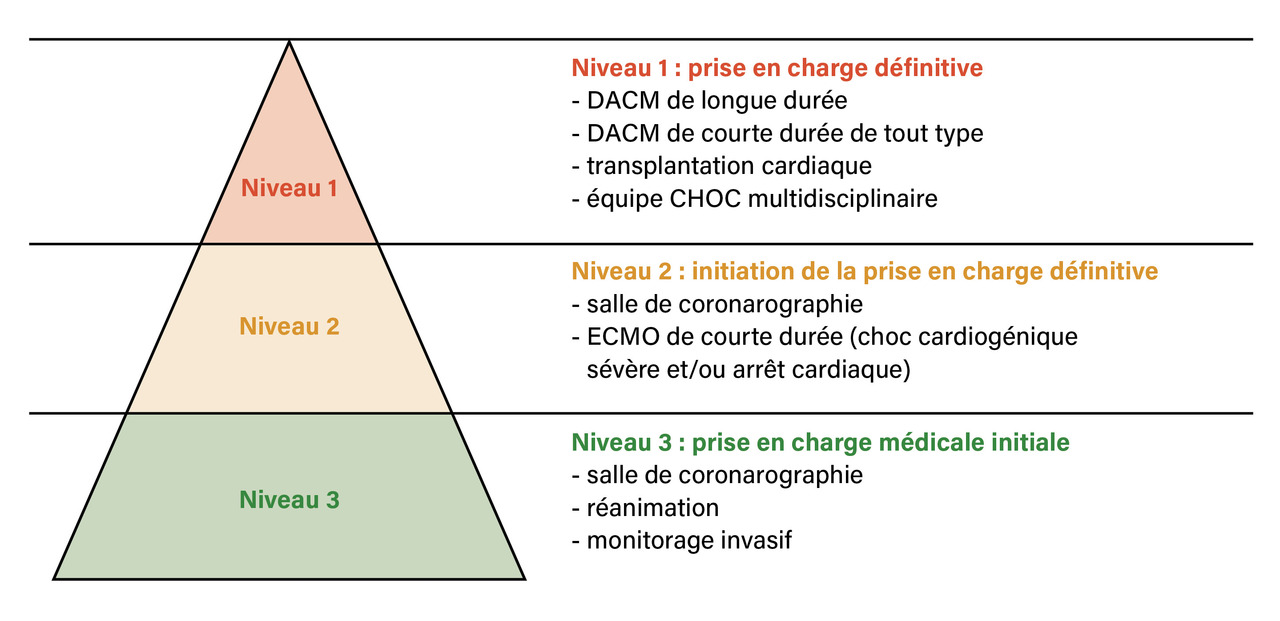
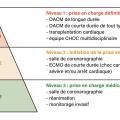
L’utilisation optimale des dispositifs d’assistance circulatoire demande une organisation spécifique de la filière « Choc et insuffisance cardiaque avancée ». Les sociétés savantes ont proposé une organisation en centres de référence de trois niveaux (fig. 4). Ce projet a été repris dans un rapport récent de la Haute Autorité de santé (HAS).16
Les centres labélisés doivent fonctionner vingt-quatre heures sur vingt-quatre et sept jours sur sept, être correctement dotés en personnel médical et infirmier et couvrir en réseau la totalité du territoire. Les dispositifs d’assistance de courte durée (ECMO) sont disponibles dans les centres de niveaux 1 et 2, de façon à permettre une prise en charge adéquate des situations d’urgence (choc et arrêt cardiaques).
Les dispositifs de longue durée sont réservés aux centres de niveau 1 (qui sont, par ailleurs, autorisés pour la transplantation cardiaque). Ils doivent avoir une unité mobile d’assistance circulatoire (UMAC) mobilisable en urgence pour assurer la prise en charge des urgences dans les centres de niveau 3. Les centres de niveau 1 sont multidisciplinaires, regroupant au minimum des chirurgiens cardiaques référents, des cardiologues spécialistes de l’insuffisance cardiaque, des cardiologues interventionnels et des médecins anesthésistes-réanimateurs référents en chirurgie cardiaque. Ils doivent être aussi dotés du personnel paramédical nécessaire à la surveillance des patients implantés vivant à domicile et du personnel de recherche permettant la tenue d’un registre fiable et une recherche clinique de qualité.
2. Truby LK, Rogers JG. Advanced heart failure: Epidemiology, diagnostic, and therapeutic approaches. JACC Heart Fail 2020;8(7):523-36.
3. Loisance D, Vouhé P. Rapport 23-06. Assistance circulatoire et remplacement cardiaque mécaniques. Bull Acad Natl Med 2023;207:685-94.
4. Loisance D. De l’assistance circulatoire au cœur artificiel. Bull Acad Natl Med 2002;186(1):59-71.
5. Vis A, Arfaee M, Khambati H, Slaughter MS, Gummert JF, Overvelde JTB, et al. The ongoing quest for the first total artificial heart as destination therapy. Nat Rev Cardiol 2022;19(12):813-28.
6. Kirklin JK, Pagani FD, Goldstein DJ, John R, Rogers JG, Atluri P, et al. American Association for Thoracic Surgery/International Society for Heart and Lung Transplantation guidelines on selected topics in mechanical circulatory support. J Thorac Cardiovasc Surg 2020;159(3):865-96.
7. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur J Heart Fail 2022;24(1):4-131.
8. Bernhardt AM, Copeland H, Deswal A, Gluck J, Givertz M, et al. The International Society for Heart and Lung Transplantation/Heart Failure Society of America Guideline on acute mechanical circulatory support. J Card Fail 2023;29(3);304-74.
9. Wong ASK, Sin SWC. Short-term mechanical circulatory support (intra-aortic balloon pump, Impella, extracorporeal membrane oxygenation, TandemHeart): A review. Ann Transl Med 2020;8(13):829-42.
10. Tehrani BN, Truesdell AG, Psotka MA, Rosner C, Singh R, Sinha S, et al. A standardized and comprehensive approach to the management of cardiogenic shock. JACC Heart Fail 2020;8(11):879-91.
11. Abrams D, MacLaren G, Lorusso R, Price S, Yannopoulos D, Vercaemst L, et al. Extracorporeal cardiopulmonary resuscitation in adults: Evidence and implications. Intensive Care Med 2022;48(1):1-15.
12. Mehra MR, Uriel N, Naka Y, Cleveland JC, Yuzefpolskaya M, Salerno CT, et al. A fully magnetically levitated left ventricular assist device. Final report. N Engl J Med 2019;380(17):1618-27.
13. Zimpfer D, Gustafsson F, Potapov E, Pya Y, Schmitto J, Berchtold-Herz M, et al. Two-year outcome after implantation of a full magnetically levitated left ventricular assist device: Results from the ELEVATE Registry. Eur Heart J 2020;41(39):3801-9.
14. Mehra MR, Goldstein DJ, Cleveland JC, Cowger JA, Hall S, Salerno CT, et al. Five-year outcomes in patients with fully magnetically levitated vs axial-flow left ventricular assist devices in the MOMENTUM 3 randomized trial. JAMA 2022;328(12):1233-42.
15. Allen LA, Yager JE, Jonsson Funk M, Levy WC, Tulsky JA, Bowers MT, et al. Discordance between patient predicted and model predicted life expectancy among ambulatory patients with heart failure. JAMA 2008;299(21):2533-42.
16. Haute Autorité de santé. Dispositifs d’assistance circulatoire mécanique (DACM) de longue durée. Actualisation des conditions de prise en charge. Juin 2021. https://vu.fr/ZSVwi