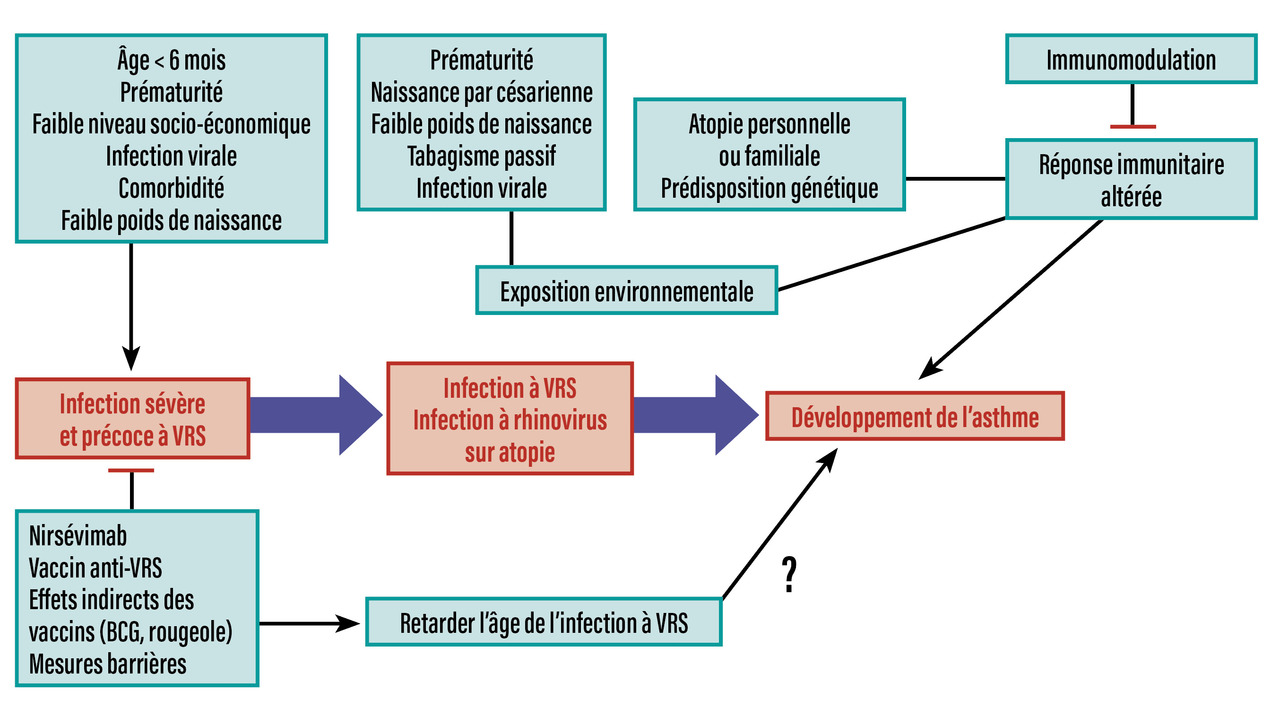
Un certain nombre de facteurs de risque d’asthme chez l’enfant ont été répertoriés, qu’ils concernent la période pré- ou post-natale précoce. Ils sont résumés dans la figure.
Facteurs de risque environnementaux pré- et post-nataux
La prématurité est indiscutablement associée à une vulnérabilité respiratoire dans les premiers mois de vie, surtout sous la forme d’épisodes sifflants hivernaux.
La naissance par césarienne a été suspectée de favoriser l’asthme en modifiant le microbiote, mais une étude récente1 n’est pas en faveur de cette hypothèse.
Les virus respiratoires (virus respiratoire syncytial [VRS] et rhinovirus) sont à l’origine de manifestations asthmatiques précoces avec des conséquences à long terme.
L’impact du tabagisme passif doit être souligné.
L’exposition environnementale peut influencer précocement la réponse immunitaire. À ce titre, l’exposition aux pesticides durant la période fœtale est particulièrement étudiée.2 Ils peuvent, en effet, franchir la barrière placentaire et être responsables d’une réduction de la capacité vitale et de sifflements, selon certaines études. Islam et al.3 ont ainsi mené une étude prospective pré- et post-natale au Costa Rica en mesurant la concentration de plusieurs métabolites urinaires des pesticides entre la naissance et l’âge de 5 ans. Ils ont montré une relation significative entre ces taux urinaires et l’existence d’infections respiratoires ou d’asthme surtout avec la famille des pyréthrinoïdes. Les polluants atmosphériques4 provenant de la combustion fossile, les nanoparticules émises par les industries chimiques, les microplastiques présents dans les textiles, les émissions des grandes exploitations agricoles et les détergents exposent une large population à des risques pour la santé. Ces expositions constituent les principaux facteurs de risque de maladies chroniques pulmonaires. Les perturbateurs endocriniens suscitent des inquiétudes pour la population pédiatrique. Ils se retrouvent dans de nombreux objets et produits de la vie courante. Ils sont également présents dans l’environnement du fait d’une contamination des différents milieux. Les études de biosurveillance dans la population française ont montré une imprégnation généralisée de la population. Parmi eux, le bisphénol A, les phtalates, le triclosan et le parabène ont des effets sur le développement des allergies, soit directement en interagissant sur le système immunitaire, soit indirectement par le biais du microbiote.5
La prédisposition génétique doit être prise en compte
Des antécédents personnels ou familiaux d’atopie sont de puissants prédicteurs de l’asthme pendant l’enfance et au début de l’âge scolaire. Mais, contrairement aux maladies monogéniques, les gènes de susceptibilité de l’asthme ne peuvent à eux seuls expliquer les symptômes et leur évolution. C’est l’interaction avec l’environnement sur un terrain génétique prédisposé qui induit l’expression de la maladie atopique et de l’asthme.
La prévention primaire concerne l’ensemble de la population
La diminution du tabagisme passif doit rester une priorité, surtout celle concernant la période fœtale. Une supplémentation en vitamine D3 durant la grossesse a donné des résultats positifs sur les bronchites sifflantes du nourrisson mais pas sur l’asthme plus tard dans la vie.6 La modification du microbiote pourrait constituer une piste de recherche en se référant au mode de vie de certains enfants vivant à la ferme.7 Ce mode de vie est généralement associé à une diversité importante du microbiote intestinal, avec un impact sur l’activité du système immunitaire pouvant expliquer la moindre fréquence de l’asthme ou des allergies. Le recours systématique à l’allaitement maternel prolongé n’a pas d’effet bénéfique indiscutable dans les études prospectives. De même, l’utilisation de pré- ou probiotiques durant la grossesse ou dans les premiers mois de vie n’a pas donné de résultats significatifs sur la réduction de l’asthme.8
Les poumons normaux sont caractérisés par une abondance faible du microbiote dont le développement est intense durant les premiers mois de vie, pour se stabiliser dès l’âge de deux ans. Une dysbiose respiratoire chez le nourrisson, combinée avec un dysfonctionnement des cytokines pro-inflammatoires de l’épithélium nasal lors d’une infection virale, peut augmenter le risque de développer une maladie respiratoire dans la première année de vie, et ensuite de l’asthme. Les stratégies préventives ciblent donc les infections virales, en premier lieu celle à virus respiratoire syncytial (VRS).9 L’arrivée, depuis 2023, du nirsévimab, anticorps monoclonal actif en une seule injection couvrant toute la période hivernale, devrait permettre de réduire encore le risque chez tous les nourrissons ; toutefois, il n’y a aucune donnée à l’heure actuelle concernant la prévention de l’asthme par le nirsévimab. L’arrivée d’un vaccin anti-VRS administré aux femmes enceintes devrait renforcer cette stratégie. En dehors de ces actions dirigées contre le VRS, des préventions alternatives sont à l’étude concernant une immunomodulation par le vaccin contre la rougeole ou le BCG.6
Une vaccination précoce contre la rougeole, à quatre mois, s’est montrée efficace contre le risque d’une infection sévère à VRS chez des nourrissons vulnérables de moins de six mois. Une réduction du risque d’infection à VRS (hospitalisation et mortalité) a également été démontrée dans un groupe de nourrissons vaccinés par le BCG comparé à un groupe non vacciné.
La prévention ciblée s’adresse aux populations allergiques
Les enfants nés de parents allergiques sont considérés comme à haut risque de développer un asthme précoce, parfois sévère, surtout s’il existe une sensibilisation associée à des trophallergènes ou pneumallergènes. La sensibilisation allergique est, en effet, étroitement associée à certains phénotypes d’asthme. La rhinite allergique peut précéder l’apparition de l’asthme. Par conséquent, l’immunothérapie pourrait prévenir l’asthme, même si le niveau de preuve reste encore faible. L’étude GAP10 sur la prévention de l’asthme a proposé une désensibilisation sublinguale au pollen de graminées chez des enfants souffrant de rhinite allergique. L’étude a montré une réduction des symptômes d’asthme avec diminution de l’utilisation de médicaments antiasthmatiques dans le bras désensibilisé, mais aucun effet sur l’incidence de l’asthme après deux ans de suivi. Une explication pourrait être que cette étude a été entreprise à un âge relativement avancé (scolaire), donc sans doute trop loin de la phase précoce de modulation immunitaire. Dans cette perspective, l’étude LEAP pourrait constituer un exemple utile d’approche préventive, étant donné qu’elle a permis d’induire une tolérance alimentaire par une exposition précoce à des trophallergènes chez des enfants atteints d’eczéma sévère ou d’allergie aux œufs, âgés de quatre à onze mois.11 Bien que les deux études ne ciblent pas le même groupe d’allergènes et que l’allergie alimentaire soit différente de l’asthme, ces résultats pourraient néanmoins souligner l’importance de l’induction précoce d’une tolérance active, plutôt que de mesures d’éviction, utilisant une fenêtre d’opportunité thérapeutique prometteuse chez le nourrisson. Le développement et l’approbation récents d’anticorps monoclonaux dirigés contre des molécules clés de l’inflammation allergique (omalizumab, mépolizumab, dupilumab) constituent une grande avancée. Ces antagonistes ont montré des effets thérapeutiques remarquables, mais leur effet sur l’histoire naturelle de l’asthme reste à démontrer. À ce jour ils ne peuvent être utilisés qu’après l’âge de six ans et il est très probable qu’à cet âge, les phénomènes immunologiques soient déjà fixés. Il serait utile d’évaluer de telles interventions pharmacologiques à un stade plus précoce.
Intervenir dès le plus jeune âge
Pour prévenir l’asthme chez l’adulte, il faut intervenir chez l’enfant à un stade précoce de son développement. Si l’utilisation préventive des biothérapies reste encore au stade des intentions, la mise en route de mesures efficaces et simples, comme la lutte contre le tabagisme passif et la limitation des infections virales saisonnières, est à la portée de tous.
2. Ventura-Miranda MI, Fernández-Medina IM, Guillén-Romera E, et al. Effect of gestational pesticide exposure on the child’s respiratory system: A narrative review. Int J Environ Res Public Health 2022;19:15418.
3. Islam JY, Hoppin J, Mora AM, et al. Respiratory and allergic outcomes among 5-years-old children exposed to pesticides. Thorax 2023;78:41-9.
4. Aghapour M, Ubags ND, Bruder D, et al. Role of air pollutants in airway epithelial barrier dysfunction in asthma and COPD. Eur Respir Rev 2022;31:210112.
5. Guzylack-Piriou L, Bouchaud G. Exposition aux perturbateurs endocriniens et développement des maladies allergiques. Rev Fr Allergol 2019;59:22-31.
6. Von Mutius E, Smits HH. Primary prevention of asthma: From risk and protective factors to targeted strategies for prevention. Lancet 2020;396:854-66.
7. Frei R, Heye K, Roduit C. Environnemental influences on chilhood allergies and asthma-the farm effect. Pediatr Allergy Immunol 2022;33:e13807.
8. Nuzzi G, Di Cicco M, Trambusti I, et al. Primary prevention of pediatric asthma through nutritional interventions. Nutrients 2022;14:754.
9. Binn SE, Tuckerman J, Licciardi PV, et al. Respiratory syncytial virus, recurrent wheeze and asthma: A narrative review of pathophysiology, prevention and future directions. J Paediatr Child Health 2022;58:1741-6.
10. Valovirta E, Petersen TH, Piotrowska T, et al. Results from the 5-year SQ grass sublingual immunotherapy tablet asthma prevention (GAP) trial in children with grass pollen allergy. J Allergy Clin Immunol 2018;141:529-38.
11. Du Toit G, Roberts G, Sayre PH, et al. Randomized trial of peanut consumption in infants at risk for peanut allergy. N Engl J Med 2015;372:803-13.