La médecine nucléaire, spécialité d’imagerie médicale en plein essor depuis cinquante ans, joue aujourd’hui un rôle important dans de nombreuses spécialités, telles que l’oncologie, la cardiologie ou encore la neurologie. Le principe de la médecine nucléaire repose sur l’utilisation de sources radioactives non scellées pour visualiser in vivo des processus physiopathologiques. Contrairement à la radiologie, qui étudie l’aspect anatomique, la médecine nucléaire s’intéresse à l’aspect fonctionnel des organes.
Pour réaliser un examen de médecine nucléaire, un radiopharmaceutique est administré par voie intraveineuse au patient. Il se compose d’un vecteur ciblant un récepteur ou un transporteur spécifique et d’un atome radioactif qui émet un rayonnement détecté par le système d’imagerie, ce qui permet de localiser la pathologie.
En matière d’équipement, la médecine nucléaire dispose de deux principaux types de caméra : la tomographie par émission monophotonique (TEMP) et la tomographie par émission de positons (TEP). La TEMP utilise des rayonnements gamma, avec des émetteurs comme le technétium 99m ou l’iode 123, tandis que la TEP détecte des rayons de 511 keV produits par l’annihilation d’un positon avec un électron. En oncologie, le radiotraceur TEP le plus utilisé est le 18F-fluorodésoxyglucose (FDG), un analogue du glucose capté par les cellules en division. Sa demi-vie de cent dix minutes et sa production par des cyclotrons en France facilitent son acheminement régulier vers les centres de médecine nucléaire.
Déroulement d’un examen de médecine nucléaire
Lors d’un examen de médecine nucléaire, des instructions précises doivent être suivies par le patient. Pour un examen TEP-FDG, il est requis d’être à jeun depuis au moins quatre heures afin de réduire la compétition entre le sucre endogène et le radiotraceur. En cas de perfusion, une solution de chlorure de sodium est recommandée et toute alimentation parentérale doit être interrompue au minimum quatre heures avant l’examen. Les patients diabétiques doivent suspendre leur prise d’insuline rapide pour éviter une hyperfixation musculaire, susceptible de compromettre la qualité des images. Certains centres préconisent également la prise d’une dose unique de bêtabloquant avant l’examen pour limiter la fixation de la graisse brune, altérant la qualité de l’examen, notamment chez les patients jeunes.
À son arrivée dans le service de médecine nucléaire, le patient est pris en charge par un manipulateur, qui lui administre le radiotraceur. Après l’injection, il est installé dans un box pendant une heure, temps nécessaire pour que le radiotraceur se fixe sur les tissus cibles. L’examen se déroule ensuite avec l’acquisition simultanée de la TEP et du scanner couplé, du vertex jusqu’à mi-cuisses. Pour les cas de mélanomes ou certains cancers ostéophiles, une acquisition du corps entier est nécessaire. Dans certains centres, le scanner bénéficie d’une injection d’agents de contraste à base de gadolinium, permettant ainsi une imagerie scanner de qualité diagnostique simultanée. Dans la plupart des cas cependant, la résolution du scanner reste inférieure à celle des centres de radiologie et celui-ci est principalement utilisé à des fins de localisation et de correction d’atténuation. Hormis la grossesse, il n’existe pas de contre-indication à la réalisation d’une TEP et aucun effet indésirable n’est attendu à la suite de l’injection du radiopharmaceutique. Une extravasation du produit injecté est parfois possible dans les espaces périvasculaires ou sous-cutanés, pouvant déclencher un œdème ou une douleur au point d’injection. Sa résolution est rapide après surélévation du membre, massage et application de compresses chaudes. Du fait des demi-vies courtes des isotopes radioactifs utilisés en médecine nucléaire et de l’élimination biologique urinaire, la dose radioactive reçue par le patient est très faible. Aucune mesure d’éviction particulière n’est recommandée pour le patient après un examen de médecine nucléaire.
Exemples d’applications en oncologie
En oncologie, la TEP-FDG fait partie intégrante de la prise en charge des cancers FDG-avides, que ce soit pour le bilan d’extension ou le suivi sous traitement. C’est le cas, par exemple, du cancer du poumon, du sein ou des lymphomes.1 - 3
La TEP permet de détecter précocement l’efficacité d’un traitement, y compris avant que la taille de la lésion ne diminue de manière significative.4 Il est important toutefois de réaliser cet examen après un certain délai suivant les thérapeutiques (deux semaines après une chimiothérapie ; un mois après une chirurgie et trois mois après la radiothérapie) pour éviter l’impact des remaniements inflammatoires qui peuvent faussement augmenter le métabolisme glucidique. Il est également essentiel de comprendre que l’absence de captation du FDG ne signifie pas nécessairement l’absence de maladie, car certaines pathologies, telles que le carcinome lobulaire du sein, le carcinome lépidique du poumon, le carcinome à cellules claires du rein ou les tumeurs neuroendocrines, montrent peu ou pas d’affinité pour le FDG.
Plusieurs radiotraceurs autres que le FDG sont disponibles et leur utilisation dépend de l’indication clinique spécifique. Le 68Ga-DOTATOC, qui se lie fortement aux récepteurs de type 2 de la somatostatine, est utilisé pour l’imagerie des tumeurs neuroendocrines pulmonaires et du système digestif, ainsi que pour les méningiomes.5 La 18F-fluorodopa, ciblant les transporteurs LAT, est privilégiée pour les tumeurs neuroendocrines iléales, les paragangliomes et les tumeurs gliales.6 En oncologie prostatique, le 68Ga-PSMA et le 18F-PSMA, récemment approuvés, sont recommandés lors de la récidive biologique, supplantant progressivement la 18F-choline.7 Enfin, le radiotraceur FAPI cible spécifiquement la protéine d’activation des fibroblastes, abondante dans le stroma des tumeurs.8
Nouveaux outils en imagerie nucléaire
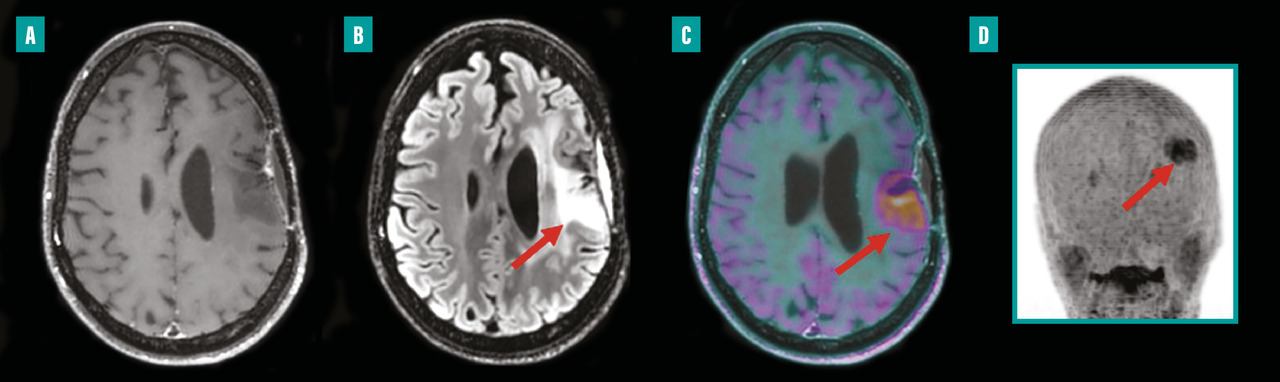
Depuis environ une décennie, des systèmes hybrides alliant TEP et imagerie par résonance magnétique (IRM) sont disponibles en milieu clinique. La TEP-IRM présente l’avantage d’exposer les patients à moins de radiations que la TEP, ce qui est particulièrement bénéfique pour les enfants ou les personnes nécessitant des examens répétés dans le cadre de leur traitement. L’intégration de l’IRM améliore considérablement l’analyse des tissus mous et assure une correspondance spatiale parfaite avec les anomalies fonctionnelles détectées par la TEP. Grâce à sa haute résolution, la TEP-IRM permet d’examiner avec précision les petites structures et de détecter les changements subtils dans les images au cours du traitement. En oncologie, la TEP-IRM est principalement utilisée pour les patients atteints de cancers pelviens (gynécologiques et de la prostate) ainsi que pour les cancers ORL et en neuro-oncologie (fig. 1).9
Une autre avancée technique en cours de développement est la TEP grand champ.10 Cette technologie permet de réaliser l’imagerie TEP sur l’ensemble du corps en une seule acquisition contrairement aux acquisitions traditionnelles qui se font par segments de 15 à 30 cm. L’avantage de ce type de caméra réside dans l’augmentation du nombre de détecteurs, permettant de capter la majorité des photons émis et d’accroître ainsi considérablement la sensibilité de l’appareil. Ce dispositif ultraperformant offre plusieurs avantages par rapport aux TEP conventionnelles, tels qu’une meilleure résolution, un temps d’acquisition réduit et une diminution de la dose injectée. En permettant de couvrir tout le corps en une seule position de lit et d’acquérir des projections dynamiques de tout l’organisme simultanément, la TEP grand champ permet également d’évaluer la cinétique des traceurs dans l’organisme ouvrant la voie à de futures recherches pour mieux comprendre la physiopathologie des cancers.
En médecine nucléaire, l’interprétation des images en TEMP (tomographie par émission monophotonique ou scintigraphie) est principalement visuelle, tandis que celle en TEP est plutôt semi-quantitative. Les deux paramètres semi-quantitatifs les plus couramment utilisés en TEP sont la SUVmax (maximum standardized uptake value), qui mesure l’intensité de captation du radiotraceur dans le voxel le plus actif de la lésion, et le MTV, un volume métabolique tumoral calculé sur la base d’un seuil spécifique. De nombreuses méta-analyses ont confirmé que la SUVmax est un biomarqueur pronostique fiable dans divers types de cancer.11 Cependant, la radiomique introduit une nouvelle avancée dans l’analyse des images en médecine nucléaire. Apparu vers 2015, ce concept vise à extraire des caractéristiques de texture spatiales complexes des images qui sont imperceptibles à l’œil nu. Des études ont confirmé une corrélation significative entre les caractéristiques radiomiques et l’hétérogénéité cellulaire. L’analyse radiomique des images de cancer pourrait donc révéler l’hétérogénéité tumorale in vivo, un marqueur pronostique crucial en oncologie. Ainsi, plusieurs équipes ont identifié des « signatures radiomiques » spécifiques, liées aux niveaux d’agressivité de certaines tumeurs.12,13
La médecine nucléaire tire également profit de l’intelligence artificielle (IA) pour transformer ses pratiques. Des algorithmes permettent de réduire le temps d’acquisition des images, de diminuer la dose de radiopharmaceutique administrée et d’augmenter la résolution des images. De plus, l’IA pourrait aider à la caractérisation et la segmentation automatique des lésions, facilitant ainsi l’interprétation des résultats. En parallèle, l’IA contribue à la conception de nouveaux radiopharmaceutiques en optimisant la structure des molécules ciblant des sites spécifiques. Ces avancées représentent une évolution significative dans la capacité diagnostique de la médecine nucléaire.14
Radiothérapie interne vectorisée
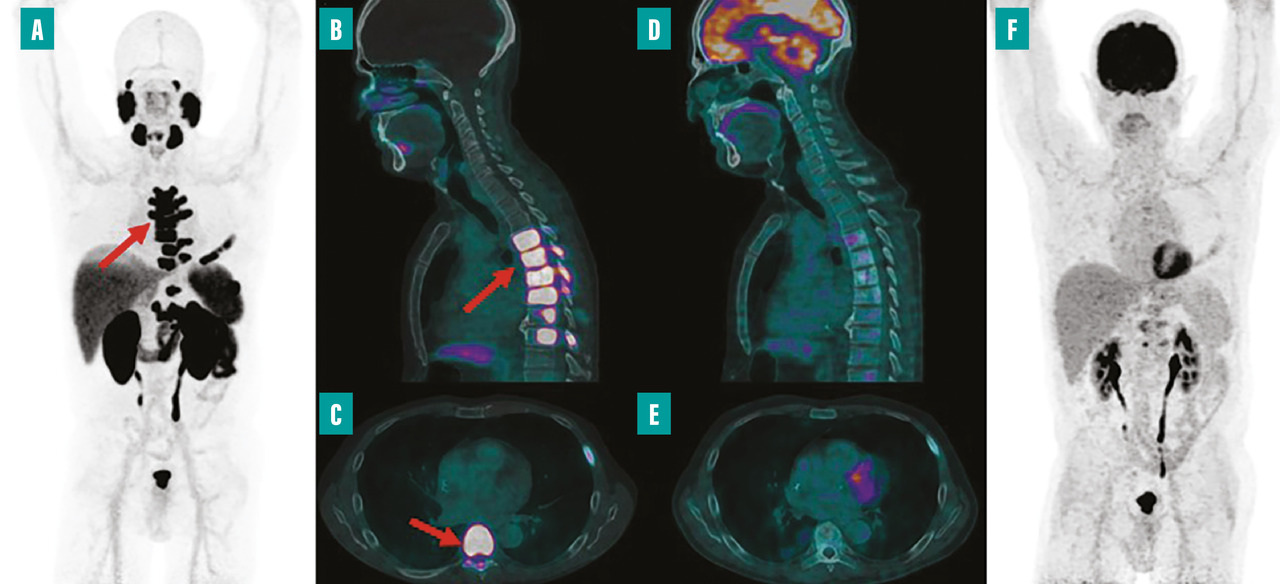
La médecine nucléaire, depuis ses débuts, a joué un rôle non seulement en imagerie mais aussi en thérapie, notamment grâce à la radiothérapie interne vectorisée (RIV). L’iode 131, utilisé depuis longtemps pour traiter les troubles thyroïdiens, illustre bien cette dimension thérapeutique fondamentale de la discipline. Ce traitement a introduit le concept de théranostique, qui consiste à visualiser précisément la maladie avant de la traiter et ainsi à sélectionner les patients avec le phénotype le plus adapté (ceux avec la plus forte fixation) pour maximiser l’efficacité thérapeutique. Actuellement, la RIV est également appliquée dans le traitement des tumeurs neuro-endocrines et, depuis peu, dans le cancer de la prostate. En effet, en 2023, Pluvicto (lutécium [177Lu] vipivotide tétraxétan) a été approuvé pour le traitement du cancer de la prostate métastatique, résistant à la castration après échec du traitement par hormonothérapie et chimiothérapie (fig. 2).15 Les recherches actuelles examinent l’intégration de la RIV avec des thérapies ciblées et étudient son utilisation en première ligne de traitement.
Rôle clé dans le diagnostic et le traitement des cancers
La médecine nucléaire, enrichie par des décennies de progrès, joue un rôle clé non seulement dans le diagnostic mais également de plus en plus dans le traitement des cancers. L’introduction de l’IA et de techniques d’imagerie avancées ouvre de nouvelles voies pour améliorer la précision diagnostique et l’efficacité thérapeutique, promettant des soins personnalisés et moins invasifs pour les patients.
2. Kakhki VRD. Positron emission tomography in the management of lung cancer. Ann Thorac Med 2007;2:69-76.
3. Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: The Lugano classification. J Clin Oncol 2014;32:3059-68.
4. MacManus MP, Seymour JF, Hicks RJ. Overview of early response assessment in lymphoma with FDG-PET. Cancer Imaging 2007;7:10-8.
5. Graham MM, Gu X, Ginader T, et al. 68Ga-DOTATOC imaging of neuroendocrine tumors: A systematic review and metaanalysis. J Nucl Med 2017;58:1452-8.
6. Chondrogiannis S, Marzola MC, Al-Nahhas A, et al. Normal biodistribution pattern and physiologic variants of 18F-DOPA PET imaging. Nucl Med Commun 2013;34:1141-9.
7. Farolfi A, Calderoni L, Mattana F, et al. Current and emerging clinical applications of PSMA PET diagnostic imaging for prostate cancer. J Nucl Med 2021;62:596-604.
8. Mori Y, Dendl K, Cardinale J, et al. FAPI PET: Fibroblast activation protein inhibitor use in oncologic and nononcologic disease. Radiology 2023;306:e220749.
9. Miles KA, Voo SA, Groves AM. Additional clinical value for PET/MRI in oncology: Moving beyond simple diagnosis. J Nucl Med 2018;59:1028-32.
10. Daube-Witherspoon ME, Pantel AR, Pryma DA, et al. Total-body PET: A new paradigm for molecular imaging. Br J Radiol 2022;95:20220357.
11. Sarker A, Im H-J, Cheon GJ, et al. Prognostic implications of the SUVmax of primary tumors and metastatic lymph node measured by 18F-FDG PET in patients with uterine cervical cancer: A meta-analysis. Clin Nucl Med 2016;41:34-40.
12. Gong X-Q, Tao Y-Y, Wu Y, et al. Progress of MRI radiomics in hepatocellular carcinoma. Front Oncol 2021;11:698373.
13. Delli Pizzi A, Chiarelli AM, Chiacchiaretta P, et al. MRI-based clinical-radiomics model predicts tumor response before treatment in locally advanced rectal cancer. Sci Rep 2021;11:5379.
14. Weber WA, Czernin J, Anderson CJ, et al. The future of nuclear medicine, molecular imaging, and theranostics. J Nucl Med 2020;61:263S-272S.
15. Hennrich U, Eder M. [177Lu]Lu-PSMA-617 (PluvictoTM): The first FDA-approved radiotherapeutical for treatment of prostate cancer. Pharmaceuticals (Basel) 2022;15:1292.