L’antibiorésistance, favorisée par le mésusage des antibiotiques, est un enjeu majeur de santé publique. Environ 1,3 million de décès seraient liés à une infection due à une bactérie résistante aux antibiotiques chaque année dans le monde.1
Dans le but de contrôler et de prévenir l’antibiorésistance, l’Organisation mondiale de la santé (OMS) et l’European Centre for Disease Prevention and Control (ECDC) recommandent de mettre en œuvre des plans nationaux d’« antimicrobial stewardship », ou « politique de bon usage des antibiotiques ».2 Le bon usage des antibiotiques est défini comme un ensemble cohérent de mesures en faveur d’un usage responsable des antimicrobiens avec pour objectifs de préserver leur efficacité et d’en limiter les effets indésirables, notamment l’antibiorésistance (encadré ). Il s’agit donc à la fois de mieux mais aussi de moins prescrire ces médicaments.
Dans le but de contrôler et de prévenir l’antibiorésistance, l’Organisation mondiale de la santé (OMS) et l’European Centre for Disease Prevention and Control (ECDC) recommandent de mettre en œuvre des plans nationaux d’« antimicrobial stewardship », ou « politique de bon usage des antibiotiques ».2 Le bon usage des antibiotiques est défini comme un ensemble cohérent de mesures en faveur d’un usage responsable des antimicrobiens avec pour objectifs de préserver leur efficacité et d’en limiter les effets indésirables, notamment l’antibiorésistance (
Bon usage des antibiotiques : définition et historique
Ce concept de bon usage des antibiotiques (BUA) a été introduit dès les années 1970 pour désigner les programmes visant à contrôler les résistances des bactéries et à améliorer l’usage des antibiotiques.3 Il s’agit d’une approche éducationnelle multifacettes qui inclut entre autres des actions de formation continue, des audits de pratiques avec retour aux prescripteurs, un conseil en infectiologie et l’utilisation d’outils informatiques.4,5
En France, la mise en place d’un programme de BUA dans les hôpitaux a été évoquée en 2002 par la conférence de consensus centrée sur le thème de l’amélioration de la qualité de l’antibiothérapie dans les établissements de soins.6 En effet, les évaluations menées montraient une prévalence élevée des prescriptions d’antibiotiques dans les hôpitaux (de l’ordre de 25 % des patients en « médecine, chirurgie, obstétrique » (MCO) et 50 % des patients en réanimation), avec une marge importante d’amélioration puisque entre 25 et 50 % de ces prescriptions étaient inutiles ou inadaptées. Les causes les plus fréquentes de mésusage sont une erreur de diagnostic, l’utilisation d’une antibiothérapie à spectre trop large ou une durée trop longue de traitement.7 Une circulaire de la Direction de l’hospitalisation et de l’organisation des soins (DHOS) datée de 2002 a fixé les grandes lignes du plan d’action proposé par Bernard Kouchner, alors ministre de la Santé.8 Elle est renforcée par le décret du 20 septembre 2013 qui reprend la nécessité d’assurer une activité de conseil sur le bon usage des antibiotiques.9
La plupart des équipes d’infectiologie mettent en place des dispositifs d’aide à la prescription pour répondre à une demande croissante des cliniciens non infectiologues.10
En France, la mise en place d’un programme de BUA dans les hôpitaux a été évoquée en 2002 par la conférence de consensus centrée sur le thème de l’amélioration de la qualité de l’antibiothérapie dans les établissements de soins.6 En effet, les évaluations menées montraient une prévalence élevée des prescriptions d’antibiotiques dans les hôpitaux (de l’ordre de 25 % des patients en « médecine, chirurgie, obstétrique » (MCO) et 50 % des patients en réanimation), avec une marge importante d’amélioration puisque entre 25 et 50 % de ces prescriptions étaient inutiles ou inadaptées. Les causes les plus fréquentes de mésusage sont une erreur de diagnostic, l’utilisation d’une antibiothérapie à spectre trop large ou une durée trop longue de traitement.7 Une circulaire de la Direction de l’hospitalisation et de l’organisation des soins (DHOS) datée de 2002 a fixé les grandes lignes du plan d’action proposé par Bernard Kouchner, alors ministre de la Santé.8 Elle est renforcée par le décret du 20 septembre 2013 qui reprend la nécessité d’assurer une activité de conseil sur le bon usage des antibiotiques.9
La plupart des équipes d’infectiologie mettent en place des dispositifs d’aide à la prescription pour répondre à une demande croissante des cliniciens non infectiologues.10
Moyens et actions : cinq axes
Cinq grands axes ont été développés à l’échelon des établissements comportant une équipe d’infectiologues :
– mise en place d’une structure opérationnelle à trois niveaux avec une commission des anti-infectieux émanant du comité du médicament, en charge de la mise en place des actions de BUA, une équipe multidisciplinaire spécialiste de l’antibiothérapie (EMA) animée par un référent antibiotique et un correspondant en infectiologie dans chaque service ;
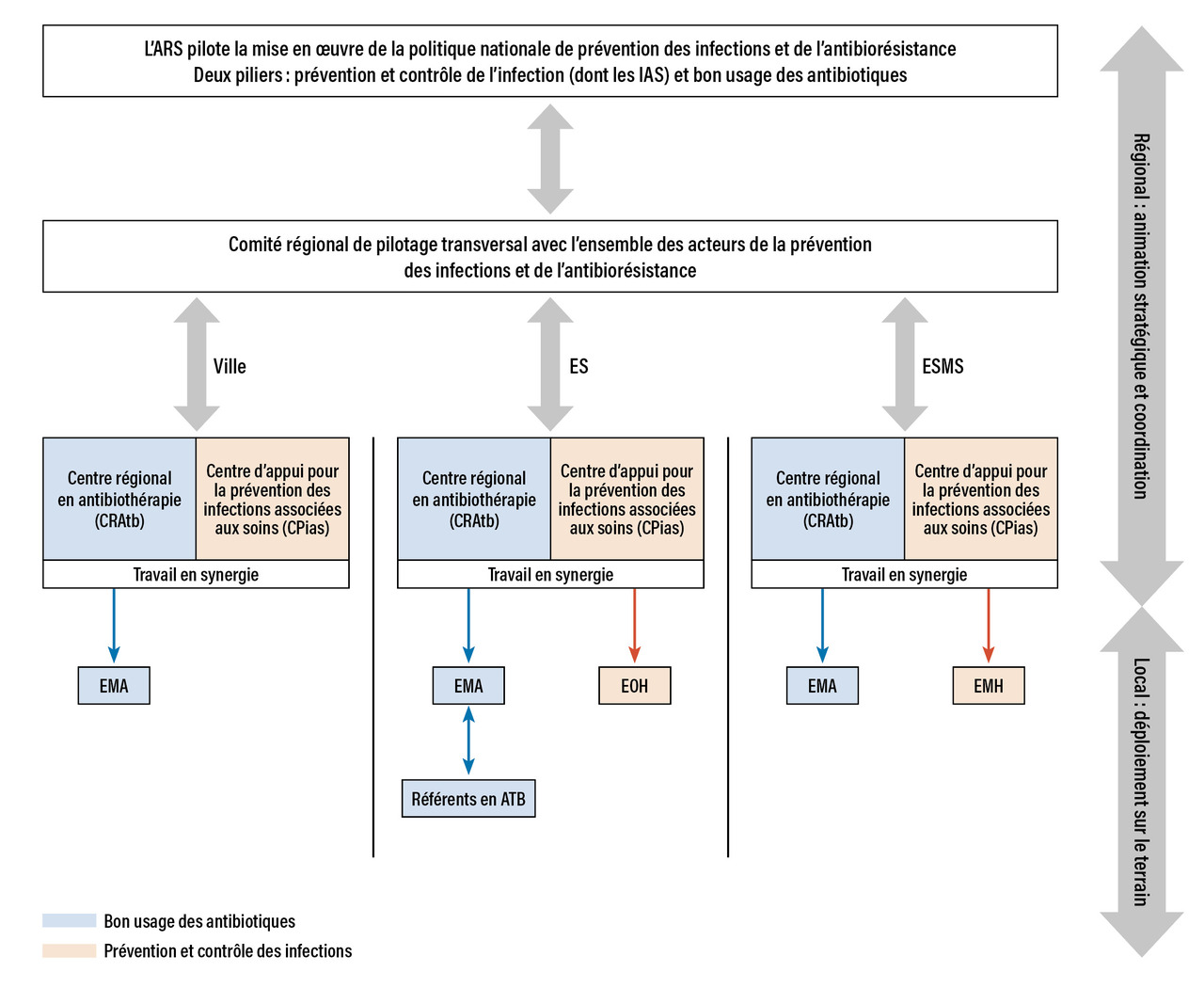
Ces éléments sont repris dans la stratégie nationale 2022-2025 de prévention des infections et de l’antibiorésistance du ministère de la Santé et des Solidarités dont l’un des objectifs est de préserver l’efficacité des antibiotiques.11 Ainsi, au niveau régional, la politique de santé déclinée par les agences régionales de santé (ARS) dans son volet BUA s’appuie désormais sur les 16 centres régionaux en antibiothérapie (CRAtb) qui ont une mission d’expertise et d’appui, de coordination et d’animation des réseaux de professionnels de santé en charge des programmes de BUA (notamment les EMA, les référents en antibiothérapie des établissements de santé et le réseau de médecins généralistes formés à l’antibiothérapie) [figure ]. À ce titre, ils ont un rôle important à jouer pour la coordination des actions de formation et d’évaluation à destination de la médecine générale et des établissements médico-sociaux, ainsi que pour servir de passerelle entre le monde hospitalier et les deux autres secteurs de soins.
Les EMA sont situées au niveau du groupement hospitalier de territoire (GHT) et interviennent dans les trois secteurs de soins (établissements de santé publics et privés, établissements et services médico-sociaux et ville). À la différence des CRAtb, les EMA ont à la fois des missions stratégiques (organisation, mise en place et pilotage des programmes locaux de BUA) et des activités cliniques de conseils diagnostique et thérapeutique (tableau ). Leur composition doit comprendre des personnels hospitaliers mobilisés sur ces activités avec du temps dédié, a minima infectiologue, microbiologiste, pharmacien et infirmier formé en infectiologie. Cette équipe doit bénéficier du soutien (notamment financier) de la direction de l’hôpital.12
– mise en place d’une structure opérationnelle à trois niveaux avec une commission des anti-infectieux émanant du comité du médicament, en charge de la mise en place des actions de BUA, une équipe multidisciplinaire spécialiste de l’antibiothérapie (EMA) animée par un référent antibiotique et un correspondant en infectiologie dans chaque service ;
- déploiement d’outils d’aide à la prescription des antibiotiques (référentiels et recommandations, mesure des consommations d’antibiotiques et des résistances bactériennes et diffusion des résultats aux services et aux prescripteurs) ;
- encadrement de la prescription (liste des antibiotiques contrôlés, formulaires de prescription des antibiotiques, réévaluation au troisième et au septième jours de traitement) ;
- évaluation et formation des prescripteurs ;
- création de centres de conseils en antibiothérapie à destination des médecins hospitaliers non infectiologues et des médecins généralistes.
Ces éléments sont repris dans la stratégie nationale 2022-2025 de prévention des infections et de l’antibiorésistance du ministère de la Santé et des Solidarités dont l’un des objectifs est de préserver l’efficacité des antibiotiques.11 Ainsi, au niveau régional, la politique de santé déclinée par les agences régionales de santé (ARS) dans son volet BUA s’appuie désormais sur les 16 centres régionaux en antibiothérapie (CRAtb) qui ont une mission d’expertise et d’appui, de coordination et d’animation des réseaux de professionnels de santé en charge des programmes de BUA (notamment les EMA, les référents en antibiothérapie des établissements de santé et le réseau de médecins généralistes formés à l’antibiothérapie) [
Les EMA sont situées au niveau du groupement hospitalier de territoire (GHT) et interviennent dans les trois secteurs de soins (établissements de santé publics et privés, établissements et services médico-sociaux et ville). À la différence des CRAtb, les EMA ont à la fois des missions stratégiques (organisation, mise en place et pilotage des programmes locaux de BUA) et des activités cliniques de conseils diagnostique et thérapeutique (
Résultats des programmes mis en place
Les règles de prescription proposées par les infectiologues sont bien établies. Elles proposent notamment de réaliser un diagnostic précis d’infection bactérienne (supposée ou confirmée microbiologiquement), de documenter, dans la mesure du possible, les infections en réalisant des prélèvements guidés par le diagnostic clinique avant d’instaurer une éventuelle antibiothérapie, d’utiliser les antibiotiques à spectre le plus étroit possible, de limiter l’utilisation des associations d’antibiotiques et de prévoir les durées de traitement les plus courtes possibles. Il est notamment impératif de réévaluer et réadapter systématiquement le traitement aux troisième et septième jours (encadré ).
Depuis vingt ans, les données de la littérature sur l’efficacité des programmes mis en place se sont accumulées et permettent d’en dégager les objectifs et les moyens à utiliser.4,5 En optimisant la prise en charge des patients ayant une infection avec des traitements antimicrobiens plus appropriés, les équipes d’infectiologie transversale améliorent la prise en soins et l’évolution des patients, évitent les effets indésirables des médicaments, raccourcissent les durées de séjour à l’hôpital et réduisent la consommation d’antibiotiques. Les interventions des infectiologues ont un impact positif sur la gestion des patients, la pertinence de la prescription, la sécurité des thérapeutiques, la qualité des soins et les coûts d’hospitalisation.13,14
De nombreux travaux ont évalué les prescriptions d’antibiotiques au sein des hôpitaux. En raison de prescriptions à large échelle par l’ensemble des praticiens dont un grand nombre n’a pas de formation particulière, la pertinence de ces prescriptions est généralement faible. À titre d’exemple, Roger et al. ont rapporté 50 prescriptions erronées (43 %) sur 117 dossiers évalués au hasard dans un service d’accueil d’urgence.15 Ces prescriptions inadaptées ont un impact délétère sur l’évolution des patients atteints d’infections graves ; ainsi, l’étude de Kumar et al. montre que chaque heure de retard à la mise en place d’une antibiothérapie adaptée au cours du choc septique accroît le taux de mortalité de 7 %.16 Ceci a conduit les infectiologues à intervenir de façon non sollicitée pour les patients présentant une bactériémie, forme potentiellement la plus grave des cas d’infections bactériennes chez des patients hospitalisés.
Outre l’amélioration de la prise en charge des patients, d’autres études ont montré que l’intervention des infectiologues a un intérêt économique : raccourcissement de la durée de séjour, diminution du nombre des réadmissions et diminution du coût de la consommation des antibiotiques.17,18
L’impact écologique sur la résistance bactérienne semble plus difficile à démontrer. Une étude danoise montre néanmoins qu’un programme multifacettes ciblé sur la réduction des consommations de céphalosporines et de fluoroquinolones permet de réduire la résistance des Enterobacterales à ces deux antibiotiques.19
Réduire la consommation des antibiotiques est aussi une mesure efficace pour contrôler ses effets indésirables, notamment les épidémies à Clostridioides difficile.
Certaines actions de contrôle de la prescription d’antibiotiques ont été mises en place sans effet évident sur la qualité de prescription. Plusieurs outils ont été testés : liste d’antibiotiques réservés car « critiques » au sens de l’OMS ou coûteux, listes de prescripteurs référents formés, prescription limitée… ; d’une manière générale, ces actions restrictives sont mal perçues et peu efficaces. Elles ont été généralement abandonnées au profit de la mise en place de standards de soins adaptés à l’écologie et aux pratiques de chaque établissement, et, mieux encore, d’actions de formation continue de type face-face dans les services de soins avec revue des prescriptions et modification si nécessaire.5,12
D’une manière générale, cette politique de bon usage des antibiotiques a conduit les infectiologues à sortir de leurs unités d’hospitalisation et à développer une activité transversale. Cela est particulièrement vrai pour les équipes ayant développé des activités de téléconseil, ou hotline, pour guider les prescripteurs dans l’adaptation d’un traitement antibiotique ou d’une antibioprophylaxie. À l’hôpital, il a été démontré que le suivi des avis donnés par téléconseil en infectiologie diminue la consommation des anti-infectieux et améliore la qualité de la prise en soins globale des patients.13,20,21
L’équipe d’infectiologie du CHU de Grenoble a mis en place, dès 2000, l’une des premières hotlines téléphoniques ayant pour objectif de répondre aux médecins non infectiologues à l’hôpital et en ville. Celle-ci a été d’emblée sollicitée tant par la médecine ambulatoire que par la médecine hospitalière.21
L’étude de Bal et al. auprès des médecins généralistes de l’Isère – département couvert par cette hotline – a confirmé que ces médecins expriment le besoin d’un soutien et d’une expertise en infectiologie.22 Les médecins généralistes sont globalement satisfaits du dispositif (97,9 %). Par la suite, les programmes de hotline téléphonique en infectiologie à destination des médecins généralistes se sont progressivement déployés dans d’autres hôpitaux et territoires français.
Depuis vingt ans, les données de la littérature sur l’efficacité des programmes mis en place se sont accumulées et permettent d’en dégager les objectifs et les moyens à utiliser.4,5 En optimisant la prise en charge des patients ayant une infection avec des traitements antimicrobiens plus appropriés, les équipes d’infectiologie transversale améliorent la prise en soins et l’évolution des patients, évitent les effets indésirables des médicaments, raccourcissent les durées de séjour à l’hôpital et réduisent la consommation d’antibiotiques. Les interventions des infectiologues ont un impact positif sur la gestion des patients, la pertinence de la prescription, la sécurité des thérapeutiques, la qualité des soins et les coûts d’hospitalisation.13,14
De nombreux travaux ont évalué les prescriptions d’antibiotiques au sein des hôpitaux. En raison de prescriptions à large échelle par l’ensemble des praticiens dont un grand nombre n’a pas de formation particulière, la pertinence de ces prescriptions est généralement faible. À titre d’exemple, Roger et al. ont rapporté 50 prescriptions erronées (43 %) sur 117 dossiers évalués au hasard dans un service d’accueil d’urgence.15 Ces prescriptions inadaptées ont un impact délétère sur l’évolution des patients atteints d’infections graves ; ainsi, l’étude de Kumar et al. montre que chaque heure de retard à la mise en place d’une antibiothérapie adaptée au cours du choc septique accroît le taux de mortalité de 7 %.16 Ceci a conduit les infectiologues à intervenir de façon non sollicitée pour les patients présentant une bactériémie, forme potentiellement la plus grave des cas d’infections bactériennes chez des patients hospitalisés.
Outre l’amélioration de la prise en charge des patients, d’autres études ont montré que l’intervention des infectiologues a un intérêt économique : raccourcissement de la durée de séjour, diminution du nombre des réadmissions et diminution du coût de la consommation des antibiotiques.17,18
L’impact écologique sur la résistance bactérienne semble plus difficile à démontrer. Une étude danoise montre néanmoins qu’un programme multifacettes ciblé sur la réduction des consommations de céphalosporines et de fluoroquinolones permet de réduire la résistance des Enterobacterales à ces deux antibiotiques.19
Réduire la consommation des antibiotiques est aussi une mesure efficace pour contrôler ses effets indésirables, notamment les épidémies à Clostridioides difficile.
Certaines actions de contrôle de la prescription d’antibiotiques ont été mises en place sans effet évident sur la qualité de prescription. Plusieurs outils ont été testés : liste d’antibiotiques réservés car « critiques » au sens de l’OMS ou coûteux, listes de prescripteurs référents formés, prescription limitée… ; d’une manière générale, ces actions restrictives sont mal perçues et peu efficaces. Elles ont été généralement abandonnées au profit de la mise en place de standards de soins adaptés à l’écologie et aux pratiques de chaque établissement, et, mieux encore, d’actions de formation continue de type face-face dans les services de soins avec revue des prescriptions et modification si nécessaire.5,12
D’une manière générale, cette politique de bon usage des antibiotiques a conduit les infectiologues à sortir de leurs unités d’hospitalisation et à développer une activité transversale. Cela est particulièrement vrai pour les équipes ayant développé des activités de téléconseil, ou hotline, pour guider les prescripteurs dans l’adaptation d’un traitement antibiotique ou d’une antibioprophylaxie. À l’hôpital, il a été démontré que le suivi des avis donnés par téléconseil en infectiologie diminue la consommation des anti-infectieux et améliore la qualité de la prise en soins globale des patients.13,20,21
L’équipe d’infectiologie du CHU de Grenoble a mis en place, dès 2000, l’une des premières hotlines téléphoniques ayant pour objectif de répondre aux médecins non infectiologues à l’hôpital et en ville. Celle-ci a été d’emblée sollicitée tant par la médecine ambulatoire que par la médecine hospitalière.21
L’étude de Bal et al. auprès des médecins généralistes de l’Isère – département couvert par cette hotline – a confirmé que ces médecins expriment le besoin d’un soutien et d’une expertise en infectiologie.22 Les médecins généralistes sont globalement satisfaits du dispositif (97,9 %). Par la suite, les programmes de hotline téléphonique en infectiologie à destination des médecins généralistes se sont progressivement déployés dans d’autres hôpitaux et territoires français.
Faire évoluer les pratiques
Dans la mesure où l’ensemble des médecins hospitaliers, quelles que soient leurs formations et spécialités, peut être amené à prescrire un antibiotique, il est important que ceux-ci se rendent compte qu’ils ont un rôle important à jouer dans le BUA, la lutte contre l’antibiorésistance. En premier lieu, ils doivent comprendre que les antibiotiques sont une classe médicamenteuse à part, source d’antibiorésistance, dont l’efficacité doit être préservée. Ensuite, il est nécessaire de se former aux règles du BUA, notamment en veillant à documenter les infections et en connaissant et en appliquant les protocoles d’antibiothérapie. Le meilleur exemple est celui des bactériémies à Staphylococcus aureus où l’application d’indicateurs de qualité de la prise en charge est associée à une meilleure évolution des patients. De même, les durées courtes d’antibiothérapie proposées par la Haute Autorité de santé (HAS) et la Société de pathologie infectieuse de langue française (SPILF) pour les infections courantes (respiratoires, urinaires, cutanées…) doivent être appliquées par tous, ces durées courtes ayant montré leur non-infériorité par rapport aux durées plus longues, par exposition réduite aux antibiotiques.2 Un effort particulier est à mener sur les ordonnances de sortie des patients hospitalisés, où une marge d’amélioration significative est rapportée par de nombreuses études.
Le problème de l’antibiorésistance se pose aussi au niveau de la médecine ambulatoire. En 2021, la France restait le quatrième pays d’Europe le plus consommateur d’antibiotiques, et 90 % des prescriptions provenaient de la médecine générale ambulatoire.23 De nombreux outils d’aide à la prescription sont disponibles tels que Antibioclic, Antibiogarde, ePOPI ainsi que les fiches pour le choix et la durée de l’antibiothérapie publiées par la HAS.24 Par ailleurs, le développement d’une activité de conseil en infectiologie à destination des médecins généralistes fait partie des actions recommandées pour le BUA en médecine ambulatoire, ce qui semble bien accepté par ces médecins.25
Le problème de l’antibiorésistance se pose aussi au niveau de la médecine ambulatoire. En 2021, la France restait le quatrième pays d’Europe le plus consommateur d’antibiotiques, et 90 % des prescriptions provenaient de la médecine générale ambulatoire.23 De nombreux outils d’aide à la prescription sont disponibles tels que Antibioclic, Antibiogarde, ePOPI ainsi que les fiches pour le choix et la durée de l’antibiothérapie publiées par la HAS.24 Par ailleurs, le développement d’une activité de conseil en infectiologie à destination des médecins généralistes fait partie des actions recommandées pour le BUA en médecine ambulatoire, ce qui semble bien accepté par ces médecins.25
Impliquer tous les professionnels de santé
La mise en place des programmes de BUA dans les hôpitaux français a permis d’obtenir des succès certains mais qui doivent être amplifiés et consolidés. Pour progresser, il est nécessaire de renforcer les moyens (surtout humains) des EMA mais aussi d’impliquer davantage les autres personnels, notamment les médecins non spécialisés en infectiologie. En outre, la réussite de ces programmes restera limitée si les mêmes démarches ne sont pas appliquées dans les autres secteurs de soins, particulièrement en ville. Une politique plus ambitieuse doit être déployée via la mise en place des CRAtb et une plus grande collaboration entre les EMA et les médecins libéraux.
Encadre
Règles de bon usage des antibiotiques
Optimiser le traitement précoce des infections graves.
Différencier au mieux la colonisation et l’infection.
Maîtriser l’écologie locale (étudier, diffuser, connaître).
Réaliser dès que possible l’ablation de tout matériel infecté.
Mesurer les taux sériques pour adapter les doses d’anti-infectieux.
Éviter les antibiotiques exerçant une forte pression de sélection.
Utiliser autant que possible des antibiotiques à spectre étroit.
Éviter l’antibiothérapie empirique prolongée.
Éviter les bithérapies.
Pratiquer régulièrement la désescalade thérapeutique.
Administrer la durée de traitement la plus courte possible.
Favoriser la voie orale.
Références
1. Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Robles Aguilar G, Gray A, et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. The Lancet 2022;399(10325):629-55.
2. Castan B, Lesprit P, Alfandari S, Bonnet E, Diamantis S, Gauzit R, et al. Antibiotic stewardship: What’s new? Med Mal Infect 2016;46(8):403-5.
3. Rice LB. Antimicrobial stewardship and antimicrobial resistance. Med Clin North Am. 2018;102(5):805-18.
4. Davey P, Marwick CA, Scott CL, Charani E, McNeil K, Brown E, et al. Interventions to improve antibiotic prescribing practices for hospital inpatients. Cochrane Database Syst Rev 2017;2:CD003543.
5. Nathwani D, Varghese D, Stephens J, ansari W, Martin S, Charbonneau C. Value of hospital antimicrobial stewardship programs [ASPs]: A systematic review. Antimicrob Resist Infect Control 2019;8:35.
6. 14e Conférence de consensus organisée par la Société de pathologie infectieuse de langue française. Comment améliorer la qualité de l’antibiothérapie dans les établissements de soins ? Qualité = préserver l’intérêt collectif sans nuire à l’intérêt individuel du patient. Med Mal Infect 2002;32:320-8.
7. Pulcini C, Cua E, Lieutier F, Landraud L, Dellamonica P, Roger PM. Antibiotic misuse: A prospective clinical audit in a French university hospital. Eur J Clin Microbiol Infect Dis 2007;26:277-80.
8. Circulaire DHOS/E2-DGS/SD5A-n° 272 mai 2002, relative au bon usage des antibiotiques dans les établissements de santé et à la mise en place à titre expérimental de centres de conseil en antibiothérapie pour les médecins libéraux. Paris: La Documentation française, 2002.
9. Ministère des Affaires sociales et de la Santé. Décret n° 2013-841 du 20 septembre 2013 modifiant les dispositions relatives à la commission médicale d’établissement et aux transformations des établissements publics de santé et à la politique du médicament dans les établissements de santé. Journal officiel du 22 septembre 2013. https://vu.fr/TiIeN
10. Alfandari S, Riche A, Rabaud C, Cremieux AC, Gauzit R, Roblot F. Physicians referent for antimicrobial therapy. Results of a survey conducted during a French Infectious Diseases Society meeting. Med Mal Infect 2010;40(10):582-5.
11. Ministère de la Santé et des Solidarités. Stratégie nationale 2022-2025 de prévention des infections et de l’antibiorésistance. 2022. https://vu.fr/dgPCd
12. Mendelson M, Morris AM, Thursky K, Pulcini C. How to start an antimicrobial stewardship programme in a hospital. Clin Microbiol Infect 2020;26:447-53.
13. Pavese P, Sellier E, Laborde L, Gennai S, Stahl JP, François P. Requesting physicians’ experiences regarding infectious disease consultations. BMC Infect Dis 2011;11:62.
14. Lemmen SW, Häfner H, Kotterik S, Lütticken R, Töpper R. Influence of an infectious disease service on antibiotic prescription behavior and selection of multiresistant pathogens. Infection 2000;28(6):384-7.
15. Roger PM, Martin C, Taurel M, Fournier JP, Nicole I, Carles M, et al. Motives for the prescription of antibiotics in the emergency department of the University Hospital Center in Nice. A prospective study. Presse Med 2002;31(2):58-63.
16. Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, Sharma S, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006;34(6):1589-96.
17. Karanika S, Paudel S, Grigoras C, Kalbasi A, Mylonakis E. Systematic review and meta-analysis of clinical and economic outcomes from the implementation of hospital-based antimicrobial stewardship programs. Antimicrob Agents Chemother 2016;60(8):4840-52.
18. Lesprit P, Landelle C, Brun-Buisson C. Clinical impact of unsolicited post-prescription antibiotic review in surgical and medical wards: A randomized controlled trial. Clin Microbiol Infect 2013;19(2):E91-7.
19. Boel J, Andreasen V, Jarlov JO. Impact of antibiotic restriction on resistance levels of Escherichia coli: A controlled interrupted time series study of a hospital-wide antibiotic stewardship programme. J Antimicrob Chemother 2016;71:2047-51.
20. Marquet A, Ollivier F, Boutoille D, Thibaut S, Potel G, Ballereau F, et al. A national network of infectious diseases experts. Med Mal Infect 2013;43(11–12):475-80.
21. Gennai S, François P, Bal G, Epaulard O, Stahl JP, Vittoz JP, et al. Evaluation of a remote infectious disease consultation. Med Mal Infect 2009;39(10):798-805.
22. Bal G, Sellier E, Gennai S, Caillis M, François P, Pavese P. Infectious disease specialist telephone consultations requested by general practitioners. Scand J Infect Dis 2011;43(11-12):912-7.
23. Santé publique France. Prévention de la résistance aux antibiotiques : une démarche « Une seule santé ». 19 novembre 2022. https://vu.fr/camor
24. Haute Autorité de santé (HAS). Choix et durées d’antibiothérapie préconisées dans les infections bactériennes courantes. Août 2021, mise à jour juillet 2024. https://vu.fr/aHFJz
25. Giry M, Pulcini C, Rabaud C, Boivin JM, Mauffrey V, Birgé J. Acceptability of antibiotic stewardship measures in primary care. Med Mal Infect 2016;46(6):276-84.
2. Castan B, Lesprit P, Alfandari S, Bonnet E, Diamantis S, Gauzit R, et al. Antibiotic stewardship: What’s new? Med Mal Infect 2016;46(8):403-5.
3. Rice LB. Antimicrobial stewardship and antimicrobial resistance. Med Clin North Am. 2018;102(5):805-18.
4. Davey P, Marwick CA, Scott CL, Charani E, McNeil K, Brown E, et al. Interventions to improve antibiotic prescribing practices for hospital inpatients. Cochrane Database Syst Rev 2017;2:CD003543.
5. Nathwani D, Varghese D, Stephens J, ansari W, Martin S, Charbonneau C. Value of hospital antimicrobial stewardship programs [ASPs]: A systematic review. Antimicrob Resist Infect Control 2019;8:35.
6. 14e Conférence de consensus organisée par la Société de pathologie infectieuse de langue française. Comment améliorer la qualité de l’antibiothérapie dans les établissements de soins ? Qualité = préserver l’intérêt collectif sans nuire à l’intérêt individuel du patient. Med Mal Infect 2002;32:320-8.
7. Pulcini C, Cua E, Lieutier F, Landraud L, Dellamonica P, Roger PM. Antibiotic misuse: A prospective clinical audit in a French university hospital. Eur J Clin Microbiol Infect Dis 2007;26:277-80.
8. Circulaire DHOS/E2-DGS/SD5A-n° 272 mai 2002, relative au bon usage des antibiotiques dans les établissements de santé et à la mise en place à titre expérimental de centres de conseil en antibiothérapie pour les médecins libéraux. Paris: La Documentation française, 2002.
9. Ministère des Affaires sociales et de la Santé. Décret n° 2013-841 du 20 septembre 2013 modifiant les dispositions relatives à la commission médicale d’établissement et aux transformations des établissements publics de santé et à la politique du médicament dans les établissements de santé. Journal officiel du 22 septembre 2013. https://vu.fr/TiIeN
10. Alfandari S, Riche A, Rabaud C, Cremieux AC, Gauzit R, Roblot F. Physicians referent for antimicrobial therapy. Results of a survey conducted during a French Infectious Diseases Society meeting. Med Mal Infect 2010;40(10):582-5.
11. Ministère de la Santé et des Solidarités. Stratégie nationale 2022-2025 de prévention des infections et de l’antibiorésistance. 2022. https://vu.fr/dgPCd
12. Mendelson M, Morris AM, Thursky K, Pulcini C. How to start an antimicrobial stewardship programme in a hospital. Clin Microbiol Infect 2020;26:447-53.
13. Pavese P, Sellier E, Laborde L, Gennai S, Stahl JP, François P. Requesting physicians’ experiences regarding infectious disease consultations. BMC Infect Dis 2011;11:62.
14. Lemmen SW, Häfner H, Kotterik S, Lütticken R, Töpper R. Influence of an infectious disease service on antibiotic prescription behavior and selection of multiresistant pathogens. Infection 2000;28(6):384-7.
15. Roger PM, Martin C, Taurel M, Fournier JP, Nicole I, Carles M, et al. Motives for the prescription of antibiotics in the emergency department of the University Hospital Center in Nice. A prospective study. Presse Med 2002;31(2):58-63.
16. Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, Sharma S, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006;34(6):1589-96.
17. Karanika S, Paudel S, Grigoras C, Kalbasi A, Mylonakis E. Systematic review and meta-analysis of clinical and economic outcomes from the implementation of hospital-based antimicrobial stewardship programs. Antimicrob Agents Chemother 2016;60(8):4840-52.
18. Lesprit P, Landelle C, Brun-Buisson C. Clinical impact of unsolicited post-prescription antibiotic review in surgical and medical wards: A randomized controlled trial. Clin Microbiol Infect 2013;19(2):E91-7.
19. Boel J, Andreasen V, Jarlov JO. Impact of antibiotic restriction on resistance levels of Escherichia coli: A controlled interrupted time series study of a hospital-wide antibiotic stewardship programme. J Antimicrob Chemother 2016;71:2047-51.
20. Marquet A, Ollivier F, Boutoille D, Thibaut S, Potel G, Ballereau F, et al. A national network of infectious diseases experts. Med Mal Infect 2013;43(11–12):475-80.
21. Gennai S, François P, Bal G, Epaulard O, Stahl JP, Vittoz JP, et al. Evaluation of a remote infectious disease consultation. Med Mal Infect 2009;39(10):798-805.
22. Bal G, Sellier E, Gennai S, Caillis M, François P, Pavese P. Infectious disease specialist telephone consultations requested by general practitioners. Scand J Infect Dis 2011;43(11-12):912-7.
23. Santé publique France. Prévention de la résistance aux antibiotiques : une démarche « Une seule santé ». 19 novembre 2022. https://vu.fr/camor
24. Haute Autorité de santé (HAS). Choix et durées d’antibiothérapie préconisées dans les infections bactériennes courantes. Août 2021, mise à jour juillet 2024. https://vu.fr/aHFJz
25. Giry M, Pulcini C, Rabaud C, Boivin JM, Mauffrey V, Birgé J. Acceptability of antibiotic stewardship measures in primary care. Med Mal Infect 2016;46(6):276-84.

 Encadrés
Encadrés