Depuis une cinquantaine d’années, l’incidence du cancer du canal anal augmente régulièrement. Si les traitements et leurs résultats ont progressé en parallèle, les regards se tournent aujourd’hui vers la prévention, qui suscite de nouveaux espoirs.
Avec une incidence de l’ordre de 0,2 à 1,3/100 000 chez l’homme et de 0,7 à 2,1/100 000 chez la femme, en fonction des pays, le cancer du canal anal représente moins de 4 % des cancers digestifs.1 Néanmoins, son incidence augmente régulièrement depuis les années 1970, en particulier dans les pays à hauts revenus. Cette évolution est probablement liée à l’augmentation de la prévalence des infections à papillomavirus, notamment HPV 16 et 18, et aux facteurs favorisant leur persistance (immunodépression, comportements sexuels).1 Par exemple, l’incidence est très élevée (45,9/100 000) chez les patients séropositifs pour le VIH, homosexuels masculins, sans que l’avènement des thérapies antirétrovirales n’ait entraîné de diminution. Le risque de cancer anal est ainsi multiplié par 40 pour un homme infecté par le VIH et par 80 chez les homosexuels séropositifs pour le VIH.2 Le type histologique le plus fréquent est le carcinome épidermoïde. Il s’agit d’un cancer lymphophile dont l’extension peut être non seulement hémorroïdale, mésorectale et iliaque interne mais également inguinale et iliaque externe.
L’extension à distance, principalement ganglionnaire lombo-aortique mais aussi viscérale, hépatique ou pulmonaire, est plus rare.
Circonstances de découverte : ne pas négliger les symptômes banals
Une tumeur du canal anal peut être révélée par des symptômes tels que des rectorragies, un prurit ou une douleur anale, un abcès, la perception par le patient d’une masse anale, un ténesme ou une modification du transit. Ces symptômes aspécifiques, souvent liés à des pathologies bénignes telles que des fistules, des hémorroïdes et des abcès, peuvent parfois être négligés par le patient ou son médecin traitant, conduisant à un retard diagnostique.
Certaines tumeurs sont découvertes à un stade d’extension locale avancé, à l’occasion de symptômes d’incontinence anale, de fistule rectovaginale ou de syndrome occlusif.
Plus rarement, la découverte est fortuite, par l’examen anatomopathologique d’une pièce d’hémorroïdectomie.
Plusieurs étapes diagnostiques : clinique et paraclinique
L’examen clinique permet de préciser l’extension locale, d’évaluer l’état général et les comorbidités du patient, éléments essentiels pour décider de la stratégie thérapeutique. Le bilan paraclinique associe imagerie et biologie.
Bilan clinique : penser à l’examen gynécologique
L’examen local comporte une anuscopie avec biopsies, pour le diagnostic histologique, et un toucher rectal, afin de palper la tumeur et de préciser ses dimensions, le pourcentage d’envahissement circonférentiel, sa localisation sur un quadrant horaire, sa fixité, l’atteinte éventuelle de la marge anale ou l’extension au bas rectum.3 Chez les femmes, l’examen gynécologique recherche une infiltration de la cloison rectovaginale, et, au niveau du col utérin, une localisation tumorale synchrone. En l’absence de suivi gynécologique, un frottis doit être réalisé puisque l’infection à HPV prédispose également aux dysplasies et au cancer du col utérin.
Au terme de cet examen clinique, la tumeur est cotée selon la classification TNM (AJCC 2017, 8e édition,
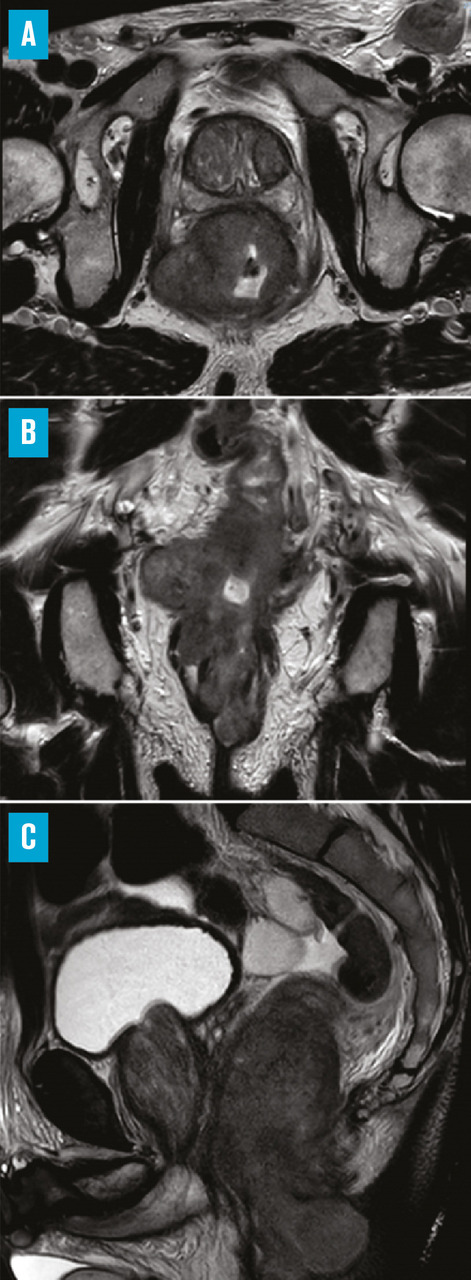
Pour l’extension locale, l’IRM pelvienne est le meilleur examen
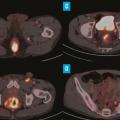
Elle évalue la taille et la localisation de la tumeur anale, ainsi que l’envahissement d’un organe de voisinage ou de la cloison rectovaginale. Elle peut également révéler des adénopathies mésorectales, inguinales, iliaques internes ou externes (
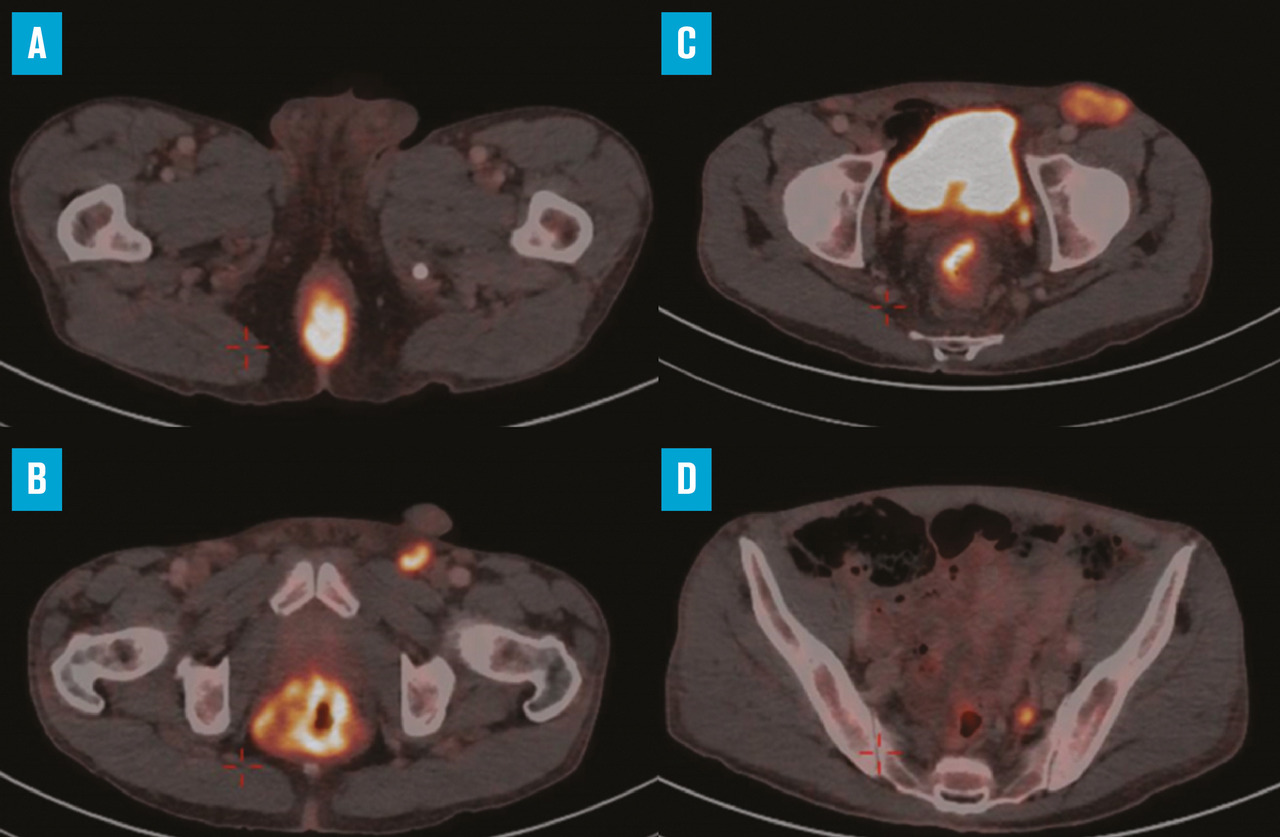
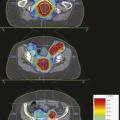
Le 18F-FDG TEP scanner est également recommandé dans le cadre du bilan d’extension du cancer du canal anal. Plusieurs études ont en effet montré son intérêt dans l’évaluation initiale, notamment ganglionnaire (
Outre un bilan biologique standard, il est nécessaire de demander les sérologies VIH et des hépatites. Le dosage du marqueur tumoral SCC (Squamous Cell Carcinoma) est plus discuté mais peut servir de référence pour la surveillance ultérieure.
Conduite à tenir thérapeutique
La stratégie thérapeutique dépend du stade de la tumeur.
Traitement des tumeurs locorégionales
Le traitement en première ligne des formes locorégionales repose sur la radiothérapie, sensibilisée par une chimiothérapie concomitante. Ce traitement assure le plus souvent la guérison du patient, sans avoir recours à la chirurgie, qui n’est réservée qu’aux situations de progression ou de récidive.
Depuis les essais de Nigro dans les années 1980, la chimiothérapie concomitante n’a pas changé.5 La mitomycine C a été la première molécule validée, en association avec le 5-fluorouracile (5-FU) et la radiothérapie, malgré son hématotoxicité. Le cisplatine a également été utilisé, par analogie avec les chimiothérapies d’autres carcinomes épidermoïdes de la sphère ORL, de l’œsophage ou du col utérin. Deux études randomisées ont comparé le cisplatine et la mitomycine, en association avec le 5-FU et la radiothérapie : l’essai RTOG 9811 a montré un avantage en survie globale, survie sans récidive et sans colostomie à cinq ans, en faveur de la mitomycine, alors que l’essai ACT2 ne met pas en évidence de différence significative.6, 7 La mitomycine associée au 5-FU reste donc la chimiothérapie recommandée en première intention. Par ailleurs, la chimiothérapie d’induction par cisplatine, comme la chimiothérapie adjuvante, ont été évaluées dans l’essai RTOG 9811 et l’essai français ACCORD 03 ; elles n’ont apporté de bénéfice ni en survie globale ni en survie sans récidive.6, 8 Les espoirs suscités par le développement des thérapies ciblées, notamment les anti-EGFR, puisque que les récepteurs à l’EGF (Epidermal Growth Factor) sont surexprimés par presque 90 % des tumeurs du canal anal, n’ont pas été confirmés par les essais cliniques, voire ont été responsables d’une toxicité accrue.9, 10
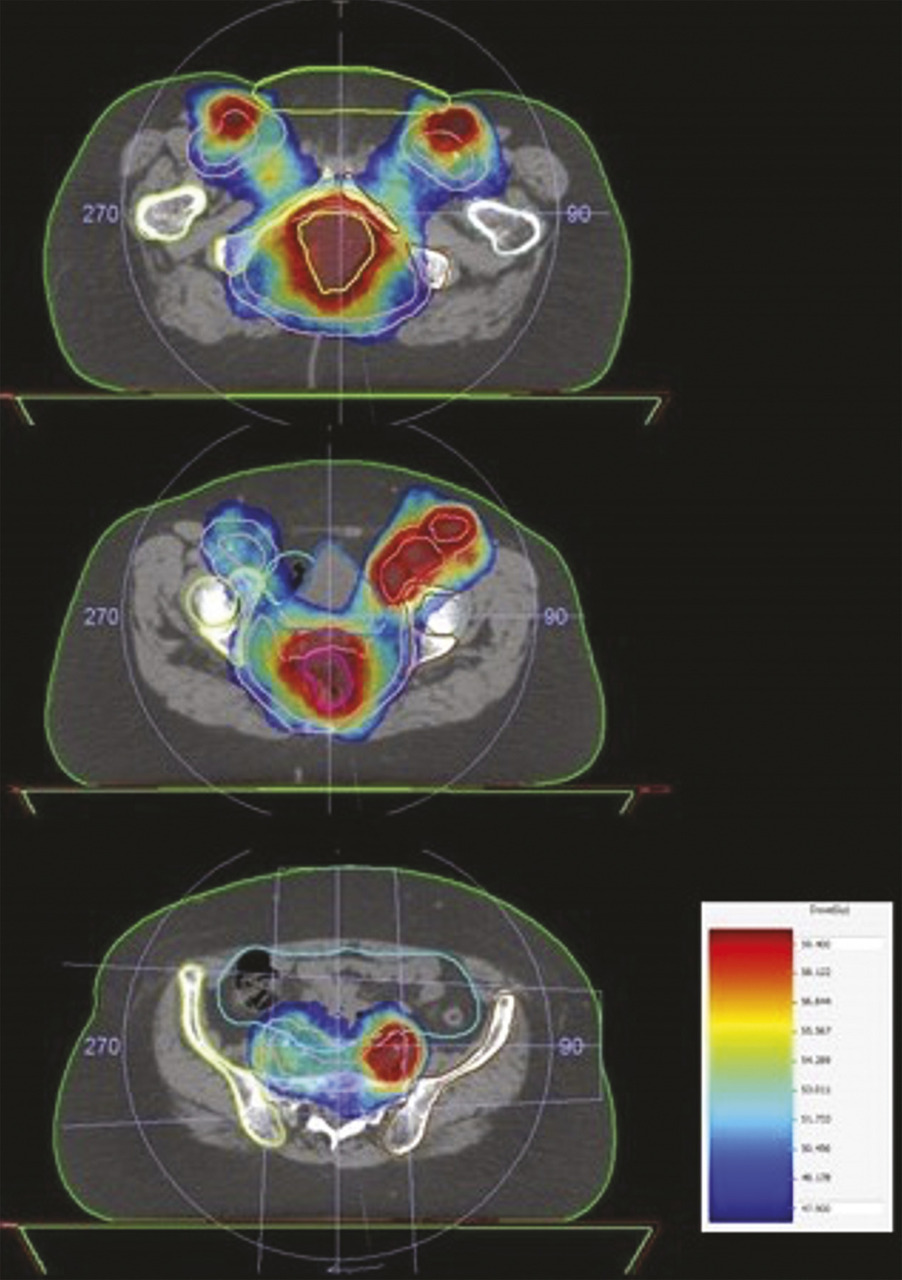
Bien que la chimiothérapie n’ait pas changé depuis quarante ans, les résultats de la chimioradiothérapie se sont améliorés, avec des survies globales de l’ordre de 80 % à cinq ans dans les derniers essais. Ces progrès peuvent probablement être attribués aux avancées techniques de la radiothérapie et des nouvelles modalités d’imagerie (IRM et TEP scanner). Ainsi, la radiothérapie conformationnelle avec modulation d’intensité (RCMI) consiste à conformer la dose au volume cible complexe (incluant la tumeur et les aires ganglionnaires inguinales et pelviennes) à traiter, tout en protégeant les organes sains (
Traitement des récidives ou des formes métastatiques
Après chimioradiothérapie, la réponse peut être lente, comme le montrent les résultats de l’essai ACT2, au cours duquel 29 % des patients étaient considérés en réponse partielle onze semaines après le début du traitement, mais en réponse complète après 26 semaines.11 Aussi, en cas de réponse partielle lors de la première évaluation, dans les deux mois suivant la fin du traitement, il est recommandé de prendre du recul avant de décider d’une chirurgie de rattrapage, et de proposer une surveillance attentive. Le délai de quatre à six mois paraît optimal pour attendre une réponse complète sans, à l’inverse, laisser évoluer une maladie persistante, au risque d’en compromettre la résécabilité.3
Les récidives concernent environ 20 à 30 % des patients ; 9 fois sur 10, elles surviennent au cours des trois ans qui suivent la fin de la chimioradiothérapie.7 Parmi ces récidives, la moitié sont locales ou locorégionales et accessibles à la chirurgie (amputation abdomino-périnéale). En cas de récidive inopérable, ou d’évolution métastatique, le traitement repose sur la chimiothérapie. En première intention, et sous réserve d’un bon état général, l’association de docétaxel, cisplatine et 5-FU (DCF) est recommandée, permettant une survie sans progression médiane de 12,2 mois et une survie globale médiane de 39,2 mois (Epitopes-HPV).12
Le cas particulier des T1
La stratégie thérapeutique est discutée pour les T1 (< 2 cm), dont le pronostic est excellent. La radiothérapie reste le traitement de référence pour ces tumeurs, mais l’association à une chimiothérapie pourrait diminuer le niveau de dose comme les volumes à irradier. L’analyse de la cohorte observationnelle nationale française ANABASE a relevé 18 % d’atteinte ganglionnaire associée (même en cas de tumeur T1), qu’il faut donc rechercher systématiquement dès le bilan initial.13 La chirurgie est indiquée pour les tumeurs T1 de la marge anale mais reste controversée dès qu’il existe une atteinte du canal anal. La stratégie se discute en réunion de concertation pluridisciplinaire ; il convient de s’assurer de l’absence d’envahissement ganglionnaire (IRM ou TEP scanner) et d’une marge d’exérèse suffisante (> 1 mm) sans délabrement sphinctérien, avant de proposer une surveillance rapprochée.
Quels résultats et perspectives ?
Si la chimioradiothérapie obtient de bons résultats pour les tumeurs localisées T1-2 N0, les résultats restent décevants pour les tumeurs T3-4 ou N1, avec 35 % de rechutes loco-régionales ou distantes dans les trois ans qui suivent la fin du traitement. Ainsi, la chimioradiothérapie avec mitomycine et 5-FU, recommandée quel que soit le stade initial, surtraite probablement les petites tumeurs alors qu’elle reste insuffisante pour les tumeurs localement évoluées. La taille tumorale (supérieure à 4 ou 5 cm selon les études), une atteinte ganglionnaire associée et le sexe masculin sont les principaux facteurs de mauvais pronostic.3
De même, une infection par le VIH semble associée à un pronostic péjoratif, sans que l’on sache si cette particularité est liée à un cancer plus agressif, du fait de mécanismes d’immunomodulation, ou à un traitement allégé chez ces patients (doses de chimiothérapie ou de radiothérapie notamment), voire plus longtemps interrompu pour toxicité. L’analyse du sous-groupe de patients infectés par le VIH, dans la cohorte ANABASE, confirme ce pronostic péjoratif, sans noter de différence de toxicité par rapport à la population séronégative, justifiant de ne pas sous-traiter ces patients.
Les essais en cours s’intéressent aux stratégies de médecine individualisée, par escalade ou désescalade du traitement en fonction du stade tumoral initial. Au Royaume-Uni, les essais PLATO (PersonnaLising Anal cancer radioTherapy dOse, ISRCTN88455282) testent différentes doses de radiothérapie dans trois groupes distincts : de risque faible, intermédiaire ou élevé (essais ACT3, ACT4 et ACT5). Parallèlement, l’arrivée de l’immunothérapie constitue une nouvelle voie de recherche avec un rationnel fort, compte tenu des voies immunitaires impliquées dans la carcinogenèse viro-induite. Cependant, les progrès les plus importants ne viendront probablement pas de la personnalisation des traitements, ou de l’arrivée de nouveaux médicaments, mais des perspectives de vaccination contre les Papillomaviridae.
Prévention renforcée et associée au dépistage
La vaccination contre les papillomavirus humains était recommandée chez les jeunes filles, et les jeunes hommes ayant des relations sexuelles avec les hommes, pour prévenir l’apparition de cancers de la sphère ano-génitale. Son indication a été élargie le 1er janvier 2021 à tous les garçons de 11 à 14 ans révolus, avec un rattrapage possible entre 15 et 19 ans révolus. La vaccination reste recommandée jusqu’à 26 ans pour les hommes ayant des relations sexuelles avec des hommes. Son efficacité et sa tolérance ont été testées chez les garçons de 9 à 18 ans : elle induit une réponse sérologique anti-HPV et atteint une efficacité de 90,4 % contre les lésions dysplasiques génitales. En plus de réduire les lésions dysplasiques, et a fortiori les cancers du canal anal, la vaccination des hommes pourrait également diminuer l’incidence des cancers du col de l’utérus chez les femmes, en limitant la transmission de l’infection. Les effets de la vaccination ne seront toutefois pas perceptibles avant plusieurs années, compte tenu de la latence d’apparition du cancer. Aussi, le dépistage constitue une autre voie de progrès, qui permet de traiter des dysplasies avant qu’elles n’évoluent ou de prendre en charge des tumeurs à un stade précoce.
Le dépistage est recommandé pour les hommes infectés par le VIH et qui ont des relations sexuelles avec des hommes ainsi que pour toute personne ayant des lésions ano-génitales liées aux HPV. De la même façon, il est important d’adresser les patients au proctologue en cas de douleur, rectorragie ou masse anale. Les moyens de ce dépistage sont discutés : cytologie anale suivie, en cas d’anomalie, d’une anuscopie à haute résolution avec biopsie des zones suspectes, ou anuscopie à haute résolution d’emblée. La reproductibilité du frottis pose problème, du fait d’une bonne sensibilité mais d’une faible spécificité, et d’une expérience limitée des cytologistes. L’accès à l’anuscopie haute résolution reste, quant à elle, réservée à des centres experts.
Miser sur la vaccination
Dans un contexte où plus de 95 % des carcinomes épidermoïdes du canal anal sont liés à une infection par HPV, avec un doublement de l’incidence en vingt ans, la vaccination contre les papillomavirus humains constitue la meilleure stratégie de lutte contre ce cancer. Son intérêt dépasse largement le spectre des cancers de l’anus puisque l’infection par HPV est associée aux cancers du col de l’utérus, de la vulve, du vagin, du pénis, de la cavité orale, de l’oropharynx et du larynx.
https://www.e-cancer.fr/Comprendre-prevenir-depister/Reduire-les-risques-de-cancer/Infections/Vaccination-contre-les-HPV-et-cancers
1. Islami F, Ferlay J, Lortet-Tieulent J, Bray F, Jemal A. International trends in anal cancer incidence rates. Int J Epidemiol 2017;46(3):924-38.
2. Abramowitz L, Jacquard AC, Jaroud F, Haesebaert J, Siproudhis L, Pradat P, et al. Human papillomavirus genotype distribution in anal cancer in France: the EDiTH V study. Int J Cancer 2011;129(2):433-9.
3. Moureau-Zabotto L, Vendrely V, Abramowitz L, Borg C, Francois E, Goere D, et al. Anal cancer: French Intergroup Clinical Practice Guidelines for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, SNFCP). Dig Liver Dis. 2017;49(8):831-40.
4. Mistrangelo M, Lesca A. PET-CT in Anal Cancer: Indications and Limits. 2013. Disponible sur : http://cdn.intechopen.com/pdfs-wm/45922.pdf
5. Nigro ND, Vaitkevicius VK, Considine BJ. Combined therapy for cancer of the anal canal: a preliminary report. 1974. Dis Colon Rectum 1993;36(7):709-11.
6. Gunderson LL, Winter KA, Ajani JA, Pedersen JE, Moughan J, Benson AB, et al. Long-term update of US GI intergroup RTOG 98-11 phase III trial for anal carcinoma: survival, relapse, and colostomy failure with concurrent chemoradiation involving fluorouracil/mitomycin versus fluorouracil/cisplatin. J Clin Oncol 2012;30(35):4344-51.
7. James RD, Glynne-Jones R, Meadows HM, Cunningham D, Myint AS, Saunders MP, et al. Mitomycin or cisplatin chemoradiation with or without maintenance chemotherapy for treatment of squamous-cell carcinoma of the anus (ACT II): a randomised, phase 3, open-label, 2 × 2 factorial trial. Lancet Oncol 2013;14(6):516-24.
8. Peiffert D, Tournier-Rangeard L, Gérard JP, Lemanski C, François E, Giovannini M, et al. Induction chemotherapy and dose intensification of the radiation boost in locally advanced anal canal carcinoma: final analysis of the randomized UNICANCER ACCORD 03 trial. J Clin Oncol 2012 Jun 1;30(16):1941-8.
9. Vendrely V, Lemanski C, Gnep K, Barbier E, Hajbi FE, Lledo G, et al. Anti-epidermal growth factor receptor therapy in combination with chemoradiotherapy for the treatment of locally advanced anal canal carcinoma: Results of a phase I dose-escalation study with panitumumab (FFCD 0904). Radiother Oncol 2019;140:84-9.
10. Deutsch E, Lemanski C, Pignon JP, Levy A, Delarochefordiere A, Martel-Lafay I, et al. Unexpected toxicity of cetuximab combined with conventional chemoradiotherapy in patients with locally advanced anal cancer: results of the UNICANCER ACCORD 16 phase II trial. Ann Oncol 2013;24(11):2834-8.
11. Glynne-Jones R, Sebag-Montefiore D, Meadows HM, Cunningham D, Begum R, Adab F, et al. Best time to assess complete clinical response after chemoradiotherapy in squamous cell carcinoma of the anus (ACT II): a post-hoc analysis of randomised controlled phase 3 trial. Lancet Oncol 2017;18(3):347-56.
12. Kim S, Jary M, Mansi L, Benzidane B, Cazorla A, Demarchi M, et al. DCF (docetaxel, cisplatin and 5-fluorouracil) chemotherapy is a promising treatment for recurrent advanced squamous cell anal carcinoma. Ann Oncol 2013;24(12):3045-50.
13. Bacci M, Quero L, Barbier E, Parrot L, Juguet F, Pommier P, et al. What is the optimal treatment for T1N0 anal squamous cell carcinoma? Analysis of current practices in the prospective French FFCD ANABASE cohort. Dig Liver Dis 2021;53(6):776-84.