Le virus du chikungunya est un alphavirus de la famille des Togaviridae, responsable d’une arbovirose transmise à l’être humain par les moustiques du genre Aedes (principalement Aedes aegypti et Aedes albopictus), également vecteurs de la dengue, de la fièvre jaune et du virus Zika.1 Le genre Aedes est adapté aux environnements urbains et suburbains. Son activité est diurne (pic d’activité au petit matin et au crépuscule).2
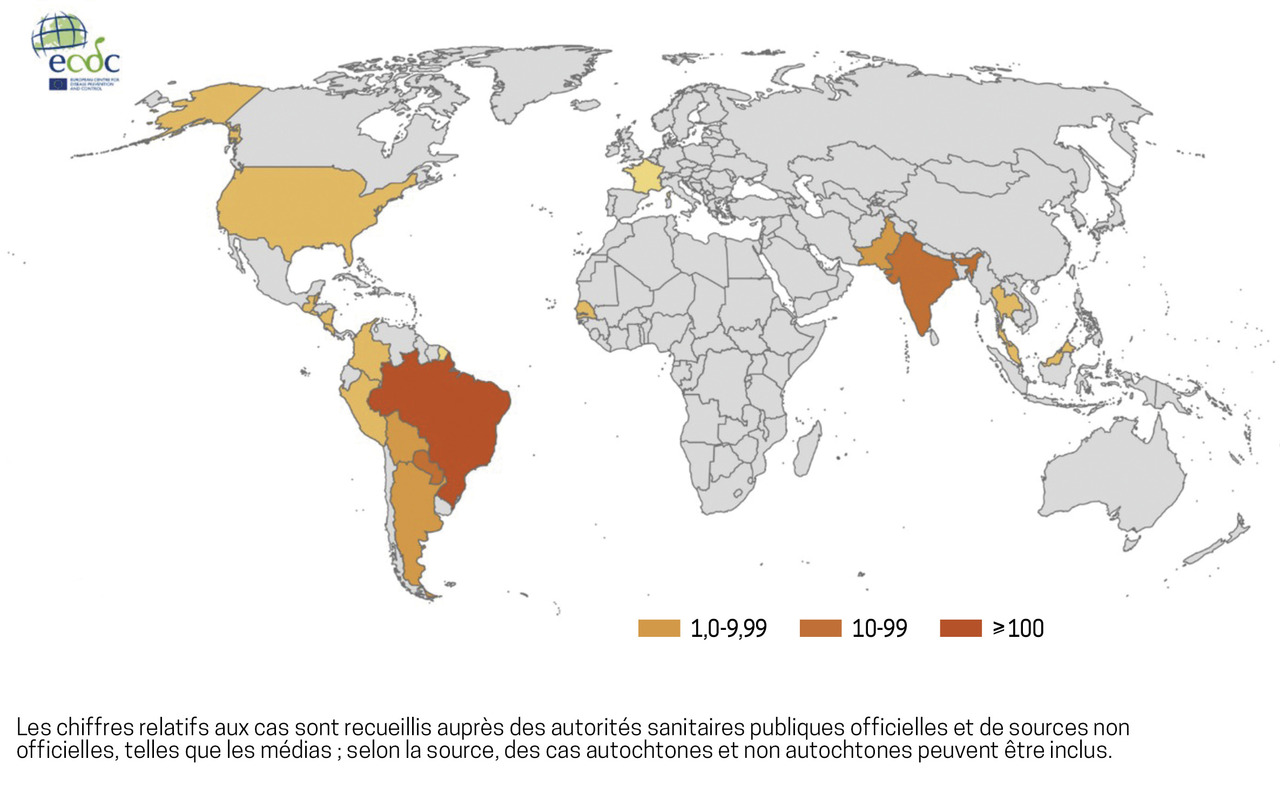
Le moustique a atteint la France hexagonale en 2004 par la Méditerranée,1 il y est actif de mai à novembre et a la capacité d’hiberner.3 Le chikungunya poursuit donc son expansion, comme en témoignent les foyers actifs identifiés à La Réunion, au Brésil, au Paraguay et en Colombie (fig. 1).4,5 En Guadeloupe, on estime qu’un peu plus de 160 000 personnes ont été infectées par le virus du chikungunya lors de l’épidémie de 2013 - 2015.6 Parmi elles, entre 20 000 et 50 000 souffrent encore de douleurs articulaires et de troubles neuropsychiques altérant la qualité de vie. Alors que la prise en charge de la phase aiguë reste symptomatique, le traitement de la phase dite chronique requiert une approche pluridisciplinaire, intégrative, avec une vision globale coordonnée et centrée sur le patient. Fort de ce constat, a été mis en place, à l’initiative du Pr Gane-Troplent, le programme Chik-Tambouyé 51, modèle innovant et unique de prise en charge pluridisciplinaire du chikungunya chronique en Guadeloupe (encadré).
Forme aiguë de la maladie
L’infection par le virus du chikungunya est asymptomatique dans 5 à 40 % des cas, selon les études. Les formes aiguës se caractérisent par un syndrome viral associant une polyarthralgie fébrile, des myalgies diffuses, des céphalées et une éruption cutanée maculo-papuleuse.7,8 Il apparaît brutalement après une période d’incubation d’un à douze jours après la piqûre (2 à 3 jours en moyenne). Ce syndrome viral aigu dure en général cinq à dix jours et se caractérise par une atteinte articulaire et périarticulaire prédominante aux extrémités.6 Les douleurs, associées à des raideurs, entraînent une incapacité fonctionnelle importante, ce que le terme chikungunya – qui signifie « fait marcher courbé » en makondé – décrit très bien. Le traitement de la forme aiguë de la maladie est essentiellement symptomatique par antipyrétiques et antalgiques (paracétamol).1
Des complications peuvent survenir au cours de cette phase aiguë de la maladie. La transmission du virus de la mère à l’enfant au moment de l’accouchement entraîne des pathologies cardiaques ou neurologiques graves chez la moitié des nourrissons. Plusieurs décès ont été constatés au cours de l’épidémie survenue à La Réunion en 2006. De rares cas d’encéphalite ont également été rapportés chez de jeunes enfants, ainsi que des cas de myocardite, directement provoqués par le virus. De plus, les données de l’épidémie de 2013 dans les Caraïbes indiquent que l’infection multiplierait par huit le risque de développer un syndrome de Guillain-Barré, ayant nécessité une assistance respiratoire.1
Des complications peuvent également survenir chez des patients ayant des pathologies chroniques cardiaques, rénales ou respiratoires, la fièvre élevée et les douleurs intenses pouvant causer une décompensation. Les complications du chikungunya sont plus fréquentes chez les personnes âgées, avec une sévérité accrue au-delà de 75 ans.9
Forme chronique : focus sur la Guadeloupe
On estime qu’un peu plus de 160 000 personnes vivant en Guadeloupe ont été infectées par le virus du chikungunya lors de l’épidémie de 2013 à 2015.10 Parmi elles, entre 20 000 et 50 000 ont vu leurs douleurs articulaires et leurs symptômes neuropsychiques persister au-delà de trois mois après la phase aiguë, et certains jusqu’à aujourd’hui :11 on parle de chikungunya chronique. À ce jour, au moins 20 000 adultes vivant en Guadeloupe en seraient atteints.11
Une physiopathologie mal comprise
Les mécanismes qui sous-tendent la chronicisation du chikungunya ne sont pas totalement élucidés. Ils pourraient faire intervenir une production excessive et persistante de signaux inflammatoires, combinée à une altération des mécanismes de régulation de l’inflammation.12 Des études réalisées sur des modèles animaux et des observations cliniques suggèrent que la persistance des symptômes pourrait être liée à une auto-immunité induite et/ou à une persistance du virus dans les tissus articulaires et périarticulaires.13
Le déconditionnement musculaire semble aussi impliqué dans la survenue des troubles musculo-squelettiques (TMS).
Des symptômes aspécifiques
Le tableau clinique de chikungunya chronique est souvent complexe et variable d’un patient à l’autre, rendant le diagnostic difficile à établir.
Cette pathologie se traduit principalement par des TMS diffus (95 %), plus rarement par des rhumatismes inflammatoires chroniques (RIC) [5 %].14,15 Ces atteintes peuvent s’accompagner d’une décompensation d’arthropathies dégénératives ou traumatiques préexistantes, comme de l’arthrose ou des tendinopathies calcifiantes.12
Outre les TMS et les RIC, et du fait de son tropisme neurologique, le chikungunya chronique se caractérise par une fatigue chronique, un ralentissement idéatoire, un syndrome confusionnel et des difficultés mnésiques.
L’évolution peut être continue ou se présenter sous la forme de crises douloureuses. Les patients décrivent une rupture avec leur état de santé antérieur, marquée par une perte d’autonomie et une incapacité à effectuer des tâches quotidiennes simples, retentissant sur leur qualité de vie.6
Troubles psychiques et du sommeil entretenus par un manque de reconnaissance de la pathologie
Des troubles du sommeil et un syndrome anxiodépressif complètent souvent le tableau clinique de chikungunya chronique.16
Le sommeil joue un rôle central dans la modulation de la douleur chronique. Une revue de la littérature met en évidence une corrélation bidirectionnelle entre l’insomnie et la douleur chronique, suggérant que les troubles du sommeil précèdent et aggravent la perception de la douleur.17
L’étude de Kroenke et al. a mis en évidence en 2011 une relation réciproque entre la douleur chronique et la dépression, montrant que l’aggravation de l’un de ces symptômes entraîne souvent une détérioration de l’autre.18
L’étude de Fontaine, réalisée en 2021 sur une cohorte réunionnaise de patients atteints de chikungunya chronique, met en évidence un taux de symptômes anxiodépressifs de 46,8 % et un taux de dépression de 28,9 %.16 Ces symptômes neuropsychiques engendrent un retentissement fonctionnel qui amplifie la souffrance des patients, renforce leur isolement social et contribue à l’altération de leur qualité de vie.19 Par ailleurs, ils partagent aussi la sensation d’un vieillissement prématuré depuis l’infection initiale.
Le chikungunya chronique manque de reconnaissance par le corps médical ; la faible communication institutionnelle autour de la maladie et l’absence de dépistage associées à la méconnaissance des praticiens peuvent en être la cause. De plus, la présence de facteurs confondants pouvant expliquer certains symptômes contribuent à cette problématique. L’absence de diagnostic formel et de déclaration en affection de longue durée rend aussi plus difficile l’accès aux soins. Cette situation génère un sentiment d’incompréhension, d’isolement et de désespoir, laissant de nombreux patients livrés à eux-mêmes.
Une prise en soins pluridisciplinaire
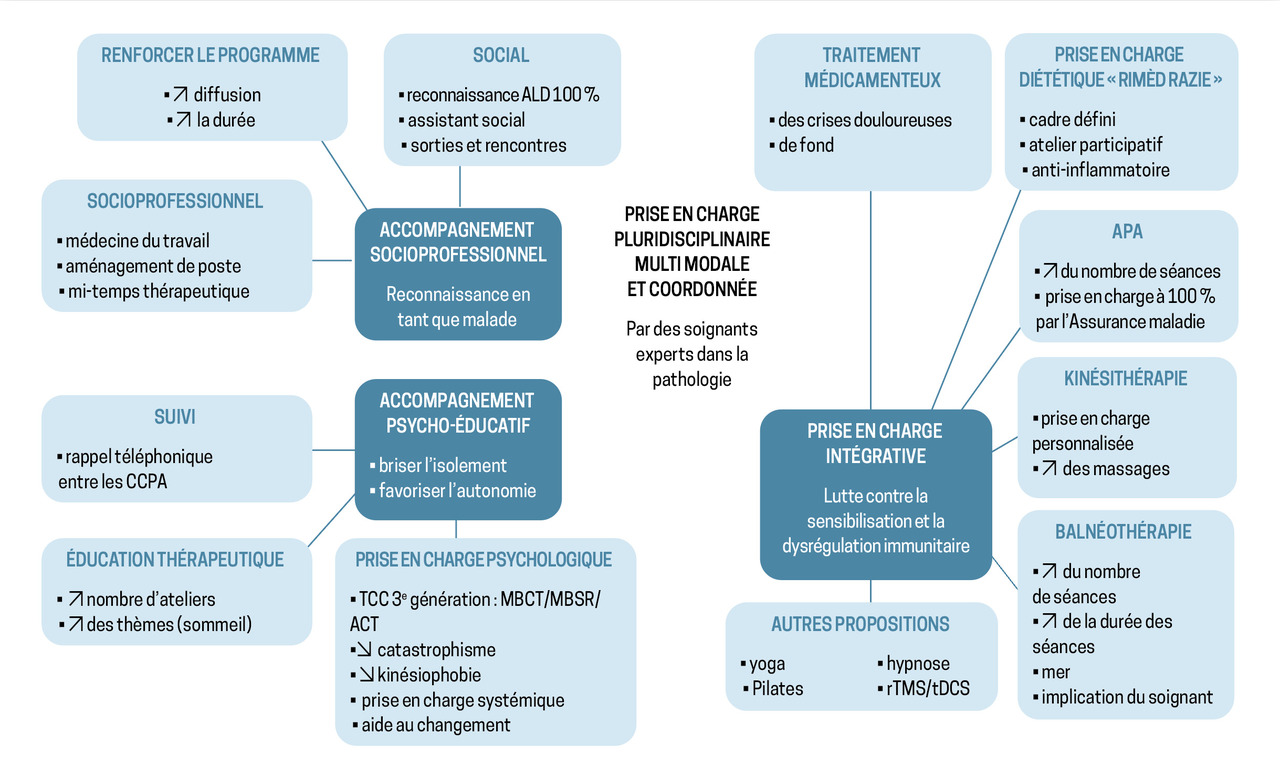
La prise en charge du chikungunya chronique est multimodale et repose sur une approche coordonnée et centrée sur le patient. Elle intègre les traitements antalgiques (paracétamol, AINS), la kinésithérapie, la balnéothérapie, l’activité physique adaptée, l’accompagnement diététique, l’accompagnent psychologique et l’éducation thérapeutique (fig. 2).
Traiter la douleur
En cas de douleur neuropathique associée, des traitements spécifiques comme la prégabaline, la gabapentine, l’amitriptyline peuvent être utilisés. Dans les formes sévères et résistantes, une corticothérapie systémique, l’hydroxychloroquine ou le méthotrexate peuvent être envisagés avec prudence.
L’efficacité du traitement est évaluée sur plusieurs semaines et nécessite un suivi clinique régulier.12
Les patients reconnaissent l’efficacité des antalgiques et des anti-inflammatoires, mais ils les perçoivent comme une solution temporaire, insuffisante pour une prise en charge durable.
Fort ancrage des traditions culinaires et médicinales
Le régime occidental, riche en aliments transformés et sucres raffinés et pauvre en fruits et légumes, favoriserait un état pro-inflammatoire, contribuant ainsi à la sensibilisation des voies de la douleur.20 En parallèle, les carences en micronutriments essentiels, tels que les acides gras oméga 3, les vitamines B et D, le magnésium et le zinc, seraient associées à une exacerbation des douleurs chroniques.21 Une alimentation plus riche en aliments anti-inflammatoires pourrait être un levier complémentaire dans la prise en charge. Cependant, les résistances au changement et les contraintes économiques peuvent limiter l’application de ces conseils.
Dans son ouvrage Corps, jardins, mémoires. Anthropologie du corps et de l’espace à la Guadeloupe, Catherine Benoît, anthropologue, analyse les représentations du corps et de la maladie dans les sociétés créoles et caribéennes. Elle souligne que la prévention et le traitement de certaines affections nécessitent non seulement des techniques spécifiques mais aussi l’usage des plantes médicinales, intégrées dans des systèmes de soins traditionnels. Aux Antilles, de nombreuses plantes locales sont traditionnellement utilisées pour leurs propriétés anti-inflammatoires et antalgiques : curcuma, gros thym, noni, moringa, gingembre, citronnelle, cannelle, girofle, orthosiphon, sureau, Alpinia zerumbet (gingembre coquille), herbe à fer, pourpier. Ainsi, l’intégration des remèdes traditionnels (« rimèd razié ») dans le parcours de soins pourrait renforcer l’adhésion des patients aux traitements en prenant en compte leur représentation socioculturelle de la douleur.22
Miser sur l’accompagnement psychologique et intégrer les proches dans le soin
L’accompagnement psychologique est un aspect fondamental mais encore sous-estimé dans la prise en charge des douleurs chroniques du chikungunya. Une approche psychologique intégrant les thérapies cognitivo-comportementales (TCC) de troisième génération pourrait aider les patients à modifier leur rapport à la douleur, à faire le deuil du « zéro douleur », à déconstruire le catastrophisme et à intégrer de nouvelles stratégies pour mieux appréhender leur quotidien.23
Un autre point soulevé par les patients est le manque de compréhension de leur entourage face à leur douleur chronique. Une approche systémique, intégrant les proches dans le processus de soin, pourrait améliorer la prise en charge globale des patients atteints de douleurs post-chikungunya.24
Programme Chik-Tambouyé 51 : une prise en charge innovante
En Guadeloupe, l’épidémie de chikungunya qui a sévi de 2013 à 2015 a laissé près de 20 000 patients avec des séquelles chroniques. Ces séquelles se présentent à 95 % sous la forme de troubles musculosquelettiques diffus accompagnés de symptômes neuropsychiques. La qualité de vie s’en trouve altérée. Néanmoins, le chikungunya chronique reste mal reconnu et sa prise en charge insuffisamment structurée.
Face à ce constat, le programme Chik-Tambouyé 51, lancé en septembre 2021, a été mis en place pour proposer une prise en charge pluridisciplinaire coordonnée à ces patients sur l’archipel guadeloupéen. Il s’inscrit dans le cadre de l’article 51 de la loi de financement de la Sécurité sociale de 201825 et a pour objectif principal de réduire la douleur et d’améliorer la qualité de vie des patients souffrant de chikungunya chronique. Il propose une prise en charge individuelle sur une période de deux ans, incluant cinq consultations complexes pluridisciplinaires ambulatoires (CCPA).
Il mobilise une équipe de professionnels de santé composée de médecins généralistes, kinésithérapeutes, infirmiers, diététiciens, psychologues et enseignants en activité physique adaptée. Pour intégrer le programme, les patients devaient être résidents de la Guadeloupe ou de son archipel (Marie-Galante, les Saintes, la Désirade), avoir plus de 18 ans, avoir une sérologie positive pour le chikungunya et donner leur consentement écrit. Le recrutement total a inclus 650 personnes.26 Un travail de thèse a permis d’explorer le vécu des patients atteints de chikungunya chronique ayant intégré ce programme.
Concrètement, les traitements médicamenteux regroupent antalgiques (paliers 1 et 2), AINS (oraux ou topiques), corticoïdes oraux, antidépresseurs tricycliques et médicaments indiqués pour le traitement des arthrites inflammatoires. Les traitements non médicamenteux regroupent la kinésithérapie, la balnéothérapie, l’activité physique adaptée, l’accompagnement diététique et psychologique, et la participation à des groupes/ateliers thérapeutiques. Les propositions thérapeutiques sont individualisées et adaptées à chaque patient. Une étude qualitative phénoménologique et interprétative a été réalisée auprès de 11 patients ayant participé au programme Chik-Tambouyé 51. Les données ont été recueillies par des entretiens semi-dirigés, enregistrés et retranscrits intégralement.
Il en ressort que le chikungunya chronique marque une rupture brutale avec l’état de santé antérieur des patients. Ils décrivent une sensation de vieillissement prématuré associé à un syndrome douloureux chronique avec une fatigue chronique et un retentissement psycho-émotionnel notable. Le manque de reconnaissance médical et social alimente leur sentiment d’isolement. Le programme Chik-Tambouyé 51 est perçu comme un soulagement, offrant un cadre structuré grâce à une prise en soins multimodale et personnalisée. En outre, les perceptions des traitements médicamenteux et non médicamenteux qui y sont proposés révèlent une préférence pour les approches non médicamenteuses. Si les médicaments antalgiques restent utilisés ponctuellement, ils sont souvent décrits comme associés à des effets indésirables, à un risque de dépendance, ou sont jugés insuffisamment efficaces sur le long terme.
Que dire à vos patients ?
Le chikungunya chronique marque une rupture avec l’état de santé antérieur des patients.
Un accompagnement spécifique, pluridisciplinaire et intégratif peut permettre de faire le deuil du stade « zéro douleur ».
Les soins ne se limitent pas aux médicaments. Ils associent des mesures hygiéno-diététiques intégrant les traditions culinaires et médicinales attachées à l’histoire culturelle du patient.
La participation aux ateliers thérapeutiques et l’échange avec des pairs offrent aux patients un espace d’échange et d’apprentissage qui facilite l’adhésion aux soins.
2. Cochet A, Calba C, Jourdain F, et al. Autochthonous dengue in mainland France, 2022: Geographical extension and incidence increase. Euro Surveill 2022;27(44):2200818.
3. Lacour G, Chanaud L, l’Ambert G, et al. Seasonal synchronization of diapause phases in Aedes albopictus (Diptera: Culicidae). PLoS One 2015;10(12):e0145311.
4. Santé publique France. Chikungunya et dengue à La Réunion. Bulletin du 4 février 2025. https://bit.ly/4hysDRj
5. ECDC. Chikungunya virus disease worldwide overview. 2025. https://bit.ly/4rbLPca
6. Dorléans F, Hoen B, Najioullah F, et al. Outbreak of chikungunya in the french caribbean islands of Martinique and Guadeloupe: Findings from a hospital-based surveillance system (2013–2015). Am J Trop Med Hyg 2018;98(6):1819‑25.
7. Santé publique France. Chikungunya. 5 novembre 2025. https://bit.ly/49sSBDJ
8. SPILF. Recommandations nationales sur la prise en charge du chikungunya (Formes aiguës, formes persistantes). Novembre 2014. https://bit.ly/4i73tcD
9. Godaert L, Cofais C, Hequet F, et al. Adaptation of WHO Definitions of Clinical Forms of Chikungunya Virus Infection for the Elderly. Am J Trop Med Hyg 2021;104(1):106-9.
10. Santé publique France. Le chikungunya aux Antilles. Point épidémiologique du 12 janvier au 1er mars 2015. Mars 2015.
11. Comité de veille et d’anticipation des risques sanitaires. Avis sur les risques sanitaires de la dengue et autres arboviroses à Aedes en lien avec le changement climatique. 3 avril 2023. https://bit.ly/4hz2jXj
12. Diniz Lopes Marques C, Ranzolin A, Gualberto Cavalcanti N, et al. Arboviruses related with chronic musculoskeletal symptoms. Best Pract Res Clin Rheumatol 2020;34(4):101502.
13. McCarthy MK, Davenport BJJ, Morrison TE. Chronic Chikungunya Virus Disease. Curr Top Microbiol Immunol 2022;435:55‑80.
14. Tritsch SR, Encinales L, Pacheco N, et al. Chronic joint pain 3 years after chikungunya virus infection largely characterized by relapsing-remitting symptoms. J Rheumatol 2020;47(8):1267‑74.
15. Schilte C, Staikowsky F, Couderc T, et al. Chikungunya virus-associated long-term arthralgia: A 36-month prospective longitudinal study. PLoS Negl Trop Dis 2013;7(3):e2137.
16. Fontaine J. Troubles anxio-dépressifs à distance d’une épidémie de Chikungunya : étude exposé-non exposé ancillaire à la cohorte réunionnaise CHIKGene. Sciences du Vivant, 2021.
17. Fitzcharles MA, Cohen SP, Clauw DJ, et al. Nociplastic pain: Towards an understanding of prevalent pain conditions. Lancet 2021;397(10289):2098‑110.
18. Kroenke K, Wu J, Bair MJ, et al. Reciprocal relationship between pain and depression: A 12-month longitudinal analysis in primary care. J Pain 2011;12(9):964‑73.
19. Amaral JK, Bilsborrow JB, Schoen RT. Brief report: The disability of chronic chikungunya arthritis. Clin Rheumatol 2019;38(7):2011‑4.
20. Seaman DR. The diet-induced proinflammatory state: A cause of chronic pain and other degenerative diseases? J Manipulative Physiol Ther 2002;25(3):168‑79.
21. Philpot U, Johnson MI. Diet therapy in the management of chronic pain: Better diet less pain? Pain Manag 2019;9(4):335‑8.
22. Benoît C. Corps, jardins, mémoires. Anthropologie du corps et de l'espace à la Guadeloupe. Paris : Éditions de la Maison des sciences de l’homme, CNRS Éditions, 2000. 310 p. https://bit.ly/484Hbny
23. Hughes LS, Clark J, Colclough JA, et al. Acceptance and Commitment Therapy (ACT) for Chronic Pain: A Systematic Review and Meta-Analyses. Clin J Pain 2017;33(6):552‑68.
24. Lewandowski W, Morris R, Burke Draucker C, et al. Chronic pain and the family: Theory-driven treatment approaches. Issues Ment Health Nurs 2007;28(9):1019‑44.
25. Journal officiel. Article 51 – Loi n° 2017-1836 du 30 décembre 2017 de financement de la Sécurité sociale pour 2018 (1). 31 décembre 2017. https://bit.ly/3LMAxL0
26. Résumé du protocole d'évaluation de l'expérimentation Chik Tambouyé 51. https://bit.ly/43pXcTB

 Encadrés
Encadrés