Marqueur d’exclusion des thromboses
Les D-dimères sont le produit de dégradation de la fibrine et sont donc générés dès lors qu’il y a une situation où la fibrine est synthétisée. Ces situations, fréquentes, ne permettent pas d’affirmer une maladie thromboembolique veineuse (MTEV) quand les D-dimères sont au-delà du seuil de 500 ng/mL. Cependant, les D-dimères sont un marqueur très sensible d’exclusion d’une thrombose.
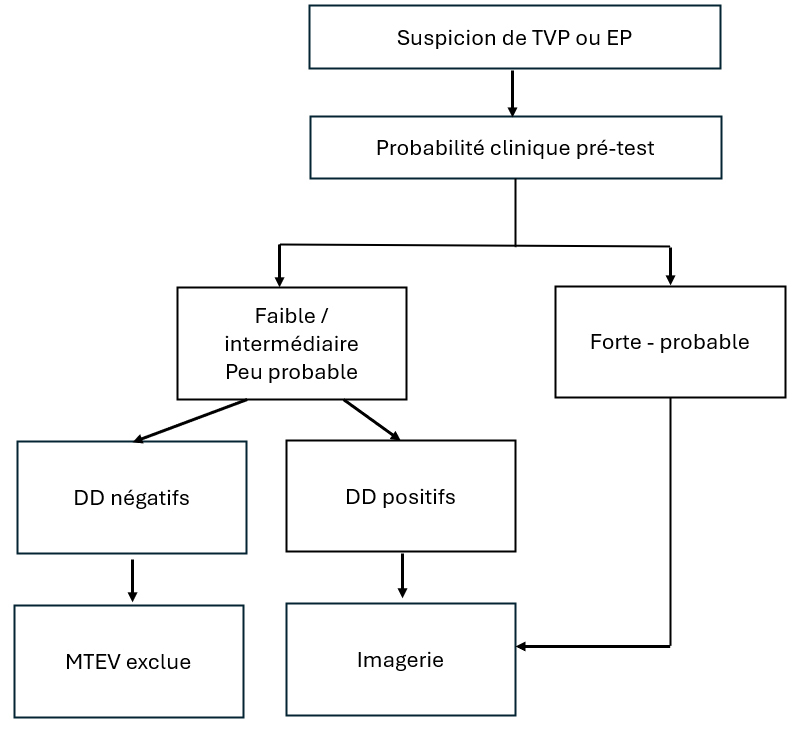
Les thromboses veineuses profondes (TVP) et les embolies pulmonaires (EP) définissent les MTEV. En cas de suspicion clinique de TVP ou d’EP, la démarche diagnostique est similaire et utilisée depuis de nombreuses années. La prise en charge des suspicions de TVP ou d’EP s’appuie sur l’évaluation clinique et le calcul d’une probabilité pré-test suivis, selon les situations, par le dosage des D-dimères et/ou par la réalisation d’examens d’imagerie (fig. 1).
Le score de Wells permet de calculer une probabilité pré-test pour la TVP, tandis que le score de Genève révisé est plus utilisé en cas de suspicion d’EP (tableaux 1 et 2).
Les deux scores cliniques ont aussi une version simplifiée dans le but de faciliter leur adoption dans la pratique clinique. L’interprétation peut se faire à 2 ou 3 niveaux.
La démarche diagnostique est la même dans les 2 situations. En cas de score faible ou modéré (3 niveaux) ou peu probable (2 niveaux), un taux de D-dimères < 500 ng/mL autorise l’exclusion d’une TVP ou d’une EP sans recourir à l’imagerie. Un résultat positif doit être suivi d’analyses d’imagerie supplémentaires (échographie, angioscanner ou scintigraphie pulmonaire).
En revanche, en cas de score élevé (3 niveaux) ou probable (2 niveaux), le dosage des D-dimères n’est pas recommandé puisqu’un résultat normal n’exclut pas la TVP ou l’EP avec certitude. Le taux de faux négatifs en cas de score élevé peut atteindre 10 %.
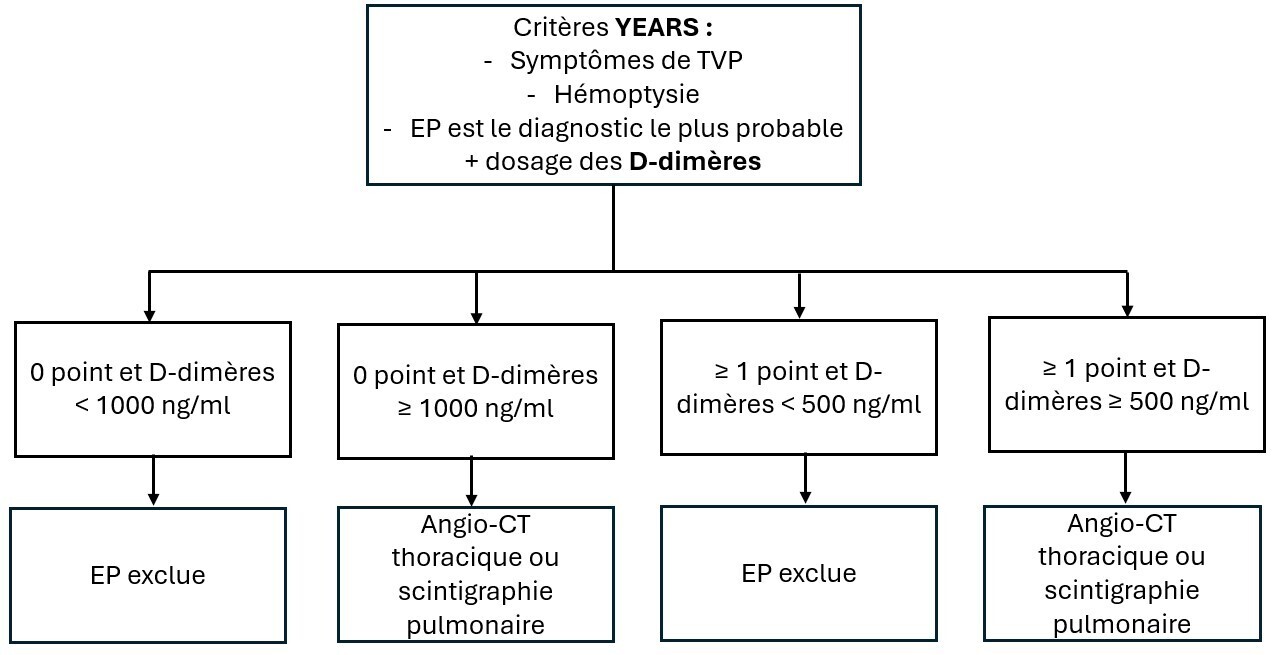
D’utilisation plus récente, l’algorithme de YEARS (fig. 2) peut être utilisé dans le cadre d’une suspicion d’EP. Il tient compte de 3 critères cliniques (signes de TVP, hémoptysie, diagnostic alternatif moins probable qu’une EP) et du dosage des D-dimères. Il permet d’éviter la prescription de l’angioscanner dans 20 à 30 % des cas suspects d’EP avec un taux de diagnostic erroné inférieur à 1,5 % à 3 mois. Selon ce modèle, l’EP est exclue chez les patients qui n’ont pas d’élément clinique et un taux de D-dimères < 1 000 ng/mL ou chez les patients qui ont au moins un critère clinique et un taux de D-dimères < 500 ng/mL.
Limites de l’utilisation des D-dimères
En cas de thromboses, la valeur des D-dimères dépend de l’importance et l’étendue du thrombus. Plus un thrombus est gros et proximal, plus la valeur sera élevée.
Le pic des D-dimères est maximal durant les 48 premières heures puis le taux diminue. Le traitement anticoagulant induit une baisse significative du taux de D-dimères dès la 48e heure et le dosage des D-dimères n’est pas indiqué lorsque le patient est sous anticoagulant à doses thérapeutiques.
Les D-dimères peuvent être faussement négatifs si le thrombus est petit, distal ou en cas d’EP sous-segmentaire ou périphérique, ou si le prélèvement est trop précoce ou trop tardif après le début des signes cliniques.
De nombreuses conditions physiologiques ou pathologiques peuvent s’accompagner d’une augmentation des D-dimères sans qu’il y ait pour autant une thrombose. Un taux de D-dimères élevé n’est absolument pas spécifique d’une thrombose et ne doit pas être utilisé comme tel.
Situations physiologiques
- Âge avancé
- Grossesse
- Post-partum
- Période néonatale
Situations pathologiques
- TVP
- EP
- Coagulation intravasculaire disséminée (CIVD)
- Dissection aortique
- Insuffisance cardiaque
- Fibrillation atriale
- Inflammation chronique
- Néoplasie
- Infection
- Traumatisme
- Intervention chirurgicale récente
- Pathologie hépatique
- Insuffisance rénale
- Infections
- Traitement thrombolytique
Cas particuliers : sujet âgé et femme enceinte
Sujet âgé
Chez le sujet âgé, l’intérêt des D-dimères est limité du fait d’un taux élevé chez près de 90 % des sujets après 80 ans, en partie en rapport avec une diminution de la filtration glomérulaire qui s’accompagne d’une augmentation de la formation de fibrine et de la fibrinolyse.
Le seuil a été adapté à la population âgée en utilisant comme seuil des D-dimères une valeur correspondant à l’âge multiplié par 10 (seuil de 750 ng/mL pour une personne de 75 ans).
Grossesse
La maladie thromboembolique est l’une des principales causes de morbidité et mortalité maternelles, avec une incidence de 1 à 2 cas pour 1 000 grossesses. Le risque est encore plus élevé dans les 6 semaines post-partum. Les D-dimères augmentent pendant la grossesse.
L’algorithme diagnostique de la TVP est similaire chez la femme enceinte et non enceinte alors que les algorithmes pour l’EP sont adaptés pour réduire le nombre de radiations liées aux examens d’imagerie.
Deux algorithmes permettent d’exclure le diagnostic d’EP sans recours à l’imagerie :
- Score de Genève révisé :
- exclusion d’EP si probabilité faible-intermédiaire au score de Genève révisé et DD < 500 ng/mL ;
- si la probabilité est élevée, ou le taux de DD ≥ 500 ng/mL, une échographie des deux membres inférieurs doit être réalisée. En cas de positivité, le diagnostic clinique d’EP est retenu sans imagerie complémentaire.
- Algorithme YEARS :
- Seules les patientes avec absence de critères YEARS et des DD ≥ 1 000 ng/mL ou ayant un ou plusieurs critères YEARS et des DD ≥ 500 ng/mL doivent bénéficier d’une imagerie complémentaire.
Place dans l’estimation du risque de récidive à l’arrêt des anticoagulants
Quel que soit le contexte clinique, une durée minimale de 3 mois de traitement anticoagulant en cas de TVP ou d’EP est recommandée. Au-delà de 3 mois, l’intérêt de la prolongation d’un traitement anticoagulant dépend du rapport bénéfice/risque selon le risque de récidive.
En l’absence d’événement déclenchant majeur (chirurgie, immobilisation, fracture) [MTEV non provoquée], le risque de récidive après 1 an de traitement est élevé, 10 % chez les hommes et 5 % chez les femmes ; à 3 ans, ces chiffres sont de 20 % chez les hommes et 9 % chez les femmes, et pourraient justifier chez certains patients de maintenir un traitement anticoagulant au long cours.
Le risque est multiplié par 2 si la valeur des D-dimères est supérieure au seuil après 3 mois de traitement anticoagulant (3,5 % / an pour patients avec D-dimères < seuil et 8,9 % / an avec des D-dimères > seuil).
Ainsi, les D-dimères élevés à distance de l’événement thrombotique sont bien un marqueur de récidive, mais il n’existe pas de corrélation entre leur concentration plasmatique et le niveau de risque.
Des scores biocliniques (score de Vienne, score DASH, HERDOO- 2), incluant notamment les D-dimères, ont été proposés pour mieux caractériser les populations à plus fort ou faible risque de récidive. Seul le score HERDOO- 2 (tableau 3) a été validé et uniquement chez la femme. Avec un score HERDOO- 2 < 2, le risque de récidive est très faible, ce qui permet d’arrêter le traitement anticoagulant avec plus de sécurité.
Le Gal G, Righini M, Roy PM, et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score. Ann Intern Med 2006;144(3):165-71.
Van der Hulle T, Cheung W, Kooij S, et al. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet 2017;390(10091):289-97.
Sanchez O, Benhamou Y, Bertoletti L, et al. Recommendations of good practice for the management of thromboembolic venous disease in adults. Rev Mal Respir 2019;36:249-83.
Franchini M, Focosi D, Pezzo MP, et al. How we manage a high D-dimer. Haematologica 2024;109(4):1035-45.
Linkins LA, Takach Lapner S. Review of D-dimer testing: Good, Bad, and Ugly. Int J Lab Hematol 2017:39 Suppl 1:98-103.
Righini M, Van Es J, Den Exter PL, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study. JAMA 2014;311(11):1117-24.