Les syndromes thrombotiques associés aux anticorps anti-PF4 présentent des caractéristiques épidémiologiques, physiopathologiques, cliniques et thérapeutiques spécifiques.
Thrombopénie induite par l’héparine : complication iatrogène grave
La thrombopénie induite par l’héparine (TIH) est une complication iatrogène grave d’un traitement par héparine, associée à un risque thrombotique élevé. Elle résulte d’une réponse immune anormale avec production d’anticorps anti-PF4/H, activant dans certains cas les plaquettes, les leucocytes et l’endothélium, favorisant ainsi une hypercoagulabilité et une thrombose. L’incidence est plus élevée après un acte chirurgical et sous héparine non fractionnée (2,6 %) comparée à l’héparine de bas poids moléculaire (0,2 %).1
Le diagnostic de TIH doit être suspecté devant une diminution brutale de la numération plaquettaire d’environ 50 %, en général cinq à vingt et un jours après le début du traitement (dès le premier jour si un traitement par héparine a déjà été donné dans les cent jours précédents), la survenue de complications thrombotiques artérielles ou veineuses et l’absence d’autre cause évidente de thrombopénie. Le diagnostic repose tout d’abord sur l’évaluation du score de probabilité clinico-biologique, le score 4T (tableau 1), fondé sur les critères cités précédemment.2 En cas de score 4T supérieur à 3, la recherche des anticorps anti-PF4/H de type immunoglobulines (Ig) G est nécessaire. La valeur prédictive négative de ces anticorps est très élevée (entre 95 et 99 %), mais leur spécificité est médiocre, notamment après chirurgie cardiaque : un résultat positif ne suffit pas à confirmer le diagnostic de TIH. Ainsi, le diagnostic ne peut être posé qu’après avoir mis en évidence l’activation de plaquettes témoins (provenant de volontaires sains sélectionnés au laboratoire) par les anticorps anti-PF4/H du patient en présence d’héparine grâce à un test fonctionnel. Le gold standard est le test de libération de sérotonine radiomarquée (SRA) réalisé à partir de plaquettes dites « lavées ». Il est réservé à des laboratoires de référence ayant l’expertise dans le lavage des plaquettes et la possibilité d’utiliser des radioéléments.3 D’autres tests fonctionnels plaquettaires peuvent être réalisés sans radioélément en microplaque4 ou par cytométrie en flux.3
Le diagnostic de TIH aiguë peut être difficile en raison de la présence de facteurs confondants, notamment en période postopératoire ou chez les patients en réanimation. Il doit être posé en tenant compte du contexte clinique et des traitements associés (chimiothérapie). Il est crucial de ne pas méconnaître ce diagnostic mais également d’éviter une conclusion erronée, car une TIH confirmée contre-indique à vie l’utilisation d’héparine. Cette interdiction a des conséquences importantes pour les patients, les obli-geant à recourir à des traitements anticoagulants à fenêtre thérapeutique plus étroite et souvent plus coûteux. Lors d’une suspicion forte de TIH et encore plus si celle-ci est confirmée, il est nécessaire d’arrêter immédiatement le traitement par héparine et de le remplacer par un anticoagulant non héparinique à dose thérapeutique. En France, les médicaments disponibles et autorisés pour le traitement d’une TIH sont le danaparoïde sodique et l’argatroban, qui ne s’administrent que par voie parentérale. Depuis quelques années, les anticoagulants oraux directs (AOD) sont utilisés dans cette indication chez les patients stables.2,5
Thrombopénie thrombotique immune induite par les vaccins lors de la pandémie de Covid- 19
En décembre 2020, les campagnes de vaccination de masse ont représenté un tournant majeur dans la lutte contre la pandémie à SARS-CoV- 2 (Covid- 19). Ces programmes, initiés dans un contexte d’urgence sanitaire mondiale, ont permis de réduire drastiquement la morbidité et la mortalité liées au SARS-CoV- 2.6 Toutefois, en mars 2021, l’émergence de rares cas de thromboses atypiques associées à une thrombopénie a attiré l’attention des cliniciens et des agences sanitaires.6,7 Ces événements, survenant majoritairement après administration des vaccins à vecteur adénoviral ChAdOx1 nCov- 19 (Oxford/AstraZeneca) et Ad26.COV2.S (Johnson & Johnson/Janssen), ont conduit à l’identification d’un nouveau syndrome nommé thrombopénie immune thrombotique induite par les vaccins (vaccine-induced immune thrombotic thrombocytopenia [VITT]).6,8 Ce syndrome, caractérisé par la présence d’une thrombopénie (le plus souvent sévère), d’événement thrombotique veineux et artériel ainsi que d’anticorps anti-PF4 activant les plaquettes a des similitudes physiopathologiques avec la TIH, bien qu’il survienne en l’absence d’exposition préalable à l’héparine6 et que les anti-PF4 présentent le plus souvent une réactivité indépendante de l’héparine lors des tests fonctionnels plaquettaires (tableau 2). Bien que rarissime, ce syndrome a suscité des inquiétudes légitimes quant à la sécurité de ces vaccins. De plus, la VITT représente un défi médical unique en raison de sa gravité potentielle, de ses mécanismes immunologiques complexes et de la nécessité d’une prise en charge spécifique.
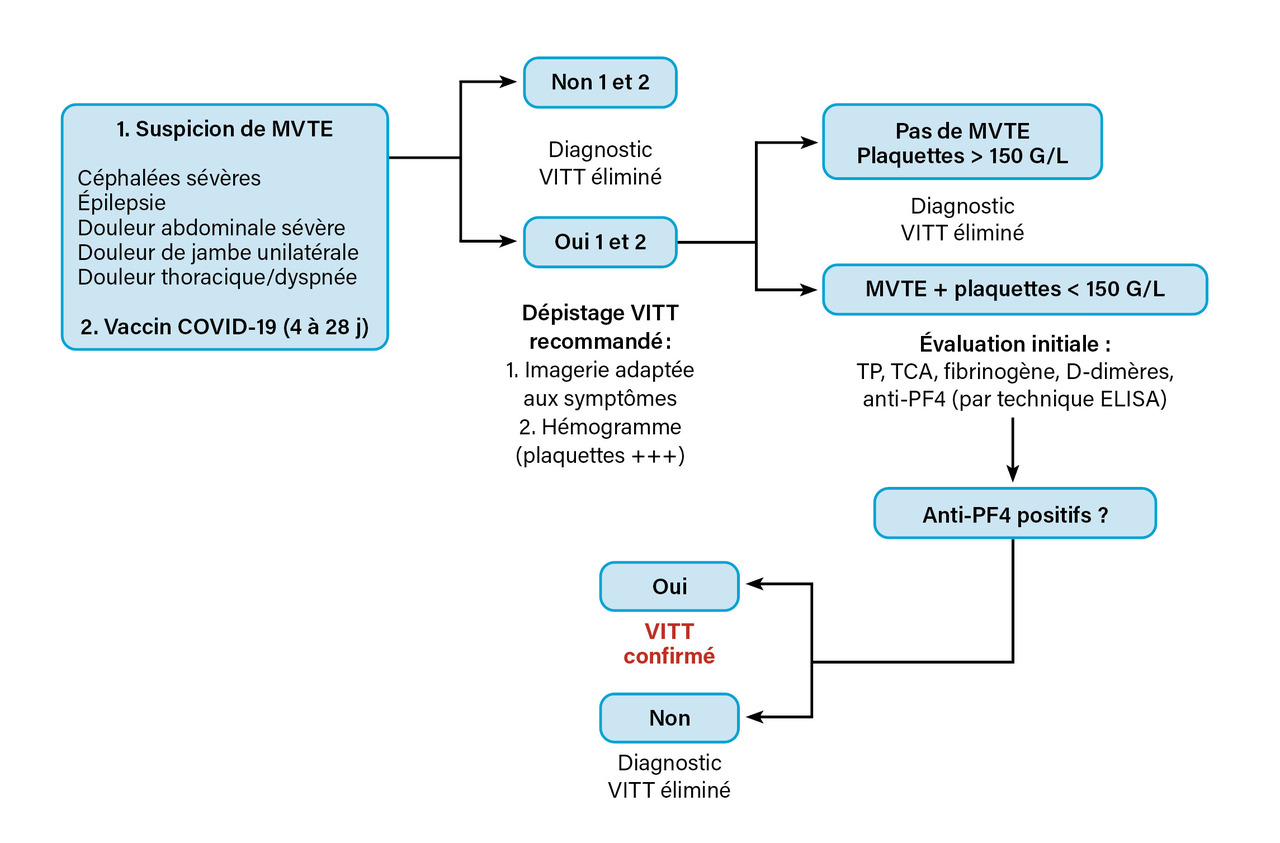
En 2022, l’incidence globale de VITT était estimée entre 11 et 21 cas par million de doses administrées pour le ChAdOx1 nCov- 19 et à 2,5 cas par million pour le vaccin Ad26.COV2.S.9 La triade clinique évocatrice de la VITT repose sur l’association d’une thrombose (veineuse ou artérielle), d’une thrombopénie et d’un antécédent récent de vaccination avec un vaccin à adénovirus anti-Covid- 19 (figure). Le diagnostic et le traitement précoce améliorent significativement le pronostic, mais le taux de létalité reste élevé, estimé à environ 22 %.10
Un cas a également été signalé après vaccination avec le vaccin adénoviral BBIBP-CorV (Sinopharm). Le mécanisme spécifique impliquerait une interaction entre le vecteur adénoviral et le PF4, entraînant la formation de complexes immuns anti-PF4, une activation plaquettaire et une cascade favorisant thrombose et thrombopénie.
Par rapport à la TIH, la VITT se distingue par des thromboses atypiques, notamment :
- thromboses veineuses cérébrales (TVC) [de 50 à 73 %] ;
- thromboses veineuses splanchniques (19 %) ;
- thromboses veineuses profondes (TVP) et embolies pulmonaires (EP) [de 20 à 30 %] ;
- thromboses artérielles (20 %) ;
- présence d’hémorragies cérébrales associées aux thromboses cérébrales.
Ces complications surviennent entre quatre et trente jours après la vaccination, avec une prédominance chez les moins de 55 ans, généralement en bonne santé et sans antécédents de thrombose, thrombophilie ou maladie auto-immune.10
Le diagnostic de la VITT repose sur une suspicion clinique fondée sur l’apparition de symptômes (céphalées persistantes, douleurs abdominales, dyspnée, signes neurologiques) dans les quatre à trente jours suivant la vaccination, une confirmation biologique, incluant un test ELISA pour détecter les anticorps anti-PF4, et des tests fonctionnels pour évaluer l’activation plaquettaire. Les tests rapides utilisés pour diagnostiquer la TIH ne sont pas adaptés, en raison d’un risque élevé de faux négatifs ; ainsi, toute suspicion doit être discutée avec un centre expert.
Selon les recommandations de l’International Society on Thrombosis and Haemostasis (ISTH),11 le diagnostic de VITT est défini par l’association d’une thrombopénie (taux inférieur à 150 G/L), de thromboses (souvent atypiques et multiples), d’une élévation marquée des D-dimères (taux supérieur à 4 000 ng/mL) et d’une détection d’anticorps anti-PF4 par test ELISA.11
La prise en charge de la VITT nécessite une approche multidisciplinaire urgente et repose sur une anticoagulation sans héparine : utilisation d’argatroban, fondaparinux ou AOD, administration d’immunoglobulines intraveineuses (IgIV) à forte dose (1 g/kg) pour neutraliser l’activation plaquettaire. De façon similaire à la TIH, il faut éviter strictement l’héparine, les anticoagulants de type antivitamine K (AVK) et la transfusion de plaquettes.12
Il est essentiel de mettre en perspective le risque extrêmement faible de VITT avec les complications thromboemboliques asso-ciées au Covid- 19. L’infection par le SARS-CoV- 2 est liée à un risque accru de TVP et d’EP (incidence 4 à 8 fois supérieure à celle de la VITT), de TVC, d’accidents vasculaires cérébraux ischémiques, d’infarctus du myocarde et de décès. Les données épidémiologiques ont montré que les vaccins, en particulier ceux à ARNm, réduisaient significativement ces risques chez les patients infectés par le SARS-CoV- 2. Les bénéfices de la vaccination dépassent donc largement les risques de complications rares, comme celui de VITT, notamment pour les vaccins à adénovirus.
Bien que la VITT soit principalement associée aux vaccins à vecteur adénoviral, des cas isolés ont été rapportés avec d’autres vaccins, suggérant une possible coïncidence avec une TIH auto-immune ou un syndrome VITT-like. Ainsi, un cas a été observé après BNT162b2 (Pfizer-BioNTech) et un autre après mRNA- 1273 (Moderna).8 Un cas a également été décrit après une vaccination contre les papillomavirus (Cervarix).13 Ces occurrences, bien que rares et surprenantes, nécessitent des investigations approfondies.
Syndromes VITT-like : premier cas décrit en France en 2010
Depuis 2022, plusieurs cas de thromboses multiples associées à une thrombopénie et à la présence d’anticorps anti-PF4 ont été signalés, sans exposition préalable à l’héparine ni à une vaccination. En particulier, des cas de syndrome thrombotique suivant une infection par adénovirus mais aussi associé à une gammapathie monoclonale de spécificité anti-PF4 ont été rapportés.14
Il apparaît, avec l’évolution des connaissances depuis les cas de VITT, que le premier cas de syndrome VITT-like post-infection à adénovirus a été décrit en France en 2010 chez une jeune fille de 13 ans.15 Cette patiente a développé une TVC, une thrombopénie et des anticorps anti-PF4/H activant les plaquettes dans un contexte infectieux, sans récidive ultérieure de l’infection. Ces syndromes VITT-like peuvent survenir à tout âge mais semblent plus fréquents chez les enfants dans des contextes infectieux.
Plus récemment, cinq cas ont été observés, en France et dans le monde, chez des patients souvent jeunes, atteints de gammapathies monoclonales et considérés initialement comme des gammapathies de signification indéterminée mais présentant des thromboses veineuses et/ou artérielles multiples, récidivantes et de sites atypiques, accompagnées de thrombopénie. La mise en évidence d’anticorps anti-PF4 activant les plaquettes chez ces patients et leur réponse aux traitements hématologiques ont permis d’identifier une nouvelle entité : les gammapathies monoclonales de signification thrombotique de type VITT-like.14 À l’heure actuelle, il n’existe pas de recommandations spécifiques concernant le traitement de cette entité. Notamment, l’utilité du traitement par héparine chez ces patients, qui présentent des thromboses graves, une thrombopénie et des anticorps anti-PF4, reste à déterminer. Dans tous les cas, il semble important de suspecter cette pathologie en cas de thrombose veineuse ou artérielle associée à une thrombopénie et de procéder à une recherche d’anticorps anti-PF4.
Une prise en charge urgente
TIH et VITT illustrent la complexité des interactions entre immunité et thrombose, partageant un mécanisme physiopathologique commun impliquant les anticorps anti-PF4 tout en différant par leur facteur déclenchant. Un diagnostic rapide et précis, associé à une anticoagulation sans héparine, reste essentiel pour prévenir les complications graves. L’émergence des syndromes VITT-like élargit la compréhension des mécanismes thrombo-immuns, soulignant l’importance de suspecter cette entité face à toute thrombose inexpliquée associée à une thrombopénie, afin d’adapter au plus vite la prise en charge thérapeutique.
2. Gruel Y, De Maistre E, Pouplard C, et al. Diagnosis and management of heparin-induced thrombocytopenia. Anaesth Crit Care Pain Med 2020;39(2):291‑310.
3. Gendron N, Helley D, Thaler J, et al. Relevance of anti-PF4/H antibodies and platelet activation in systemic inflammatory diseases and thrombosis disorders: Insight from the COVID-19 pandemic. Res Pract Thromb Haemost 2025;9(1):102701.
4. Gonthier MC, Gendron N, Eloy P, et al. Heparin-induced thrombocytopenia diagnosis: A retrospective study comparing heparin-induced platelet activation test to 14 C-serotonin release assay. TH Open Companion J Thromb Haemost 2021;5(4):e507‑12.
5. Carre J, Guerineau H, Le Beller C, et al. Direct oral anticoagulants as successful treatment of heparin-induced thrombocytopenia: A parisian retrospective case series. Front Med 2021;8:713649.
6. Klok FA, Pai M, Huisman MV, et al. Vaccine-induced immune thrombotic thrombocytopenia. Lancet Haematol 2022;9(1):e73‑80.
7. Smadja DM, Yue QY, Chocron R, et al. Vaccination against COVID-19: Insight from arterial and venous thrombosis occurrence using data from VigiBase. Eur Respir J 2021;58(1):2100956.
8. Cines DB, Greinacher A. Vaccine-induced immune thrombotic thrombocytopenia. Blood 2023;141(14):1659‑65.
9. Greinacher A, Thiele T, Warkentin TE, et al. Thrombotic thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med 2021;384(22):2092‑101.
10. Pavord S, Scully M, Hunt BJ, et al. Clinical features of vaccine-induced immune thrombocytopenia and thrombosis. N Engl J Med 2021;385(18):1680‑9.
11. Nazy I, Sachs UJ, Arnold DM, et al. Recommendations for the clinical and laboratory diagnosis of VITT against COVID‐19: Communication from the ISTH SSC Subcommittee on Platelet Immunology. J Thromb Haemost 2021;19(6):1585‑8.
12. Berezne A, Bougon D, Blanc‐Jouvan F, et al. Deterioration of vaccine‐induced immune thrombotic thrombocytopenia treated by heparin and platelet transfusion: Insight from functional cytometry and serotonin release assay. Res Pract Thromb Haemost 2021;5(6):e12572.
13. Johansen S, Lægreid IJ, Ernstsen SL, et al. Thrombosis and thrombocytopenia after HPV vaccination. J Thromb Haemost 2022;20(3):700‑4.
14. Wang JJ, Schönborn L, Warkentin TE, et al. Antibody fingerprints linking adenoviral Anti-PF4 disorders. N Engl J Med 2024;390(19):1827‑9.
15. Desprez D, Desprez P, Tardy B, et al. Anti-PF4 antibodies and thrombophlebitis in a child with cerebral venous thrombosis. Ann Biol Clin (Paris) 2010;68(6):725‑8.