Les varices correspondent à un trouble veineux chronique fréquent qui, selon les études, touche 20 à 60 % des adultes dans la population générale des pays industrialisés.1-9 Cependant, la fréquence de la maladie varie considérablement selon les zones géographiques, avec une incidence comparativement plus faible de 19 % dans le groupe ethnique asiatique. Les varices sont souvent considérées comme un problème esthétique. Cependant, elles peuvent entraîner de graves complications, notamment des douleurs, une gêne, des crampes, des ulcérations, une mauvaise qualité de vie, un absentéisme, voire le décès.
La maladie veineuse chronique (MVC) est définie comme toute anomalie chronique morphologique ou physiologique du système ou de la fonction veineuse responsable de symptômes ou de signes nécessitant des investigations ou une prise en charge. Le terme d’insuffisance veineuse chronique (IVC) est réservé aux formes avancées de la MVC correspondant aux classes C3 à C6 de la classification CEAP (clinique, étiologique, anatomique, physiopathologique), caractérisant les patients qui présentent un œdème, des troubles trophiques ou un ulcère veineux (lire l’article « Diagnostic de la maladie variqueuse »,page 738 ).
Les varices ou veines variqueuses, classe C2 de la CEAP, sont des veines sous-cutanées refluantes dont le diamètre est supérieur à 3 mm en position debout. Les varices sont habituellement sinueuses et le siège d’un reflux pathologique. Elles peuvent intéresser les troncs saphènes, leurs tributaires et les réseaux non saphènes. Selon la Haute Autorité de santé, 35 % des varices touchent les troncs saphènes et 65 % les troncs non saphènes.
En France, les manifestations de l’insuffisance veineuse concerneraient au moins 18 millions de personnes, dont 10 millions auraient des varices.10 Il existe une corrélation significative entre la dégradation de la qualité de vie et la sévérité de la maladie veineuse d’une part, et son coût d’autre part. Ce dernier est estimé entre 1 à 3 % du budget de la santé des pays industrialisés.11
La maladie veineuse chronique (MVC) est définie comme toute anomalie chronique morphologique ou physiologique du système ou de la fonction veineuse responsable de symptômes ou de signes nécessitant des investigations ou une prise en charge. Le terme d’insuffisance veineuse chronique (IVC) est réservé aux formes avancées de la MVC correspondant aux classes C3 à C6 de la classification CEAP (clinique, étiologique, anatomique, physiopathologique), caractérisant les patients qui présentent un œdème, des troubles trophiques ou un ulcère veineux (lire l’article « Diagnostic de la maladie variqueuse »,
Les varices ou veines variqueuses, classe C2 de la CEAP, sont des veines sous-cutanées refluantes dont le diamètre est supérieur à 3 mm en position debout. Les varices sont habituellement sinueuses et le siège d’un reflux pathologique. Elles peuvent intéresser les troncs saphènes, leurs tributaires et les réseaux non saphènes. Selon la Haute Autorité de santé, 35 % des varices touchent les troncs saphènes et 65 % les troncs non saphènes.
En France, les manifestations de l’insuffisance veineuse concerneraient au moins 18 millions de personnes, dont 10 millions auraient des varices.10 Il existe une corrélation significative entre la dégradation de la qualité de vie et la sévérité de la maladie veineuse d’une part, et son coût d’autre part. Ce dernier est estimé entre 1 à 3 % du budget de la santé des pays industrialisés.11
Pathogénie mal élucidée
Les facteurs influençant la formation des varices ne sont pas entièrement compris. Des études épidémiologiques ont établi de multiples facteurs de risque tels que l’âge, le sexe féminin, la grossesse, l’obésité et les antécédents de thrombose veineuse profonde. Plusieurs autres facteurs supposés restent non confirmés. L’importante prédominance féminine dans les séries cliniques, sans doute liée à un biais de sélection, est beaucoup moins nette dans la population générale, et est principalement liée à un début plus précoce de la maladie en rapport avec les grossesses. Il faut même noter que, pour les varices tronculaires, la plupart des études ne trouvent pas de différence notable entre hommes et femmes. La maladie variqueuse présente également une composante familiale évidente, mais les études génétiques sont peu nombreuses et donnent des résultats contradictoires.12
La pathogénie des varices est encore loin d’être élucidée ; deux groupes de facteurs se conjuguent pour conduire à l’augmentation de diamètre et de longueur qui caractérise la veine variqueuse :
Les femmes auraient toutefois plus de risque d’avoir des varices que les hommes.13 Des études longitudinales suggèrent que les professions exigeant une station debout prolongée s’accompagnent d’une augmentation du risque d’interventions chirurgicales et d’hospitalisations subséquentes pour des varices.14
Les options thérapeutiques étant nombreuses, l’analyse des besoins du patient, la compréhension de ses motivations et de ses attentes en matière de traitement sont des préalables indispensables pour orienter au mieux les explorations et les choix thérapeutiques.15
La pathogénie des varices est encore loin d’être élucidée ; deux groupes de facteurs se conjuguent pour conduire à l’augmentation de diamètre et de longueur qui caractérise la veine variqueuse :
- la faiblesse de la paroi veineuse, ou son excès de compliance, semble être le facteur prédominant. Elle pourrait être constitutionnelle, rendant compte du facteur familial, mais les altérations acquises jouent aussi un rôle. Ainsi, l’influence des œstrogènes, qui favorisent le relâchement des fibres musculaires lisses, est reconnue au moins pendant la grossesse. Il en est de même pour l’altération de la compliance veineuse par l’intermédiaire d’une fibrose hétérogène, liée à l’âge ;
- les désordres hémodynamiques jouent au moins un rôle aggravant : des reflux liés à l’insuffisance valvulaire peuvent être favorisés par les à-coups de pression excessive occasionnés par certaines activités professionnelles et sportives, mais dépendent essentiellement du nombre et de la qualité des valvules qui peuvent être hypoplasiques ou aplasiques, comme dans l’insuffisance veineuse profonde primitive, ou simplement trop souples et facilement forcées.
Les femmes auraient toutefois plus de risque d’avoir des varices que les hommes.13 Des études longitudinales suggèrent que les professions exigeant une station debout prolongée s’accompagnent d’une augmentation du risque d’interventions chirurgicales et d’hospitalisations subséquentes pour des varices.14
Les options thérapeutiques étant nombreuses, l’analyse des besoins du patient, la compréhension de ses motivations et de ses attentes en matière de traitement sont des préalables indispensables pour orienter au mieux les explorations et les choix thérapeutiques.15
Symptômes et signes cliniques variés pour la maladie veineuse chronique
Les troubles veineux chroniques englobent l’ensemble des anomalies morphologiques et fonctionnelles affectant le système veineux, qu’elles produisent ou non des symptômes.
La MVC désigne toute anomalie morphologique ou fonctionnelle de longue durée affectant le système veineux et se manifestant par des symptômes et/ou des signes indiquant la nécessité d’une investigation et d’un traitement.
Les symptômes comprennent la douleur, les élancements, l’oppression, la lourdeur, la sensation de gonflement, la fatigue musculaire, les démangeaisons, les crampes, les sensations de brûlure, les jambes sans repos, les fourmillements ou la claudication veineuse, ainsi que les symptômes secondaires et l’insatisfaction esthétique.
Les signes cliniques comprennent les télangiectasies, les veines réticulaires et variqueuses ou l’œdème, ainsi que des modifications cutanées telles que la pigmentation, la lipodermatosclérose, l’atrophie blanche, la corona phlebectatica, l’eczéma ou l’ulcération.
La MVC est généralement causée par des anomalies primaires de la paroi veineuse et/ou des valvules, ou par des anomalies secondaires résultant d’une thrombose veineuse profonde (TVP) qui peut entraîner un reflux, une obstruction, ou les deux à la fois.
L’insuffisance veineuse chronique (IVC) est un terme réservé aux MCV avancées dues à des anomalies fonctionnelles veineuses produisant des œdèmes, des altérations cutanées ou des ulcérations veineuses.
L’anamnèse et l’examen clinique peuvent ne pas suffire à préciser la nature et l’étendue des anomalies sous-jacentes. Par conséquent, plusieurs techniques de diagnostic ont été mises au point pour définir l’étendue anatomique et la gravité fonctionnelle du reflux et de l’obstruction veineux, ainsi que le dysfonctionnement de la pompe musculaire du mollet.
La MVC désigne toute anomalie morphologique ou fonctionnelle de longue durée affectant le système veineux et se manifestant par des symptômes et/ou des signes indiquant la nécessité d’une investigation et d’un traitement.
Les symptômes comprennent la douleur, les élancements, l’oppression, la lourdeur, la sensation de gonflement, la fatigue musculaire, les démangeaisons, les crampes, les sensations de brûlure, les jambes sans repos, les fourmillements ou la claudication veineuse, ainsi que les symptômes secondaires et l’insatisfaction esthétique.
Les signes cliniques comprennent les télangiectasies, les veines réticulaires et variqueuses ou l’œdème, ainsi que des modifications cutanées telles que la pigmentation, la lipodermatosclérose, l’atrophie blanche, la corona phlebectatica, l’eczéma ou l’ulcération.
La MVC est généralement causée par des anomalies primaires de la paroi veineuse et/ou des valvules, ou par des anomalies secondaires résultant d’une thrombose veineuse profonde (TVP) qui peut entraîner un reflux, une obstruction, ou les deux à la fois.
L’insuffisance veineuse chronique (IVC) est un terme réservé aux MCV avancées dues à des anomalies fonctionnelles veineuses produisant des œdèmes, des altérations cutanées ou des ulcérations veineuses.
L’anamnèse et l’examen clinique peuvent ne pas suffire à préciser la nature et l’étendue des anomalies sous-jacentes. Par conséquent, plusieurs techniques de diagnostic ont été mises au point pour définir l’étendue anatomique et la gravité fonctionnelle du reflux et de l’obstruction veineux, ainsi que le dysfonctionnement de la pompe musculaire du mollet.
Plusieurs classifications cliniques
La classification CEAP a été élaborée lors d’une réunion de consensus d’experts internationaux en 1994. Elle a été mise à jour en 2004, puis en 2020 (lire l’article « Diagnostic de la maladie variqueuse », page 738 .
Elle est fondée sur les signes cliniques, l’étiologie, l’anatomie et la pathologie (reflux et obstruction) des troubles veineux chroniques.
Les patients présentant des veines réticulaires (veines sous-cutanées d’un diamètre compris entre 1 et moins de 3 mm) et des télangiectasies (veines « d’araignée » sous-cutanées d’un diamètre inférieur à 1 mm) appartiennent à la classe C1. Les varices sont des veines sous-cutanées dilatées d’un diamètre supérieur à 3 mm et les patients atteints de varices appartiennent à la classe C2 de la CEAP. La MVC est définie comme les classes C2 à C6 de la CEAP, l’IVC comme les classes C3 à C6 de la CEAP.16
Chaque classe clinique comporte un indice indiquant la présence (s) ou l’absence (a) de symptômes. Les plus fréquents d’entre eux ont été identifiés et comprennent la lourdeur des jambes, la douleur, le gonflement, les élancements et les démangeaisons. La classification CEAP est un instrument descriptif conçu pour catégoriser le membre affecté et non une échelle quantitative de gravité ou un système de notation, ni une mesure des résultats reflétant les changements au fil du temps.17
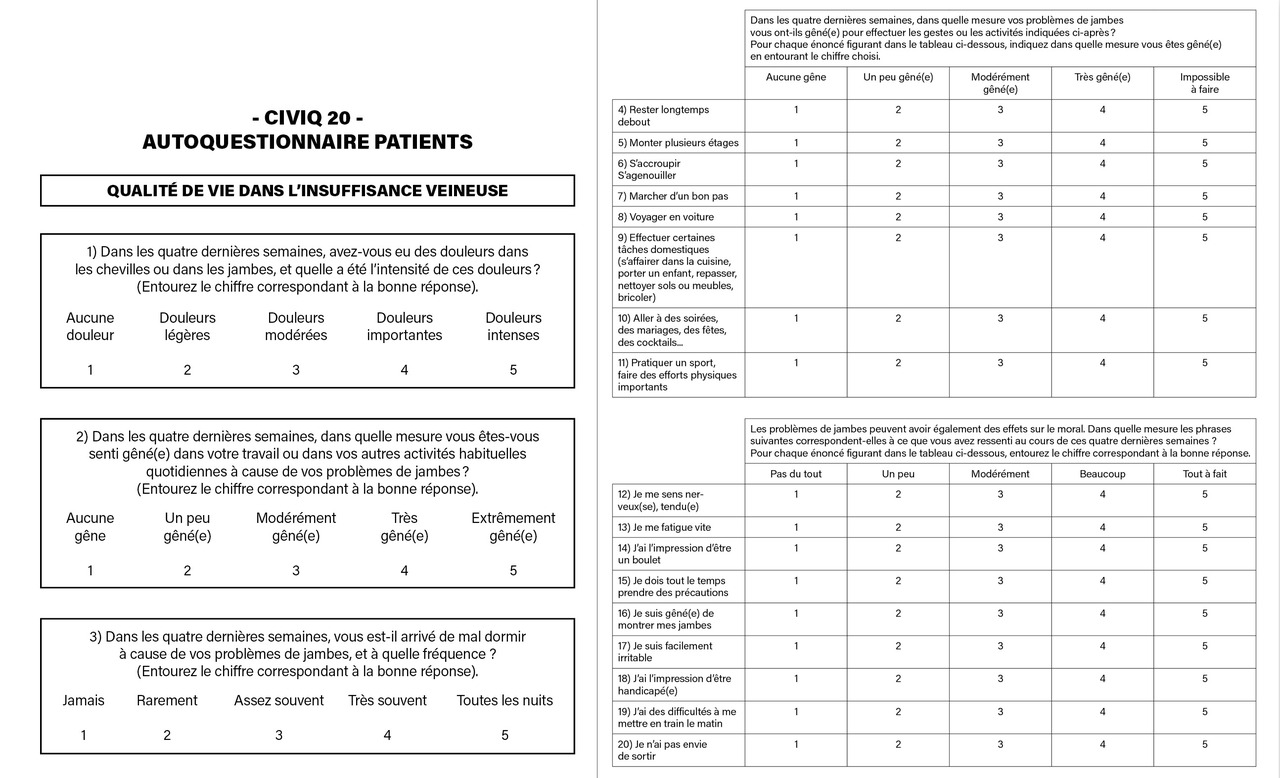
En complément de la classification CEAP, l’usage du score de sévérité clinique VCSS (venous clinical severity score) [tableau ] est recommandé pour les patients ayant des troubles veineux chroniques afin d’évaluer la gravité clinique et les résultats après réalisation d’un traitement. Le VCSS révisé est un instrument d’évaluation physique utile pour décrire la gravité des troubles veineux chroniques : il est sensible aux changements de symptomatologie dans le temps et permet de documenter la réponse au traitement. Le VCSS ainsi que la classification CEAP ont été largement adoptés dans les directives internationales. Le VCSS comprend dix catégories, chacune classée sur une échelle de 0 à 3 : douleur, varices, œdème, pigmentation, inflammation, induration, présence, durée et taille des ulcères et utilisation de la thérapie par compression. Le VCSS est validé et il existe une corrélation entre VCSS, CEAP, chronic venous insufficiency questionnaire (CIVIQ) modifié (instrument de mesure des résultats rapportés par les patients) [figure ] et les résultats de l’écho-Doppler veineux. La corrélation la plus forte concerne la douleur (r = 0,55, p < 0,0001). Une bonne corrélation a également été trouvée dans la capacité du VCSS et de l’échelle de Villalta-Prandoni18 à détecter la MVC post-thrombotique légère à modérée. D’autres classifications, comme le score de Widmer ou l’échelle MOS SF-36, peuvent être utilisées.
Elle est fondée sur les signes cliniques, l’étiologie, l’anatomie et la pathologie (reflux et obstruction) des troubles veineux chroniques.
Les patients présentant des veines réticulaires (veines sous-cutanées d’un diamètre compris entre 1 et moins de 3 mm) et des télangiectasies (veines « d’araignée » sous-cutanées d’un diamètre inférieur à 1 mm) appartiennent à la classe C1. Les varices sont des veines sous-cutanées dilatées d’un diamètre supérieur à 3 mm et les patients atteints de varices appartiennent à la classe C2 de la CEAP. La MVC est définie comme les classes C2 à C6 de la CEAP, l’IVC comme les classes C3 à C6 de la CEAP.16
Chaque classe clinique comporte un indice indiquant la présence (s) ou l’absence (a) de symptômes. Les plus fréquents d’entre eux ont été identifiés et comprennent la lourdeur des jambes, la douleur, le gonflement, les élancements et les démangeaisons. La classification CEAP est un instrument descriptif conçu pour catégoriser le membre affecté et non une échelle quantitative de gravité ou un système de notation, ni une mesure des résultats reflétant les changements au fil du temps.17
En complément de la classification CEAP, l’usage du score de sévérité clinique VCSS (venous clinical severity score) [
Évolution progressive
Plusieurs études épidémiologiques prospectives ont démontré que l’évolution des MVC est progressive.
Dans l’étude de Bochum,19 740 enfants âgés de 10 à 12 ans sans MVC ont été examinés tous les cinq ans jusqu’à un total de vingt ans. L’examen clinique a été combiné à des examens écho-Doppler et à une photopléthysmographie du temps de remplissage pour le reflux. Les principales observations ont été les suivantes : augmentation progressive de la présence de reflux de 2,4 à 20,6 % accompagnée d’un accroissement de la fréquence des varices tronculaires de 0 à 11 % ; apparition d’une varice tronculaire précédée par un reflux dans la veine tronculaire ; localisation initiale du reflux principalement aux jonctions saphéno-fémorales et saphéno-poplitées ; début du reflux vers la puberté ; et risque de 30 % de développer des varices tronculaires dans les quatre années qui suivent en cas de reflux préclinique.
Dans l’étude d’Edinburgh,20 4,3 % des sujets atteints de MVC ont évolué chaque année vers une classe clinique CEAP plus sévère.
Une autre étude prospective avec suivi pendant cinq ans du membre controlatéral non atteint de 73 patients opérés pour des varices a montré que des varices et un reflux se développaient chez 52 % d’entre eux avec une détérioration associée de la classe CEAP. La progression était plus rapide chez les patients ayant des antécédents de TVP.21
Une étude de suivi pendant cinq ans portant sur 1 560 patients ayant des symptômes de MVC depuis un an a montré qu’une ulcération se développait chez 3,6 % des 1 435 patients sans antécédent de TVP et chez 14,4 % des 125 patients avec antécédents de TVP (p < 0,05).22
Une autre étude cas-témoins a démontré que la progression était encore plus rapide chez les patients ayant un antécédent de TVP proximale.23
Dans l’étude de Bochum,19 740 enfants âgés de 10 à 12 ans sans MVC ont été examinés tous les cinq ans jusqu’à un total de vingt ans. L’examen clinique a été combiné à des examens écho-Doppler et à une photopléthysmographie du temps de remplissage pour le reflux. Les principales observations ont été les suivantes : augmentation progressive de la présence de reflux de 2,4 à 20,6 % accompagnée d’un accroissement de la fréquence des varices tronculaires de 0 à 11 % ; apparition d’une varice tronculaire précédée par un reflux dans la veine tronculaire ; localisation initiale du reflux principalement aux jonctions saphéno-fémorales et saphéno-poplitées ; début du reflux vers la puberté ; et risque de 30 % de développer des varices tronculaires dans les quatre années qui suivent en cas de reflux préclinique.
Dans l’étude d’Edinburgh,20 4,3 % des sujets atteints de MVC ont évolué chaque année vers une classe clinique CEAP plus sévère.
Une autre étude prospective avec suivi pendant cinq ans du membre controlatéral non atteint de 73 patients opérés pour des varices a montré que des varices et un reflux se développaient chez 52 % d’entre eux avec une détérioration associée de la classe CEAP. La progression était plus rapide chez les patients ayant des antécédents de TVP.21
Une étude de suivi pendant cinq ans portant sur 1 560 patients ayant des symptômes de MVC depuis un an a montré qu’une ulcération se développait chez 3,6 % des 1 435 patients sans antécédent de TVP et chez 14,4 % des 125 patients avec antécédents de TVP (p < 0,05).22
Une autre étude cas-témoins a démontré que la progression était encore plus rapide chez les patients ayant un antécédent de TVP proximale.23
Quelques facteurs de risque identifiés
Les antécédents familiaux de MCV, le sexe féminin, les épisodes antérieurs de TVP ou de thrombose veineuse superficielle, un mode de vie incluant des occupations en position debout et une sédentarité, l’obésité, la multiparité sont des facteurs de risque associés à la progression des MCV.
Références
1. Carpentier PH, Maricq HR, Biro C, Poncot-Makinen CO, Franco A. Prevalence, risk factors, and clinical patterns of chronic venous disorders of lower limbs: A population-based study in France. J Vasc Surg 2004;40(4):650-9.
2. Coon WW, Willis PW, Keller JB. Venous thromboembolism and other venous disease in the Tecumseh Community Health Study. Circulation 1973;48:839-46.
3. Da Silva A, Widmer LK, Martin H, Mall T, Glaus L, Schneider M. Varicose veins and chronic venous insufficiency. Vasa 1974;3(2):118-25.
4. Beaglehole R, Prior IA, Salmond CE, Davidson F. Varicose veins in the South Pacific. Int J Epid 1975;4(4):295-9.
5. Evans CJ, Fowkes FG, Ruckley CV, Lee AJ. Prevalence of varicose veins and chronic venous insufficiency in men and women in the general population: Edinburgh Vein Study. J Epidemiol Community Health 1999;53(3):149-53.
6. Laurikka JO, Sisto T, Tarkka MR, Auvinen O, Hakama M. Risk indicators for varicose veins in forty- to sixty-year-olds in the Tampere varicose vein study. World J Surg 2002;26(6):648-51.
7. Criqui MH, Jamosmos M, Fronek A, Denenberg JO, Langer RD, Bergan J, et al. Chronic venous disease in an ethnically diverse population: The San Diego population study. Am J Epidemiol 2003;158(5):448-56.
8. Pannier-Fischer F, Rabe E. Epidemiologie der chronischen Venenerkrankungen. Hautarzt 2003;54(11):1037-44.
9. Zolotukhin IA, Seliverstov EI, Shevtsov YN, Avakiants IP, Nikishkov AS, Tatarintsey AM, et al. Prevalence and risk factors for chronic venous disease in the general Russian population. Eur J Vasc Endovasc Surg 2017;54(6):752-8.
10. L’insuffisance veineuse. Le Moniteur des Pharmacies 2005;2575.
11. Rabe E, Pannier F. Societal costs of chronic venous disease in CEAP c4, c5, c6 disease. Phlebology 2010;25(Suppl.1):64-7.
12. Carpentier P. Chapitre 97 : Épidémiologie et pathogénie. Traité de médecine vasculaire. Elsevier Masson 2021.
13. Preziosi P, Galan P, Aissa M, Hercberg S, Roccalon H. Prevalence of venous insufficiency in French adults of SUVIMAX cohort. Int Angiol 1999;18(2):171-5.
14. Shakya R, Karmacharya RM, Shrestha R, Shrestha A. Varicose veins, and its risk factors among nurses at Dhulikhel hospital: A cross sectional study. BMC Nurs 2020;19(1):8.
15. Menez C. Chapitre 98 : Clinique, stratégie des explorations. Traité de médecine vasculaire. Elsevier Masson 2021.
16. Gloviczki P, Lawrence PF, Wasan SM, Meissner MH, Almeida J, Brown KR, et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. Endorsed by the Society of Interventional Radiology and the Society for Vascular Medicine. J Vasc Surg Venous Lymphat Disorders 2024;12(1):101670.
17. Eklof B, Rutherford RB, Bergan JJ, Carpentier PH, Gloviczki P, Kistner RL, et al. Revision of the CEAP classification for chronic venous disorders: Consensus statement. J Vasc Surg 2004;40(6):1248-52.
18. Jayaraj A, Meissner MH. A comparison of Villalta-Prandoni scale and venous clinical severity score in the assessment of post thrombotic syndrome. Ann Vasc Surg 2014;28:313-7.
19. Shultz-Ehrenburg U, Reich-Schupke S, Robak-Pawelczyk B, Rudolph T, Moll C, Weindorf N, et al. Prospective epidemiological study on the beginning of varicose veins. Phlebologie 2009;38:17-25.
20. Lee AJ, Robertson LA, Boghossian SM, Allan PL, Ruckley CV, Fowkes FG, et al. Progression of varicose veins and chronic venous insufficiency in the general population in the Edinburgh Vein Study. J Vasc Surg Venous Lymphat Disord 2015;3:18-26.
21. Kostas TI, Ioannou CV, Drygiannakis I, Georgakarakos E, Kounos C, Tsetis D, et al. Chronic venous disease progression and modification of predisposing factors. J Vasc Surg 2010;51:900-7.
22. Lozano Sánchez FS, González-Porras JR, Díaz Sánchez S, Marinel Lo Roura J, Sánchez Nevarez I, Carrasco E, et al.; C-VIVES Study investigators. Negative impact of deep venous thrombosis on chronic venous disease. Thromb Res 2013;131(4):e123-6.
23. Labropoulos N, Gasparis AP, Pefanis D, Leon LR Jr, Tassiopoulos AK. Secondary chronic venous disease progresses faster than primary. J Vasc Surg 2009;49:704-10.
2. Coon WW, Willis PW, Keller JB. Venous thromboembolism and other venous disease in the Tecumseh Community Health Study. Circulation 1973;48:839-46.
3. Da Silva A, Widmer LK, Martin H, Mall T, Glaus L, Schneider M. Varicose veins and chronic venous insufficiency. Vasa 1974;3(2):118-25.
4. Beaglehole R, Prior IA, Salmond CE, Davidson F. Varicose veins in the South Pacific. Int J Epid 1975;4(4):295-9.
5. Evans CJ, Fowkes FG, Ruckley CV, Lee AJ. Prevalence of varicose veins and chronic venous insufficiency in men and women in the general population: Edinburgh Vein Study. J Epidemiol Community Health 1999;53(3):149-53.
6. Laurikka JO, Sisto T, Tarkka MR, Auvinen O, Hakama M. Risk indicators for varicose veins in forty- to sixty-year-olds in the Tampere varicose vein study. World J Surg 2002;26(6):648-51.
7. Criqui MH, Jamosmos M, Fronek A, Denenberg JO, Langer RD, Bergan J, et al. Chronic venous disease in an ethnically diverse population: The San Diego population study. Am J Epidemiol 2003;158(5):448-56.
8. Pannier-Fischer F, Rabe E. Epidemiologie der chronischen Venenerkrankungen. Hautarzt 2003;54(11):1037-44.
9. Zolotukhin IA, Seliverstov EI, Shevtsov YN, Avakiants IP, Nikishkov AS, Tatarintsey AM, et al. Prevalence and risk factors for chronic venous disease in the general Russian population. Eur J Vasc Endovasc Surg 2017;54(6):752-8.
10. L’insuffisance veineuse. Le Moniteur des Pharmacies 2005;2575.
11. Rabe E, Pannier F. Societal costs of chronic venous disease in CEAP c4, c5, c6 disease. Phlebology 2010;25(Suppl.1):64-7.
12. Carpentier P. Chapitre 97 : Épidémiologie et pathogénie. Traité de médecine vasculaire. Elsevier Masson 2021.
13. Preziosi P, Galan P, Aissa M, Hercberg S, Roccalon H. Prevalence of venous insufficiency in French adults of SUVIMAX cohort. Int Angiol 1999;18(2):171-5.
14. Shakya R, Karmacharya RM, Shrestha R, Shrestha A. Varicose veins, and its risk factors among nurses at Dhulikhel hospital: A cross sectional study. BMC Nurs 2020;19(1):8.
15. Menez C. Chapitre 98 : Clinique, stratégie des explorations. Traité de médecine vasculaire. Elsevier Masson 2021.
16. Gloviczki P, Lawrence PF, Wasan SM, Meissner MH, Almeida J, Brown KR, et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. Endorsed by the Society of Interventional Radiology and the Society for Vascular Medicine. J Vasc Surg Venous Lymphat Disorders 2024;12(1):101670.
17. Eklof B, Rutherford RB, Bergan JJ, Carpentier PH, Gloviczki P, Kistner RL, et al. Revision of the CEAP classification for chronic venous disorders: Consensus statement. J Vasc Surg 2004;40(6):1248-52.
18. Jayaraj A, Meissner MH. A comparison of Villalta-Prandoni scale and venous clinical severity score in the assessment of post thrombotic syndrome. Ann Vasc Surg 2014;28:313-7.
19. Shultz-Ehrenburg U, Reich-Schupke S, Robak-Pawelczyk B, Rudolph T, Moll C, Weindorf N, et al. Prospective epidemiological study on the beginning of varicose veins. Phlebologie 2009;38:17-25.
20. Lee AJ, Robertson LA, Boghossian SM, Allan PL, Ruckley CV, Fowkes FG, et al. Progression of varicose veins and chronic venous insufficiency in the general population in the Edinburgh Vein Study. J Vasc Surg Venous Lymphat Disord 2015;3:18-26.
21. Kostas TI, Ioannou CV, Drygiannakis I, Georgakarakos E, Kounos C, Tsetis D, et al. Chronic venous disease progression and modification of predisposing factors. J Vasc Surg 2010;51:900-7.
22. Lozano Sánchez FS, González-Porras JR, Díaz Sánchez S, Marinel Lo Roura J, Sánchez Nevarez I, Carrasco E, et al.; C-VIVES Study investigators. Negative impact of deep venous thrombosis on chronic venous disease. Thromb Res 2013;131(4):e123-6.
23. Labropoulos N, Gasparis AP, Pefanis D, Leon LR Jr, Tassiopoulos AK. Secondary chronic venous disease progresses faster than primary. J Vasc Surg 2009;49:704-10.