Alors que le cancer colorectal est la deuxième cause de mortalité par cancer en France, son dépistage – le plus performant de tous les dépistages de cancer – est un échec.
S’il n’était qu’un cancer à dépister, ce serait le cancer colorectal ! Il est parmi les cancers dépistables le plus fréquent, le plus grave, celui qui concerne le plus grand nombre, qui dispose d’une très longue phase précancéreuse, dont l’efficacité du dépistage repose sur le meilleur niveau de preuve (4 essais contrôlés randomisés), dont le dépistage n’expose pratiquement pas au sur-diagnostic, dont le traitement des formes précoces est parfaitement codifié et non mutilant, et dont les rapports bénéfice-risque et coût-efficacité sont les meilleurs. Pourtant, le dépistage du cancer colorectal est le moins prescrit des dépistages des cancers en France (tableau 1) .1-6 L’Assurance maladie a estimé que près de 50 % des personnes âgées de 50 à 74 ans avaient bénéficié d’un dépistage du cancer colorectal ou d’une coloscopie de diagnostic en 2012 (56,2 % en Alsace en 2016-2017). Il est paradoxal que le dépistage du cancer de la prostate, non recommandé, bénéficie du meilleur taux de couverture (71 %).
Avec 43 000 nouveaux cas et 18 000 décès en 2015 en France, le cancer colorectal est le 3e cancer le plus fréquent et la 2e cause de mortalité par cancer.7 Dans notre pays, la mortalité par cancer colorectal diminue de plus de 1 % par an depuis les années 1980, principalement du fait des progrès thérapeutiques, et son incidence reste globalement stable malgré une ébauche de diminution de 0,3 % par an depuis 2005.7 Bon nombre de ces décès et de ces nouveaux cas pourraient être évités. Plusieurs essais contrôlés randomisés ont démontré que le dépistage périodique par recherche de sang occulte dans les selles et par recto- sigmoïdoscopie permettait de diminuer la mortalité par cancer colorectal, voire son incidence.8 Quatre essais contrôlés randomisés évaluant le dépistage par coloscopie sont en cours.
Cet article a pour objectif d’analyser les raisons pour lesquelles le dépistage du cancer colorectal est, à l’heure actuelle, un échec en France et de proposer quelques pistes d’amélioration.
Avec 43 000 nouveaux cas et 18 000 décès en 2015 en France, le cancer colorectal est le 3e cancer le plus fréquent et la 2e cause de mortalité par cancer.7 Dans notre pays, la mortalité par cancer colorectal diminue de plus de 1 % par an depuis les années 1980, principalement du fait des progrès thérapeutiques, et son incidence reste globalement stable malgré une ébauche de diminution de 0,3 % par an depuis 2005.7 Bon nombre de ces décès et de ces nouveaux cas pourraient être évités. Plusieurs essais contrôlés randomisés ont démontré que le dépistage périodique par recherche de sang occulte dans les selles et par recto- sigmoïdoscopie permettait de diminuer la mortalité par cancer colorectal, voire son incidence.8 Quatre essais contrôlés randomisés évaluant le dépistage par coloscopie sont en cours.
Cet article a pour objectif d’analyser les raisons pour lesquelles le dépistage du cancer colorectal est, à l’heure actuelle, un échec en France et de proposer quelques pistes d’amélioration.
Les vrais chiffres de la mortalité évitable mis en perspective
Certains ont estimé le nombre de décès annuels évités en France par le programme de dépistage organisé du cancer colorectal à environ 2 500 avec le test Hemoccult et 5 400 avec le test immunologique.9 Ces chiffres sont très surévalués. Le chiffre de 2 500 correspond à une réduction de 15 % appliquée aux 17 000 décès par cancer colorectal annuels observés en France en 2012.1, 10 Cependant, le programme ne s’adresse qu’à la population de 50 à 74 ans à risque moyen de cancer colorectal, soit environ 80 % de cette population. Si l’on considère que le bénéfice du dépistage organisé perdure jusqu’à 84 ans, la réduction de mortalité de 15 % s’applique à 80 % des 12 000 décès observés dans la tranche d’âge 50-84 ans, soit 1 440 décès annuels. Cependant, la réduction de 15 % est le gain observé dans les essais avec des taux de participation de 53 à 67 % en premières campagnes.10 Ces résultats n’ont à ce jour jamais été reproduits en population générale. Le programme pilote écossais n’a observé qu’une réduction de mortalité de 10 % malgré une participation dépassant 60 %.11 Le taux de participation du programme français est nettement inférieur, situé entre 30 et 35 %. En conséquence, la réduction de mortalité devrait être notablement inférieure aux 15 % des essais et se limiter à 7 %, voire moins.12 Si l’on applique une réduction de 7 % aux 9 600 décès observés en 2012 chez les personnes à risque moyen des tranches d’âge 50-84 ans, le nombre de décès annuels évités grâce au dépistage organisé du cancer colorectal par Hemoccult est estimé à 700 (672 exactement). Il n’y a pas de données permettant de chiffrer le nombre de décès évités avec le test immunologique. Avec une participation inchangée, comme c’est le cas à ce jour, ce nombre ne devrait pas dépasser le double de celui obtenu avec Hemoccult, soit 1 400 par an. Ce nombre de décès évités, inférieur aux prévisions, reste considérable. Il est moindre que celui des décès pouvant être évités par une réduction des comportements à risque tels que tabagisme, alcoolisme et conduites routières dangereuses (mortalité évitable liée aux pratiques de prévention primaire), mais supérieur au nombre de décès évités par cancers pour lesquels un dépistage est recommandé (tableau 1) . Le Centre international de recherche sur le cancer vient d’estimer que près de la moitié (48,6 %) des cancers colorectaux étaient attribuables au mode de vie et à l’environnement en France métropolitaine en 2015, soit 19 280 cancers potentiellement évitables : principalement en relation avec l’alimentation (8 839), la consommation d’alcool (6 654), le surpoids et l’obésité (4 436) et le tabagisme (2 608). De plus, la prise régulière d’aspirine a permis d’éviter 1 743 nouveaux cas de cancer colorectal (http://gco.iarc.fr/resources/paf-france_fr.php).
Une efficacité modeste du dépistage par recherche de sang occulte dans les selles
Le dépistage biennal par test au gaïac (Hemoccult) avait une efficacité modeste : à condition d’une participation suffisante, il permettait de réduire de 15 % le risque de décéder d’un cancer colorectal dans la population invitée, sans effet sur son incidence.10 Le test immunologique quantitatif (OC-Sensor) [ fig. 1 ] , qui a remplacé le test au gaïac depuis 2015, serait plus efficace. Il permettrait de réduire la mortalité par cancer colorectal de 13 à 52 % selon les études et de diminuer son incidence de 22 %.13 Lors du passage du test au gaïac au test immunologique, le taux de positivité a doublé (4,6 %) et le rendement des coloscopies a augmenté significativement. La valeur prédictive positive du test OC-Sensor au seuil de 30 μg/g est de 40 % pour une néoplasie avancée* (6 % pour un cancer invasif et 34% pour un adénome avancé, carcinome in situ inclus). À participation égale, le nouveau test devrait permettre de dépister 2,5 fois plus de cancers et 3,7 fois plus d’adénomes avancés que l’ancien test, au prix de 2,4 fois plus de coloscopies.14
Une participation bien trop faible
La réduction de la mortalité induite par un programme est fonction du taux de participation.12 Les instances européennes ont recommandé un minimum de 45 % pour qu’un programme soit efficient. Avec le test Hemoccult, la participation plafonnait à 32 % en 2010-2011. Avec le test immunologique, elle était de 33,5 % en 2016-2017, la meilleure acceptabilité du test venant compenser l’abandon de l’envoi postal du test à domicile.15 Ces taux cachent une grande disparité de participation entre les départements (de 14,2 % à 50,6 % en 2016-2017). Ils sont parmi les plus faibles d’Europe : 61 % en Écosse et 68 % en Finlande (Hemoccult), 70 % en Hollande (test immunologique). Même d’autres pays latins font mieux : 47,1 % en Italie, 64,3 % au Pays basque espagnol.
Un nombre de coloscopies à la fois excessif et insuffisant
Il est démontré, à l’étranger comme en France, que le nombre de coloscopies est excessif pour la population à risque faible ou moyen de cancer colorectal. Dans le programme de dépistage organisé du Haut-Rhin, une personne sur 7 ayant une coloscopie normale bénéficiait d’une surveillance coloscopique abusive, et un quart des personnes ayant une lésion cancéreuse ou adénomateuse avaient une surveillance coloscopique trop précoce par rapport aux recommandations.14
A contrario, avec les taux de participation au programme de dépistage organisé observés en France à ce jour, le nombre de coloscopies est trop faible pour engendrer un effet mesurable sur la mortalité par cancer colorectal (et a fortiori sur son incidence) : environ 70 000 coloscopies en 2012 dans le programme Hemoccult, soit 5,5 % des 1,3 million de coloscopies annuelles ; un peu moins de 10 % des coloscopies nationales en 2016 avec le test immunologique. Toutes indications confondues, le taux de coloscopies était de 19,2 pour 1 000 habitants en France en 2012, nettement moindre qu’en Allemagne (30,3). En Allemagne, un dépistage opportuniste par colos- copie est recommandé depuis fin 2002, et la mortalité par cancer colorectal a diminué de plus de 20 % entre 2003 et 2012 et son incidence de 14 %. Aux États-Unis, où 65 % de la population est actuellement dépistée, principalement par coloscopie opportuniste, la mortalité et l’incidence du cancer colorectal ont diminué de plus de 40 % entre 1975 et 2011. En France, 10 ans après son démarrage, il n’y a pas d’effet mesurable du programme de dépistage organisé, ni sur la mortalité ni sur l’incidence du cancer colorectal.16 Il ne s’agit en aucun cas d’un plaidoyer pour le dépistage par coloscopie. Le taux de coloscopies normales d’un programme de dépistage par coloscopie est prohibitif en termes de rapports bénéfice-risque et coût-efficacité en regard de notre capacité de soins (coloscopies) et de financement(tableau 2) . L’expérience de l’Allemagne et des États-Unis démontre qu’il faut probablement un taux minimal de coloscopies de haute qualité pour engendrer un effet mesurable sur la mortalité et l’incidence du cancer colorectal, taux non atteint en France à ce jour.
Au total, le nombre de coloscopies réalisées en France hors dépistage organisé est probablement excessif, celui des coloscopies du programme de dépistage organisé insuffisant.
A contrario, avec les taux de participation au programme de dépistage organisé observés en France à ce jour, le nombre de coloscopies est trop faible pour engendrer un effet mesurable sur la mortalité par cancer colorectal (et a fortiori sur son incidence) : environ 70 000 coloscopies en 2012 dans le programme Hemoccult, soit 5,5 % des 1,3 million de coloscopies annuelles ; un peu moins de 10 % des coloscopies nationales en 2016 avec le test immunologique. Toutes indications confondues, le taux de coloscopies était de 19,2 pour 1 000 habitants en France en 2012, nettement moindre qu’en Allemagne (30,3). En Allemagne, un dépistage opportuniste par colos- copie est recommandé depuis fin 2002, et la mortalité par cancer colorectal a diminué de plus de 20 % entre 2003 et 2012 et son incidence de 14 %. Aux États-Unis, où 65 % de la population est actuellement dépistée, principalement par coloscopie opportuniste, la mortalité et l’incidence du cancer colorectal ont diminué de plus de 40 % entre 1975 et 2011. En France, 10 ans après son démarrage, il n’y a pas d’effet mesurable du programme de dépistage organisé, ni sur la mortalité ni sur l’incidence du cancer colorectal.16 Il ne s’agit en aucun cas d’un plaidoyer pour le dépistage par coloscopie. Le taux de coloscopies normales d’un programme de dépistage par coloscopie est prohibitif en termes de rapports bénéfice-risque et coût-efficacité en regard de notre capacité de soins (coloscopies) et de financement
Au total, le nombre de coloscopies réalisées en France hors dépistage organisé est probablement excessif, celui des coloscopies du programme de dépistage organisé insuffisant.
Les médecins généralistes à la fois force et faiblesse du programme français
L’implication des médecins généralistes dans le programme de dépistage organisé du cancer colorectal est une exception française. Les autres pays emploient exclusivement l’envoi postal du test. Malgré cela, notre taux de participation est l’un des plus faibles. L’épisode malheureux de l’abandon de l’envoi postal du test (repris courant 2018 pour les personnes ayant participé à au moins l’une des 3 précédentes campagnes) a confirmé les limites d’une organisation reposant exclusivement sur les généralistes, le taux de participation national plafonnant à 33,5 %.15 Une telle organisation n’est pas équitable vis-à-vis des personnes qui ne consultent pas (jeunes en bonne santé), ont des difficultés pour consulter (déserts médicaux) ou dont le médecin traitant ne préconise pas le dépistage (pas convaincu, pas motivé, surchargé…). Plusieurs études ont montré qu’en France il fallait la conjonction du médecin généraliste et de l’envoi postal du test pour obtenir une participation suffisante.17
L’implication des généralistes est, et doit rester, un atout pour nos programmes de dépistage organisé des cancers. Leur rôle est essentiel pour évaluer le niveau de risque de cancer de leurs patients, leur expliquer le mode de dépistage le mieux adapté à leur situation, les convaincre de s’y prêter, et, le cas échéant, les aider à faire un choix éclairé en cas d’alternative. Il est démontré que la recommandation d’un professionnel de santé est le moyen le plus efficace pour obtenir l’adhésion d’un patient. Un médecin convaincu fera toujours mieux qu’un simple envoi postal, ce que confirment les bons résultats de participation en Alsace, région à forte densité médicale. Malheureusement, l’évolution de la démographie médicale donne toute raison d’être pessimiste à l’échelon national.
Si l’implication des médecins généralistes doit rester au cœur du dispositif de dépistage organisé des cancers, tout doit être fait pour leur faciliter la tâche, ce qui est loin d’être le cas aujourd’hui.
Une étude nantaise a montré que transmettre au médecin traitant la liste de ses patients non dépistés augmentait de 4,2 % le taux de participation à 1 an.18 De plus, dans la plupart des études, la signature du courrier d’invitation par le médecin traitant permet d’augmenter l’adhésion des personnes invitées. L’arrêté du 23 mars 2018 relatif aux programmes de dépistage des cancers inclut la transmission de l’identité du médecin traitant par les caisses d’assurance maladie aux centres de coordination des dépistages des cancers (interdite jusque-là par la Caisse nationale). Ces centres vont donc tous pouvoir aider les médecins généralistes à être plus systématiques et exhaustifs en leur transmettant périodiquement la liste de leurs patients non dépistés.
L’instauration d’une consultation spécifique de prévention, préconisée dès 2009 par le Haut Conseil de la santé publique, pourrait aussi être l’occasion pour l’Assurance maladie de reconnaître l’importance accordée à la prévention dans les nouvelles orientations et priorités sanitaires nationales.
Enfin, l’organisation du dépistage du cancer colorectal en France est trop complexe (deux modalités parallèles de dépistage, organisé et opportuniste, et trois niveaux de risque) et doit être simplifiée : un seul dépistage organisé pour toute la population de 50 à 74 ans et deux modalités de dépistage, test immunologique ou coloscopie (v. infra).
L’implication des généralistes est, et doit rester, un atout pour nos programmes de dépistage organisé des cancers. Leur rôle est essentiel pour évaluer le niveau de risque de cancer de leurs patients, leur expliquer le mode de dépistage le mieux adapté à leur situation, les convaincre de s’y prêter, et, le cas échéant, les aider à faire un choix éclairé en cas d’alternative. Il est démontré que la recommandation d’un professionnel de santé est le moyen le plus efficace pour obtenir l’adhésion d’un patient. Un médecin convaincu fera toujours mieux qu’un simple envoi postal, ce que confirment les bons résultats de participation en Alsace, région à forte densité médicale. Malheureusement, l’évolution de la démographie médicale donne toute raison d’être pessimiste à l’échelon national.
Si l’implication des médecins généralistes doit rester au cœur du dispositif de dépistage organisé des cancers, tout doit être fait pour leur faciliter la tâche, ce qui est loin d’être le cas aujourd’hui.
Une étude nantaise a montré que transmettre au médecin traitant la liste de ses patients non dépistés augmentait de 4,2 % le taux de participation à 1 an.18 De plus, dans la plupart des études, la signature du courrier d’invitation par le médecin traitant permet d’augmenter l’adhésion des personnes invitées. L’arrêté du 23 mars 2018 relatif aux programmes de dépistage des cancers inclut la transmission de l’identité du médecin traitant par les caisses d’assurance maladie aux centres de coordination des dépistages des cancers (interdite jusque-là par la Caisse nationale). Ces centres vont donc tous pouvoir aider les médecins généralistes à être plus systématiques et exhaustifs en leur transmettant périodiquement la liste de leurs patients non dépistés.
L’instauration d’une consultation spécifique de prévention, préconisée dès 2009 par le Haut Conseil de la santé publique, pourrait aussi être l’occasion pour l’Assurance maladie de reconnaître l’importance accordée à la prévention dans les nouvelles orientations et priorités sanitaires nationales.
Enfin, l’organisation du dépistage du cancer colorectal en France est trop complexe (deux modalités parallèles de dépistage, organisé et opportuniste, et trois niveaux de risque) et doit être simplifiée : un seul dépistage organisé pour toute la population de 50 à 74 ans et deux modalités de dépistage, test immunologique ou coloscopie (v. infra).
Le dépistage organisé doit être étendu à tous les 50-74 ans
Le programme de dépistage organisé du cancer colorectal exclut 20 % de la population française ; il ne concerne que les 50-74 ans à risque moyen. Au maximum, un petit tiers des cancers colorectaux sont dépistables par le programme, et, paradoxalement, les personnes les plus à risque de cancer colorectal en sont exclues. Il faut que toute la population de 50 à 74 ans soit invitée à se faire dépister pour le cancer colorectal, soit par test immunologique, soit par coloscopie. Cela suppose que les missions des centres de coordination des dépistages des cancers évoluent et qu’ils prennent en charge les invitations et les relances pour les coloscopies de dépistage et de surveillance. Une telle organisation est en cours d’évaluation dans le département du Rhône. Nous avions montré que parmi les patients ayant des lésions cancéreuses ou adénomateuses dépistées par le programme de dépistage organisé du cancer colorectal du Haut-Rhin, un quart étaient surveillés par coloscopie trop tôt, un quart correctement, un quart trop tard, et un quart échappaient à toute surveillance.14 Une relance postale par le centre de coordination des dépistages permettrait d’améliorer la surveillance par coloscopie de bon nombre de patients. Il faut de plus que toute la population relevant théoriquement d’un dépistage par coloscopie mais non dépistée soit invitée par défaut pour un dépistage par test immunologique. Mieux vaut un dépistage par test immunologique que pas de dépistage du tout.
Les trois niveaux de risque de cancer colorectal actuels sont caducs et doivent être simplifiés
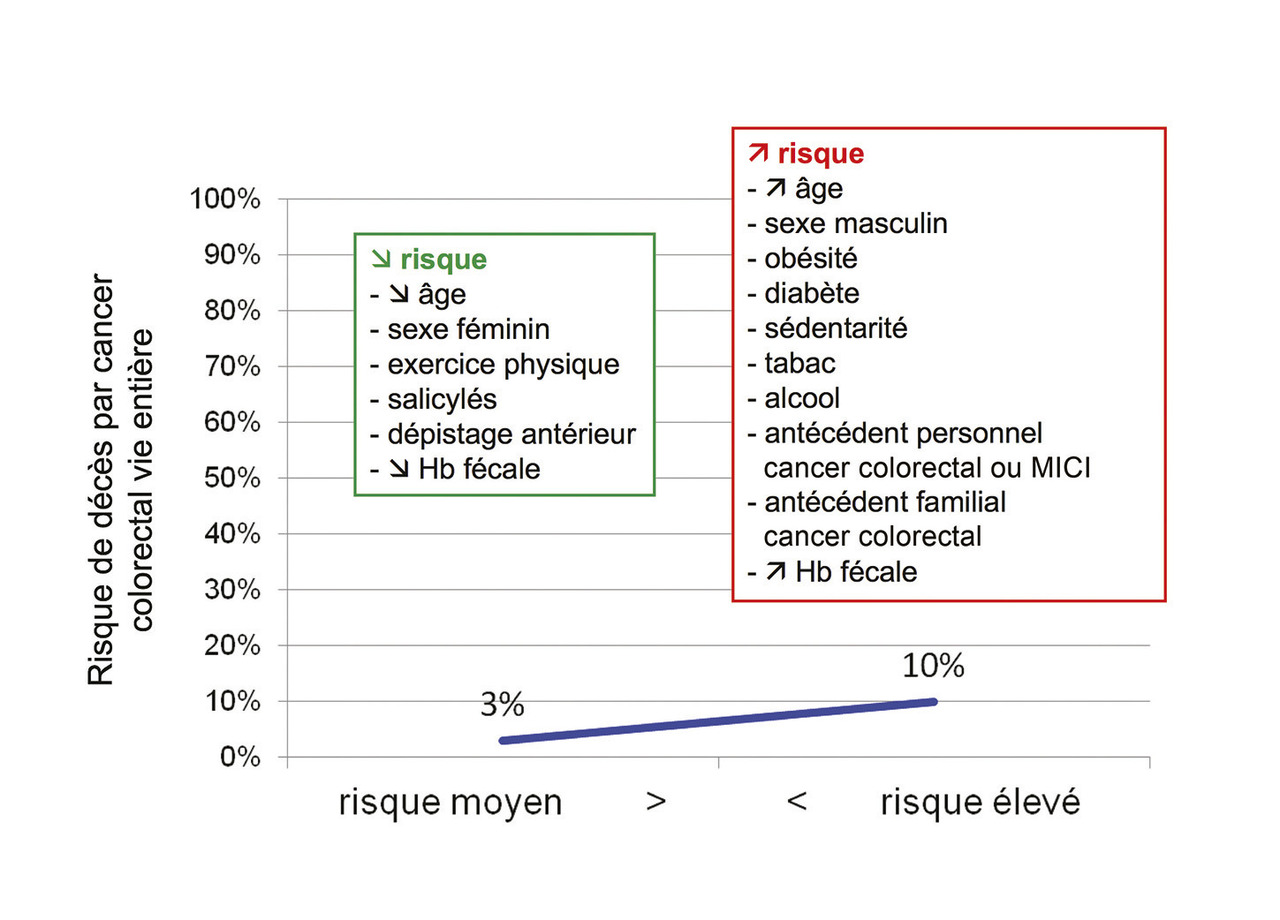
La partition de la population générale en trois groupes de risque de cancer colorectal, moyen, élevé et très élevé, est caricaturale, caduque et source de complexité et de confusion. La définition du risque moyen (celui de la population générale, soit un risque cumulé vie entière de 3 à 4 %) et du risque très élevé (cumulé vie entière de 40 à 100 %) est précise, et permet des recommandations claires de dépistage, test immunologique pour les premiers, coloscopie et consultation d’oncogénétique pour les seconds. Au contraire, celle du risque élevé (cumulé vie entière de 4 à 10 %) est floue, et les recommandations de dépistage sont hétérogènes et non consensuelles. Autant il est clair que des antécédents personnels de cancer colorectal, d’adénome et de maladie inflammatoire chronique intestinale (MICI) relèvent d’un suivi par coloscopie, autant les antécédents familiaux de cancers ou d’adénomes posent problème. Les gastroentérologues français restent très (trop) attachés au dépistage par coloscopie dans ce cas. Pourtant, les seuils recommandés (antécédent familial avant 60 ou 65 ans, adénome > 10 mm) ne sont ni consensuels, ni connus, ni respectés (Haute Autorité de santé, arrêté du 19 mars 2018). De plus, seule une minorité (de 31 à 47 %) de parents au 1er degré d’une personne atteinte de cancer colorectal est effectivement dépistée par coloscopie.19 Enfin et surtout, il est démontré que le dépistage par test immunologique est équivalent au dépistage par coloscopie chez les personnes ayant un antécédent familial de cancer colorectal.20 Une étude médico-économique française à paraître confirme l’efficience du dépistage par test immunologique chez les personnes à risque élevé. Le programme français est un des rares à exclure les personnes ayant des antécédents familiaux de cancers. Les programmes britannique et hollandais, pragmatiques et exemplaires, ne tiennent pas compte des antécédents familiaux de cancers pour inviter au dépistage organisé par recherche de sang dans les selles (de même en Australie, Finlande et Suède).
Il n’y a pas de frontière nette entre les groupes à risque moyen et élevé de cancer colorectal qui permette de trancher entre dépistage par test immunologique et par coloscopie. Il existe un continuum de niveaux de risque fonction de plusieurs variables dont seule une minorité est prise en compte à ce jour (antécédents personnels et familiaux), les autres ne l’étant pas (sexe, âge, indice de masse corporelle, tabac, alcool, diabète, activité physique, prise de salicylés, etc.)[fig. 2] .
Les recommandations de dépistage fondées sur trois groupes de risque doivent être simplifiées, de sorte que les médecins généralistes n’aient plus dans leur patientèle que deux groupes : ceux à qui ils doivent proposer une coloscopie périodique du fait d’antécédents personnels (cancer colorectal, adénome, MICI) ou d’un risque très élevé (syndrome de Lynch, polypose) ; et tous les autres, qui peuvent relever d’un dépistage par test immunologique. Il faut changer de paradigme : il n’y a pas de test de dépistage qui soit meilleur qu’un autre, le meilleur test de dépistage est celui qui est effectivement réalisé, adapté au souhait de la personne, et ce quel que soit le niveau de risque (ou presque). Il n’y a pas de risque à faire réaliser un test immunologique à la quasi-totalité de sa patientèle (sauf syndrome de Lynch, polypose et MICI). Presque tous relèvent d’un choix éclairé, test immunologique au minimum, ou coloscopie dans certaines situations : souhait du patient, risque aggravé lié à des facteurs personnels (obésité, sédentarité, diabète, tabac, alcool, etc.) ou familiaux (antécédents familiaux de cancer colorectal ou d’adénome). Des scores de risque seront bientôt disponibles permettant de guider le choix, les meilleurs scores incluant le taux quantitatif d’hémoglobine fécale.21
Au total, les personnes ayant des antécédents familiaux de cancer colorectal ou d’adénome pourraient relever d’un dépistage par test immunologique ou par coloscopie selon leur préférence (choix éclairé). Toute personne ayant des antécédents familiaux et non dépistée par coloscopie serait invitée à un dépistage par test immunologique tous les deux ans.
Il n’y a pas de frontière nette entre les groupes à risque moyen et élevé de cancer colorectal qui permette de trancher entre dépistage par test immunologique et par coloscopie. Il existe un continuum de niveaux de risque fonction de plusieurs variables dont seule une minorité est prise en compte à ce jour (antécédents personnels et familiaux), les autres ne l’étant pas (sexe, âge, indice de masse corporelle, tabac, alcool, diabète, activité physique, prise de salicylés, etc.)
Les recommandations de dépistage fondées sur trois groupes de risque doivent être simplifiées, de sorte que les médecins généralistes n’aient plus dans leur patientèle que deux groupes : ceux à qui ils doivent proposer une coloscopie périodique du fait d’antécédents personnels (cancer colorectal, adénome, MICI) ou d’un risque très élevé (syndrome de Lynch, polypose) ; et tous les autres, qui peuvent relever d’un dépistage par test immunologique. Il faut changer de paradigme : il n’y a pas de test de dépistage qui soit meilleur qu’un autre, le meilleur test de dépistage est celui qui est effectivement réalisé, adapté au souhait de la personne, et ce quel que soit le niveau de risque (ou presque). Il n’y a pas de risque à faire réaliser un test immunologique à la quasi-totalité de sa patientèle (sauf syndrome de Lynch, polypose et MICI). Presque tous relèvent d’un choix éclairé, test immunologique au minimum, ou coloscopie dans certaines situations : souhait du patient, risque aggravé lié à des facteurs personnels (obésité, sédentarité, diabète, tabac, alcool, etc.) ou familiaux (antécédents familiaux de cancer colorectal ou d’adénome). Des scores de risque seront bientôt disponibles permettant de guider le choix, les meilleurs scores incluant le taux quantitatif d’hémoglobine fécale.21
Au total, les personnes ayant des antécédents familiaux de cancer colorectal ou d’adénome pourraient relever d’un dépistage par test immunologique ou par coloscopie selon leur préférence (choix éclairé). Toute personne ayant des antécédents familiaux et non dépistée par coloscopie serait invitée à un dépistage par test immunologique tous les deux ans.
Réhabiliter la recto-sigmoïdoscopie
La recto-sigmoïdoscopie est avec le test Hemoccult le seul examen dont l’efficacité a été démontrée par cinq essais contrôlés randomisés.8 Elle permet de diminuer de 28 % la mortalité par cancer colorectal et de 18 % son incidence chez les personnes invitées (et de 44 % et 28 % respectivement chez les personnes effectivement dépistées).8 Son efficience a été confirmée par une étude française à paraître. Un programme pilote a débuté en 2013 en Angleterre, avec un taux de participation de 43 %. Nous avions obtenu un taux de 21 % en Alsace.16 La tolérance était excellente grâce à l’emploi d’un gastroscope, et pourrait être encore améliorée par l’utilisation d’un mélange équimolaire oxygène-protoxyde d’azote (MEOPA) et par une délégation de tâches à des infirmières formées. Outre son efficacité et son efficience, l’avantage principal de cet examen est qu’il permet d’explorer le côlon distal en ambulatoire en quelques minutes après préparation à domicile par un simple lavement évacuateur. Son seul inconvénient est son caractère peu lucratif, sans compter son côté quelque peu « rétrograde ». Il pourrait être proposé par le médecin traitant comme modalité alternative et efficace de dépistage opportuniste aux personnes réticentes à un dépistage par test fécal et par coloscopie. Il s’adresse préférentiellement aux personnes de 55 à 65 ans, âge où son rendement est maximal.
Apprendre à lire et à interpréter le taux quantitatif d’hémoglobine fécale
Les médecins traitants doivent apprendre à lire et interpréter le taux quantitatif d’hémoglobine fécale et ne pas se contenter du résultat positif ou négatif transmis par le laboratoire d’analyse centralisée.
Le test immunologique quantitatif est un net progrès à double titre : sa sensibilité a nettement augmenté, atteignant 60 à 65 % pour le cancer au seuil d’hémoglobine de 30 µg/g (vs 35 % pour Hemoccult) et 50 % pour l’adénome avancé, et son résultat quantitatif peut être interprété à visée diagnostique.13 Un taux d’hémoglobine indétectable, inférieur à 50 ng/mL (soit 10 µg/g), permet d’éliminer de façon quasi absolue l’hypothèse d’un cancer colorectal (valeur prédictive négative de 99,4 à 100 % selon les séries) et d’éviter la réalisation d’une coloscopie chez 75 à 80 % des patients symptomatiques.22 Ce taux inférieur à 50 ng/mL est observé chez 90 % de la population de 50 à 74 ans. Attention, l’interprétation du résultat quantitatif du test immunologique à des fins diagnostiques chez un patient symptomatique est réservée à certains symptômes digestifs aspécifiques (douleurs abdominales, modification du transit, constipation, diarrhée, altération de l’état général…) et est totalement prohibée en cas de symptômes aigus, de saignement digestif extériorisé (rectorragies et méléna), d’anémie ferriprive et de masse palpable, qui doivent impérativement conduire à la réalisation d’examens endoscopiques et/ou morphologiques adaptés.
Dans le même registre, il n’y a pas/plus d’indication à prescrire la recherche de sang occulte dans les selles en laboratoire d’analyses biomédicales. Les tests utilisés sont très hétérogènes et leurs performances diagnostiques inconnues des prescripteurs, voire des biologistes eux-mêmes. En pratique courante, ils sont prescrits à tort et à travers, et leurs résultats ne conduisent pas, loin s’en faut, aux explorations adaptées. À notre avis, ils ne devraient plus être remboursés. Quitte à prescrire une recherche de sang dans les selles, autant donner un test immunologique quantitatif dans le cadre du programme de dépistage organisé du cancer colorectal.
La deuxième situation qui peut conduire à une interprétation du résultat quantitatif du test immunologique est celle d’un patient dont le taux d’hémoglobine fécale est situé juste au-dessous du seuil de positivité adopté pour le programme français de dépistage organisé (150 ng/mL) et progressivement croissant. Il est démontré que ce taux est appelé à dépasser le seuil à court ou moyen terme et est prédictif de la survenue ultérieure d’une lésion cancéreuse ou adénomateuse avancée.23 Il ne serait pas choquant de lui proposer la réalisation d’une coloscopie avant le franchissement du seuil fatidique lors d’une consultation l’informant du rapport bénéfice-risque attendu.
Le test immunologique quantitatif est un net progrès à double titre : sa sensibilité a nettement augmenté, atteignant 60 à 65 % pour le cancer au seuil d’hémoglobine de 30 µg/g (vs 35 % pour Hemoccult) et 50 % pour l’adénome avancé, et son résultat quantitatif peut être interprété à visée diagnostique.13 Un taux d’hémoglobine indétectable, inférieur à 50 ng/mL (soit 10 µg/g), permet d’éliminer de façon quasi absolue l’hypothèse d’un cancer colorectal (valeur prédictive négative de 99,4 à 100 % selon les séries) et d’éviter la réalisation d’une coloscopie chez 75 à 80 % des patients symptomatiques.22 Ce taux inférieur à 50 ng/mL est observé chez 90 % de la population de 50 à 74 ans. Attention, l’interprétation du résultat quantitatif du test immunologique à des fins diagnostiques chez un patient symptomatique est réservée à certains symptômes digestifs aspécifiques (douleurs abdominales, modification du transit, constipation, diarrhée, altération de l’état général…) et est totalement prohibée en cas de symptômes aigus, de saignement digestif extériorisé (rectorragies et méléna), d’anémie ferriprive et de masse palpable, qui doivent impérativement conduire à la réalisation d’examens endoscopiques et/ou morphologiques adaptés.
Dans le même registre, il n’y a pas/plus d’indication à prescrire la recherche de sang occulte dans les selles en laboratoire d’analyses biomédicales. Les tests utilisés sont très hétérogènes et leurs performances diagnostiques inconnues des prescripteurs, voire des biologistes eux-mêmes. En pratique courante, ils sont prescrits à tort et à travers, et leurs résultats ne conduisent pas, loin s’en faut, aux explorations adaptées. À notre avis, ils ne devraient plus être remboursés. Quitte à prescrire une recherche de sang dans les selles, autant donner un test immunologique quantitatif dans le cadre du programme de dépistage organisé du cancer colorectal.
La deuxième situation qui peut conduire à une interprétation du résultat quantitatif du test immunologique est celle d’un patient dont le taux d’hémoglobine fécale est situé juste au-dessous du seuil de positivité adopté pour le programme français de dépistage organisé (150 ng/mL) et progressivement croissant. Il est démontré que ce taux est appelé à dépasser le seuil à court ou moyen terme et est prédictif de la survenue ultérieure d’une lésion cancéreuse ou adénomateuse avancée.23 Il ne serait pas choquant de lui proposer la réalisation d’une coloscopie avant le franchissement du seuil fatidique lors d’une consultation l’informant du rapport bénéfice-risque attendu.
Lire aussi | Testez-vous sur l’item 290
Une minorité d’endoscopistes offrent une qualité suboptimale de coloscopies
La coloscopie est un examen opérateur-dépendant. La qualité des coloscopies est très hétérogène, source d’inégalités dans un programme de dépistage organisé supposé offrir à toute la population invitée une équité d’accès à des examens de qualité. Une qualité suboptimale de coloscopie fait courir au patient deux risques prin- cipaux, celui de cancer d’intervalle après coloscopie et celui de chirurgie abusive.
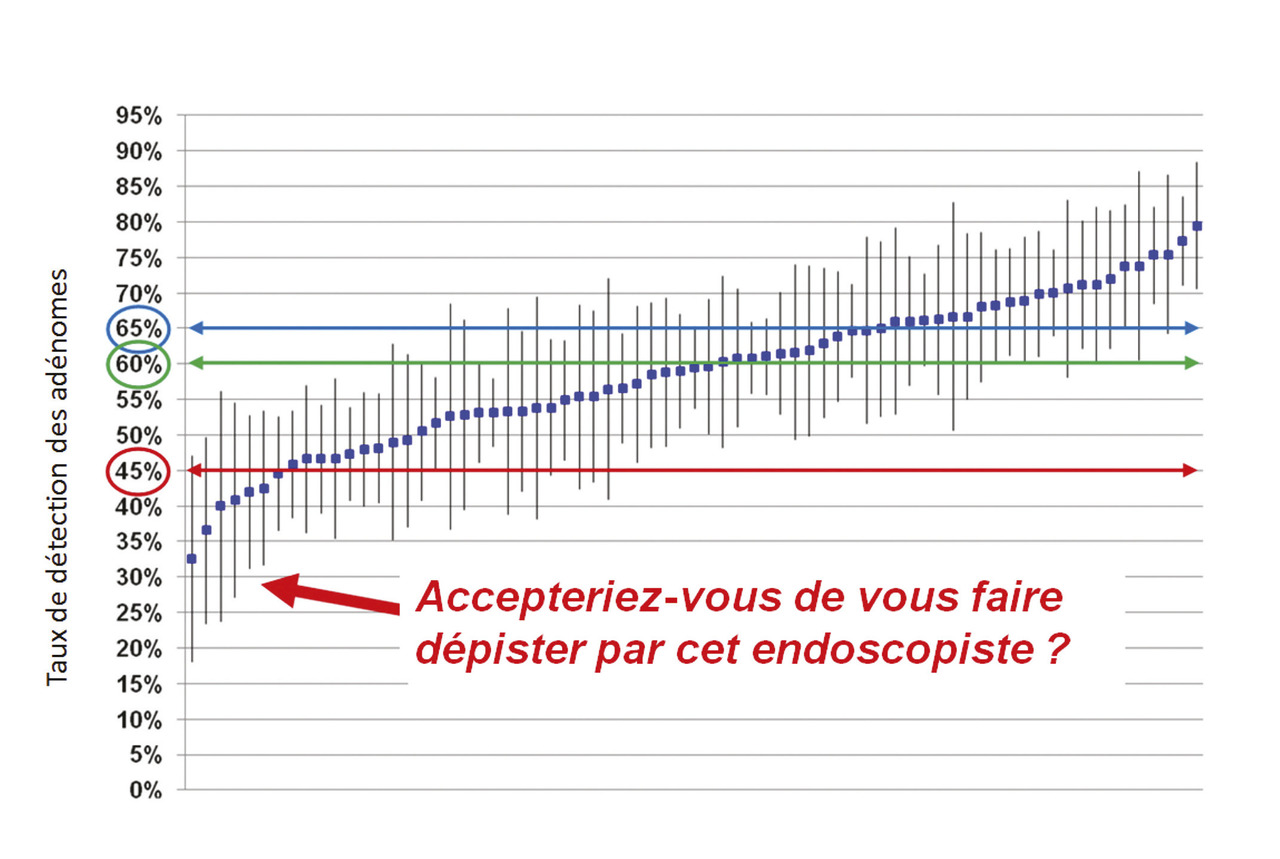
La coloscopie n’est pas « l’arme absolue » contre le cancer colorectal : 2 à 9 % des patients chez lesquels on diag- nostique un cancer colorectal ont eu une coloscopie dans les trois années précédentes.24 Le cancer colorectal d’intervalle après coloscopie est un cancer invasif diagnostiqué avant la date du prochain examen de surveillance recommandé. C’est la hantise de l’endoscopiste, le plus souvent évitable. Il est la conséquence de lésions manquées lors de la coloscopie initiale dans plus de la moitié des cas et plus rarement (10 à 20 %) de lésions mal réséquées.24 Il est démontré que le risque de cancer colorectal d’intervalle est inversement corrélé au rendement de l’endoscopiste, tel qu’évalué par le taux de détection des adénomes (nombre de coloscopies avec au moins un adénome rapporté au nombre total de coloscopies). La corrélation est « dose-dépendante », sans véritable seuil, chaque augmentation de 1 % du taux de détection étant associée à une diminution de 3 % du risque de cancer colorectal d’intervalle et de 5 % du risque de décès par cancer colorectal d’intervalle.24 Le taux de détection des adénomes s’avère l’indicateur le plus synthétique permettant d’évaluer la qualité des coloscopies d’un endoscopiste. Dans le programme de dépistage organisé utilisant le test immunologique, le taux de détection des adénomes variait de 7 à 94 % selon l’endoscopiste dans la région Grand Est.24 Nous avons proposé pour ce taux un seuil de 45 % (55 % chez l’homme, 35 % chez la femme), en dessous duquel l’endoscopiste fait courir un risque prohibitif de cancer colorectal d’intervalle à ses patients. En Alsace, 10 % des endoscopistes ont un taux inférieur à ce seuil(fig. 3) . C’est une réelle perte de chance pour leurs patients. Ces constatations ont conduit toutes les sociétés savantes à recommander un seuil minimal de taux de détection des adénomes adapté à leur programme national de dépistage : 25 % pour le dépistage par coloscopie aux États-Unis et en Pologne, 35 % pour le dépistage par Hemoccult en Angleterre. Le programme français est le seul à ce jour à ne pas proposer de référentiel qualité pour ses coloscopies. Un tel référentiel devrait être publié en 2018, qui devrait fixer à 45 % le seuil minimal en dessous duquel le risque de cancer colorectal d’intervalle est inacceptable et à 60 % l’objectif à atteindre (correspondant à la médiane des endoscopistes du Grand Est). Dans un deuxième temps, ce référentiel devrait conduire à une labellisation des endoscopistes.
Avec les progrès de l’endoscopie interventionnelle, la résection endoscopique des gros polypes est devenue la règle, la résection chirurgicale l’exception. Une méta- analyse récente de 50 séries évaluait à 3,5 % le taux de résection chirurgicale des polypes bénins ≥ 20 mm, 3 % pour échec endoscopique et 0,5 % pour complication.25 En fait, dans le programme alsacien de dépistage organisé par test immunologique, 20 % des personnes ayant un(des) polype(s) bénin(s) ≥ 20 mm étaient opérées.14 Ce constat n’est pas anodin dès lors que la morbi-mortalité chirurgicale était très significativement plus élevée que la morbi-mortalité endoscopique (14,4 vs 4,6 % ; p = 0,001). Seules 7 % des personnes étaient adressées à un endoscopiste « expert » dont le taux de succès de résection endoscopique était de 100 %. Trois endoscopistes sur quatre n’adressaient jamais de patients à un endoscopiste « expert » et préféraient les adresser à un chirurgien. Plus de la moitié des résections chirurgicales étaient abusives et auraient pu être évitées grâce au recours à un endoscopiste « expert ». Ce constat n’est pas spécifique à la France. Il sera intéressant de suivre les mesures correctrices proposées par les sociétés savantes et professionnelles françaises.
Les pratiques suboptimales sont le fait d’une minorité d’endoscopistes. Dans l’attente d’une future labellisation des endoscopistes, le médecin généraliste a probablement un rôle à jouer dans l’amélioration de la qualité et de la sécurité des coloscopies du programme français de dépistage organisé du cancer colorectal en choisissant un « bon » correspondant gastroentérologue. Un « bon » gastroentérologue utilise systématiquement une préparation colique fractionnée, a l’immense majorité de ses patients bien préparés, a un taux de détection des adénomes ≥ 60 % et n’envoie pas ou très peu (< 5 %) de patients ayant de gros polypes bénins au chirurgien, soit qu’il les résèque lui-même, soit qu’il les adresse à un endoscopiste « expert » (ce qui n’a rien de dévalorisant).
La coloscopie n’est pas « l’arme absolue » contre le cancer colorectal : 2 à 9 % des patients chez lesquels on diag- nostique un cancer colorectal ont eu une coloscopie dans les trois années précédentes.24 Le cancer colorectal d’intervalle après coloscopie est un cancer invasif diagnostiqué avant la date du prochain examen de surveillance recommandé. C’est la hantise de l’endoscopiste, le plus souvent évitable. Il est la conséquence de lésions manquées lors de la coloscopie initiale dans plus de la moitié des cas et plus rarement (10 à 20 %) de lésions mal réséquées.24 Il est démontré que le risque de cancer colorectal d’intervalle est inversement corrélé au rendement de l’endoscopiste, tel qu’évalué par le taux de détection des adénomes (nombre de coloscopies avec au moins un adénome rapporté au nombre total de coloscopies). La corrélation est « dose-dépendante », sans véritable seuil, chaque augmentation de 1 % du taux de détection étant associée à une diminution de 3 % du risque de cancer colorectal d’intervalle et de 5 % du risque de décès par cancer colorectal d’intervalle.24 Le taux de détection des adénomes s’avère l’indicateur le plus synthétique permettant d’évaluer la qualité des coloscopies d’un endoscopiste. Dans le programme de dépistage organisé utilisant le test immunologique, le taux de détection des adénomes variait de 7 à 94 % selon l’endoscopiste dans la région Grand Est.24 Nous avons proposé pour ce taux un seuil de 45 % (55 % chez l’homme, 35 % chez la femme), en dessous duquel l’endoscopiste fait courir un risque prohibitif de cancer colorectal d’intervalle à ses patients. En Alsace, 10 % des endoscopistes ont un taux inférieur à ce seuil
Avec les progrès de l’endoscopie interventionnelle, la résection endoscopique des gros polypes est devenue la règle, la résection chirurgicale l’exception. Une méta- analyse récente de 50 séries évaluait à 3,5 % le taux de résection chirurgicale des polypes bénins ≥ 20 mm, 3 % pour échec endoscopique et 0,5 % pour complication.25 En fait, dans le programme alsacien de dépistage organisé par test immunologique, 20 % des personnes ayant un(des) polype(s) bénin(s) ≥ 20 mm étaient opérées.14 Ce constat n’est pas anodin dès lors que la morbi-mortalité chirurgicale était très significativement plus élevée que la morbi-mortalité endoscopique (14,4 vs 4,6 % ; p = 0,001). Seules 7 % des personnes étaient adressées à un endoscopiste « expert » dont le taux de succès de résection endoscopique était de 100 %. Trois endoscopistes sur quatre n’adressaient jamais de patients à un endoscopiste « expert » et préféraient les adresser à un chirurgien. Plus de la moitié des résections chirurgicales étaient abusives et auraient pu être évitées grâce au recours à un endoscopiste « expert ». Ce constat n’est pas spécifique à la France. Il sera intéressant de suivre les mesures correctrices proposées par les sociétés savantes et professionnelles françaises.
Les pratiques suboptimales sont le fait d’une minorité d’endoscopistes. Dans l’attente d’une future labellisation des endoscopistes, le médecin généraliste a probablement un rôle à jouer dans l’amélioration de la qualité et de la sécurité des coloscopies du programme français de dépistage organisé du cancer colorectal en choisissant un « bon » correspondant gastroentérologue. Un « bon » gastroentérologue utilise systématiquement une préparation colique fractionnée, a l’immense majorité de ses patients bien préparés, a un taux de détection des adénomes ≥ 60 % et n’envoie pas ou très peu (< 5 %) de patients ayant de gros polypes bénins au chirurgien, soit qu’il les résèque lui-même, soit qu’il les adresse à un endoscopiste « expert » (ce qui n’a rien de dévalorisant).
Lire aussi | Tumeur villeuse rectale
Y a-t-il un pilote dans l’avion ?
Comment évoquer le programme français de dépistage organisé du cancer colorectal sans aborder son pilotage ? Encore une exception française, les dépistages organisés des cancers colorectaux, du sein, et bientôt du col de l’utérus sont gérés par les mêmes centres de coordination des dépistages des cancers. Dans la plupart des autres pays, ces programmes sont séparés, les métiers étant différents. Cela suffit-il à expliquer nos mauvais résultats ? Un élément de réponse est peut-être à rechercher dans les taux de participation observés en Alsace, parmi les meilleurs de France, seule région où les trois dépistages sont gérés par trois structures différentes.
Le pilotage national des dépistages organisés des cancers est multicéphale, partagé entre la Direction générale de la santé, l’Assurance maladie, l’Institut national du cancer, et Santé publique France. Il est pyramidal, cloisonné et illisible. Le mélange des genres entre payeur, organisateur et évaluateur n’est pas sain. Les conflits d’intérêts ne sont pas loin lorsque radiologues et gastroentérologues participent aux orientations stratégiques.
La déclinaison régionale du pilotage n’est pas non plus dénuée de critiques, très hétérogène selon les bonnes volontés locales (communication aux structures de gestion des médecins traitants déclarés, des personnes ayant bénéficié d’une coloscopie).
Les programmes français de dépistage organisé des cancers manquent d’un pilote ayant une véritable vision de santé publique, des moyens à la mesure d’une politique ambitieuse de prévention, un pouvoir de coordination des différents acteurs et une réelle écoute du terrain, faute de quoi la réduction de la mortalité et de l’incidence des cancers observée dans les essais ne sera jamais observée en population française.
Le pilotage national des dépistages organisés des cancers est multicéphale, partagé entre la Direction générale de la santé, l’Assurance maladie, l’Institut national du cancer, et Santé publique France. Il est pyramidal, cloisonné et illisible. Le mélange des genres entre payeur, organisateur et évaluateur n’est pas sain. Les conflits d’intérêts ne sont pas loin lorsque radiologues et gastroentérologues participent aux orientations stratégiques.
La déclinaison régionale du pilotage n’est pas non plus dénuée de critiques, très hétérogène selon les bonnes volontés locales (communication aux structures de gestion des médecins traitants déclarés, des personnes ayant bénéficié d’une coloscopie).
Les programmes français de dépistage organisé des cancers manquent d’un pilote ayant une véritable vision de santé publique, des moyens à la mesure d’une politique ambitieuse de prévention, un pouvoir de coordination des différents acteurs et une réelle écoute du terrain, faute de quoi la réduction de la mortalité et de l’incidence des cancers observée dans les essais ne sera jamais observée en population française.
Un bilan très décevant
Alors que la France est un des meilleurs pays d’Europe pour la mortalité évitable liée au système de soins, elle est un des pires pour la mortalité évitable liée aux pratiques de prévention primaire.26 Eu égard à l’argent investi, le bilan du programme français de dépistage organisé du cancer colorectal est très décevant. Tout doit être fait pour que l’implication des médecins traitants, force de notre programme, soit facilitée et maximisée. Pour ce faire, il faut impérativement leur communiquer périodiquement la liste de leurs patients non dépistés et simplifier l’organisation actuelle en élargissant la population cible à toute la population de 50 à 74 ans, sans exception, et en supprimant les trois niveaux de risque actuels, obsolètes, pour les remplacer par une offre de dépistage simple, test immunologique ou coloscopie. L’instauration d’une consultation spécifique de prévention est, elle aussi, impérative. De plus, une minorité d’endoscopistes grèvent la qualité des performances de la coloscopie pour dépister et prévenir le cancer colorectal. Ces endoscopistes doivent améliorer significativement leurs pratiques ou être exclus du programme de dépistage organisé. De gros progrès doivent être faits dans notre programme, à tous niveaux. L’avenir nous dira si la réorganisation en grandes régions des centres de coordination des dépistages des cancers, imposée à grands frais pour 2019, permettra d’améliorer la situation… nous en doutons. V
* Une néoplasie avancée est un cancer ou un adénome avancé (adénome de taille ≥ 10 mm, ou à contingent villeux ou tubulo-villeux, ou en dysplasie de haut grade, carcinome in situ inclus).
Références
1. Binder-Foucard F, Belot A, Delafosse P, Remontet L, Woronoff AS, Bossard N. Estimation nationale de l’incidence et de la mortalité par cancer en France entre 1980 et 2012. Étude à partir des registres des cancers du réseau Francim. InVS, juillet 2013. invs.santepubliquefrance.fr ou https://bit.ly/2iEavXk
2. Rogel A, Hamers F, Quintin C, de Maria F, Bonaldi C, Beltzer N. Incidence et dépistage du cancer du sein en France. Dernières données disponibles : octobre 2016. Santé publique France, 2016. invs.santepubliquefrance.fr ou https://bit.ly/2MVr6Jk
3. Barré S, Massetti M, Leleu H, Catajar N, de Bels F. Caractérisation des femmes ne réalisant pas de dépistage du cancer du col de l’utérus par frottis cervico-utérin en France. Bull Epidémiol Hebd 2017;(2-3):39-47.
4. Institut national du cancer. Bénéfices et limites du programme de dépistage organisé du cancer du sein. Quels éléments en 2013 ? www.e-cancer.fr/content/download/64036
5. Barré S, Massetti M, Leleu H, de Bels F. Évaluation médico-économique du dépistage du cancer du col de l’utérus en France. Bull Epidémiol Hebd 2017;(2-3):48-58.
6. Gerondeau C, Mayet P, Denizet P, et al. 80 km/h : « une mesure qui permettra d’épargner tous les ans entre 300 et 400 vies ». Le Monde, 14/05/2018.
7. Les cancers en France, édition 2016. Institut national du cancer, collection Les Données, avril 2017.
8. Holme Ø, Bretthauer M, Fretheim A, et al. Flexible sigmoidoscopy versus faecal occult blood testing for colorectal cancer screening in asymptomatic individuals. Cochrane Database Syst Rev 2013;9:CD009259.
9. Beaugerie L, Saurin JC, Richard-Molard B, Seitz JF, Faivre J, Benamouzig R. Dépistage du cancer colorectal : agissons maintenant. Le Monde, 13/01/2014.
10. Hewitson P, Glasziou P, Watson E, Towler B, Irwig L. Cochrane systematic review of colorectal cancer screening using the fecal occult blood test (hemoccult): an update. Am J Gastroenterol 2008;103:1541-9.
11. Libby G, Brewster DH, McClements PL, et al. The impact of population-based faecal occult blood test screening on colorectal cancer mortality: a matched cohort study. Br J Cancer 2012;107:255-9.
12. Lejeune C, Arveux P, Dancourt V, Béjean S, Bonithon-Kopp C, Faivre J. Cost-effectiveness analysis of fecal occult blood screening for colorectal cancer. Int J Technol Assess Health Care 2004;20:434-9.
13. Denis B, Guittet L. Dépistage du cancer colorectal par test immunologique quantitatif de recherche de sang occulte dans les selles : une révolution ? Hepato Gastro 2013;22:119-29.
14. http://www.adeca-alsace.fr/en_savoir_plus/travaux_publications.171.html
15. Santé publique France. Données issues des structures départementales du dépistage organisé du cancer colorectal. invs.santepubliquefrance.fr ou https://bit.ly/2LzyiG0
16. Denis B, Gendre I, Perrin P. Le programme français de dépistage organisé du cancer colorectal par Hemoccult : bilan et enseignements. Hepato Gastro 2017;24:142-51.
17. Tazi MA, Faivre J, Dassonville F, Lamour J, Milan C, Durand G. Participation in faecal occult blood screening for colorectal cancer in a well defined French population: results of five screening rounds from 1988 to 1996. J Med Screen 1997;4:147-51.
18. Rat C, Pogu C, Le Donné D, et al. Effect of physician notification regarding nonadherence to colorectal cancer screening on patient participation in fecal immunochemical test cancer screening: a randomized clinical trial. JAMA 2017;318:816-24.
19. Lowery JT, Ahnen DJ, Schroy PC 3rd, et al. Understanding the contribution of family history to colorectal cancer risk and its clinical implications: A state-of-the-science review. Cancer 2016;122:2633-45.
20. Quintero E, Carrillo M, Gimeno-García AZ, et al. Equivalency of fecal immunochemical tests and colonoscopy in familial colorectal cancer screening. Gastroenterology 2014;147:1021-30.
21. Stegeman I, de Wijkerslooth TR, Stoop EM, et al. Combining risk factors with faecal immunochemical test outcome for selecting CRC screenees for colonoscopy. Gut 2014;63:466-71.
22. Westwood M, Lang S, Armstrong N, et al. Faecal immunochemical tests (FIT) can help to rule out colorectal cancer in patients presenting in primary care with lower abdominal symptoms: a systematic review conducted to inform new NICE DG30 diagnostic guidance. BMC Med 2017;15:189.
23. Grobbee EJ, Schreuders EH, Hansen BE, et al. Association between concentrations of hemoglobin determined by fecal immunochemical tests and long-term development of advanced colorectal neoplasia. Gastroenterology 2017;153:1251-9.
24. Denis B. Taux de détection des adénomes : indicateur qualité prioritaire des coloscopies de prévention et de dépistage. Hepato Gastro 2018;25:306-24.
25. Hassan C, Repici A, Sharma P, et al. Efficacy and safety of endoscopic resection of large colorectal polyps: a systematic review and meta-analysis. Gut 2016;65:806-20.
26. Haut Conseil de la santé publique. Indicateurs de mortalité « prématurée » et « évitable ». Rapport HCSP, avril 2013. www.hscp.fr ou https://bit.ly/2MQmRib
2. Rogel A, Hamers F, Quintin C, de Maria F, Bonaldi C, Beltzer N. Incidence et dépistage du cancer du sein en France. Dernières données disponibles : octobre 2016. Santé publique France, 2016. invs.santepubliquefrance.fr ou https://bit.ly/2MVr6Jk
3. Barré S, Massetti M, Leleu H, Catajar N, de Bels F. Caractérisation des femmes ne réalisant pas de dépistage du cancer du col de l’utérus par frottis cervico-utérin en France. Bull Epidémiol Hebd 2017;(2-3):39-47.
4. Institut national du cancer. Bénéfices et limites du programme de dépistage organisé du cancer du sein. Quels éléments en 2013 ? www.e-cancer.fr/content/download/64036
5. Barré S, Massetti M, Leleu H, de Bels F. Évaluation médico-économique du dépistage du cancer du col de l’utérus en France. Bull Epidémiol Hebd 2017;(2-3):48-58.
6. Gerondeau C, Mayet P, Denizet P, et al. 80 km/h : « une mesure qui permettra d’épargner tous les ans entre 300 et 400 vies ». Le Monde, 14/05/2018.
7. Les cancers en France, édition 2016. Institut national du cancer, collection Les Données, avril 2017.
8. Holme Ø, Bretthauer M, Fretheim A, et al. Flexible sigmoidoscopy versus faecal occult blood testing for colorectal cancer screening in asymptomatic individuals. Cochrane Database Syst Rev 2013;9:CD009259.
9. Beaugerie L, Saurin JC, Richard-Molard B, Seitz JF, Faivre J, Benamouzig R. Dépistage du cancer colorectal : agissons maintenant. Le Monde, 13/01/2014.
10. Hewitson P, Glasziou P, Watson E, Towler B, Irwig L. Cochrane systematic review of colorectal cancer screening using the fecal occult blood test (hemoccult): an update. Am J Gastroenterol 2008;103:1541-9.
11. Libby G, Brewster DH, McClements PL, et al. The impact of population-based faecal occult blood test screening on colorectal cancer mortality: a matched cohort study. Br J Cancer 2012;107:255-9.
12. Lejeune C, Arveux P, Dancourt V, Béjean S, Bonithon-Kopp C, Faivre J. Cost-effectiveness analysis of fecal occult blood screening for colorectal cancer. Int J Technol Assess Health Care 2004;20:434-9.
13. Denis B, Guittet L. Dépistage du cancer colorectal par test immunologique quantitatif de recherche de sang occulte dans les selles : une révolution ? Hepato Gastro 2013;22:119-29.
14. http://www.adeca-alsace.fr/en_savoir_plus/travaux_publications.171.html
15. Santé publique France. Données issues des structures départementales du dépistage organisé du cancer colorectal. invs.santepubliquefrance.fr ou https://bit.ly/2LzyiG0
16. Denis B, Gendre I, Perrin P. Le programme français de dépistage organisé du cancer colorectal par Hemoccult : bilan et enseignements. Hepato Gastro 2017;24:142-51.
17. Tazi MA, Faivre J, Dassonville F, Lamour J, Milan C, Durand G. Participation in faecal occult blood screening for colorectal cancer in a well defined French population: results of five screening rounds from 1988 to 1996. J Med Screen 1997;4:147-51.
18. Rat C, Pogu C, Le Donné D, et al. Effect of physician notification regarding nonadherence to colorectal cancer screening on patient participation in fecal immunochemical test cancer screening: a randomized clinical trial. JAMA 2017;318:816-24.
19. Lowery JT, Ahnen DJ, Schroy PC 3rd, et al. Understanding the contribution of family history to colorectal cancer risk and its clinical implications: A state-of-the-science review. Cancer 2016;122:2633-45.
20. Quintero E, Carrillo M, Gimeno-García AZ, et al. Equivalency of fecal immunochemical tests and colonoscopy in familial colorectal cancer screening. Gastroenterology 2014;147:1021-30.
21. Stegeman I, de Wijkerslooth TR, Stoop EM, et al. Combining risk factors with faecal immunochemical test outcome for selecting CRC screenees for colonoscopy. Gut 2014;63:466-71.
22. Westwood M, Lang S, Armstrong N, et al. Faecal immunochemical tests (FIT) can help to rule out colorectal cancer in patients presenting in primary care with lower abdominal symptoms: a systematic review conducted to inform new NICE DG30 diagnostic guidance. BMC Med 2017;15:189.
23. Grobbee EJ, Schreuders EH, Hansen BE, et al. Association between concentrations of hemoglobin determined by fecal immunochemical tests and long-term development of advanced colorectal neoplasia. Gastroenterology 2017;153:1251-9.
24. Denis B. Taux de détection des adénomes : indicateur qualité prioritaire des coloscopies de prévention et de dépistage. Hepato Gastro 2018;25:306-24.
25. Hassan C, Repici A, Sharma P, et al. Efficacy and safety of endoscopic resection of large colorectal polyps: a systematic review and meta-analysis. Gut 2016;65:806-20.
26. Haut Conseil de la santé publique. Indicateurs de mortalité « prématurée » et « évitable ». Rapport HCSP, avril 2013. www.hscp.fr ou https://bit.ly/2MQmRib
Dans cet article
- Les vrais chiffres de la mortalité évitable mis en perspective
- Une efficacité modeste du dépistage par recherche de sang occulte dans les selles
- Une participation bien trop faible
- Un nombre de coloscopies à la fois excessif et insuffisant
- Les médecins généralistes à la fois force et faiblesse du programme français
- Le dépistage organisé doit être étendu à tous les 50-74 ans
- Les trois niveaux de risque de cancer colorectal actuels sont caducs et doivent être simplifiés
- Réhabiliter la recto-sigmoïdoscopie
- Apprendre à lire et à interpréter le taux quantitatif d’hémoglobine fécale
- Une minorité d’endoscopistes offrent une qualité suboptimale de coloscopies
- Y a-t-il un pilote dans l’avion ?
- Un bilan très décevant