Le cancer bronchopulmonaire est un bon candidat pour un dépistage dans une population à risque (fumeurs et anciens fumeurs). En effet, il s’agit d’une maladie fréquente, et grave si elle est découverte tardivement. Inversement, elle est curable dans les stades précoces. Ainsi, deux larges études randomisées, NLST et NELSON, ont démontré, respectivement chez 53 439 et 13 195 grands fumeurs ou anciens grands fumeurs, que le dépistage annuel par scanner thoracique faiblement dosé diminue significativement la mortalité spécifique par cancer bronchopulmonaire. L’étude NLST a également démontré une diminution de la mortalité globale, reflétant la contribution du cancer pulmonaire dans cette mortalité globale. Néanmoins, plusieurs inconvénients potentiels de ce dépistage par scanner sont régulièrement mis en avant : le risque de faux positifs et leur hétérogénéité d’investigation, l’irradiation liée aux scanners, le risque de surdiagnostic, l’influence sur le tabagisme, le risque d’altération de la qualité de vie et le coût. Ces inconvénients restent parfaitement contrôlables et modérés, et les publications récentes concluent à un rapport bénéfice/risque favorable du dépistage par scanner. De nombreuses sociétés savantes internationales le recommandent actuellement, et de nombreux pays ont initié un programme national organisé de dépistage. Un groupe d’experts français a publié en 2012 et 2021 des recommandations fermes en faveur de ce dépistage. La Haute Autorité de santé (HAS) a ouvert la porte à des « expérimentations » régionales, pour en vérifier l’implémentation en France et les modalités d’organisation. Un dépistage individuel, « opportuniste » chez un sujet fumeur ou ex-fumeur à risque, doit respecter les critères d’éligibilité et les modalités de surveillance ultérieure, définis dans les essais internationaux, sur la taille et l’évolution volumétrique d’un nodule dépisté sur deux scanners successifs.
Pourquoi dépister le cancer bronchopulmonaire ?
Le cancer bronchopulmonaire répond aux dix conditions proposées par l’Organisation mondiale de la santé pour la mise en place d’une démarche de dépistage.1
1. « La maladie recherchée constitue une menace grave pour la santé publique » : avec 46 000 nouveaux cas annuels en France, dont 40 % de stades métastatiques au diagnostic, le cancer bronchopulmonaire est la première cause de mortalité par cancer, chez l’homme comme chez la femme, avec 33 000 décès annuels.
2. « Un traitement dont l’efficacité est démontrée existe » : la chirurgie guérit 90 % des cancers de stade IA (tumeur de taille inférieure ou égale à 3 cm sans atteinte ganglionnaire ni métastase). La démonstration en est apportée par l’importante base de données constituée pour la huitième édition de la classification TNM.
3. « Des moyens appropriés de diagnostic et de traitement existent » : le système de santé français dispose de scanners, et la chirurgie thoracique des stades précoces bénéficie de l’essor de la vidéochirurgie assistée par robot, permettant des suites plus simples et des incisions plus petites, avec un confort accru pour la réalisation de curages ganglionnaires médiastinaux de qualité.
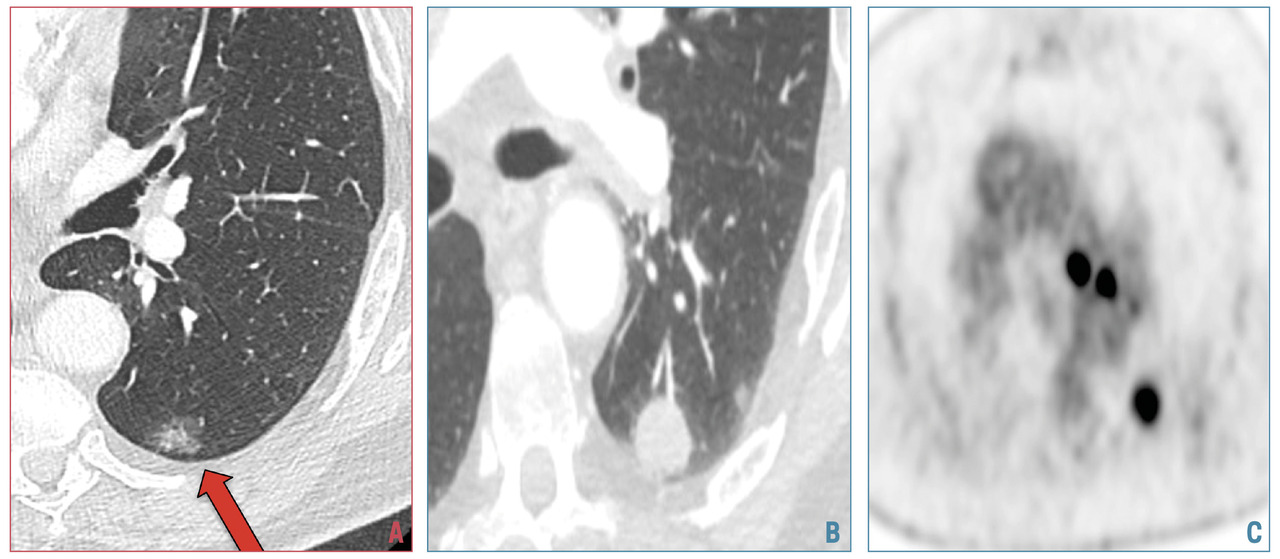
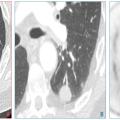
4. « La maladie est décelable pendant une phase de latence ou au début de la phase clinique et l’histoire naturelle de la maladie est connue » :le cancer du poumon est décelable avant d’être cliniquement parlant, pendant une durée variable, dépendant du temps de doublement du cancer. Il s’agit le plus souvent d’un nodule infracentimétrique solide, non calcifié, ou en verre dépoli, totalement asymptomatique, qui précède de plusieurs années le développement de masses pulmonaires plus grosses ou de cancers métastatiques (fig. 1).
6. « Il existe un examen de dépistage efficace » :des essais randomisés ayant inclus des dizaines de milliers de fumeurs à haut risque de cancer pulmonaire ont montré que le scanner thoracique faiblement irradiant diminue le risque de décès par cancer du poumon de ces fumeurs de 24 à 33 %.
7. « Cet examen est acceptable par la population » :le scanner faiblement dosé est un examen non invasif, sans contre-indication, largement disponible et accessible.
8. « Le choix des sujets qui recevront un traitement est préétabli » : le traitement du cancer bronchopulmonaire est défini par des référentiels reconnus, selon la classification TNM, les stades précoces dépistés relevant dans la plupart des cas d’un traitement chirurgical.
9. « Le coût n’est pas disproportionné par rapport au coût global des soins médicaux » : les études de la littérature montrent le caractère coût-efficace du dépistage du cancer pulmonaire par scanner faiblement irradiant.
10. « Le dépistage ne doit pas être effectué une fois pour toutes, mais doit être continu » : tous les essais ont inclus plusieurs tours successifs de dépistage, et les recommandations prévoient donc un dépistage annuel (voire tous les deux ans pour les lésions non évolutives sur deux tours successifs), pendant une période de vingt-cinq ans, de 50 à 74 ans.
Enfin, un dépistage doit être ciblé. C’est de fait le cas, puisque seule une partie de la population, constituée des grands fumeurs et anciens grands fumeurs, de 50 à 74 ans, est ciblée par le dépistage. Les Britanniques ont suggéré l’envoi à tous les sujets de 50 à 74 ans d’un questionnaire de tabagisme très simple, permettant d’identifier, à partir des patientèles des médecins généralistes, les potentiels candidats.2
Scanner thoracique hélicoïdal à faible dose d’irradiation : l’outil du dépistage
Une dizaine d’études randomisées ont été menées dans le monde. Les principales sont résumées dans le tableau 1 (ne figurent pas les essais qui n’ont comporté qu’un ou deux tours, ni deux essais asiatiques concernant une population différente, avec notamment des non-fumeurs) et leurs résultats détaillés dans le tableau 2.
Deux essais avaient une puissance suffisante pour objectiver une réduction significative de la mortalité spécifique : l’essai National Lung Screening Trial (NLST) et l’essai Nederlands–Leuvens Longkanker Screenings Onderzoek (NELSON).
Essai NLST : scanner faiblement dosé versus radio des poumons
L’essai américain NLST,3 - 5 prospectif et randomisé, a comparé le scanner faiblement dosé à la radiographie pulmonaire. Plus de 53 000 participants âgés de 55 à 74 ans ont été inclus selon le critères suivants : ils devaient être fumeurs ou anciens fumeurs, asymptomatiques, et leur tabagisme cumulé devait être au moins de trente paquets-années ; s’ils étaient anciens fumeurs, ils devaient avoir arrêté depuis moins de quinze ans. L’examen de dépistage (radiographie thoracique ou scanner faiblement dosé) a été réalisé à l’inclusion, puis répété à un et deux ans (soit trois examens). Les scanners étaient considérés comme positifs lorsqu’ils objectivaient des nodules de plus de 4 mm.
Lors des trois « tours » de dépistage de l’étude NLST, le scanner a décelé un nombre élevé de participants avec nodules faussement positifs (bénins). Mais ces sujets n’étaient suivis pour la plupart (97 % des cas) que par des scanners itératifs, sans interventions diagnostiques invasives, l’absence d’évolution dans le temps permettant d’éviterces dernières.
L’objectif principal de cet essai a été atteint, puisque la mortalité spécifique était significativement réduite de 20 % (IC à 95 % : 6,8 - 26,7 % ; p = 0,004), réduction identique à celle atteinte grâce au test Hémoccult annuel dans le dépistage du cancer colorectal.6 La mortalité globale était aussi réduite de 6,7 % (IC à 95 % :1,2 - 13,6 % ; p = 0,02) illustrant, dans une population de fumeurs, l’importante contribution du cancer bronchopulmonaire à cette mortalité globale. Dans cet essai, 320 sujets à risque devaient être testés pour éviter un décès par cancer du poumon.7
NELSON : scanner faiblement dosé ou observation
L’essai européen randomisé NELSON8 a comparé un scanner faiblement dosé à l’absence d’intervention. Par rapport à l’essai NSLT, les participants étaient plus jeunes (50 à 75 ans) et pouvaient avoir moins fumé (plus de 10 cigarettes/j pendant au moins 30 ans ou 15 cigarettes/j pendant au moins 25 ans). Ils devaient avoir interrompu leur tabagisme depuis moins de dix ans. Les scanners étaient réalisés à l’inclusion, puis répétés à un an, deux ans et deux ans et demi. Près de 15 000 sujets ont été randomisés.
Les résultats publiés avec un suivi très prolongé (10 ans) ont montré que, chez les hommes, le taux cumulé de décès par cancer bronchopulmonaire à dix ans était significativement réduit dans le bras dépistage par rapport au bras contrôle : risque relatif de décès (RR) à 0,76 (IC à 95 % : 0,61 - 0,94 ; p = 0,01).Chez les femmes, le bénéfice était plus important mais n’atteignait pas la significativité (RR = 0,67 ; IC à 95 % : 0,38 - 1,14), par manque de puissance statistique (l’effectif n’était que de 2 594 femmes). Globalement, les deux sexes confondus, le risque relatif de décès était diminué de 24 % (RR = 0,76 ; IC à 95 % : 0,61 - 0,9 ; p = 0,01).
Des études de registres récentes ont confirmé ces données. Ainsi, une étude américaine ayant porté sur plus de 700 000 sujets a utilisé les données provenant de la National Cancer Database : aux États-Unis, bien que la mise en place du dépistage scanographique soit lente, elle se serait traduite par une augmentation relative des diagnostics de cancers de stade I curables par rapport aux cancers de stade IV, et par une diminution de la mortalité des malades avec cancer du poumon.9
Deux inconvénients potentiels redoutés du dépistage scannographique
Faux positifs (tumeurs bénignes considérées comme malignes) et surdiagnostic (cancer qui serait passé inaperçu s’il n’avait pas été recherché) sont les risques évoqués pour discuter l’intérêt du dépistage scanographique. Sont-ils réels ?
Faux positifs
Les faux positifs induisent un risque de réalisation d’examens multiples, avec un coût élevé et une morbidité, voire une mortalité, inadmissibles chez des personnes « en bonne santé ».
Pourtant, dans l’étude NLST, la grande majorité des participants ayant une anomalie scanographique n’a pas nécessité d’examens invasifs mais un suivi par imagerie. Seulement 148 endoscopies bronchiques (2,2 %), 57 (0,8 %) abords histologiques directs (endoscopie ou ponction sous scanner) et 41 (0,6 %) thoracotomies ont été réalisés parmi les 6 779 faux positifs du bras scanner (déterminés comme tels par le suivi évolutif), de sorte que peu de complications sont survenues.
Dans l’étude française DEP KP 80 du département de la Somme,10 dont l’organisation rigoureuse a associé étroitement pneumologues, radiologues et médecins généralistes du département – preuve qu’une telle organisation est possible en France –, le seul examen invasif pratiqué chez des patients faux positifs a permis de diagnostiquer et traiter une malformation adénoïde kystique.
Pour réduire ce taux de faux positifs, l’étude NELSON a défini les « positifs » non seulement sur le volume initial de la tumeur mais aussi sur le temps de doublement de ce volume, calculé sur un deuxième scanner faiblement dosé, réalisé chez les personnes qui n’ont ni un scanner « positif » (≥ 10 mm, soit ≥ 500 mm3) ni un scanner « négatif » (< 5 - 6 mm, soit < 50 mm3). Chez les individus de ce groupe dit « intermédiaire », l'évolution volumétrique entre les deux scanners permet de calculer le temps de doublement : lorsqu’il est inférieur à 400 jours, le dépistage est considéré comme positif, requérant des explorations supplémentaires. S’il est supérieur à 400 jours, un simple suivi annuel est réalisé, le temps de doublement étant recalculé à chaque tour de dépistage. Ainsi, les taux de positifs dans l’essai NELSON ne sont que de 2,6 et 1,8 % aux premier et deuxième tours,10 et le nombre d’examens invasifs est encore plus faible que dans l’étude NLST. Des résultats actualisés de l’étude NELSON ont validé cette méthode avec des valeurs limites plus basses : 100 mm3 (6 mm) et 300 mm3 (8 mm).11 Avec ces règles rigoureuses, la gestion des faux positifs n’est pas un obstacle au déploiement du dépistage.
Surdiagnostic
Un cancer « surdiagnostiqué » est un cancer qui n’aurait jamais été décelé durant la vie du patient s’il n’avait pas été dépisté, et qui n’aurait entraîné ni symptôme ni décès. Ce risque est évoqué pour le dépistage du cancer de la prostate, cancer particulièrement « indolent » du dernier tiers de vie. Il a été suggéré que quelques cancers pulmonaires, comme certains adénocarcinomes in situ, se traduisant par des opacités peu denses, dites « en verre dépoli », pourraient être des cancers « indolents », qui n’auraient pas été à l’origine du décès du patient s’ils n’avaient pas été décelés.
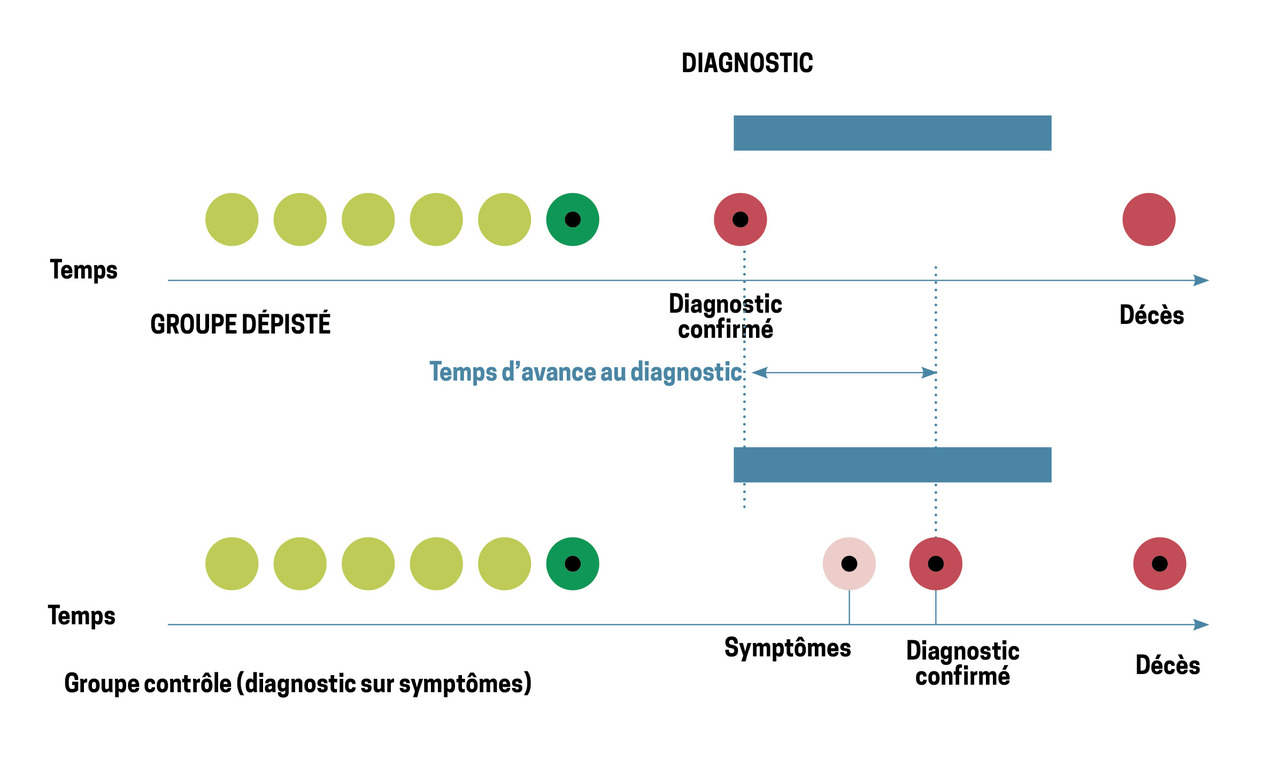
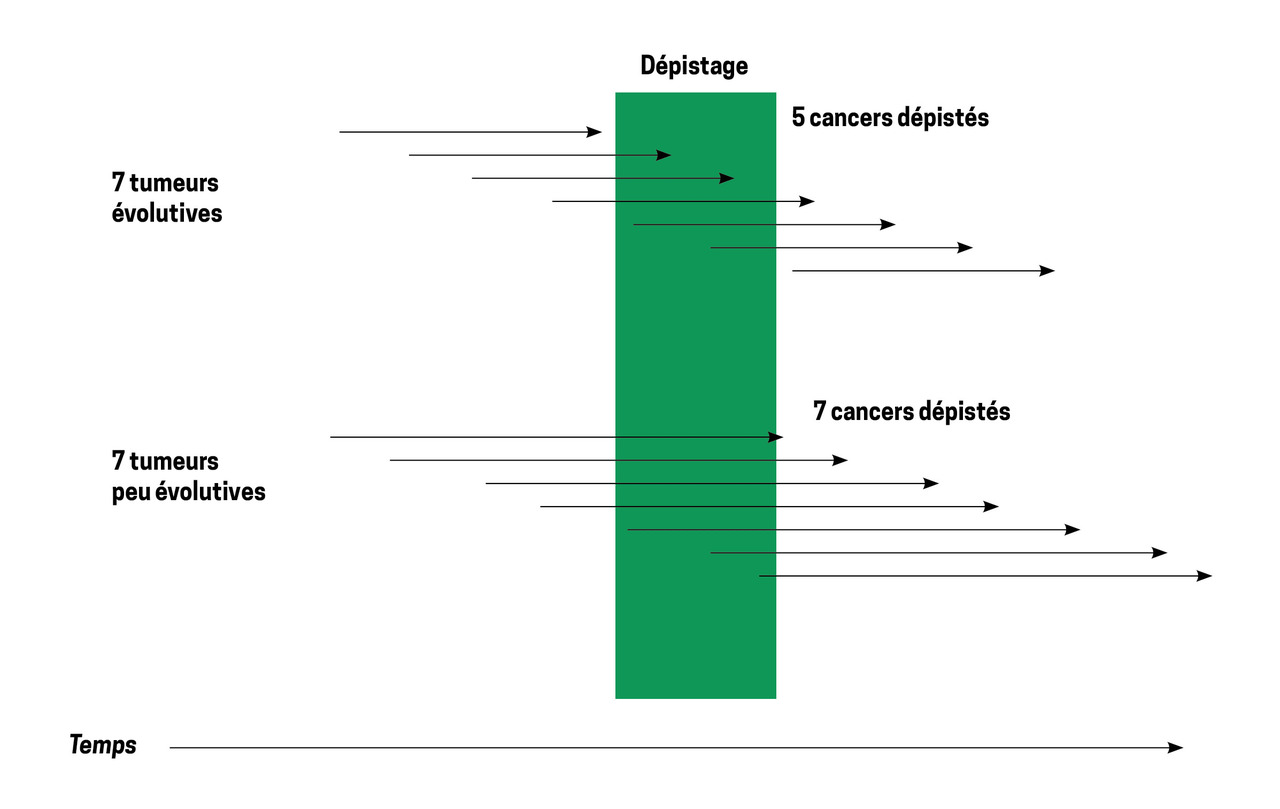
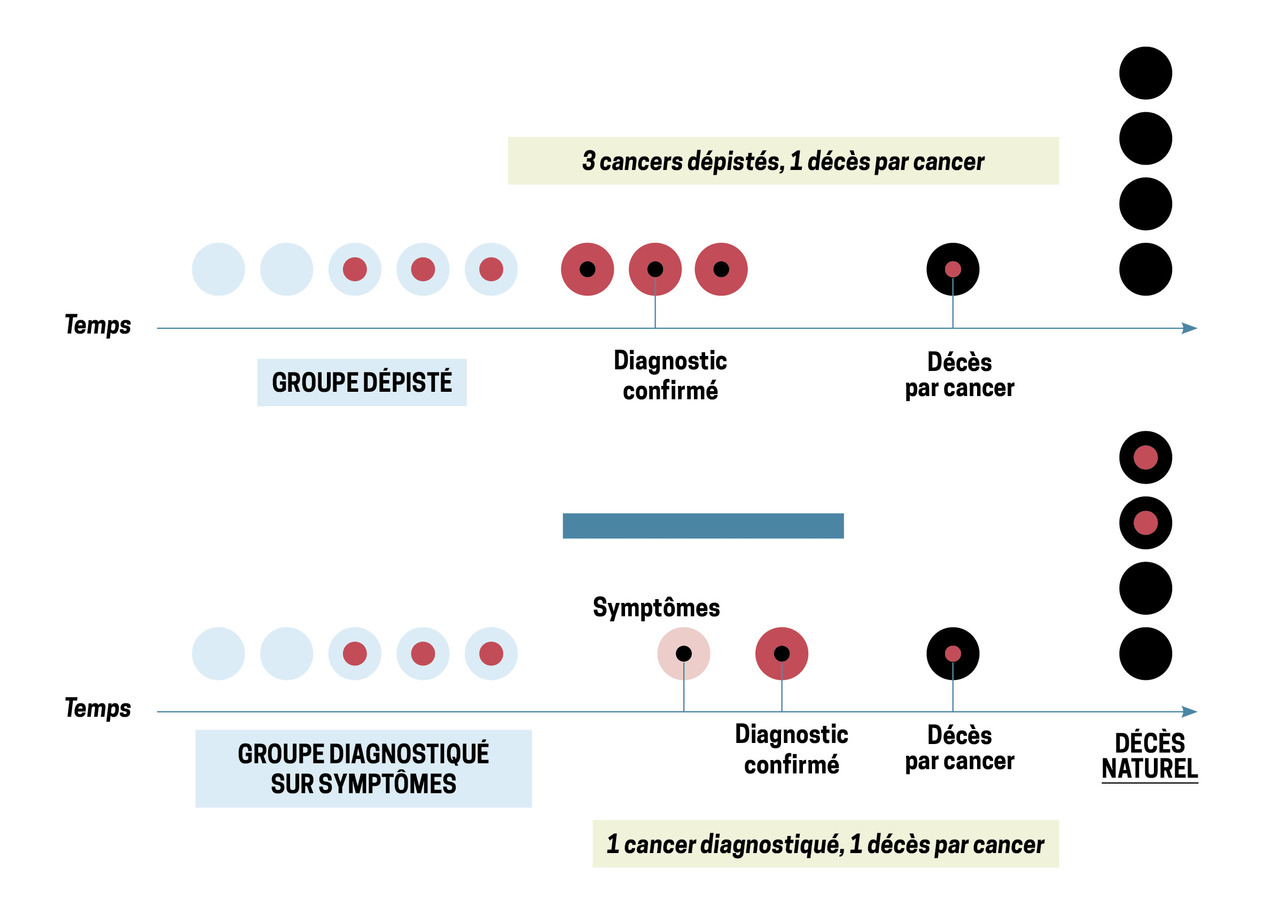
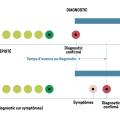
Dans l’étude NLST, le risque de surdiagnostic a été initialement estimé à 18,5 % mais avec un recul de seulement six ans, la majorité étant composée de cancers bronchiolo-alvéolaires sous forme de verre dépoli pur.12 Cependant, une partie de cet excès était liée non pas à un surdiagnostic mais à l’un des deux autres biais classiquement rencontrés dans le dépistage des cancers : le biais d’avance au diagnostic (fig. 2) et le biais de lenteur d’évolution (fig. 3) qui, comme le biais de surdiagnostic (fig. 4), peuvent induire un excès de cancers dans le bras dépistage. De fait, seul un très long recul permet de définir la part qui revient réellement au surdiagnostic et, dans une nouvelle évaluation effectuée avec un recul cette fois de onze ans, le surdiagnostic n’était plus estimé qu’à 3 %.13
Il est ainsi difficile, comme l’illustre la figure 4, de penser qu’il n’est pas utile de dépister une maladie susceptible d’évoluer, certes lentement et de façon insidieuse, mais qui peut tout de même entraîner le décès, après progression métastatique au bout de quelques années.
Le dépistage scannographique est-il actuellement recommandé ?
À l’étranger
Les recommandations des sociétés nord-américaines sur le dépistage du cancer bronchopulmonaire (American Society of Clinical Oncology [ASCO], American College of Clinical Pharmacy [ACCP], American Association for Thoracic Surgery [AATS], United States Preventive Services Task Force [USPSTF], National Comprehensive Cancer Network [NCCN]) sont détaillées dans le tableau 3.
En Grande-Bretagne, le National Health Service (NHS) a annoncé, en juin 2023, son programme de dépistage ciblé chez les fumeurs ou anciens fumeurs de 55 à 73 ans, par scanner tous les deux ans – soit un coût de 270 millions de livres par an –, afin de dépister et traiter de façon curative 9 000 cas de cancers du poumon chaque année.2
En France
En France, une analyse de la littérature consacrée à ce sujet publiée dès 2013 par l’Intergroupe francophone de cancérologie thoracique (IFCT) et plusieurs sociétés savantes a été actualisée en 2021, intégrant la publication récente des résultats de l’étude NELSON, dont ils faisaient leurs les critères d’inclusion et modalités d’évaluation.14 Après un premier avis négatif en 2016 fondé sur une analyse de la littérature excluant l’essai NLST, au prétexte que le bras comparateur était la radiographie thoracique, la Haute Autorité de santé a revu sa position en 2021 : elle reconnaît que la démonstration a été faite que le dépistage scannographique peut sauver des vies ; elle précise néanmoins que son implémentation en France, sur un mode organisé à l’échelle nationale, nécessite d’autres études, ne serait-ce que pour s’assurer de l’adhésion à ce nouveau dépistage.
Pour les autres dépistages en France, l’adhésion reste médiocre : elle était estimée en 2021 par Santé publique France à 34 % pour la recherche de sang dans les selles dans le dépistage du cancer colorectal, et à 49 % pour la mammographie dans le dépistage du cancer du sein.
C’est dans ce cadre que six études ont été initiées en France : l’étude CASCADE de l’AP-HP, ciblant 2 400 femmes fumeuses (autant que dans l’étude la plus large, NLST) ; l’étude DP KP80 de la Somme qui aborde son quatrième tour de dépistage (n = 1 307) ; l’étude ACAPULCO en Corse (n = 800) ; DA CAPO promue par le CHU de Nice (n = 2 600), avec des questions spécifiques sur les biomarqueurs ; le projet lyonnais ILYAD (n = 838), avec un camion de dépistage pouvant cibler, comme dans les études britanniques,15 les populations précaires ; le programme INTERCEPTION de l’institut Gustave-Roussy, qui ambitionne d’inclure 2 500 participants avec, là encore, un axe biomarqueurs.
Ainsi, l’implémentation française devrait être démontrée, si tant est qu’elle ne le soit pas déjà, conduisant la HAS à valider le dépistage scannographique organisé au niveau national, afin de dépasser le dépistage opportuniste et diminuer la mortalité par cancer bronchopulmonaire d’au moins 20 % à l’échelon du pays tout entier.
Que dire à vos patients ?
Le dépistage annuel par scanner thoracique en basse irradiation est efficace pour dépister un cancer pulmonaire chez des fumeurs actifs ou anciens fumeurs sevrés depuis moins de dix ans et asymptomatiques, entre 50 à 74 ans.
Une fois débuté, pour être efficace, le dépistage doit être continu, répété tous les ans ; puis, en l’absence d’anomalie sur deux scanners annuels successifs, il doit être effectué tous les deux ans.
La découverte d’un nodule pulmonaire dense (solide) ne débouche pas forcément sur un geste diagnostique (biopsie) ou thérapeutique invasif.
Cette stratégie de dépistage permet de diminuer le risque de décès par cancer pulmonaire de plus de 24 % chez l’homme et de 33 % chez la femme.
Le scanner permet aussi de détecter d’autres maladies liées au tabac, comme l’emphysème, la fibrose pulmonaire ou les calcifications coronariennes, qui peuvent bénéficier d’un traitement spécifique.
Enfin, le dépistage constitue l’opportunité idéale pour arrêter du fumer, démarche dans laquelle le patient est accompagné sur le long terme par son médecin traitant et des spécialistes du sevrage tabagique.
2. Gourd E. Middle-age lung screening for everyone who has smoked. Lancet Oncol 2023;S1470-2045(23)00325-X.
3. Aberle DR, Adams AM, Berg CD, et al. Reduced Lung-Cancer Mortality with Low-Dose Computed Tomographic Screening. N Engl J Med 2011;365:395-409.
4. Church TR, Black WC, Aberle DR, et al. Results of initial low-dose computed tomographic screening for lung cancer. N Engl J Med 2013;368:1980-91.
5. Aberle DR, DeMello S, Berg CD, et al. Results of the two incidence screenings in the National Lung Screening Trial. N Engl J Med 2013;369:920-31.
6. Shaukat A, Mongin S, Geisser M, et al. Long-term mortality after screening for colorectal cancer. N Engl J Med 2013;369(12):1106-14.
7. Manser R, Lethaby A, Irving LB, et al. Screening for lung cancer. The Cochrane database of systematic reviews. 2013;6:CD001991.
8. de Koning HJ, van der Aalst CM, de Jong PA, et al. Reduced Lung-Cancer Mortality with Volume CT Screening in a Randomized Trial. N Engl J Med 2020;382:503-13.
9. Potter AL, Rosenstein AL, Kiang MV, et al. Association of computed tomography screening with lung cancer stage shift and survival in the United States: quasi-experimental study. Brit Med J 2022;376:e069008.
10. Leleu O, Basille D, Auquier M, et al. Lung cancer screening by low-dose CT scan: baseline results of a French prospective study. Clin Lung Cancer 2020;21:145-52.
11. van Klaveren RJ, Oudkerk M, Prokop M, et al. Management of lung nodules detected by volume CT scanning. N Engl J Med 2009;361:2221-913.
12. Horeweg N, van Rosmalen J, Heuvelmans MA, et al. Lung cancer probability in patients with CT detected pulmonary nodules: a prespecified analysis of data from the NELSON trial of low-dose CT screening. Lancet Oncol 2014;15:1332-41.
13. National Lung Screening Trial Research Team. Lung Cancer Incidence and Mortality with Extended Follow-up in the National Lung Screening Trial. J Thor Oncol 2019;14(10):732-1742.
14. Couraud S, Ferretti G, Milleron B, et al. Intergroupe francophone de cancérologie thoracique, Société de pneumologie de langue française, and Société d'imagerie thoracique statement paper on lung cancer screening. Diagn Interv Imaging 2021;102:199-211.
15. Crosbie P, Balata H, Evison M, et al. Implementing lung cancer screening: baseline results from a community-based 'Lung Health Check' pilot in deprived areas of Manchester. Thorax 2019;74(4):405-9.
16. Patz EF Jr, Goodman PC, Bepler G. Screening for lung cancer. N Engl J Med 2000;343:1627-33.

 Encadrés
Encadrés