Les infections sexuellement transmissibles (IST) sont fréquemment d’origine virale ou bactérienne. Pourtant, certains dermatophytes ont récemment été identifiés comme agents responsables d’IST. C’est notamment le cas du génotype ITS VII de Trichophyton mentagrophytes (TMVII), responsable depuis 2021 de nombreux cas de dermatophyties survenant chez des hommes ayant des relations sexuelles avec des hommes (HSH) ;1 - 3 mais d’autres espèces sont également en cause.4 Ces dermatophyties se distinguent par une présentation clinique parfois sévère et trompeuse et, souvent, des difficultés thérapeutiques. L’émergence de TMVII, maintenant bien documentée en France (en région parisienne et dans d’autres grandes villes comme Lyon, Nice, Strasbourg…), en Europe (notamment à Berlin,5 Barcelone6 et Milan7) et aux États-Unis,8 impose une vigilance accrue. Ces infections posent en effet un défi nouveau, tant sur le plan diagnostique que thérapeutique et préventif.
Contexte épidémiologique et mécanismes de transmission
Les dermatophytes sont des champignons kératinophiles dont les espèces les plus fréquemment impliquées en pathologie humaine appartiennent aux genres Trichophyton, Microsporum et Epidermophyton. Leur transmission est classiquement décrite comme indirecte, via des surfaces contaminées (piscine, tapis de sport, serviettes), ou directe, interhumaine (intrafamiliale, sports de combat…) ou à partir d’animaux réservoirs.
Ils sont responsables de mycoses superficielles fréquentes au niveau de la peau, des cheveux ou des ongles.
Certaines souches (TMVII) de l’espèce T. mentagrophytes, considérée comme zoophile, montrent une adaptation à la transmission interhumaine, probablement facilitée par le contact cutané prolongé au cours des rapports sexuels.9 En effet, ces derniers impliquent des frictions, de la transpiration et parfois des microtraumatismes de la peau ou des follicules pileux, qui favorisent sans doute la pénétration fongique.
De même, les contacts cutanés au cours des relations sexuelles ont été un mode important de transmission du virus Mpox au cours de l’épidémie de 2022.
D’autres pathogènes de la peau ou des poils tels que Sarcoptes scabiei ou Pthirus pubis ont un mécanisme de transmission similaire et sont également considérés comme des agents d’IST.
À ce jour, l’infection à TMVII touche essentiellement des patients HSH, usagers de la prophylaxie préexposition du VIH (PrEP) ou infectés par le VIH, dans un contexte de partenaires multiples et d’antécédents d’IST.1,2,4,7,8 La co-infection par d’autres IST est fréquente.1,2,4,7 D’autres populations peuvent toutefois être atteintes de dermatophyties sexuellement transmises (DST) : des cas ont été décrits chez des femmes travailleuses du sexe.10
Outre TMVII, d’autres espèces ont été identifiées dans des cas de DST, notamment M. canis et T. rubrum4 et, de façon plus rare mais particulièrement préoccupante, T. indotineae.11 En effet, T. indotineae est responsable de lésions cutanées étendues et est fréquemment associé à des difficultés thérapeutiques, liées à un taux élevé de résistance à la terbinafine (antifongique par voie orale de première intention pour le traitement des dermatophyties nécessitant un traitement systémique).
Présentation clinique
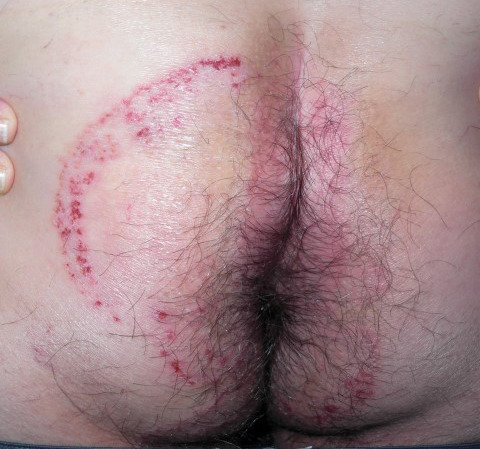
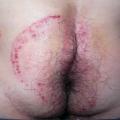
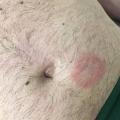
Après une incubation d’une durée variable – de quelques jours à deux mois –,2 des lésions souvent érythématosquameuses, circinées, avec une bordure active apparaissent. Elles siègent préférentiellement au niveau des zones de contact sexuel, comme le siège (fig. 1), le pubis, le scrotum, la racine des cuisses (fig. 2), le visage (notamment la barbe), mais peuvent également concerner d’autres zones du corps, comme les cuisses, l’abdomen (fig. 3), voire le tronc.1 - 3,7
Dans certains cas, les lésions peuvent être très inflammatoires (kérions), pustuleuses ou nodulaires (type granulome de Majocchi). Des sycosis de la barbe ou de la moustache ont en particulier été décrits dans plusieurs cas récents.1 - 3,7 Le rasage semble favoriser la pénétration du dermatophyte en profondeur et le développement de ces formes sévères, qui nécessitent un traitement systémique prolongé.9 Cet aspect inflammatoire peut être trompeur, mimant une folliculite ou une surinfection bactérienne, retardant souvent le diagnostic.
Diagnostic positif et diagnostics différentiels
Le diagnostic repose sur un examen clinique évocateur et doit être impérativement confirmé par une analyse mycologique comportant un examen direct associé à une culture sur milieu de Sabouraud avec identification de l’espèce. Le diagnostic d’espèce est parfois complexe en raison de la proximité morphologique entre T. mentagrophytes, T. interdigitale et T. indotineae. Seul le séquençage de la région ITS, disponible dans certains laboratoires spécialisés, permet l’identification de T. mentagrophytes génotype VII.
Le délai entre l’apparition des signes et la réalisation du prélèvement mycologique excède parfois trois à quatre semaines,1,2,4,9 du fait des difficultés du diagnostic clinique. Cela augmente le risque de dissémination de l’infection.
Le diagnostic de DST peut, en effet, être difficile, en particulier chez les patients ayant des lésions atypiques ou ayant déjà reçu des traitements inappropriés (dermocorticoïdes, antibiotiques).1 L’application de dermocorticoïdes peut ainsi parfois masquer les signes typiques de dermatophyties.
Les DST peuvent également mimer d’autres pathologies dermatologiques fréquentes en médecine générale :
- psoriasis (lésions érythémateuses bien limitées dans les plis [psoriasis inversé] ou médaillons de psoriasis du corps facilement confondus avec des lésions de dermatophyties de la peau glabre) ;
- eczéma de contact ou dermite d’irritation (lésions érythématovésiculeuses et suintantes, puis squameuses) ;
- syphilis secondaire (plaques annulaires érythématosquameuses) ;
- folliculite ou surinfection bactérienne (pustules ou nodules douloureux).
Il est important de noter que la localisation des lésions dans des zones de contact sexuel ne suffit pas à elle seule à porter le diagnostic de DST. Il faut impérativement éliminer une auto-inoculation à partir d’un foyer à distance, le plus fréquemment, un pied d’athlète ainsi que des contacts avec des animaux potentiellement source de la contamination (transmission zoophile).
La clé du diagnostic repose donc sur un interrogatoire ciblé (contexte sexuel, voyages, animaux), un examen clinique, et surtout la réalisation d’un prélèvement mycologique. Un prélèvement bactériologique peut être nécessaire pour rechercher une éventuelle surinfection bactérienne ou pour éliminer les diagnostics différentiels. Le diagnostic peut également nécessiter l’aide d’un dermatologue, d’un mycologue ou d’un infectiologue en cas d’évolution atypique, d’échec ou de rechutes après traitement, devant faire suspecter une résistance.
Prise en charge thérapeutique
Les antifongiques locaux semblent avoir une action limitée sur TMVII et sont parfois associés à une aggravation des lésions. Le traitement repose donc le plus souvent sur des antifongiques systémiques. La terbinafine orale (250 mg/j) est recommandée en première intention pour quatre à huit semaines. En cas de contre-indication ou d’échec, l’itraconazole est une alternative.8 Les antifongiques topiques comme l’éconazole ou le ciclopirox peuvent être utilisés en adjuvant pour accélérer la guérison locale, mais ils ne doivent pas être prescrits seuls, surtout dans les formes inflammatoires ou profondes.2
Un contrôle clinique est recommandé après traitement. Au moindre doute, un nouveau prélèvement mycologique doit être réalisé pour s’assurer de la guérison. Le dépistage et le traitement des partenaires atteints sont tout aussi indispensables pour prévenir les recontaminations et la diffusion de l’infection.
Aucune résistance à la terbinafine n’a été rapportée à ce jour pour TMVII.
En cas de persistance des lésions ou de rechute, il est recommandé de :
- vérifier l’observance thérapeutique ;
- s’assurer que la durée de traitement a été suffisante ;
- écarter une source de réinfection (linge, partenaires) ;
- éliminer une résistance (jamais documentée pour l’instant avec TMVII mais devant faire suspecter T. indotineae) ;
- rechercher une eczématisation secondaire, parfois liée au traitement topique ou au champignon lui-même.
Rôle du médecin généraliste et prévention
Le médecin généraliste joue un rôle central dans la détection de ces cas. La démarche est la suivante :
- évoquer une DST devant tout prurit associé à des lésions érythématosquameuses ou inflammatoires des zones évocatrices de transmission sexuelle ;
- interroger sur les pratiques sexuelles (rapports anaux, oraux, massages, partenaires multiples) ;
- éviter la prescription de dermocorticoïdes ou d’antibiotiques sans diagnostic certain ;
- faire réaliser un prélèvement mycologique ;
- rechercher d’autres IST associées ;
- prévenir le patient qu’il peut rester contagieux pendant les premières semaines de traitement ;
- réaliser un suivi médical jusqu’à guérison complète.
Des mesures d’hygiène simples peuvent être proposées : laver le linge à 60 °C, ne pas partager les serviettes. L’abstinence sexuelle est souhaitable jusqu’à la fin du traitement ou, à défaut, l’éviction des contacts avec les zones infectées. En prévention de la transmission sexuelle des champignons, il apparaît pertinent de conseiller aux patients ayant des facteurs de risque de se doucher à l’eau et au savon après un rapport sexuel, même si l’intérêt de cette recommandation n’a pas été démontré scientifiquement.
Que dire à vos patients ?
« Ce champignon se transmet par contact intime, souvent lors des rapports sexuels. » Ce n’est pas une IST classique. La maladie n’est pas grave mais assez contagieuse.
« Le traitement est efficace, mais long. » Il faut bien suivre les consignes et éviter les rapports sexuels jusqu’à guérison complète.
« Prévenez vos partenaires. » Pour éviter les recontaminations, les partenaires doivent être alertés, examinés et éventuellement traités.
« Protégez votre entourage. » Ne partagez pas votre linge, lavez les draps et serviettes à 60 °C.
Plus d’informations sur https ://bit.ly/4oY7nYy
2. Jabet A, Berot V, Chiarabini T, et al. T. mentagrophytes ITS genotype VII infections among men who have sex with men in France an ongoing phenomenon. J Eur Acad Dermatol Venereol 2025;39:407-15.
3. Porquet A, Wirbel C, Godinot M, et al. Dermatophytoses à Trichophyton mentagrophytes de génotype VII : une IST émergente de présentation clinique polymorphe. Annales de dermatologie et de vénéréologie - FMC 2024;4:A237.
4. Chromy D, Osmers AM, Bauer WM, et al. Sexually transmitted dermatophytes in MSM as tinea genitalis. Open Forum Infect Dis 2023;10:ofad519.
5. Kämmerer K, Huynh J, Deutsch C, et al. Trichophyton mentagrophytes type VII: cohort study on patient characteristics, clinical features, disease course, and treatment. J Dtsch Dermatol Ges 31 juillet 2025.
6. Descalzo V, Martín MT, Álvarez-López P, et al. Trichophyton mentagrophytes Genotype VII and Sexually Transmitted Tinea: An Observational Study in Spain. Mycoses 2025;68:e70049.
7. Bortoluzzi E, Gasparini G, Carugno A, et al. Tinea barbae caused by T. mentagrophytes genotype VII. J Eur Acad Dermatol Venereol 2025;39:e187-90.
8. Zucker J, Caplan AS, Gunaratne SH. Notes from the field: Trichophyton mentagrophytes Genotype VII – New York City, April-July 2024. MMWR Morb Mortal Wkly Rep 2024;73:985-8.
9. Kupsch C, Czaika VA, Deutsch C, Gräser Y. T. mentagrophytes genotype VII: A new zoophilic dermatophyte causing sexually transmitted infections. J Dtsch Dermatol Ges 2019;17:493-501.
10. Otero L, Palacio V, Vázquez F. Tinea cruris in female prostitutes. Mycopathologia 2002;153:29‑31.
11. Spivack S, Gold JAW, Loc khart SR et al. Potential sexual transmission of antifungal-resistant Trichophyton indotineae. Emerg Infect Dis 2024;30:807-9.

 Encadrés
Encadrés