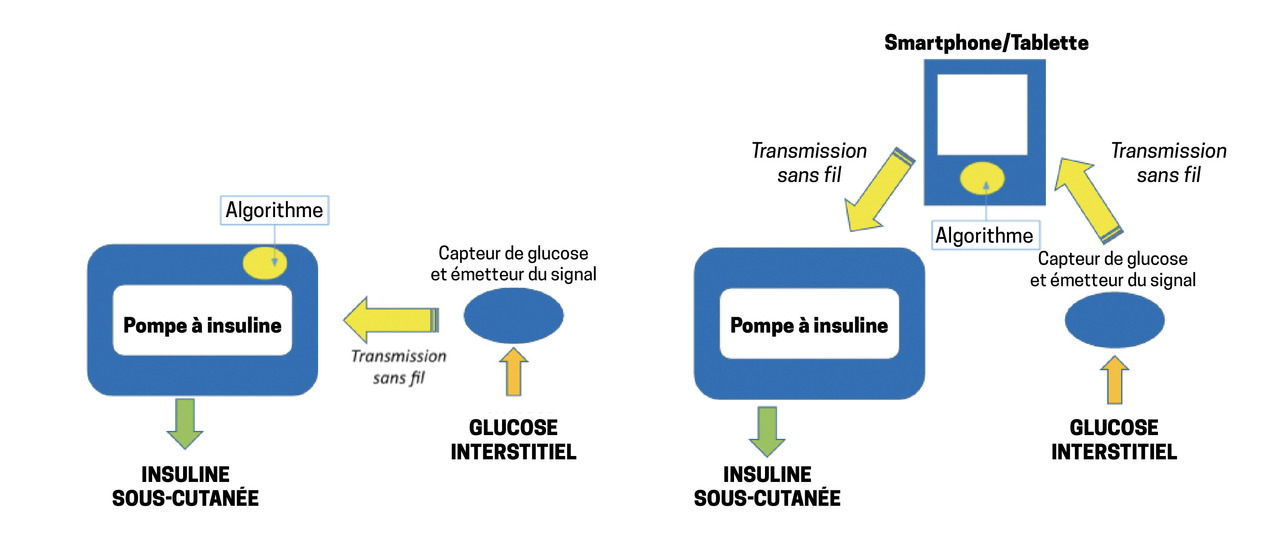
L’insulinothérapie automatisée dite « en boucle fermée », plus couramment dénommée « pancréas artificiel », constitue un espoir depuis près de quarante ans pour les patients atteints de diabète de type 1. Le projet est aujourd’hui concrétisé : des capteurs sous-cutanés peuvent désormais mesurer le glucose interstitiel en continu ; ils sont connectés à un algorithme de contrôle maîtrisant une pompe miniaturisée qui perfuse l’insuline en sous-cutané. Ces systèmes ajustant l’administration d’insuline en fonction de la glycémie parviennent désormais au stade de la commercialisation mais restent « hybrides » : l’automatisation ne concerne que l’ajustement des besoins de base. Les situations marquées par une variation rapide de la glycémie (repas, activité physique) nécessitent toujours une intervention du patient.
Le résultat d’une longue histoire
La difficulté à couvrir les besoins changeants en insuline des patients diabétiques de type 1 a conduit, dès les années 1970, à chercher des dispositifs capables d’administrer l’insuline en fonction des niveaux et tendances d’évolution de la glycémie afin de l’amener et la maintenir à des taux proches de la normale.
Un système d’abord hospitalier
Cet objectif a été atteint par plusieurs équipes (en Europe et en Amérique du Nord), au moyen d’une mesure continue intraveineuse de la glycémie, d’une perfusion intraveineuse d’insuline (voire de glucose) et d’algorithmes de contrôle (prenant en compte la différence entre la glycémie instantanée et la glycémie-cible et la rapidité de variation de la glycémie au fil du temps). Ces systèmes dénommés « pancréas artificiels » étaient efficaces « au lit du malade » mais non ambulatoires ; ils étaient donc confinés à des travaux de recherche hospitaliers.
Pompes portables utilisant la voie sous-cutanée
Dans les années 1980-90, grâce aux progrès de la micro-informatique, des pompes portables utilisant la voie sous-cutanée (SC) pour perfuser l’insuline ont été développées. À la fin du XXe et au début du XXIe siècle, des capteurs de glucose électro-enzymatiques insérés sous la peau ont enfin permis une mesure fiable du glucose interstitiel en continu pendant quelques jours, mesure étalonnée sur des glycémies itératives ponctuelles. Les progrès de la connectique ont alors réactivé le projet de concevoir des dispositifs permettant une administration ambulatoire sous-cutanée d’insuline, selon les relevés continus de glycémie et grâce à des algorithmes de contrôle.1
De la réduction des hypoglycémies…
La première approche a visé la réduction des hypoglycémies : la mesure continue du glucose (CGM) est communiquée sans fil à la pompe à insuline. Celle-ci héberge un algorithme simple d’arrêt dela perfusion d’insuline (jusqu’à une durée de 2 heures) lors du franchissement d’un seuil déterminé de glycémie, estimé à partir des données de CGM et si le patient ne perçoit pas lui-même l’hypoglycémie. Ce dispositif s’est effectivement montré efficace pour réduire la durée et la profondeur des hypoglycémies, en particulier la nuit.
... à leur prédiction
Une étape complémentaire a été franchie en intégrant une composante prédictive fondée sur la vitesse de décroissance glycémique : lorsque les données de CGM prévoient le franchissement d’un seuil (prédéterminé) d’hypoglycémie dans les trente minutes, la perfusion d’insuline est interrompue. La pompe reprend sa fonction quand le risque prédit d’hypoglycémie disparaît, ou sur intervention du patient. Ce système permet encore une réduction des hypoglycémies.2 Il a été commercialisé par Medtronic (système MiniMed 640G). Un système similaire vient d’être développé par la société Tandem (système Tandem Basal-IQ).
Réduction du temps passé en hyperglycémie
Après une attente de près de quarante ans, les premiers systèmes ambulatoires d’insulinothérapie automatisée sont aujourd’hui disponibles. Leur spécificité par rapport aux dispositifs précédemment cités est de réduire en sus le temps passé en hyperglycémie. Combinant une mesure continue du glucose, une pompe à insuline et un algorithme de contrôle, ces systèmes portables visent à maintenir la glycémie en permanence dans un intervalle de sécurité fixé entre 0,7 et 1,8 g/L, ou à ramener et maintenir la glycémie à un niveau-cible prédéfini (
Des essais en vie réelle ont montré leur sécurité et leur efficacité. Mais ces systèmes demeurent incomplètement automatisés, d’où leur nom de « pancréas artificiels hybrides » : ils nécessitent l’intervention des utilisateurs lors des variations glycémiques rapides attendues. Ainsi, l’intervention du patient est nécessaire avant la prise alimentaire pour programmer un bolus proportionnel au niveau glycémique et aux glucides consommés. De même, en cas d’activité physique exposant à un risque d’hypoglycémie, l’annonce faite par le patient à l’algorithme relève le niveau de la glycémie-cible, rendant ainsi l’algorithme moins « agressif » dans ses commandes de correction. L’éducation des patients au fonctionnement de l’algorithme, à ses bénéfices et à ses risques est nécessaire pour en obtenir les avantages et prévenir d’éventuelles déceptions.
« Boucle fermée » : sûre et efficace
Le recours croissant des patients diabétiques de type 1 au traitement par pompe à insuline (environ 70 000 en France) et la disponibilité de capteurs de glucose sous-cutanés effectuant une mesure continue de plus en plus fine ont incité à élaborer les premiers systèmes d’insulinothérapie automatisée. Leurs algorithmes (dont le choix fait débat) ont été testés successivement en simulation (« in silico »), dans des centres d’essais cliniques, dans un environnement proche de l’ambulatoire (à l’hôtel, par exemple) puis en vie réelle.
Système Medtronic MiniMed 670G
Ce système a été le premier pancréas artificiel commercialisé aux États-Unis après approbation de la Food and Drug Administration (FDA). Il délivre l’insuline en fonction du niveau glycémique, de sa vitesse de variation, du temps nécessaire pour atteindre la cible et de l’insuline active, avec annonce nécessaire des repas par le patient. Sur la base des glucides alimentaires déclarés, des ratios individuels insuline/grammes de glucides et de l’estimation de l’insuline active, un calculateur de bolus propose une quantité d’insuline pour couvrir le repas que valide le patient. De la même façon, l’annonce d’une activité physique par le patient abaisse la cible glycémique visée par l’algorithme, pour réduire le risque d’hypoglycémie.
L’étude prospective observationnelle de sécurité qui a permis l’approbation de ce système a montré chez l’adulte une augmentation moyenne du temps passé dans la cible glycémique 0,7-1,8 g/L sur trois mois (de 68,8 à 73,8 %), une réduction du temps passé sous 0,7 g/L (de 1,1 à 0,6 %) et une baisse de l’HbA1c (de 7,3 à 6,8 %). Chez l’adolescent, elle a également montré une augmentation moyenne du temps passé dans la cible 0,7-1,8 g/L sur trois mois (de 60,4 à 67,2 %), une réduction non significative du temps passé sous 0,7 g/L (de 0,7 à 0,5 %) et une baisse de l’HbA1c (de 7,7 à 7,1 %). Aucune hypoglycémie sévère n’a été rapportée, et seuls 11 cas d’hyperglycémie sévère ont été relatés (dont 5 liés à des problèmes de système ou de logiciel).3 Une autre étude, menée chez l’enfant de 7 à 13 ans, a rapporté récemment une augmentation moyenne du temps passé dans la cible 0,7-1,8 g/L sur trois mois (de 56,2 à 65 %).4 Le système 670G a évolué vers le système 780G mis à disposition en France.
Algorithmes prédisant l’évolution glycémique
L’adjonction d’algorithmes qui prédisent l’évolution glycémique améliore le système. La plupart des groupes de recherche ont développé des algorithmes fondés sur une prévision de l’évolution glycémique au cours des heures à venir en fonction de l’insuline administrée et d’après la mesure continue de la glycémie. La perfusion d’insuline est ainsi ajustée afin que la glycémie reste dans un intervalle-cible ou atteigne une valeur-cible de référence. L’évolution glycémique est prédite selon un modèle d’action de l’insuline. Ces algorithmes nécessitent également une annonce des repas et de l’activité physique pour délivrer des bolus préprandiaux ou modifier la cible glycémique, et ainsi réduire les hyperglycémies postprandiales et les hypoglycémies à l’effort.
Afin de diminuer plus spécifiquement le risque d’hypoglycémie, un module algorithmique complémentaire peut être adjoint. Ce dernier inhibe les commandes de l’algorithme principal en cas de prédiction d’hypoglycémie. Ces algorithmes ont fait à ce jour l’objet des études cliniques les plus longues (atteignant 6 mois), faisant appel à des schémas randomisés qui permettent de comparer le fonctionnement en boucle fermée à l’utilisation d’une pompe et d’une mesure continue de la glycémie par les patients. Des relations significatives ont pu être démontrées entre le temps passé en boucle fermée et le temps passé dans l’intervalle-cible consensuel 0,7-1,8 g/L ou l’HbA1c.5
Systèmes bihormonaux : moins d’hypoglycémies, plus de contraintes
Plusieurs équipes de recherche (Boston, Montréal, Oregon) ont évalué des pancréas artificiels bihormonaux associant une perfusion d’insuline et de glucagon pour mieux prévenir le risque hypoglycémique. Leurs performances, généralement comparées à celles d’une pompe à insuline gérée par les patients sans mesure continue du glucose, ont des caractéristiques voisines de celles des systèmes automatisés ne perfusant que de l’insuline, avec cependant un moindre temps passé en hypoglycémie, surtout en postprandial tardif et lors d’un exercice physique. Le bénéfice du glucagon apparaît surtout lorsque la cible glycémique fixée est plus basse.
Les contraintes d’un double système de perfusion, plus encombrant, la nécessité de changer quotidiennement la cartouche de solution de glucagon peu stable à température ambiante, l’innocuité inconnue de la perfusion de glucagon de façon prolongée sont à mettre en balance avec les bénéfices obtenus sur le contrôle glycémique par rapport à la seule perfusion d’insuline.
Des résultats convaincants mais avec un recrutement favorable
Une méta-analyse a été publiée en 2018 dans le British Medical Journal. Il s’agissait d’une revue systématique des études publiées sur des modèles de pancréas artificiels soit en période nocturne seule soit 24 heures/24, avec ou sans perfusion de glucagon. Il en ressort que l’insulinothérapie automatisée améliore de 9,62 % le temps passé dans la cible glycémique 0,7-1,8 g/L (intervalle de confiance à 95 % [IC à 95 %] : 7,54- 11,70) sur 24 heures et de 15,15 % la nuit (IC à 95 % : 12,21- 18,09). Le temps passé sur 24 heures au-dessus de 1,8 g/L est réduit de 8,52 % (IC à 95% : −11,14 - −5,9) ; le temps passé sur 24 heures en-dessous de 0,7 g/L est réduit de 1,49 % (IC à 95% : −1,86 - −1,11 %). La moyenne glycémique n’est que modestement réduite (0,09 g/L ; IC à 95 % : 0,05-0,12) mais l’HbA1c l’est plus nettement (-0,26 % ; IC à 95 % : −0,38- −0,13).6
L’interprétation de ces résultats cumulés doit cependant considérer qu’au moment de leur inclusion dans les essais, les patients n’avaient pas un très mauvais contrôle glycémique (HbA1c entre 7 et 9 %). De plus, ils n’avaient eu d’épisode ni d’hypoglycémie sévère ni d’acidocétose au cours des six à douze mois précédant l’inclusion. Enfin, l’accompagnement de sécurité par les équipes investigatrices dépasse dans les études celui des patients diabétiques de type 1 en vie courante. Il est ainsi impossible de connaître les bénéfices et les risques de l’utilisation de ces systèmes automatisés chez des patients ayant un défaut de contrôle important de leur diabète marqué par une HbA1c très élevée et/ou des hypoglycémies sévères.
Perspectives de commercialisation des systèmes d’insulinothérapie automatisée
Système Medtronic MiniMed 670G
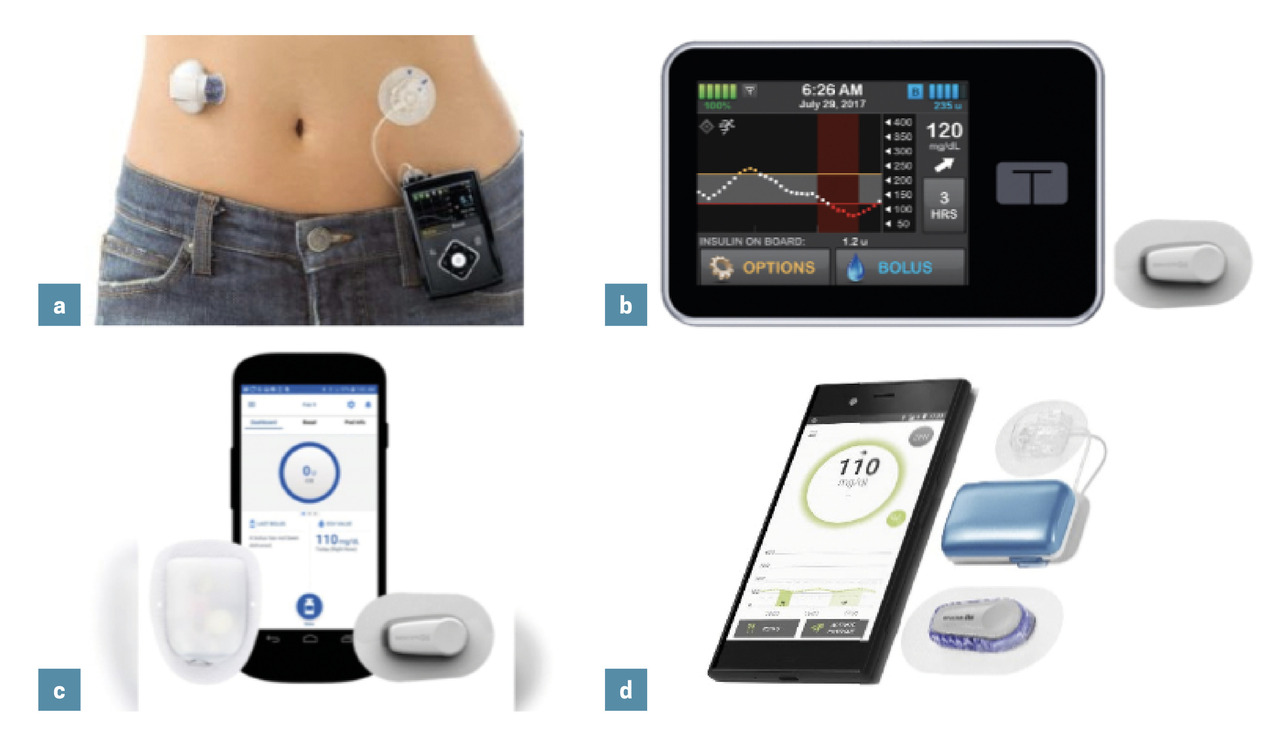
Comme indiqué plus haut, ce système a été le premier à être approuvé pour le traitement du diabète de type 1 (fig. 2a). Lancé sur le marché américain durant l’été 2017, il a été adopté par plusieurs dizaines de milliers de patients diabétiques de type 1 traités préalablement par pompe à insuline ou non.
Le pourcentage d’abandon au cours des six premiers mois a été cependant élevé, en particulier chez les adolescents :7 les quatre mesures glycémiques capillaires par jour nécessaires à l’étalonnage du capteur de glucose, la nécessité d’annoncer les repas, leur gestion par des bolus validés par les patients, les limites de sécurité imposées par le système pour le fonctionnement en boucle fermée (notamment quantité maximale autorisée de perfusion d’insuline sur des tranches de 2 heures) ont concouru aux abandons. Ce constat illustre l’importance de bien expliquer au patient ce qu’il peut attendre d’un pancréas artificiel et de lui apporter une éducation spécifique à l’utilisation d’un tel système. Le système 780G mis à disposition en France constitue une amélioration de ce système.
Système Tandem Control-IQ
Approuvé et commercialisé aux États-Unis depuis décembre 2019, iI associe la pompe à insuline Tandem X2, dans laquelle un algorithme testé dans un grand nombre d’études cliniques est implanté, et la mesure continue du glucose par le Dexcom G6 (fig. 2b). Ce système se distingue du 670G par la possibilité de bolus de correction automatisés et la présence d’un algorithme de sécurité qui bride l’algorithme de contrôle visant l’intervalle-cible en cas de prédiction d’une hypoglycémie.
Un essai randomisé contrôlé sur six mois chez l’adulte a montré que le système est opérationnel plus de 95 % du temps et améliore le temps dans la cible glycémique 0,7-1,8 g/L tout en réduisant le temps passé avec une glycémie inférieure à 0,7 g/L. Le bénéfice sur le contrôle glycémique est significatif chez l’adulte quel que soit le niveau d’HbA1c initial. Les résultats chez l’enfant ont confirmé les résultats obtenus chez l’adulte.8
Système Omnipod 5
Également conçu avec un hébergement de l’algorithme dans le système de perfusion d’insuline, le système OmniPod 5 (fig. 2c) couple la « pompe-patch » OmniPod d’Insulet à la mesure continue du glucose par Dexcom G6. Il fait l’objet d’études-pivots dont les résultats projettent une commercialisation en 2021. L’algorithme utilisé vise une zone glycémique-cible et est proche de celui du système Tandem Control-IQ.
Autres systèmes
D’autres systèmes d’insulinothérapie automatisée, en voie de commercialisation, ont conservé la structure des premiers systèmes expérimentaux ambulatoires élaborés dans un contexte de recherche : une pompe à insuline est connectée sans fil à une plateforme mobile de gestion de l’algorithme (de type tablette ou smartphone) qui reçoit le signal de l’émetteur du dispositif de mesure continue du glucose.
Le système Diabeloop (fig. 2d), élaboré en France et ayant obtenu un marquage « CE », en est un exemple. Il utilise un algorithme fondé sur la prédiction glycémique associé à un module de sécurité sur la dose d’insuline administrée par unité de temps. Les pompes utilisées ont été jusqu’à présent la pompe Cellnovo, puis la pompe Kaleido ; la mesure du glucose en continu se fait par le dispositif Dexcom G6. La faisabilité de son utilisation en ambulatoire sur trois mois chez l’adulte a été démontrée, ainsi que sa capacité à gérer l’activité physique et les repas abondants en réduisant les déviations glycémiques.9
En décembre 2019, la FDA a validé l’algorithme Control-IQ comme premier système de contrôle interopérable : ce concept exprime la possibilité d’utiliser cet algorithme avec toute pompe (validée pour utiliser un contrôleur alternatif) et un dispositif de mesure continue du glucose (validé comme interopérable).
Les années qui viennent verront apparaître d’autres systèmes en cours de développement, dont certains à perfusion bi-hormonale (Beta Bionics, InReda).
Mise en place et évolutions attendues des boucles fermées
Les modalités de mise en place d’un système d’insulinothérapie automatisée chez un patient font l’objet de réflexions de la part des équipes qui en ont eu la pratique dans des essais cliniques.
Un patient informé en vaut deux !
L’expérience préalable d’un traitement par pompe et de la mesure continue du glucose apparaît comme une condition facilitatrice, notamment pour la maîtrise par le patient des risques et limites de ces dispositifs : reconnaissance d’une obstruction de cathéter, identification des dérives de la mesure continue du glucose nécessitant un réétalonnage, par exemple. La capacité de calcul des glucides des repas et la connaissance des ratios individuels insuline/grammes de glucides sont des prérequis pour le calcul des bolus appropriés lors des repas, même si l’algorithme peut corriger les approximations en postprandial.
Qu’en pensent les patients ?
Les avis des patients ayant eu une expérience de la boucle fermée sont globalement positifs en ce qui concerne les résultats obtenus sur le contrôle glycémique, surtout en période nocturne où le bénéfice est le plus marqué.
L’adoption au long cours bénéficierait pour beaucoup d’entre eux d’une miniaturisation et d’une intégration des dispositifs, idéalement sous forme d’un « tout en un ». Les systèmes actuels restent en effet encombrants, en particulier lors des baignades, d’activités sportives ou lorsque la discrétion est recherchée.
La contrainte du mode hybride est aussi mise en avant, avec un souhait de pouvoir se libérer des annonces des repas.
Quelles avancées attendues à l’avenir ?
La disponibilité d’analogues de l’insuline d’action plus rapide pourrait améliorer les performances du contrôle postprandial, mais la dispense d’une annonce des repas en utilisant ces nouveaux analogues paraît improbable. La résolution de cette question ravive l’intérêt pour l’insulinothérapie par voie intrapéritonéale. Les caractéristiques pharmacocinétiques et pharmacodynamiques de cette voie d’administration, associées à une distribution plus physiologique de l’insuline avec premier passage hépatique, permettent de réaliser une insulinothérapie automatisée sans annonce des repas, efficace sur le contrôle glycémique postprandial.10Au niveau algorithmique, l’adaptabilité automatisée avec le temps et les variations de besoins en insuline est un progrès attendu. L’intelligence artificielle peut être le moyen de répondre à cette demande par auto-apprentissage des variations de la sensibilité à l’insuline induites par différents facteurs : stress, changements saisonniers, cycle menstruel… La prise en compte d’informations issues d’autres capteurs, de fréquence cardiaque, des mouvements corporels, mesurant les lactates, mais aussi l’amélioration en exactitude de la prédiction du profil glycémique sont autant de moyens de rendre les algorithmes mieux adaptés en temps quasi réel.
L’auteur déclare avoir été consultant pour les entreprises Abbott, Air Liquide Santé International, Cellnovo, Dexcom, Eli Lilly, Insulet, Johnson & Johnson (Animas, LifeScan), Medtronic, Novo Nordisk, Roche et Sanofi, avoir reçu des soutiens pour la recherche des entreprises Abbott, Dexcom, Insulet, Roche et Tandem, et être membre du conseil scientifique de l’entreprise Diabeloop.
Le concept « do it yourself » (DIY) : non sans danger !
Certains patients diabétiques de type 1 ou leurs proches, férus d’informatique, trouvent la mise à disposition des boucles fermées trop lente en suivant les modalités de développement des industriels et des équipes de recherche. Ils ont dès lors par eux-mêmes « craqué » les codes d’accès aux CGM et à certaines pompes pour les coupler à un algorithme disponible en open source. Ces assemblages bricolés de façon non conforme à la règlementation ont montré leur faisabilité et leur efficacité mais exposent à des accidents hypoglycémiques ou de déconnexion. Un esprit d’entraide communautaire s’est installé entre ces patients « francs-tireurs ». Les médecins sollicités pour les suivre sont exposés à des problèmes de responsabilité face à l’utilisation de ces systèmes non validés.
« Que dire à vos patients ? »
Les difficultés à contrôler les fluctuations glycémiques liées à la variabilité des besoins en insuline dans le diabète de type 1 sont réduites, en particulier la nuit, par le recours aux systèmes d’insulinothérapie en boucle fermée en voie de mise sur le marché.
Ces dispositifs nécessitent une éducation thérapeutique spécialisée car ils ne sont pas complètement autonomes.
Leur fiabilité et l’amélioration constante de la technologie diminuent la charge mentale liée à la gestion de l’insulinothérapie au quotidien.
1. Cobelli C, Renard E, Kovatchev B. Artificial pancreas: past, present, future. Diabetes 2011;60(11):2672-82.
2. Maahs DM, Calhoun P, Buckingham BA, et al. A randomized trial of a home system to reduce nocturnal hypoglycemia in type 1 diabetes. Diabetes Care 2014;37(7):1885-91.
3. Garg SK, Weinzimer SA, Tamborlane WV, et al. Glucose Outcomes with the In-Home Use of a Hybrid Closed-Loop Insulin Delivery System in Adolescents and Adults with Type 1 Diabetes. Diabetes Technol Ther 2017;19(3):155-63.
4. Forlenza GP, Pinhas-Hamiel O, Liljenquist DR, et al. Safety Evaluation of the MiniMed 670G System in Children 7-13 Years of Age with Type 1 Diabetes. Diabetes Technol Ther 2019;21(1):11-9.
5. Kovatchev B, Cheng P, Anderson SM, et al. Feasibility of Long-Term Closed-Loop Control: A Multicenter 6-Month Trial of 24/7 Automated Insulin Delivery. Diabetes Technol Ther 2017;19(1):18-24.
6. Bekiari E, Kitsios K, Thabit H, et al. Artificial pancreas treatment for outpatients with type 1 diabetes: systematic review and meta-analysis. BMJ 2018;361:k1310.
7. Lal RA, Basina M, Maahs DM, et al. One Year Clinical Experience of the First Commercial Hybrid Closed-Loop System. Diabetes Care 2019;42(12):2190-6.
8. Brown SA, Kovatchev BP, Raghinaru D, et al. Six-Month Randomized, Multicenter Trial of Closed-Loop Control in Type 1 Diabetes. N Engl J Med 2019;381(18):1707-17.
9. Hanaire H, Franc S, Borot S, et al. Efficacy of the Diabeloop closed-loop system to improve glycaemic control in patients with type 1 diabetes exposed to gastronomic dinners or to sustained physical exercise. Diabetes Obes Metab 2020;22(3):324-34.
10. Dassau E, Renard E, Place J, et al. Intraperitoneal insulin delivery provides superior glycemic regulation to subcutaneous insulin delivery in model predictive control-based fully-automated artificial pancreas in patients with type 1 diabetes: a pilot study. Diabetes Obes Metab 2017;19(12):1698-705.

 Encadrés
Encadrés