Introduction
Le méningocoque, ou Neisseria meningitidis (Nm), bactérie diplocoque à Gram négatif, est une espèce commensale du rhinopharynx exclusivement humaine. Depuis l’introduction de la vaccination antiméningococcique C en 2009 en France, en 2023 les infections invasives à méningocoques (IIM) sont majoritairement dues aux sérogroupes B (44 %), W (29 %) et Y (24 %).1 La transmission est essentiellement aérienne par les sécrétions rhinopharyngées, en cas d’exposition en face-à-face pendant plus d’une heure à moins d’un mètre.
Physiopathologie
Portage nasopharyngé de Nm
Les adolescents ont le taux de portage nasopharyngé le plus élevé (23,7 % à 19 ans), et sont à l'origine de la transmission dans la population générale.2 Cette acquisition nasopharyngée est le préalable à l’infection par Nm.3
Les vaccins conjugués C et ACWY induisent une immunité collective en réduisant la transmission nasopharyngée de Nm.4 Cet impact collectif n’a pas été retrouvé avec les vaccins contre les méningocoques B dont la technologie est différente.
Plusieurs facteurs comportementaux augmentent de manière significative le portage tels que fumer, les baisers, la fréquentation des bars et boîtes de nuit.5
Immunité
L’immunité peut être acquise naturellement par la production d'anticorps bactéricides sériques en réponse au portage de Nm ou par transfert d'anticorps maternels aux nourrissons. Les nourrissons sont les plus sensibles en raison de l'immaturité du système immunitaire et de la décroissance rapide (avant 6 mois) des niveaux d’anticorps protecteurs transmis pendant la grossesse.6
Pathologie
La période d'incubation moyenne est de trois à quatre jours (max : 2 à 10 j).
Une fois que la bactérie a pénétré dans la circulation sanguine, de nombreux facteurs contribuent au déclenchement de la maladie, mais les plus importants sont le temps de doublement rapide des bactéries et leur capacité à libérer de l’endotoxine, molécule toxique la plus puissante et dont les taux sont en corrélation directe avec la gravité des manifestations cliniques, et des cytokines pro-inflammatoires.
Elles touchent avant tout des sujets sans pathologie sous-jacente même si des facteurs de risque sont connus.
Les facteurs de survenue sont multiples.
Ils ont liés :
– à la bactérie : certaines lignées sont hypervirulentes grâce à leur capacité à résister aux défenses immunitaires ;
– et/ou liés à l’hôte : des données de l'Assurance maladie sur six ans (2012 - 2017) permettent de définir les facteurs de risque :7
- prématurité : l’incidence est significativement plus élevée chez les prématurés surtout < 32 SA, que chez les nourrissons nés à terme, avec un risque plus élevé de séquelles ;8
- déficit immunitaire : l'immunodéficience congénitale, ainsi que les déficits en properdine et complément, l'immunodéficience acquise en général et les infections par le VIH en particulier, et l'asplénie/hyposplénie ;
- état de la muqueuse respiratoire : une bronchite, une pneumopathie, ou une bronchiolite à virus respiratoire syncytial, nécessitant une hospitalisation au cours des six derniers mois ont été associés significativement à une hospitalisation pour IIM. La grippe était à la limite de la significativité dans cette étude ;
- les maladies auto-immunes, l'hémophilie et les troubles respiratoires chroniques sévères étaient également fortement associés.
Un environnement défavorisé socialement (statut CMU-c) est associé à un risque accru d'hospitalisation, particulièrement pour les nourrissons de moins de 1 an.7
Biologie
Le diagnostic repose sur l'isolement bactériologique, la détection d'antigènes ou d'ADN de Nm dans un liquide normalement stérile (sang, liquide cérébrospinal [LCS], liquide synovial ou pleural). La sensibilité de la culture est réduite après le début de l’antibiothérapie, les tests basés sur la réaction en chaîne par polymérase (PCR) sont de plus en plus utilisés. Cette confirmation microbiologique est nécessaire pour répondre à la définition de cas confirmé.
Présentations cliniques des IIM
Les manifestations cliniques peuvent se présenter indépendamment ou en combinaison.
Présentations fréquentes
Méningite (> 50 %) : associe raideur de nuque, céphalées et vomissements, photophobie. Chez le nourrisson, cette raideur de nuque est remplacée par une hypotonie axiale. Les éléments cliniques évocateurs sont : le caractère grognon, les geignements, l’hyperesthésie cutanée, les troubles de la conscience (somnolence inhabituelle, agitation, inconsolable), et des modifications du comportement : une perte de l’interactivité et un refus répété du biberon. Le bombement de la fontanelle est très évocateur.
Septicémie méningococcique (de 5 à 20 %) : due à la prolifération rapide dans le sang d’une concentration très élevée de méningocoques et de ses endotoxines. Le syndrome infectieux associe douleurs aux jambes, extrémités froides (mains et pieds) et couleur anormale de la peau (marbrée, grise, pâle). Son signe le plus caractéristique est le purpura rapidement extensif et nécrotique.
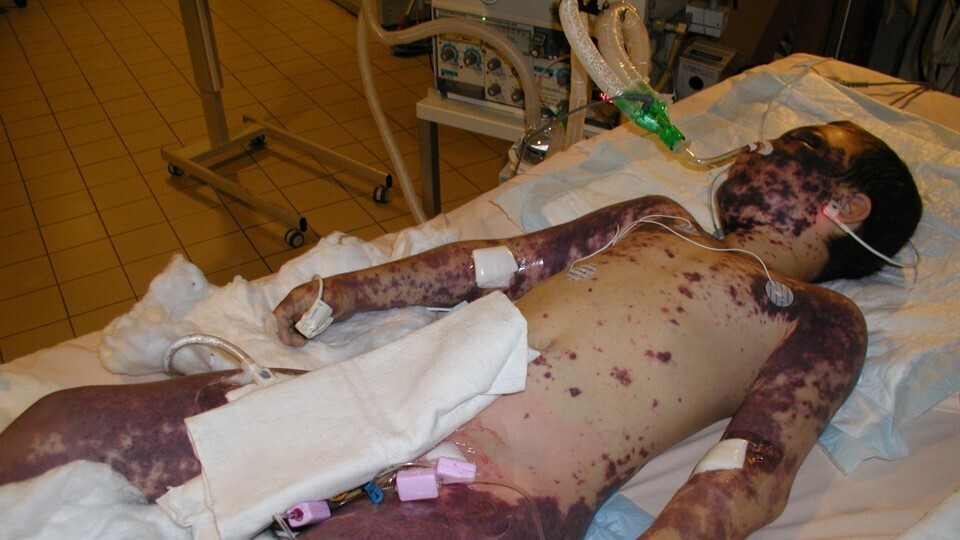
Choc septique méningococcique (20 %) : caractérisé par une réponse inflammatoire fulminante de l’hôte à l’invasion bactérienne, souvent combinée à un purpura fulminans (figure). Cela se traduit par une défaillance cardiovasculaire, une coagulation intravasculaire disséminée (CIVD), des défaillances multiples d’organes. Le taux de létalité est très élevé et les séquelles sont graves en lien avec l’ischémie.
Présentations moins fréquentes
La pneumonie bactériémique peut toucher jusqu’à 15 % des patients atteints d’IIM, plus fréquente chez les sujets âgés, bien que décrite aussi chez l’adolescent.9 D’autres manifestations sont moins courantes (< 5 %), comme la conjonctivite, l’endophtalmie, l’épiglottite, l’arthrite septique, la péricardite septique, les myocardites et des formes abdominales. Le sérogroupe W a augmenté de prévalence ces dernières années, il peut se présenter sous formes atypiques, notamment des symptômes gastro-intestinaux, arthrite septique et pneumonie bactériémique, mais aussi épiglottites.10 En France, 13 cas d’épiglottites étaient associés à un sepsis et le sérogroupe W est surreprésenté (62 %), avec une proportion encore plus élevée pour la période post-pandémique (75 %) que pour la période pré-pandémique (40 %).11
Les IIM ont pour caractéristiques principales d’être imprévisibles, de diagnostic difficile et d’une extrême gravité. Les signes très précoces ne sont pas spécifiques. Les symptômes rapportés pendant les six premières heures sont la fièvre, l’anorexie, les nausées/vomissements et l’irritabilité. Les nouveaux signes identifiés entre H7 et H12 sont les douleurs des membres inférieurs, les extrémités froides et les troubles de la coloration cutanée. Les signes classiques tels que le purpura, le syndrome méningé et les troubles de la conscience sont tardifs, survenant après douze heures d’évolution. Les symptômes initiaux non spécifiques entraînent des retards diagnostiques et des taux de létalité plus élevés. Le délai médian d’admission à l’hôpital est de dix-neuf heures dans une infection ou chaque heure compte.12 Dans une étude française, 28,2 % des sujets ont consulté un médecin généraliste, un pédiatre, un médecin hospitalier ou le service des urgences dans les trois jours précédant leur admission.13 La mortalité globale reste supérieure à 10 % depuis plus de vingt ans malgré les progrès de la réanimation et de l’antibiothérapie. La létalité élevée en 2023 des IIM W .(19 % vs 7 % pour les IIM B et 8 % pour les IIM Y) confirme la virulence de ces souches.1
Les séquelles sont neurologiques (déficit moteur, ataxie, paralysie des nerfs crâniens, épilepsie …), sensorielles (surdité à rechercher systématiquement), cognitives et psychiatriques (troubles des apprentissages, déficit cognitif, neurodéveloppemental, désordres neuropsychiatriques). Elles peuvent être aussi systémiques et orthopédiques : nécrose tissulaire, amputations, altération d’un cartilage de croissance, parfois insuffisance rénale. En France, 25,4 % des cas ont au moins une séquelle mise en évidence durant la période de suivi de six ans et 9,2 % ont présenté des séquelles multiples.13
Conclusion
Les IIM sont des pathologies imprévisibles, de diagnostic difficile en raison de premiers symptômes souvent aspécifiques, entrainant fréquemment un retard de diagnostic. Les présentations les plus sévères sont la méningite, la septicémie et le choc méningococcique, pouvant se combiner. Elles sont d’une extrême gravité, avec un taux de létalité en moyenne de 10 % et de séquelles chez les survivants de plus de 25 % qui nécessitent un accompagnement prolongé.
2. Christensen H, May M, Bowen L, Hickman M, Trotter CL. Meningococcal carriage by age: a systematic review and meta-analysis. Lancet Infect Dis. 2010 dec;10(12):853-61.
3. DGS/SP/2018/163 du 27 juillet 2018 relative à la prophylaxie des infections invasives à méningocoque. https://sante.gouv.fr/IMG/pdf/instruction_dgs_sp_2018_163.pdf
4. Maiden MC, Ibarz-Pavón AB, Urwin R. Impact of meningococcal serogroup C conjugate vaccines on carriage and herd immunity. J Infect Dis. 2008; 197:737–743.
5. MacLennan JM, Rodrigues C, Bratcher HB, et al. Meningococcal carriage in periods of high and low invasive meningococcal disease incidence in the UK: comparison of UKMenCar1–4 cross-sectional survey results. Lancet Infect Dis. 2021 May; 21(5): 677–687.
6. Pollard AJ, Frasch C. Development of natural immunity to Neisseria meningitidis. Vaccine. 2001;19:1327–1346.
7. Taha MK, Weil-Olivier C, Bouée S, Emery C, Nachbaur G, Pribil C, Loncle-Provot V. Risk factors for invasive meningococcal disease: a retrospective analysis of the French national public health insurance database. Hum Vaccin Immunother. 2021; 17(6): 1858–1866.
8. Calvert A, Campbell H, Heath PT, Jones CE, Le Doare K, Mensah A, Ladhani S. Risk of Invasive Meningococcal Disease in Preterm Infants. Open Forum Infect Dis. 2024 Apr 15;11(4):ofae164.
9. Säll O, Stenmark B, Glimåker M, et al. Clinical presentation of invasive disease caused by Neisseria meningitidis serogroup Y in Sweden, 1995-2012. Epidemiol Infect. 2017;145(10):2137–2143.
10. Birrell MT, Strachan J, Holmes NE, et al. Clinical manifestations of invasive meningococcal disease in Victoria with the emergence of serogroup W and serogroup Y Neisseria meningitidis. Int Med J. 2021;51:390–397.
11. Taha S, Hong E, Denizon M, et al. The rapid rebound of invasive meningococcal disease in France at the end of 2022. J Infect Public Health 2023; 16: 1954–60.
12. Thompson MJ, Ninis N, Perera R, et al. Clinical recognition of meningococcal disease in children and adolescents. Lancet. 2006; 367(9508): 397–403.
13. Weil Olivier C, Taha MK, Bouée S, et al. Care patways in invasive meningococcal disease : a retrospective analysis of the french national public health insurance database. Hum Vaccin.