La maladie rénale chronique (MRC) est fréquente et en progression dans le monde. À son stade terminal (MRC5), un traitement de suppléance vital doit être mis en place. Quatre options sont proposées au patient : la transplantation rénale qui, en dehors de contre-indication, est le traitement à privilégier du fait de l’amélioration significative de la survie et de la qualité de vie ; l’hémodialyse en centre ; les dialyses au domicile avec la dialyse péritonéale (DP) ; l’hémodialyse à domicile.
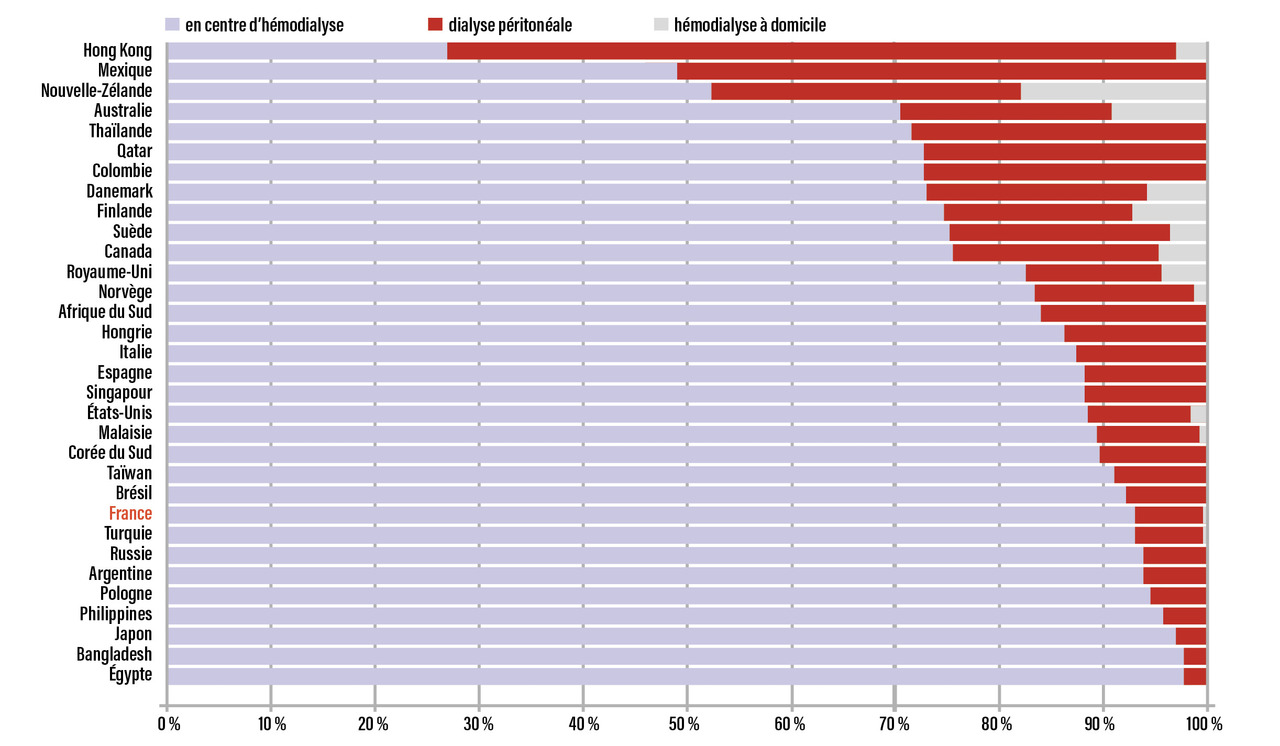
Le pourcentage de patients traités par dialyse péritonéale dans le monde est de l’ordre de 11 %, avec une grande variabilité internationale (fig. 1). En effet, dans plusieurs pays comme Hong Kong, la Nouvelle-Zélande et la Colombie, plus de 30 % de patients atteints de MRC5 sont traités par DP ; dans d’autres, comme la Finlande, le Danemark, les Pays-Bas, ce taux est de l’ordre de 20 % ; enfin, dans certains pays comme la France, l’Allemagne, le Portugal, la Belgique, le Royaume-Uni, cette proportion est inférieure à 10 %. Depuis quelques années, certains pays ont une tendance significative à augmenter le nombre de patients pris en charge en DP tels que les États-Unis, le Bangladesh, le Chili, l’Espagne, l’Argentine, la Thaïlande et Taïwan.1
En France, en 2021, la prévalence de la MRC5 était de 92 535 patients (1 362/million d’habitants) et l’incidence de 11 437 patients (169/million d’habitants). Parmi ces patients, 41 210 sont transplantés, 51 325 sont traités en dialyse dont seulement 6 % en DP. Il existe une grande variabilité inter-régionale (tableau).2
Parcours de soins recommandé
Un parcours de soins est recommandé par la Haute Autorité de santé (HAS) pour les patients atteints de MRC.3 Au cours de ce parcours, tous les patients atteints de MRC4 ou 5 doivent bénéficier d’une consultation d’annonce, d’une information éclairée et structurée sur toutes les techniques de dialyse, d’une prise en charge par un diététicien et de recommandations pour une activité physique adaptée. Le choix du patient concernant la technique de dialyse est obligatoire et doit être éclairé, ce qui fait souvent défaut, surtout lorsqu’il est pris en charge en urgence au stade terminal de sa maladie – ce qui représente environ 30 % des cas incidents.2 Les patients sont alors le plus souvent traités par hémodialyse, nécessitant la mise en place d’une voie veineuse centrale.
L’information sur les différentes techniques de suppléance fait souvent défaut, or elle est capitale. Selon les données existantes, les patients bénéficiant d’une information éclairée sur les différentes techniques de dialyse choisissent pour moitié d’entre eux la DP, soit deux à trois fois plus qu’en l’absence d’information.4 De plus, les résultats de l’étude PDOPPS – étude observationnelle, multicentrique, internationale – montrent que la perception de la DP par les patients traités est positive. Les avantages soulignés par les utilisateurs sont, entre autres, le fait que le traitement soit réalisé à domicile, permettant davantage d’autonomie, limitant le temps passé à l’hôpital et les temps de transport (allers-retours centre-domicile) et ne nécessitant pas de voie d’abord vasculaire.5
Principes de la dialyse péritonéale
La DP est une technique d’épuration extrarénale qui permet d’éliminer les toxines urémiques et de rétablir l’équilibre acide-base et hydrosodé grâce aux échanges entre le sang des capillaires péritonéaux et une solution de dialyse infusée dans la cavité péritonéale.
Cette technique fait appel à la capacité filtrante du péritoine, qui est constitué de deux feuillets (viscéral et pariétal) formant une cavité virtuelle. Sa surface est de l’ordre de 0,5 à 2 m2. Il est constitué de cellules mésothéliales, de capillaires péritonéaux et de tissu conjonctif. C’est une membrane dite semi-perméable car elle est poreuse de manière hétérogène, permettant le transfert de molécules, de solutés et d’eau entre le compartiment sanguin et la cavité péritonéale remplie d’une solution de dialysat selon le débit physiologique des capillaires péritonéaux, qui est de l’ordre de 50 à 100 mL/min.
Les transferts de solutés entre le compartiment sanguin et la cavité péritonéale se font selon trois grands mécanismes : la diffusion avec un gradient de concentration, l’ultrafiltration (transfert d’eau et des substances dissoutes) avec un gradient osmotique et l’absorption d’eau et de substances dissoutes de la cavité péritonéale vers les capillaires sanguins et les vaisseaux lymphatiques.6 Le modèle mathématique des trois pores rend compte de ces échanges transpéritonéaux avec les moyens pores, les grands pores et les ultrapetits pores, constitués d’aquaporine,1 qui ne laissent passer que l’eau libre et assurent ainsi près de 50 % de l’ultrafiltration.7
Dialyse cyclique en trois étapes
La DP est une dialyse cyclique. Chaque cycle comprend : l’infusion de la solution de dialysat dans la cavité péritonéale dont la durée est de l’ordre de dix minutes, la stase de la solution de dialysat dans la cavité péritonéale, permettant les échanges transpéritonéaux et le drainage de la solution durant environ dix à quinze minutes. Le nombre de cycles, le volume infusé par cycle et le temps de stase sont variables. Ils répondent à une prescription adaptée au besoin du patient. Durant la phase de stase, le patient est libre de mener ses activités sociales et/ou professionnelles.
L’infusion de la solution de dialyse se fait grâce à la mise en place d’un cathéter de DP dans le cul-de-sac de Douglas. Il est posé dans des conditions d’asepsie chirurgicale stricte par un opérateur expérimenté sous anesthésie locale ou générale. Le cathéter suit un trajet en trois parties : une partie intrapéritonéale dans le cul-de-sac de Douglas, une partie dans la paroi abdominale, puis une partie extériorisée raccordée à un prolongateur permettant la connexion à la poche de dialysat. Le cathéter est laissé en place au long cours. En revanche, le prolongateur est changé tous les six mois.6
Plusieurs types de solutions de dialysat
Les solutions de dialysat sont de natures différentes. Elles sont contenues dans des poches souples à usage unique, stérilisées à la chaleur et stockées à température ambiante. Certaines sont monocompartimentées et prêtes à l’emploi, d’autres sont bicompartimentées et doivent être reconstituées au moment de l’infusion.
Elles sont amenées à une température de 37 °C avant l’infusion grâce à l’utilisation d’un réchauffeur dédié.
Chacune contient un agent osmotique, un tampon et des électrolytes. L’agent osmotique est variable : il s’agit soit de glucose à concentration variable, soit d’un polymère de glucose appelé icodextrine, soit d’acides aminés. L’ultrafiltration est assurée par les solutions à hautes concentrations en glucose (ultrafiltration cristalloïde) ou par celles contenant de l’icodextrine (ultrafiltration colloïde). Les tampons sont soit du lactate, soit du bicarbonate, soit une combinaison lactate-bicarbonate. La teneur en électrolytes varie uniquement pour le calcium (1,25 ou 1,75 mmol/L). La concentration en sodium est de l’ordre de 132 ou 134 mmol/L. Les solutions sont dépourvues de potassium. La teneur en produits de dégradation de glucose (formés lors de la stérilisation de la poche à la chaleur) est variable, mais moindre dans les solutions bicompartimentées.
Deux techniques
La DP est réalisée au domicile soit par le patient lui-même, soit par un aidant formé (une infirmière [IDE] ou un proche). Il s’agit d’une dialyse continue, sans instabilité hémodynamique, quotidienne, réalisée la journée ou la nuit pendant le sommeil du patient.
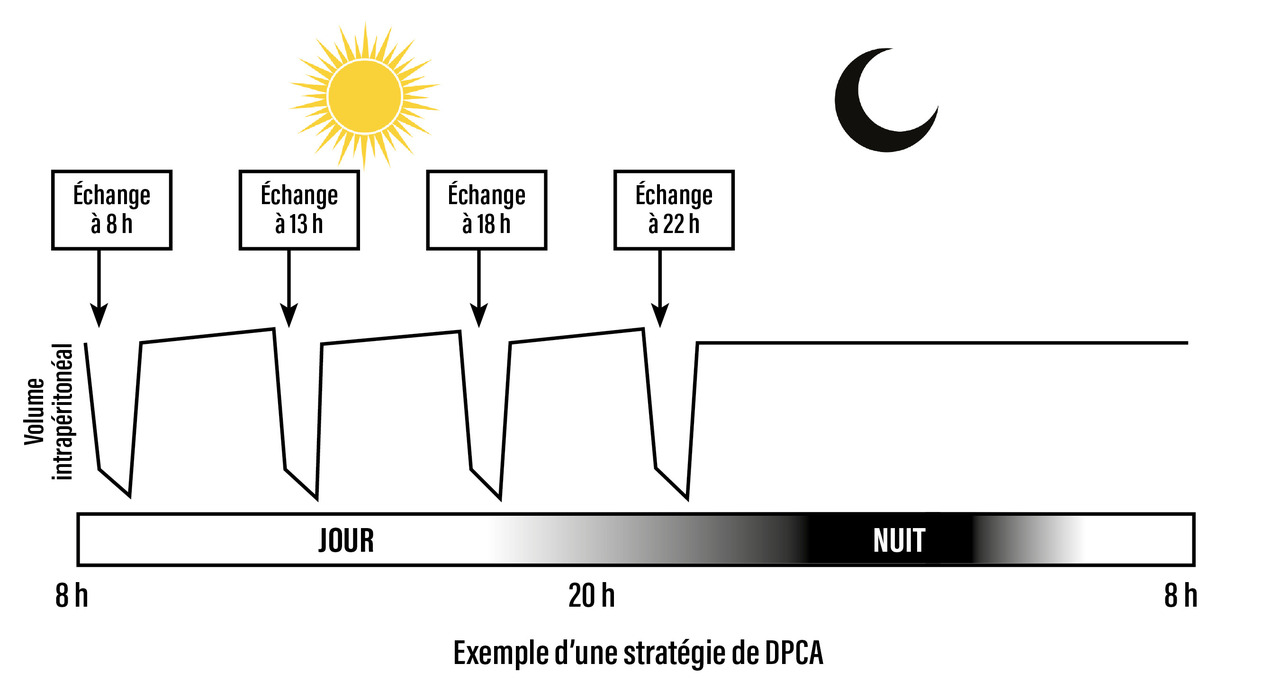
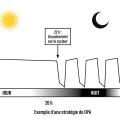
Dialyse péritonéale cyclique ambulatoire
La dialyse péritonéale cyclique ambulatoire (DPCA) est réalisée de jour.
Elle comporte une succession de cycles au cours de la journée dont le nombre varie selon les besoins des patients. Le temps de stase de chaque cycle de jour est le plus souvent de quatre heures. Un échange long nocturne, de l’ordre de huit à douze heures, peut être associé (fig. 2).
Un système à double poche est utilisé : une poche vide raccordée en Y avec une poche pleine de dialysat, permettant le drainage de la cavité péritonéale, puis son remplissage. Aujourd’hui, deux types de connexion sont disponibles. L’infusion et le drainage de la poche se font selon la pesanteur (poche pleine accrochée à une potence pour l’infusion et poche vide en déclive au sol pour le drainage). Un échange (infusion + drainage) dure environ trente minutes.
Les paramètres de la dialyse sont notés par le patient ou l’aidant pour chaque échange dans un cahier dédié.
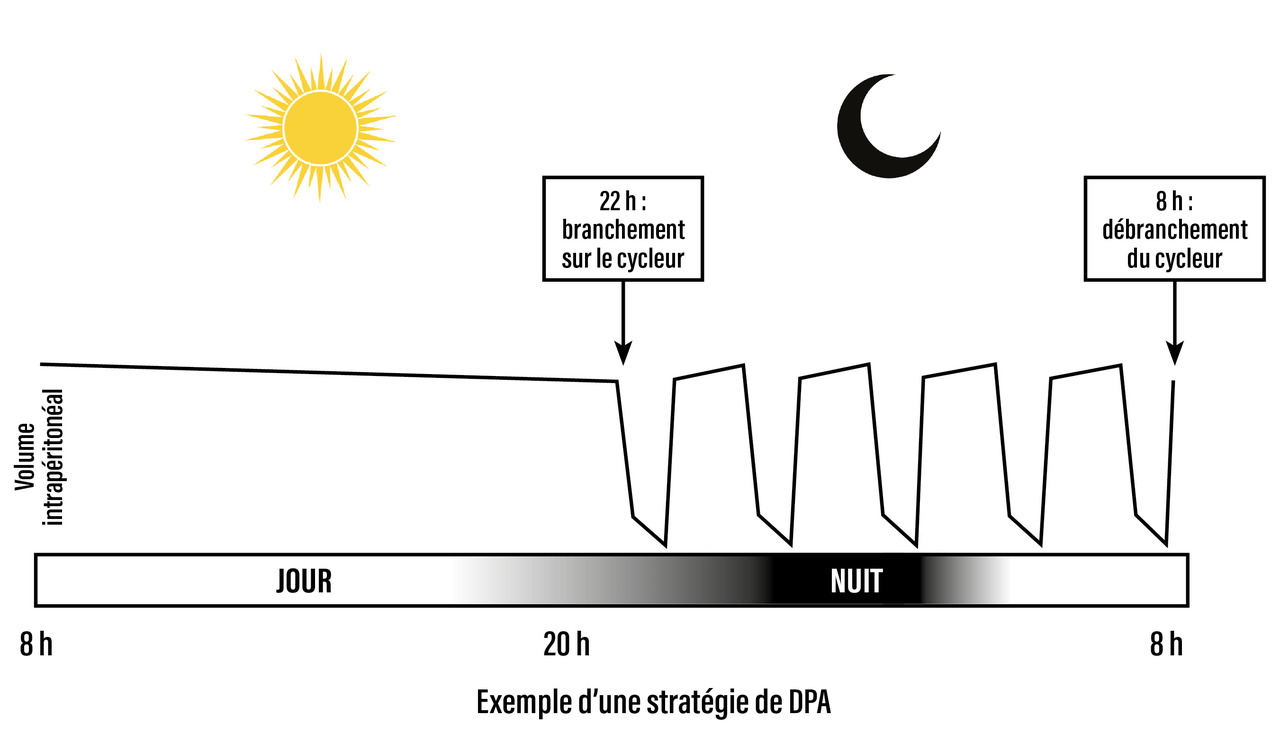
Dialyse péritonéale automatisée
La dialyse péritonéale automatisée (DPA) est réalisée la nuit, pendant le sommeil du patient.
Une machine de dialyse appelée « cycleur » assure automatiquement les cycles (infusion, stase, drainage). La durée moyenne totale de la dialyse est variable selon les besoins du patient, assez souvent de l’ordre de huit heures. De manière générale, les stases sont plus courtes et les cycles plus nombreux. Un échange long (de huit à douze heures) durant la journée peut être associé (fig. 3).
Les paramètres de la dialyse sont enregistrés et récupérés soit sur une carte pro (puce électronique), soit en temps réel par un système sécurisé de télésurveillance.
Modalités pratiques
Dans les deux cas (DPCA et DPA), la connexion du prolongateur aux lignes des poches de dialysat doit se faire de manière aseptique, c’est-à-dire dans une pièce au calme avec fenêtre fermée, après mise en place d’un masque chirurgical et un lavage des mains Le patient est éduqué à la réalisation de sa dialyse : exécution des échanges, connexions, surveillance et signes d’alerte. Il est le plus souvent formé aux deux techniques s’il est autonome. Chaque formation dure en moyenne une semaine. Il peut être assisté selon les besoins tout au long de son parcours par une IDE à domicile ou par un proche également formés. L’éducation est capitale et est continue tout au long du parcours de soins. En France, le pourcentage d’assistance est de 45 % (39 % par une IDE et 6 % par l’entourage) des patients traités en DP. Il s’agit principalement de patients en DPCA et âgés.8
Indications et contre-indications
La DP est un traitement de suppléance de choix de la MRC5 (accord fort).3,9 Les patients immunodéprimés, polyvasculaires et avec de lourdes comorbidités peuvent également bénéficier de ce traitement. La DP a un intérêt particulier en première intention en cas de difficulté à créer une voie d’abord pour l’hémodialyse, en cas d’emboles de cholestérol et d’insuffisance cardiaque. Elle est recommandée chez les patients en attente de transplantation rénale mais aussi chez le sujet âgé et l’enfant de moins de 5 ans.9
Les contre-indications absolues sont les conditions empêchant l’infusion et le drainage de la solution de dialysat, tout processus entravant la filtration du péritoine et l’impossibilité de disposer d’une assistance au domicile si l’état de santé du patient l’impose. Les contre-indications sont donc un délabrement de paroi abdominale important, une hernie ou une éventration abdominale inopérable, un indice de masse corporelle supérieur à 45 kg/m2, une perte de la capacité de filtration du péritoine et un habitat insalubre.
Les contre-indications relatives sont une dénutrition importante avec une hypoalbuminémie, une insuffisance respiratoire chronique, une maladie infectieuse ou inflammatoire du tube digestif, une pancréatectomie, la mise en place d’une prothèse aorto-iliaque depuis moins de trois mois.
Le refus de l’entourage et l’addiction ne sont pas de véritables contre-indications, mais nécessitent un accompagnement soutenu par l’équipe de néphrologie et tous les soignants.
Dans tous les cas, une visite au préalable du domicile du patient par l’équipe de dialyse est obligatoire.9
Effets sur la survie
La comparaison de la survie entre les patients en hémodialyse et en DP a fait l’objet de nombreuses études et controverses. De nombreux biais (différents types d’études, périodes, pays) rendent la comparaison difficile. Cependant, il existe un accord fort pour dire que la survie en DP et en hémodialyse chronique est identique. En témoignent les résultats de cette récente méta-analyse dont le but était de comparer le risque de mortalité entre les patients incidents en DP et en HD sur une large période de 1993 à 2014. Les auteurs ont analysé les résultats de 17 études en utilisant un score de propension, soit un pool de 113 578 patients incidents en DP et en HD. Le risque de mortalité en HD et en DP est identique (risque relatif [RR] : 1,06 [0,99 - 1,14]) y compris chez les patients diabétiques (RR : 1,09 [0,98 - 1,21]) et non diabétiques (RR : 0,99 [0,90 - 1,09]).10
Une grande partie des résultats cliniques et épidémiologiques en DP sont tirés de registres nationaux existant dans la plupart des pays. En France, il s’agit du Registre de dialyse péritonéale de langue française (RDPLF) et du Réseau épidémiologique et information en néphrologie (REIN). Le taux de survie à cinq ans en DP varie d’un pays à l’autre. Il oscille entre 48,4 et 64 % (Europe, Océanie, Amérique du Sud et Amérique du Nord).11
Les taux de mortalité et d’infection péritonéale ont diminué constamment durant les vingt dernières années dans le monde et en France.12,13 En 2021, en France métropolitaine, le taux de péritonites, en incluant les récidives, était d’un épisode tous les 37,8 mois, soit 0,32 épisode par an (données RDPLF 2021).
Principal avantage : l’autonomie du patient
Les avantages de la DP par rapport à l’hémodialyse en centre sont à rappeler.14
Il s’agit d’un traitement réalisé au domicile permettant davantage d’autonomie. La flexibilité des horaires de dialyse est beaucoup plus grande, favorisant les activités sociales et professionnelles des patients. Il n’y a pas de transport aller-retour (domicile-centre), ce qui est un gain majeur en matière de qualité de vie et de coût économique. Le risque infectieux est réduit en période épidémique. Ce point a été rapporté au cours de la première vague de la pandémie de Covid- 19.15
Les patients peuvent voyager plus aisément en France et à l’étranger.
La réalisation de la DP est facile à apprendre par le patient et/ou son entourage et/ou une IDE libérale. Ainsi, en cas de fragilité ou de handicap, une assistance peut être mise en place, avec de bons résultats.
Le suivi médical et paramédical consiste en général, selon les équipes, en une consultation mensuelle et deux ou trois séances annuelles en hôpital de jour. L’équipe doit être disponible et assurer, si besoin, une assistance vingt-quatre heures sur vingt-quatre.
La dialyse est quotidienne, sans fluctuation volémique brutale, permettant un meilleur équilibre hémodynamique capital pour le ressenti du patient. La fonction rénale résiduelle, facteur pronostique majeur chez les patients atteints de MRC5 dialysés, est mieux préservée en DP. Il n’y a pas besoin de circuit sanguin ni a fortiori d’anticoagulation locale. Il n’y a pas non plus besoin de créer de fistule artérioveineuse.
La pose du cathéter de DP peut être réalisée sous anesthésie locale chez les patients fragiles.
Enfin, l’avantage économique est nettement en faveur de la dialyse à domicile par rapport à l’hémodialyse en centre, selon de nombreuses études nationales et internationales et le dernier rapport de la Cour des comptes.16,17
Limites amenant à un passage à l’hémodialyse en centre
À long terme, l’exposition prolongée du péritoine aux solutions de dialyse et la répétition d’éventuels épisodes d’infections péritonéales entraînent des altérations morphologiques et fonctionnelles du péritoine, avec l’apparition d’une fibrose et d’une néovascularisation.18 Cette modification irréversible induit une perte de l’ultrafiltration chez plus de 30 % des patients après six ans de DP. Il faut alors envisager un transfert définitif en hémodialyse chronique.
D’autres circonstances amènent à un transfert transitoire ou définitif en hémodialyse chronique : la perte d’autonomie, avec l’impossibilité d’avoir recours à une assistance, certains épisodes d’infections péritonéales (par exemple de type fongique, ou résistant au traitement antibiotique bien conduit, ou associés à une perte d’ultrafiltration avec une surcharge hydrosodée incontrôlée…).
L’absence de fonction rénale résiduelle rend dans certains cas plus difficile l’accès à la cible de dialyse adéquate.
Par ailleurs, l’impossibilité de pouvoir stocker le matériel à domicile fait également partie des limites de la technique.
Enfin, même si les patients soulignent les avantages de ce traitement réalisé au domicile et en ont le plus souvent une perception positive, il faut surveiller et prévenir l’apparition d’un éventuel burn-out du patient lui-même ou de son entourage.
La dialyse péritonéale reste peu utilisée, faute d’information des patients
La dialyse péritonéale est un traitement de choix de la MRC5. Elle est pourtant peu utilisée en France, certainement par manque d’information. Pourtant ce traitement a un intérêt médical, social et économique. La DP a certains avantages par rapport à la dialyse en centre. Il est capital que les patients soient pris en charge dans le cadre du parcours MRC4 - 5 et reçoivent une information éclairée complète et systématique sur l’ensemble des techniques de dialyse existantes.
2. Agence de la biomédecine. Rapport REIN 2021 (Réseau épidémiologique et information en néphrologie). https://vu.fr/QmDvQ
3. Haute Autorité de santé. Guide du parcours de soins Maladie rénale chronique (MRC) de l’adulte, 2023. https://vu.fr/OsdXZ
4. Devoe DJ, Wong B, James MT, et al. Patient education and peritoneal dialysis modality selection: A systematic review and meta-analysis. Am J Kidney Dis 2016;68(3):422-33.
5. Sukul N, Zhao J, Fuller DS, et al. Patient-reported advantages, and disadvantages of peritoneal dialysis: Results from the PDOPPS; clinical application of PD therapy working group. BMC Nephrol 2019;20(1):116.
6. Teitelbaum I. Peritoneal Dialysis. N Engl J Med 2021;385(19):1786-95.
7. Rippe B, Venturoli D, Simonsen O, et al. Fluid and electrolyte transport across the peritoneal membrane during CAPD according to the three-pore model. Perit Dial Int 2004;24:10-27.
8. Verger C, Fabre E, Veniez G, et al. Données statistiques synthétiques du Registre de dialyse péritonéale de langue française et hémodialyse à domicile (RDPLF) en 2018. Bull Dial Domic 2019;2(1):1-10.
9. Indications et non-indications de la dialyse péritonéale chronique chez l’adulte. Consensus formalisé. Recommandations Haute Autorité de santé 2007. https://vu.fr/KPuFI
10. Elsayed ME, Morris AD, Li X, et al. Propensity score matched mortality comparisons of peritoneal and in centre hemodialysis: Systematic review and meta-analysis. Nephrol Dial Transplant 2020 ;35(12):2172-82.
11. Li PKT, Chow KM, Van de Luijtgaarden MWM, et al. Changes in the worldwide epidemiology of peritoneal dialysis. Nat Rev Nephrol 2017;13(2):90-103.
12. Marshall MR. A systematic review of peritoneal dialysis-related peritonitis rates over time from national or regional population-based registries and databases. Perit Dial Int 2022;42(1):39-47.
13. Boyer A, Lanot A, Lambie M, et al. Am J Nephrol 2021;52(4):318-27.
14. Brown EA, Ekstrand A, Gallieni M, et al. Availability of assisted peritoneal dialysis in Europe: Call for increased and equal access. Nephrol Dial Transplant 2022;37(11):2080-9.
15. Guy Rostoker, Belkacem Issad, Hafedh Fessi, et al. Why and how should we promote home dialysis for patients with end-stage kidney disease during and after the coronavirus 2019 disease pandemic? A French perspective. J Nephrol 2021;34(4):985-9.
16. Rapport public annuel 2020. Février 2020. Cour des comptes. L’insuffisance rénale chronique terminale : une prise en charge à réformer au bénéfice des patients. https://vu.fr/tnBNP
17. Guy Rostoker. Cost of home dialysis in France. Bulletin de la dialyse à domicile 2022;5(3).
18. Krediet RT, Struijk DG. Peritoneal changes in patients on long-term peritoneal dialysis. Nat Rev Nephrol 2013;9(7):419-29.