Depuis l’utilisation des antibiotiques, la résistance bactérienne n’a jamais cessé d’augmenter, mais cette évolution était compensée par la régulière mise sur le marché de nouveaux antibiotiques. Malheureusement, celle-ci s’est considérablement ralentie devant les difficultés de développement et le faible retour sur investissement de la recherche sur les antibiotiques, au risque de voir émerger de plus en plus d’infections difficiles à traiter. Deux facteurs essentiels sont mis en cause dans l’augmentation de la résistance aux antibiotiques : la consommation des antibiotiques chez l’homme mais également chez l’animal, créant ainsi une pression de sélection pour les bactéries résistantes, et l’hygiène au sens large, incluant la gestion de l’environnement qui joue un rôle dans leur transmission. La résistance aux antibiotiques doit désormais être abordée avec une vision holistique appelée One Heath, considérant que les santés humaine, animale et environnementale sont liées et que la lutte contre la résistance ne doit plus être cloisonnée, ni entre les différents secteurs, ni entre les pays.
État des lieux de la résistance bactérienne aux antibiotiques chez l’homme
Si l’évolution de la résistance bactérienne aux antibiotiques est inquiétante pour certaines familles ou espèces bactériennes, elle l’est moins pour d’autres. C’est le cas des bactéries associées aux infections communautaires respiratoires ou ORL, premières causes de prescription d’antibiotiques en France. Les dernières données du Centre national de référence (CNR) des pneumocoques montrent une diminution de la proportion de pneumocoques de sensibilité diminuée à la pénicilline (PSDP) dans les infections invasives, passant de 51 % en 2001 à 21 % en 2014, puis remontant à 35 % en 2020 (incluant 15 % de souches résistantes à l’amoxicilline). Cette évolution est probablement liée à un changement de la distribution des sérotypes responsables d’infections invasives chez l’enfant et l’adulte, à la suite de la mise en place des différents vaccins.1 La résistance aux macrolides est toujours stable, autour de 24 %, et la résistance aux fluoroquinolones reste anecdotique (moins de 1 % de souches résistantes à la lévofloxacine).1 De même, la résistance aux antibiotiques chez Haemophilus influenzae reste stable, avec 25 % de souches résistantes à l’amoxicilline, majoritairement par production de bêtalactamase. Cependant, on observe l’émergence de souches résistantes par mutation des gènes codant les protéines liant la pénicilline (PLP) touchant l’association amoxicilline-acide clavulanique et, plus rarement, les céphalosporines de troisième génération (C3G), pouvant atteindre une prévalence de 10 % certaines années.2 Mais qu’il s’agisse des mutations de PLP chez le pneumocoque ou chez H. influenzae, leur impact en matière d’échecs cliniques reste faible.
L’évolution de la résistance aux antibiotiques chez les germes responsables d’infections sexuellement transmissibles (IST) est bien plus inquiétante, comme le montre le rapport du CNR des IST bactériennes. Chez Neisseria gonorrhoeae, la résistance aux C3G reste anecdotique en France, avec quelques souches résistantes isolées par an, ce qui n’est pas le cas dans d’autres pays du monde.3,4 En revanche, l’évolution de la résistance aux fluoroquinolones est fulgurante, passant de 37 à 68 % entre 2017 et 2021 ; leur utilisation n’est donc plus permise sans documentation bactériologique. Mycoplasma genitalium, dont le traitement repose sur l’utilisation d’un macrolide ou d’une fluoroquinolone, voit ses taux de résistance à ces deux antibiotiques augmenter régulièrement, atteignant, en France, respectivement 35 % et 15 % avec une majorité de souches corésistantes aux deux familles d’antibiotiques.4
L’évolution de la résistance aux antibiotiques chez les germes responsables d’infections sexuellement transmissibles (IST) est bien plus inquiétante, comme le montre le rapport du CNR des IST bactériennes. Chez Neisseria gonorrhoeae, la résistance aux C3G reste anecdotique en France, avec quelques souches résistantes isolées par an, ce qui n’est pas le cas dans d’autres pays du monde.3,4 En revanche, l’évolution de la résistance aux fluoroquinolones est fulgurante, passant de 37 à 68 % entre 2017 et 2021 ; leur utilisation n’est donc plus permise sans documentation bactériologique. Mycoplasma genitalium, dont le traitement repose sur l’utilisation d’un macrolide ou d’une fluoroquinolone, voit ses taux de résistance à ces deux antibiotiques augmenter régulièrement, atteignant, en France, respectivement 35 % et 15 % avec une majorité de souches corésistantes aux deux familles d’antibiotiques.4
Enterobacterales
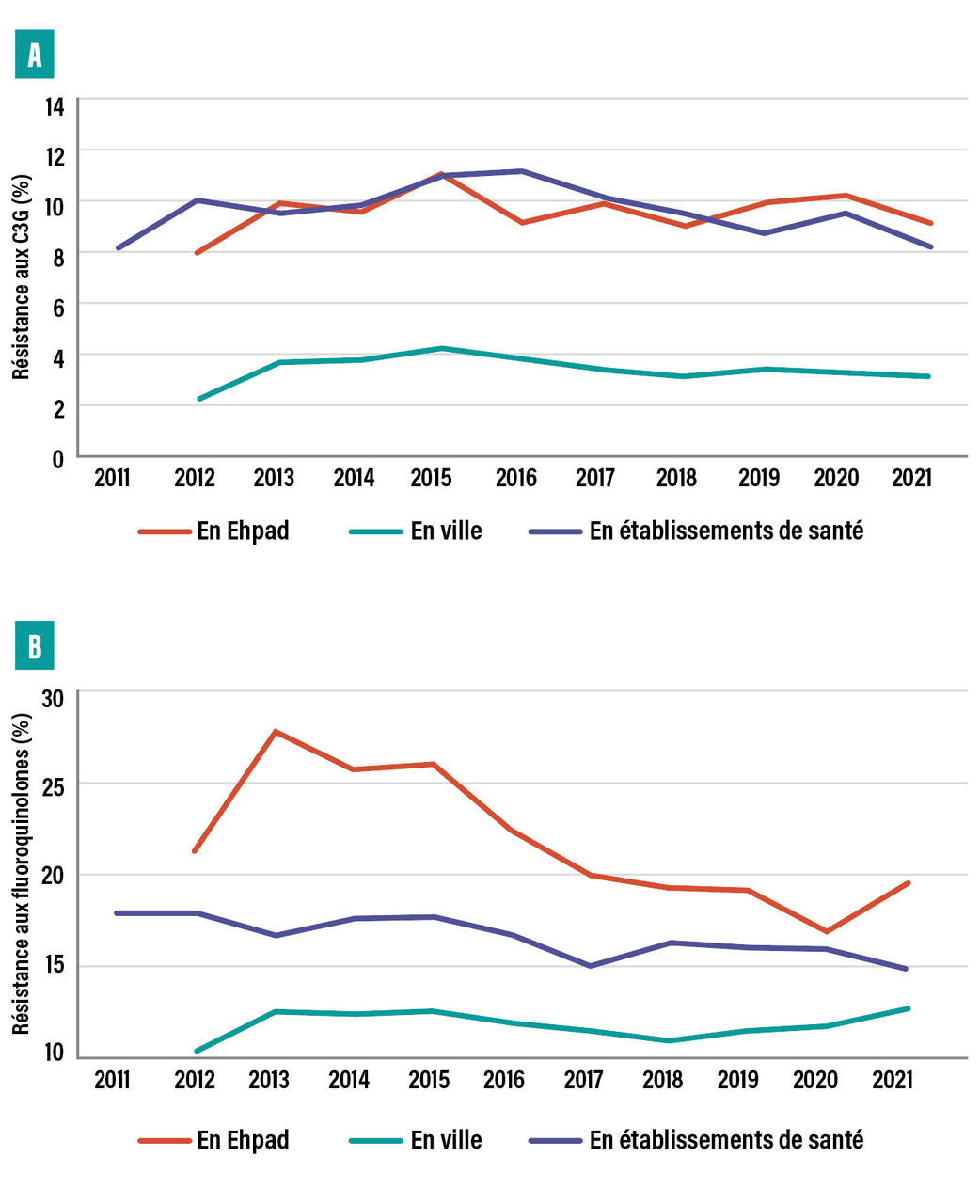
C’est au sein de l’ordre des Enterobacterales que la résistance a le plus évolué et constitue donc la principale menace actuelle. Depuis les années 2000 s’observe la dissémination communautaire des Enterobacterales productrices de bêtalactamases à spectre étendu (E-BLSE). Ces dernières sont résistantes à toutes les bêtalactamines, à l’exception des carbapénèmes, des céphamycines, de la témocilline et de certains nouveaux antibiotiques comme l’association ceftazidime-avibactam ; elles présentent très fréquemment des corésistances aux autres classes d’antibiotiques (fluoroquinolones, cotrimoxazole, aminosides). Une méta-analyse récente estimait à 14 % la prévalence moyenne de portage d’E-BLSE dans le monde, avec une augmentation annuelle de 5,4 % et d’importantes disparités selon les régions du monde (de 5 à 10 % en Europe, 30 % en Afrique et 70 % en Asie).5,6 En France, les données estiment de 5 à 10 % le taux de portage d’E-BLSE dans la population générale en ville. Concernant les infections, le réseau européen EARS-Net rapportait, en 2021, une prévalence de la résistance aux C3G dans les bactériémies de 8 % en France chez Escherichia coli, espèce dite « communautaire », contre 25 % chez Klebsiella pneumoniae, espèce dite « hospitalière ».7 En ville, la résistance aux C3G est plus faible, touchant 4 % des E. coli responsables d’infections urinaires (dont 95 % producteurs de BLSE), chiffre en légère baisse depuis 2015. La résistance aux fluoroquinolones, quant à elle, n’a fait que croître, passant de moins de 5 % dans les années 1990 à près de 12 % et 20 % en 2019 dans les infections communautaires et hospitalières respectivement.8 La résistance au cotrimoxazole est également élevée, atteignant 20 à 24 % chez les souches d’E. coli communautaires (fig. 1 ).8 La dissémination massive des E-BLSE a été suivie d’une augmentation de la consommation des carbapénèmes faisant le lit de l’émergence des Enterobacterales productrices de carbapénémases (EPC), résistantes à la quasi-totalité des antibiotiques.9 Le nombre d’EPC n’a cessé d’augmenter en France (de quelques dizaines de souches en 2009 à plus de 3 000 relevées par le CNR en 2019), mais leur description reste encore cantonnée aux établissements de santé, avec peu de souches isolées en ville.10
Staphylococcus aureus
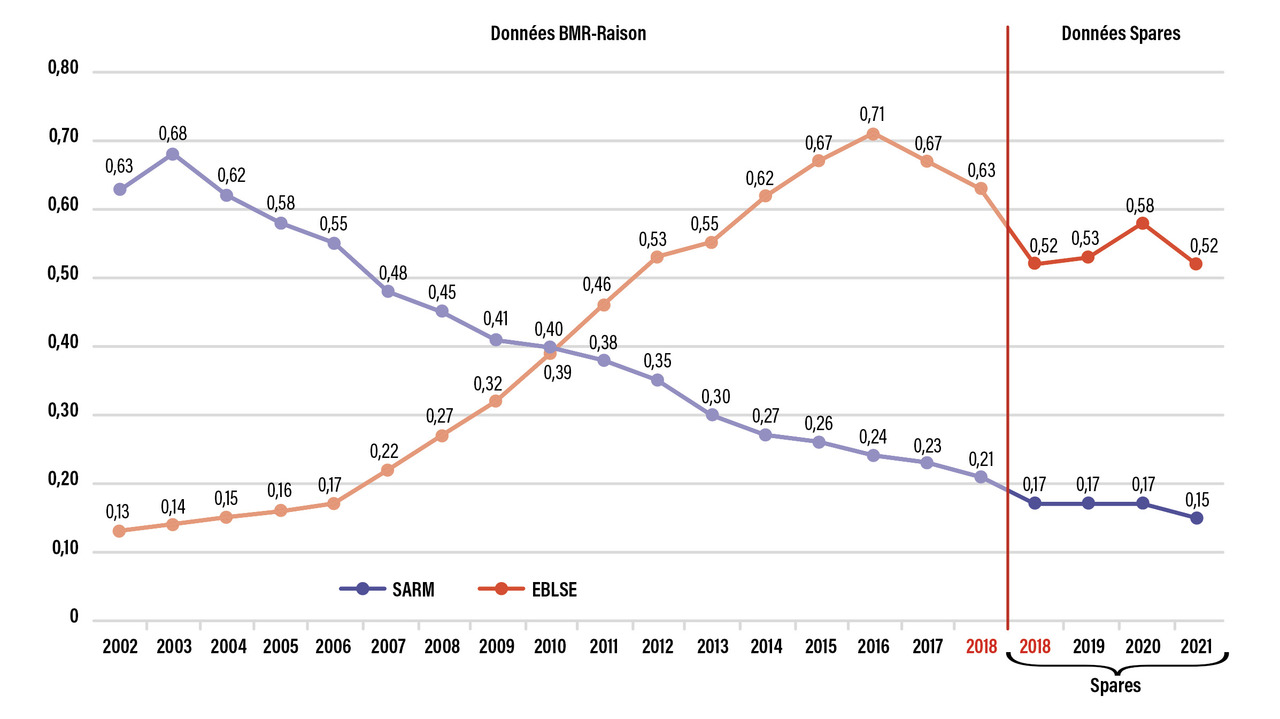
Très tôt après la mise sur le marché de la pénicilline M, l’émergence de résistance de S. aureus à la méticilline (Sarm) a été rapportée, liée à l’acquisition d’une nouvelle PLP (PLP2a) lui conférant une résistance à l’ensemble des bêtalactamines (à l’exception de la ceftaroline et du ceftobiprole) et souvent associée à une résistance à d’autres classes d’antibiotiques. En France, l’incidence des Sarm n’a fait que diminuer au sein des établissements hospitaliers depuis les années 1990 grâce à la mise en place des équipes opérationnelles d’hygiène et à l’utilisation des solutions hydroalcooliques (fig. 2 ). La prévalence des Sarm au sein de l’espèce S. aureus est ainsi passée de 34 à 11 % ces vingt dernières années.10 En Europe, on observe un gradient Nord/Sud avec une prévalence des Sarm dans les bactériémies, autour de 2 % dans les pays scandinaves alors qu’elle atteint près de 40 % dans les pays bordant la Méditerranée.7 En ville, l’isolement d’une souche de Sarm est souvent associé à un contact avec un établissement de soin ou un établissement d’hébergement pour personnes âgées. Au début des années 2000, aux États-Unis, un clone de Sarm communautaire (USA 300) également producteur de la toxine de Panton-Valentine, s’est disséminé de façon fulgurante, avec une prévalence pouvant atteindre 78 % dans les infections cutanées communautaires. À la même époque, l’émergence d’un clone de Sarm communautaire, ST80, producteur de la même toxine, a fait craindre le même phénomène en Europe, mais l’épidémiologie européenne s’est avérée différente de celle des États-Unis et l’incidence des Sarm communautaires est restée limitée.11,12 Concernant la résistance aux autres antibiotiques, celle aux fluoroquinolones reste associée aux souches de Sarm hospitalières (de 80 à 90 % de résistance) alors que les autres antibiotiques, comme la rifampicine, le cotrimoxazole ou la pristinamycine sont très peu concernés.
État des lieux de la résistance bactérienne aux antibiotiques chez l’animal
La médecine vétérinaire diffère de la médecine humaine en de nombreux points. Elle est principalement collective, par exemple les poulets de chair sont élevés en lots de plusieurs milliers d’individus dans le même bâtiment, et les antibiotiques sont administrés par voie orale dans l’eau de boisson. Sauf pour les animaux de compagnie ou les chevaux, qui s’apparentent à la médecine humaine communautaire, le traitement est souvent métaphylactique, c’est-à-dire que l’ensemble des animaux peut être traité dès qu’une fraction d’entre eux est malade. De plus, l’essentiel de l’antibiothérapie chez les animaux de production se pratique sur des individus jeunes, et les problématiques du sujet âgé sont exceptionnelles. L’antibiothérapie vétérinaire est très encadrée par la loi (antibiotiques autorisés ou interdits). La réglementation prévoit aussi un délai d’attente entre la dernière antibiothérapie et l’abattage de l’animal, pour protéger les consommateurs des résidus d’antibiotiques dans les aliments d’origine animale. La prescription d’antibiotiques d’importance critique pour l’homme (C3G et fluoroquinolones) est soumise à un antibiogramme obligatoire. Enfin, l’usage des antibiotiques à des fins de « promotion de croissance » est interdit en Europe depuis le 1er janvier 2006.
Ainsi, la résistance bactérienne aux antibiotiques chez l’animal s’entend chez le sujet malade mais également chez le sujet sain au stade de son abattage, puis dans les produits alimentaires dérivés (poulet à la distribution, par exemple).13
Ainsi, la résistance bactérienne aux antibiotiques chez l’animal s’entend chez le sujet malade mais également chez le sujet sain au stade de son abattage, puis dans les produits alimentaires dérivés (poulet à la distribution, par exemple).13
Chez les animaux sains
En application des décisions européennes, la surveillance de l’antibiorésistance dans la chaîne alimentaire est organisée à l’abattoir chez les porcs, bovins, poulets et dindes.
L’antibiorésistance des salmonelles est très faible vis-à-vis des C3G et des fluoroquinolones. Aucune résistance aux carbapénèmes n’est détectée. En revanche, la résistance à la tétracycline est très élevée chez le porc (58,8 %), le veau (55,8 %) et la dinde (59,5 %). La résistance aux sulfamides est également élevée chez le veau (34,9 %) et très élevée chez le porc (58,8 %). Enfin, 44,1 % et 25,6 % des souches respectivement isolées chez le porc et le veau sont résistantes à l’ampicilline. Le profil de résistance est également très dépendant du sérovar (ou sérotype) des salmonelles.
S’agissant du genre Campylobacter, deux espèces sont suivies, C. jejuni et C. coli. Aucune souche de C. jejuni n’est résistante à l’érythromycine ou à la gentamicine, mais les pourcentages de résistance aux fluoroquinolones sont très élevés (70 %). Ce dernier point reste mal expliqué eu égard à la réduction drastique de l’usage des fluoroquinolones animales en France (-90 %).14 Des phénomènes de co-sélection, de disséminations clonales et de valeur sélective différents entre clones sont évoqués. Pour autant, cette persistance a peu d’impact en santé publique car aucune souche de C. jejuni n’est résistante à l’érythromycine, qui est le deuxième antibiotique de choix pour le traitement des campylobactérioses chez l’homme (et le premier chez l’enfant).
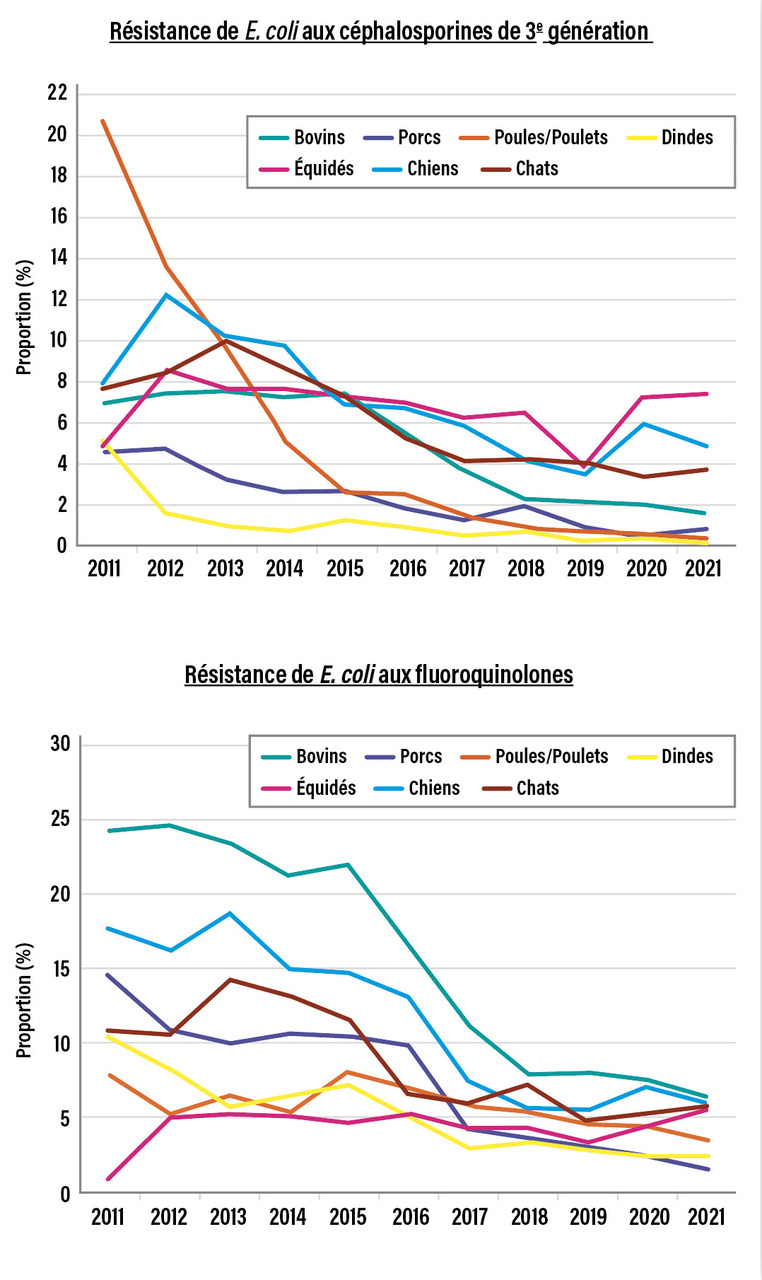
Enfin, la proportion de E. coli de portage sensibles à tous les antibiotiques testés, a augmenté de manière très significative. Et la prévalence très élevée en 2016 (62,9 %) des E. coli résistants aux C3G dans la viande de poulet a chuté en 2018 (25,5 %), puis en 2020 (11,1 %).
L’antibiorésistance des salmonelles est très faible vis-à-vis des C3G et des fluoroquinolones. Aucune résistance aux carbapénèmes n’est détectée. En revanche, la résistance à la tétracycline est très élevée chez le porc (58,8 %), le veau (55,8 %) et la dinde (59,5 %). La résistance aux sulfamides est également élevée chez le veau (34,9 %) et très élevée chez le porc (58,8 %). Enfin, 44,1 % et 25,6 % des souches respectivement isolées chez le porc et le veau sont résistantes à l’ampicilline. Le profil de résistance est également très dépendant du sérovar (ou sérotype) des salmonelles.
S’agissant du genre Campylobacter, deux espèces sont suivies, C. jejuni et C. coli. Aucune souche de C. jejuni n’est résistante à l’érythromycine ou à la gentamicine, mais les pourcentages de résistance aux fluoroquinolones sont très élevés (70 %). Ce dernier point reste mal expliqué eu égard à la réduction drastique de l’usage des fluoroquinolones animales en France (-90 %).14 Des phénomènes de co-sélection, de disséminations clonales et de valeur sélective différents entre clones sont évoqués. Pour autant, cette persistance a peu d’impact en santé publique car aucune souche de C. jejuni n’est résistante à l’érythromycine, qui est le deuxième antibiotique de choix pour le traitement des campylobactérioses chez l’homme (et le premier chez l’enfant).
Enfin, la proportion de E. coli de portage sensibles à tous les antibiotiques testés, a augmenté de manière très significative. Et la prévalence très élevée en 2016 (62,9 %) des E. coli résistants aux C3G dans la viande de poulet a chuté en 2018 (25,5 %), puis en 2020 (11,1 %).
Chez les animaux malades
Une spécificité de la médecine vétérinaire est la diversité des espèces animales, ce qui exclut d’extrapoler les résultats de l’une à l’autre, tant les bactéries infectieuses diffèrent entre animaux, ou dans leur physiopathologie d’un animal à l’autre. Par exemple, S. aureus n’est pas pathogène chez le porc alors qu’il l’est fortement chez le chien et le chat. Les streptocoques animaux sont généralement spécifiques de l’hôte (Streptococcus equi, S. suis, S. canis, S. bovis). On peut retenir néanmoins que les streptocoques animaux ne posent guère de problème de résistance aux antibiotiques. De même, les germes responsables d’infections respiratoires (pasteurelles au sens large) sont très sensibles aux antibiotiques.
fig. 3 ).
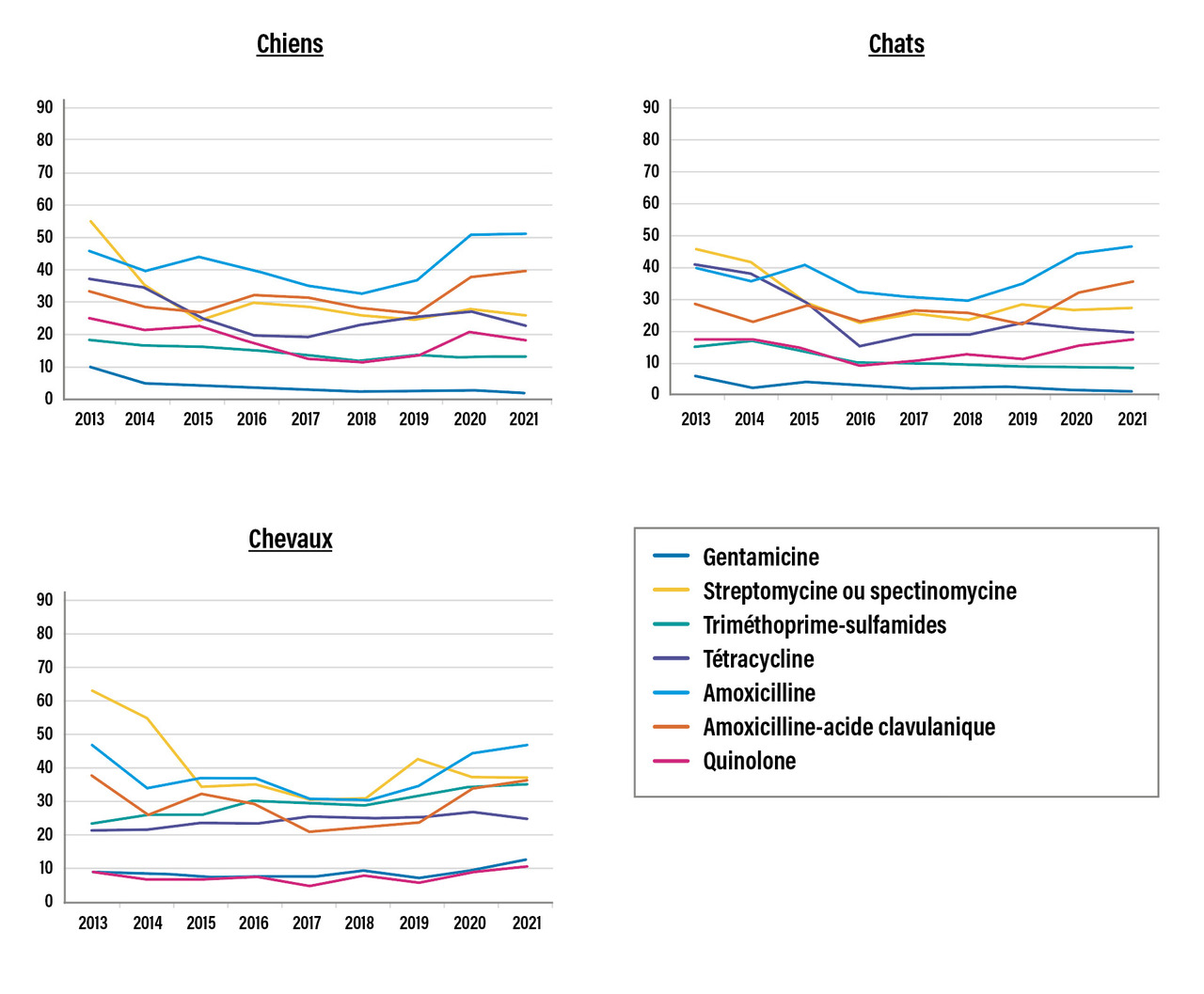
Par ailleurs, les tendances des résistances de E. coli aux autres antibiotiques sur les dix dernières années montrent une diminution de la résistance à la tétracycline dans les filières avicoles et dans une moindre mesure chez le porc et les bovins. Les proportions de souches antibiorésistantes ont été fortement réduites : dindes (-59 %), poules-poulets (-48 %), porcs (-17 %) et bovins (-13 %). En filière bovine, les tendances sont toutefois moins marquées. Une tendance à la hausse est même observée pour certains antibiotiques (amoxicilline, amoxicilline-acide clavulanique), notamment chez les chiens, les chats et les chevaux (fig. 4 ).
Enterobacterales
Le groupe d’infections retrouvées chez tous les animaux est celui à Enterobacterales, plus particulièrement à E. coli. On observe des infections urinaires chez les chiens et les chats, ou des infections gastro-intestinales chez les animaux de production, au moment des transitions alimentaires du jeune vers l’adulte. La résistance de E. coli aux antibiotiques est un indicateur majeur du suivi de la résistance bactérienne chez l’animal, et l’évolution des résistances aux C3G et aux fluoroquinolones dans cette espèce bactérienne est très favorable (Par ailleurs, les tendances des résistances de E. coli aux autres antibiotiques sur les dix dernières années montrent une diminution de la résistance à la tétracycline dans les filières avicoles et dans une moindre mesure chez le porc et les bovins. Les proportions de souches antibiorésistantes ont été fortement réduites : dindes (-59 %), poules-poulets (-48 %), porcs (-17 %) et bovins (-13 %). En filière bovine, les tendances sont toutefois moins marquées. Une tendance à la hausse est même observée pour certains antibiotiques (amoxicilline, amoxicilline-acide clavulanique), notamment chez les chiens, les chats et les chevaux (
Résistance à la méticilline
Comme la médecine humaine, la médecine vétérinaire est confrontée à la résistance à la méticilline, portée par S. aureus (Sarm) mais également par Staphylococcus pseudintermedius (SPRM) chez les chiens et les chats. Chez ces derniers, la prévalence de SPRM est de l’ordre de 20 %, celle de Sarm de 2 %. En revanche, chez les animaux de production, la prévalence varie par espèce animale. Faible chez les bovins et la volaille, la prévalence de Sarm a drastiquement augmenté chez le porc en France : elle est passée de 2 à 3 % en 2008 à plus de 40 % en 2022. Rappelons que le Sarm du porc a engendré une crise majeure en Europe en 2004, du fait de sa transmission aux éleveurs et autres professionnels aux Pays-Bas et au Danemark.15Vision One Health pour diminuer la résistance aux antibiotiques
La France a mis en place des plans nationaux de lutte contre la résistance aux antibiotiques, à la fois chez l’homme, dans les élevages et chez les animaux de compagnie, avec une sensibilisation des professionnels de santé et du grand public à l’utilisation appropriée des antibiotiques. Des résultats positifs importants de réduction de la résistance bactérienne et de l’usage des antibiotiques ont été obtenus en médecine vétérinaire, plus mitigés en médecine humaine. Au-delà des comparaisons entre secteurs, c’est davantage dans une vision One Health qu’il faut avancer, en définissant des cibles communes du besoin en antibiotiques en médecine humaine et vétérinaire dans les années futures. La santé humaine, la santé animale, le bien-être animal et la sécurité alimentaire sont indissociables ; les antibiotiques sont essentiels pour tous ces domaines. Au-delà d’une meilleure maîtrise de l’utilisation des antibiotiques chez l’homme et l’animal, il convient également de poursuivre les efforts pour renforcer l’hygiène (encore appelée biosécurité en élevage) dans tous les secteurs, véritable barrière à la dissémination des bactéries, y compris celles résistantes aux antibiotiques.
Références
1. Centre national de référence des pneumocoques. Rapport d’activité 2021. Épidémiologie 2020. https://urlz.fr/sal1
2. Centre national de référence des méningocoques et de Haemophilus influenzae. Bilan des activités scientifiques et techniques 2017-2021. https://urlz.fr/sal5
3. Unemo M, Lahra MM, Cole M, Galarza P, Ndowa F, Martin I, et al. World Health Organization Global Gonococcal Antimicrobial Surveillance Program (WHO GASP): Review of new data and evidence to inform international collaborative actions and research efforts. Sexual health 2019;16: 412-25.
4. Centre national de référence des infections sexuellement transmissibles bactériennes. Bilan 2017-2021. https://urlz.fr/sal8.
5. Karanika S, Karantanos T, Arvanitis M, Grigoras C, Mylonakis E. Fecal colonization with extended-spectrum beta-lactamase-producing Enterobacteriaceae and risk factors among healthy individuals: A systematic review and metaanalysis. Clin Infect Dis 2016;63:310-8.
6. Woerther PL, Burdet C, Chachaty E, Andremont A. Trends in human fecal carriage of extended-spectrum beta-lactamases in the community: Toward the globalization of CTX-M. Clin Microbiol Rev 2013;26:744-58.
7. WHO. Antimicrobial resistance surveillance in Europe 2023 - 2021 data. Stockholm: European centre for disease prevention and control and world health organization 2023. https://urlz.fr/sale
8. Santé publique France. Prévention de la résistance aux antibiotiques : une démarche « Une seule santé » 2022. https://urlz.fr/salr
9. Jousset AB, Emeraud C, Bonnin RA, Naas T, Dortet L. Caractéristiques et évolution des souches d’entérobactéries productrices de carbapénémases (EPC) isolées en France 2012-2020. Bull Epidemiol Hebd 2021;18-19.
10. Santé publique France. Surveillance de la résistance bactérienne aux antibiotiques en soins de ville et en établissements pour personnes âgées dépendantes. Mission Primo, résultats 2022 https://urlz.fr/salM
11. Moran GJ, Krishnadasan A, Gorwitz RJ, Fosheim GE, McDougal LK, Carey RB, et al. Methicillin-resistant S. aureus infections among patients in the emergency department. The New England journal of medicine 2006;355:666-74.
12. Bouchiat C, Curtis S, Spiliopoulou I, Bes M, Cocuzza C, Codita I, et al. MRSA infections among patients in the emergency department: A European multicentre study. J Antimicrob Chemother 2017;72:372-5.
13. Madec JY. Antibiorésistance chez l’animal en France : quels résultats ? INRAE Productions animales 2023;35:275-92.
14. Ministère de l’Agriculture et de la souveraineté alimentaire. Le plan EcoAntibio 2012-2017 - Synthèse et principales réalisations. 2016; 24 pages. https://agriculture.gouv.fr/plan-ecoantibio-2012-2017-lutte-contre-lantibioresistance
15. Khanna T, Friendship R, Dewey C, Weese JS. Methicillin resistant Staphylococcus aureus colonization in pigs and pig farmers. Vet Microbiol 2008;128:298-303.
2. Centre national de référence des méningocoques et de Haemophilus influenzae. Bilan des activités scientifiques et techniques 2017-2021. https://urlz.fr/sal5
3. Unemo M, Lahra MM, Cole M, Galarza P, Ndowa F, Martin I, et al. World Health Organization Global Gonococcal Antimicrobial Surveillance Program (WHO GASP): Review of new data and evidence to inform international collaborative actions and research efforts. Sexual health 2019;16: 412-25.
4. Centre national de référence des infections sexuellement transmissibles bactériennes. Bilan 2017-2021. https://urlz.fr/sal8.
5. Karanika S, Karantanos T, Arvanitis M, Grigoras C, Mylonakis E. Fecal colonization with extended-spectrum beta-lactamase-producing Enterobacteriaceae and risk factors among healthy individuals: A systematic review and metaanalysis. Clin Infect Dis 2016;63:310-8.
6. Woerther PL, Burdet C, Chachaty E, Andremont A. Trends in human fecal carriage of extended-spectrum beta-lactamases in the community: Toward the globalization of CTX-M. Clin Microbiol Rev 2013;26:744-58.
7. WHO. Antimicrobial resistance surveillance in Europe 2023 - 2021 data. Stockholm: European centre for disease prevention and control and world health organization 2023. https://urlz.fr/sale
8. Santé publique France. Prévention de la résistance aux antibiotiques : une démarche « Une seule santé » 2022. https://urlz.fr/salr
9. Jousset AB, Emeraud C, Bonnin RA, Naas T, Dortet L. Caractéristiques et évolution des souches d’entérobactéries productrices de carbapénémases (EPC) isolées en France 2012-2020. Bull Epidemiol Hebd 2021;18-19.
10. Santé publique France. Surveillance de la résistance bactérienne aux antibiotiques en soins de ville et en établissements pour personnes âgées dépendantes. Mission Primo, résultats 2022 https://urlz.fr/salM
11. Moran GJ, Krishnadasan A, Gorwitz RJ, Fosheim GE, McDougal LK, Carey RB, et al. Methicillin-resistant S. aureus infections among patients in the emergency department. The New England journal of medicine 2006;355:666-74.
12. Bouchiat C, Curtis S, Spiliopoulou I, Bes M, Cocuzza C, Codita I, et al. MRSA infections among patients in the emergency department: A European multicentre study. J Antimicrob Chemother 2017;72:372-5.
13. Madec JY. Antibiorésistance chez l’animal en France : quels résultats ? INRAE Productions animales 2023;35:275-92.
14. Ministère de l’Agriculture et de la souveraineté alimentaire. Le plan EcoAntibio 2012-2017 - Synthèse et principales réalisations. 2016; 24 pages. https://agriculture.gouv.fr/plan-ecoantibio-2012-2017-lutte-contre-lantibioresistance
15. Khanna T, Friendship R, Dewey C, Weese JS. Methicillin resistant Staphylococcus aureus colonization in pigs and pig farmers. Vet Microbiol 2008;128:298-303.