Arythmie cardiaque la plus fréquente : 33,5 millions de personnes dans le monde.1
Principale complication : survenue d’un événement thrombo-embolique (TE), infarctus cérébral (particulièrement morbide) ou embolie artérielle périphérique.
Anticoagulation à doses efficaces : fondamentale.
Principale complication : survenue d’un événement thrombo-embolique (TE), infarctus cérébral (particulièrement morbide) ou embolie artérielle périphérique.
Anticoagulation à doses efficaces : fondamentale.
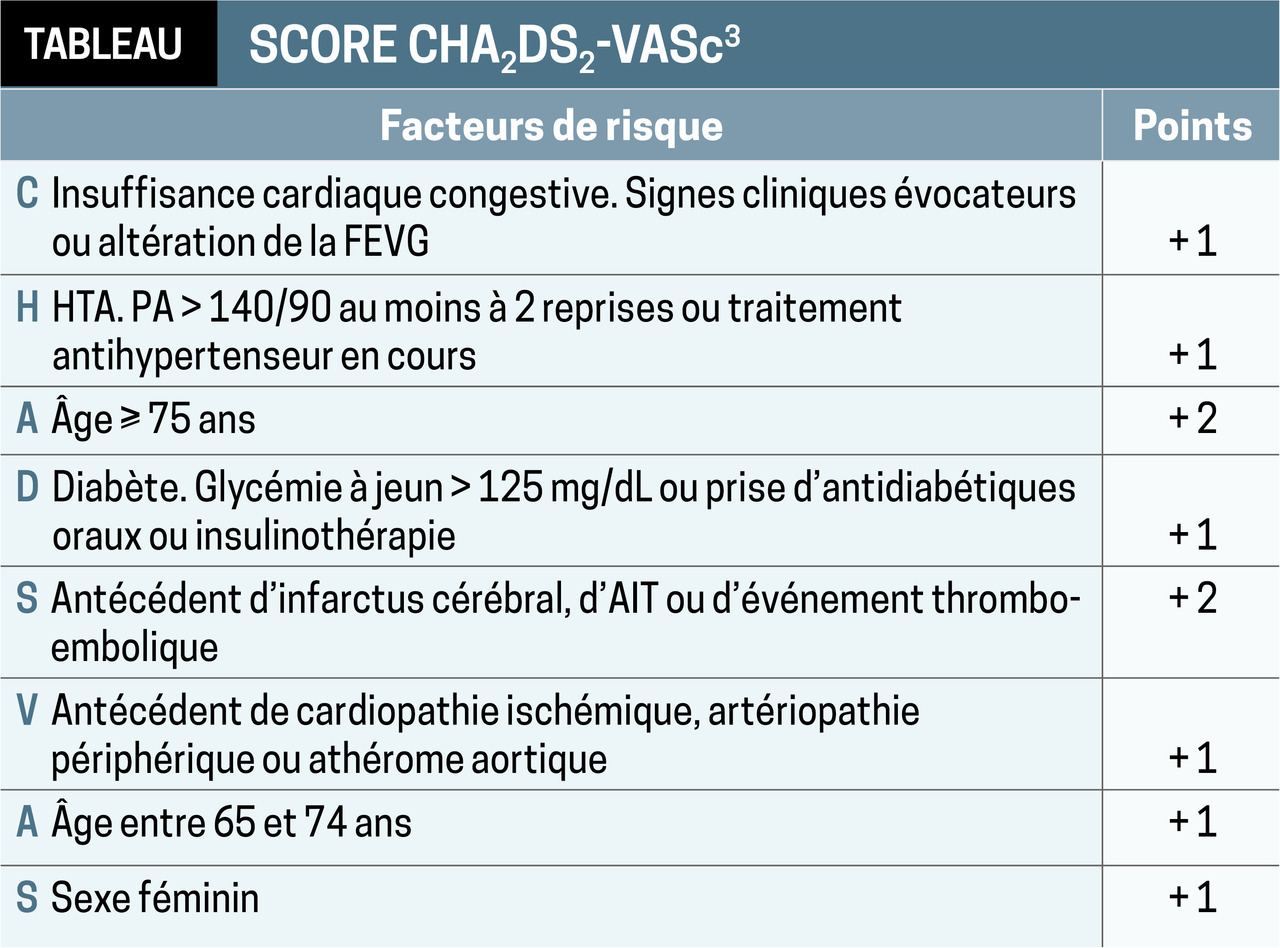
Évaluer le risque thrombo-embolique
Utiliser le score CHA2DS2-VASc (tableau)2, 3
Si ≥ 2 chez l’homme et ≥ 3 chez la femme : traitement anticoagulant à doses efficaces au long cours.
Si les scores sont ≥ 1 et ≥ 2 : cette thérapie est à envisager.
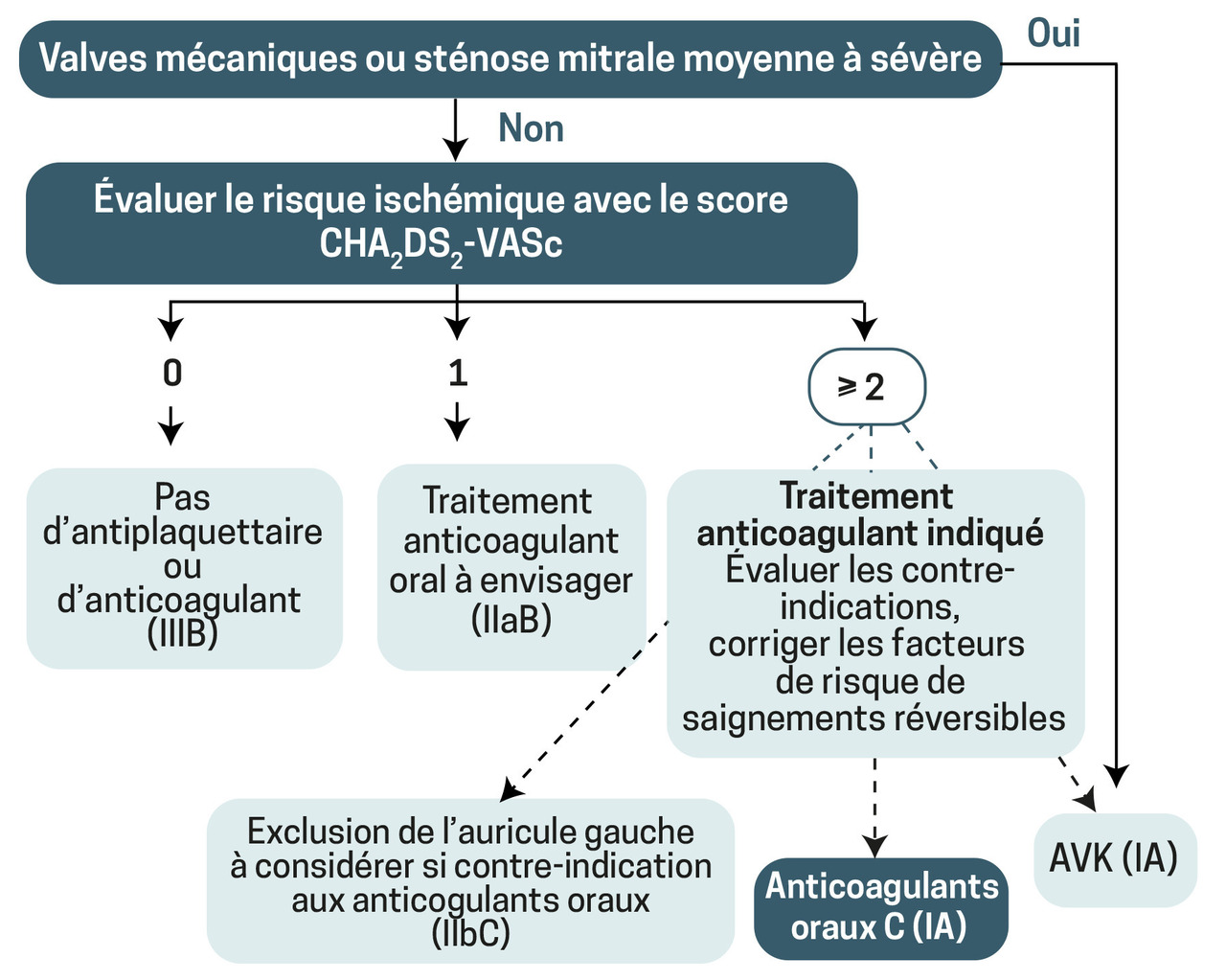
Anticoagulant oral direct en 1re intention (apixaban, Eliquis ; dabigatran, Pradaxa ; rivaroxaban, Xarelto) en l’absence de contre-indication, ou AVK (figure ).
Si les scores sont ≥ 1 et ≥ 2 : cette thérapie est à envisager.
Anticoagulant oral direct en 1re intention (apixaban, Eliquis ; dabigatran, Pradaxa ; rivaroxaban, Xarelto) en l’absence de contre-indication, ou AVK (
Marqueurs échographiques
Seulement si stratégie de contrôle du rythme par cardioversion électrique ou ablation de la FA (persistante).
En échocardiographie transthoracique (ETT) : dysfonction systolique du ventricule gauche, fort prédicteur d’événement cardiovasculaire. Ce critère fait partie du score CHA2DS2-VASc (insuffisance cardiaque clinique ou FEVG < 40 %).
Dilatation de l’oreillette gauche (OG), reflétée par le diamètre antéropostérieur : > 38 mm chez la femme et > 40 mm chez l’homme. Volume de l’OG (méthode surface-longueur ou Simpson biplan) : pathologique si dépasse 34 mL/m2.4
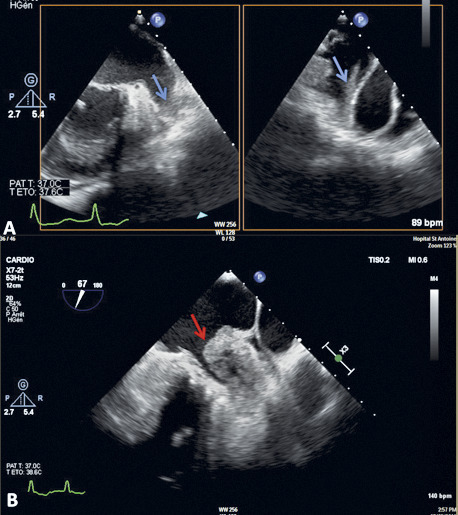
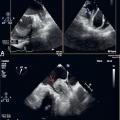
En échocardiographie transœsophagienne (ETO) : on voit mieux l’OG et surtout l’auricule gauche (AG), structure déclive et borgne dans le massif auriculaire, siège électif de la thrombose (90 % des cas hors FA valvulaire).
Sévérité stratifiée selon son intensité (grade 1 à 4), la localisation (OG et/ou AG) et l’éventuel aspect tourbillonnant spontané.
Sludge (grade 4) : stase sanguine préthrombotique caractérisée par du contraste spontané intense donnant un aspect de fumée tourbillonnante mais stagnante au sein de tout ou partie de la cavité auriculaire gauche.
Vitesses de remplissage et de vidange de l’auricule gauche abaissées < 20 cm/s.
Surface de l’AG > 5 cm2.
Thrombus intra-auriculaire gauche, principal déterminant échographique du risque TE artériel.
Cependant, ETO non indiquée pour décider d’un traitement anticoagulant à doses efficaces et sa durée.
Recommandée en cas de stratégie de contrôle du rythme par cardioversion électrique chez un patient en FA n’ayant pas reçu d’anticoagulant à doses efficaces pendant au moins 3 semaines. Objectif : éliminer un thrombus ou un sludge, contre-indications à la cardioversion.
En échocardiographie transthoracique (ETT) : dysfonction systolique du ventricule gauche, fort prédicteur d’événement cardiovasculaire. Ce critère fait partie du score CHA2DS2-VASc (insuffisance cardiaque clinique ou FEVG < 40 %).
Dilatation de l’oreillette gauche (OG), reflétée par le diamètre antéropostérieur : > 38 mm chez la femme et > 40 mm chez l’homme. Volume de l’OG (méthode surface-longueur ou Simpson biplan) : pathologique si dépasse 34 mL/m2.4
En échocardiographie transœsophagienne (ETO) : on voit mieux l’OG et surtout l’auricule gauche (AG), structure déclive et borgne dans le massif auriculaire, siège électif de la thrombose (90 % des cas hors FA valvulaire).
Sévérité stratifiée selon son intensité (grade 1 à 4), la localisation (OG et/ou AG) et l’éventuel aspect tourbillonnant spontané.
Sludge (grade 4) : stase sanguine préthrombotique caractérisée par du contraste spontané intense donnant un aspect de fumée tourbillonnante mais stagnante au sein de tout ou partie de la cavité auriculaire gauche.
Vitesses de remplissage et de vidange de l’auricule gauche abaissées < 20 cm/s.
Surface de l’AG > 5 cm2.
Thrombus intra-auriculaire gauche, principal déterminant échographique du risque TE artériel.
Cependant, ETO non indiquée pour décider d’un traitement anticoagulant à doses efficaces et sa durée.
Recommandée en cas de stratégie de contrôle du rythme par cardioversion électrique chez un patient en FA n’ayant pas reçu d’anticoagulant à doses efficaces pendant au moins 3 semaines. Objectif : éliminer un thrombus ou un sludge, contre-indications à la cardioversion.
Apport des biomarqueurs
Facteur Willebrand, NT-proBNP, troponine élevés peuvent prédire les événements TE.
Le score ABC cumule âge, biomarqueurs (NT-proBNP, troponine ultrasensible) et critères cliniques (antécédent d’infarctus cérébral).5 Non supérieur au CHA2DS2-VASc en cas de FA efficacement anticoagulée.6 Pas de nécessité à changer les pratiques.
Le HAS-BLED destiné à prédire les événements hémorragiques n’est plus mentionné dans les dernières recommandations.2 On lutte contre les facteurs modifiables (encadré ).
Un ABC prédictif du risque hémorragique associant troponine ultrasensible, facteur de croissance GDF-15, hémoglobine, âge et antécédents d’hémorragie s’est montré plus performant que le HAS-BLED. Mais pas de recommandation concernant son utilisation.7
Le score ABC cumule âge, biomarqueurs (NT-proBNP, troponine ultrasensible) et critères cliniques (antécédent d’infarctus cérébral).5 Non supérieur au CHA2DS2-VASc en cas de FA efficacement anticoagulée.6 Pas de nécessité à changer les pratiques.
Le HAS-BLED destiné à prédire les événements hémorragiques n’est plus mentionné dans les dernières recommandations.2 On lutte contre les facteurs modifiables (
Un ABC prédictif du risque hémorragique associant troponine ultrasensible, facteur de croissance GDF-15, hémoglobine, âge et antécédents d’hémorragie s’est montré plus performant que le HAS-BLED. Mais pas de recommandation concernant son utilisation.7
Encadre
Facteurs de risque hémorragique chez un patient anticoagulé
> Facteurs modifiables
– HTA (PAS > 160 mmHg)
– INR labile ou temps passé dans la zone thérapeutique < 60 % si AVK
– Traitements favorisants : AAP et AINS
– Consommation d’alcool ≥ 8 verres par semaine
> Facteurs potentiellement modifiables
– Anémie
– Insuffisance rénale
– Insuffisance hépatique
– Thrombopénie ou thrombopathie
> Non modifiables
– âge (> 65 ans) ou (≥ 75 ans)
– Antécédent d’hémorragie majeure
– ATCD d’AVC
– IR dialysée ou transplantée
– Cirrhose hépatique
– Cancer
– Facteurs génétiques
> Biomarqueurs
– Troponine HS
– GDF 15 (Growth differentiation factor 15)
– Créatininémie/clairance de la créatinine
Références
1. Chugh SS, Havmoeller R, Narayanan K, et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation 2014;129:837‑47.
2. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:2893‑962.
3. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-nased approach. Chest 2010;137:263‑72.
4. Providência R, Trigo J, Paiva L, Barra S. The role of echocardiography in thrombo- embolic risk assessment of patients with nonvalvular atrial fibrillation. J Am Soc Echocardiogr 2013;26:801‑12.
5. Hijazi Z, Lindbäck J, Alexander JH, et al. The ABC (age, biomarkers, clinical history) stroke risk score: a biomarker-based risk score for predicting stroke in atrial fibrillation. Eur Heart J 2016;37:1582‑90.
6. Rivera-Caravaca JM, Roldán V, Esteve-Pastor MA, et al. Long-Term Stroke Risk Prediction in Patients With Atrial Fibrillation: Comparison of the ABC-Stroke and CHA2DS2-VASc Scores. J Am Heart Assoc 2017;6:pii: e006490.
7. Hijazi Z, Oldgren J, Lindbäck J, et al. The novel biomarker-based ABC (age, biomarkers, clinical history)-bleeding risk score for patients with atrial fibrillation: a derivation and validation study. Lancet 2016;387:2302‑11.
2. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:2893‑962.
3. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-nased approach. Chest 2010;137:263‑72.
4. Providência R, Trigo J, Paiva L, Barra S. The role of echocardiography in thrombo- embolic risk assessment of patients with nonvalvular atrial fibrillation. J Am Soc Echocardiogr 2013;26:801‑12.
5. Hijazi Z, Lindbäck J, Alexander JH, et al. The ABC (age, biomarkers, clinical history) stroke risk score: a biomarker-based risk score for predicting stroke in atrial fibrillation. Eur Heart J 2016;37:1582‑90.
6. Rivera-Caravaca JM, Roldán V, Esteve-Pastor MA, et al. Long-Term Stroke Risk Prediction in Patients With Atrial Fibrillation: Comparison of the ABC-Stroke and CHA2DS2-VASc Scores. J Am Heart Assoc 2017;6:pii: e006490.
7. Hijazi Z, Oldgren J, Lindbäck J, et al. The novel biomarker-based ABC (age, biomarkers, clinical history)-bleeding risk score for patients with atrial fibrillation: a derivation and validation study. Lancet 2016;387:2302‑11.

 Encadrés
Encadrés