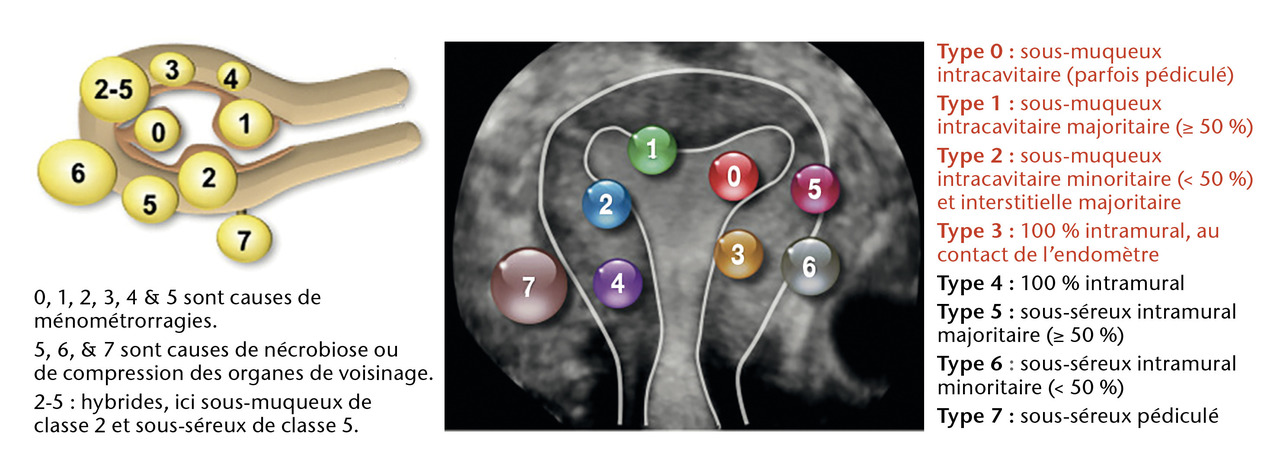
Souvent asymptomatiques, ils croissent en période reproductive et régressent après la ménopause.
Le fibrome est une tumeur bénigne de l’utérus affectant 50 % des femmes caucasiennes et 80 % des afro-caribéennes de plus de 30 ans. Il n’est symptomatique que chez une patiente sur trois.1, 2
Principaux symptômes : saignements, ménorragies et/ou ménométrorragies (règles augmentées en durée et abondance), douleurs pelviennes chroniques et manifestations liées au volume du fibrome et/ou de l’utérus, par compression sur la vessie (pollakiurie) ou le tube digestif (constipation).
On considère qu’au moment du diagnostic, le nombre moyen de symptômes est de trois environ. Ils altèrent la qualité de vie chez 10 % des femmes.3 Le diagnostic peut être évoqué au cours d’un examen retrouvant un utérus trop volumineux.
Seuls ceux déformant la cavité utérine sont impliqués dans l’infertilité. Dans tous les autres cas, le risque de cette complication reste inférieur à 5 % et les conséquences sur l’évolution d’une grossesse sont peu marquées (absence de lien avec le risque de fausse couche précoce ou tardive, d’accouchement prématuré, et/ou de retard de croissance intra-utérin).
Principaux symptômes : saignements, ménorragies et/ou ménométrorragies (règles augmentées en durée et abondance), douleurs pelviennes chroniques et manifestations liées au volume du fibrome et/ou de l’utérus, par compression sur la vessie (pollakiurie) ou le tube digestif (constipation).
On considère qu’au moment du diagnostic, le nombre moyen de symptômes est de trois environ. Ils altèrent la qualité de vie chez 10 % des femmes.3 Le diagnostic peut être évoqué au cours d’un examen retrouvant un utérus trop volumineux.
Seuls ceux déformant la cavité utérine sont impliqués dans l’infertilité. Dans tous les autres cas, le risque de cette complication reste inférieur à 5 % et les conséquences sur l’évolution d’une grossesse sont peu marquées (absence de lien avec le risque de fausse couche précoce ou tardive, d’accouchement prématuré, et/ou de retard de croissance intra-utérin).
Quelle imagerie ?
L’examen de première intention est l’échographie pelvienne abdominale et vaginale. Une échographie 3D avec coupe coronale optimise la cartographie des tumeurs.
Depuis 2011, la classification de référence FIGO, mondialement reconnue, distingue 7 types de fibromes :4
– les types 0, 1 ou 2 : anciennement sous-muqueux ;
– 3, 4, 5 : interstitiels ;
– 6 ou 7 : sous-séreux (figure).
L’échosonographie en injectant 3 à 5 mL de sérum physiologique peut compléter le diagnostic en montrant au mieux les images endocavitaires et donc les types 0, 1 ou 2. L’analyse de la vascu- larisation différencie les fibromes utérins des adénomyomes (localisation de l’endométriose dans le myomètre) ou des sarcomes, même si ce dernier diagnostic est très rare : 1 sarcome pour 500 à 1 000 fibromes symptomatiques.5
Une IRM s’impose pour compléter la cartographie quand plus de 5 fibromes sont visualisés en échographie.
Dans la forme classique, les myomes utérins apparaissent en hyposignal T2 et en isosignal T1. Pour les myomes intracavitaires de types 0 à 2, l’hystéroscopie diagnostique faite en consultation sans spéculum ni pince (appelée vaginoscopie) évalue la faisa- bilité de la résection endoscopique. L’hystérographie, la tomo-densitométrie n’ont aucune indication dans le diagnostic.
En raison de leur caractère bénin, seuls les fibromes symptomatiques imposent un traitement. Préalablement, il est essentiel de s’enquérir du souhait des patientes vis-à-vis d’une future procréation. Cette question doit se poser quel que soit l’âge compte tenu des possibilités de grossesses par don de gamètes. Il est en effet toujours possible de conserver ou de restaurer une cavité utérine apte à la nidation.
Depuis 2011, la classification de référence FIGO, mondialement reconnue, distingue 7 types de fibromes :4
– les types 0, 1 ou 2 : anciennement sous-muqueux ;
– 3, 4, 5 : interstitiels ;
– 6 ou 7 : sous-séreux (figure).
L’échosonographie en injectant 3 à 5 mL de sérum physiologique peut compléter le diagnostic en montrant au mieux les images endocavitaires et donc les types 0, 1 ou 2. L’analyse de la vascu- larisation différencie les fibromes utérins des adénomyomes (localisation de l’endométriose dans le myomètre) ou des sarcomes, même si ce dernier diagnostic est très rare : 1 sarcome pour 500 à 1 000 fibromes symptomatiques.5
Une IRM s’impose pour compléter la cartographie quand plus de 5 fibromes sont visualisés en échographie.
Dans la forme classique, les myomes utérins apparaissent en hyposignal T2 et en isosignal T1. Pour les myomes intracavitaires de types 0 à 2, l’hystéroscopie diagnostique faite en consultation sans spéculum ni pince (appelée vaginoscopie) évalue la faisa- bilité de la résection endoscopique. L’hystérographie, la tomo-densitométrie n’ont aucune indication dans le diagnostic.
En raison de leur caractère bénin, seuls les fibromes symptomatiques imposent un traitement. Préalablement, il est essentiel de s’enquérir du souhait des patientes vis-à-vis d’une future procréation. Cette question doit se poser quel que soit l’âge compte tenu des possibilités de grossesses par don de gamètes. Il est en effet toujours possible de conserver ou de restaurer une cavité utérine apte à la nidation.
Traitements médicaux
Les progestatifs ont pour seule indication le traitement de l’hypertrophie endométriale associée au fibrome. On peut les prescrire en discontinu 21 jours par mois (acétate de chlormadinone ou de nomégestrol 1 cp/j) avec maintien des menstruations ou en continu sur une période de 3 mois. Au-delà, l’hypertrophie est traitée et ne justifie pas le maintien du progestatif qui peut augmenter la croissance volumétrique des fibromes.6
Un SIU au lévonorgestrel 52 mg (Mirena) bien qu’il n’ait pas l’AMM dans l’indication fibrome peut être inséré en cas de ménométrorragies en l’absence de fibrome de types 0 à 2, qui rendraient sa pose difficile, voire impossible. Ce stérilet a une efficacité non négligeable sur ces hémorragies mais provoque 6 mois de spotting.
L’acide tranéxamique (Exacyl), antifibrinolytique dont l’efficacité sur le volume des saignements est de l’ordre de 50 %, peut être proposé en cas de ménorragies sans fibrome de type 0, 1 ou 2 chez des femmes souhaitant procréer (500 mg à 1 g, 2 à 3 x/j, durant 48-72 h).7
Les analogues de la GnRH (Décapeptyl LP en IM, Enantone LP 3,75 mg ou Gonapeptyl 3,75 mg 1 fois par mois pendant 3 mois au maximum) ont une AMM en préopératoire pour corriger l’anémie et réduire le volume des fibromes et/ou de l’utérus, soit pour optimiser un traitement conservateur, soit pour éviter de pratiquer une laparotomie en vue d’un traitement radical.8
L’acétate d’ulipristal (Esmya) est le premier des SPRM (modulateur sélectif du récepteur de la progestérone) utilisé depuis 2013 dans cette indication. Il entraîne une apoptose cellulaire et donc une régression volumétrique pérenne. Soit au bout d’une semaine un arrêt de tout saignement et chez 80 % des patientes une réduction de volume de 25 %. Il peut être prescrit avec prudence par le gynécologue en préopératoire en se limitant à une cure de 3 mois chez des femmes bien informées des risques (encadré). Son utilisation en « traitement séquentiel » est restreinte aux patientes non éligibles à la chirurgie. Au bout de 2 cures, on observe une réduction de volume de 50 % des fibromes chez la moitié des femmes.9, 10
Un SIU au lévonorgestrel 52 mg (Mirena) bien qu’il n’ait pas l’AMM dans l’indication fibrome peut être inséré en cas de ménométrorragies en l’absence de fibrome de types 0 à 2, qui rendraient sa pose difficile, voire impossible. Ce stérilet a une efficacité non négligeable sur ces hémorragies mais provoque 6 mois de spotting.
L’acide tranéxamique (Exacyl), antifibrinolytique dont l’efficacité sur le volume des saignements est de l’ordre de 50 %, peut être proposé en cas de ménorragies sans fibrome de type 0, 1 ou 2 chez des femmes souhaitant procréer (500 mg à 1 g, 2 à 3 x/j, durant 48-72 h).7
Les analogues de la GnRH (Décapeptyl LP en IM, Enantone LP 3,75 mg ou Gonapeptyl 3,75 mg 1 fois par mois pendant 3 mois au maximum) ont une AMM en préopératoire pour corriger l’anémie et réduire le volume des fibromes et/ou de l’utérus, soit pour optimiser un traitement conservateur, soit pour éviter de pratiquer une laparotomie en vue d’un traitement radical.8
L’acétate d’ulipristal (Esmya) est le premier des SPRM (modulateur sélectif du récepteur de la progestérone) utilisé depuis 2013 dans cette indication. Il entraîne une apoptose cellulaire et donc une régression volumétrique pérenne. Soit au bout d’une semaine un arrêt de tout saignement et chez 80 % des patientes une réduction de volume de 25 %. Il peut être prescrit avec prudence par le gynécologue en préopératoire en se limitant à une cure de 3 mois chez des femmes bien informées des risques (encadré). Son utilisation en « traitement séquentiel » est restreinte aux patientes non éligibles à la chirurgie. Au bout de 2 cures, on observe une réduction de volume de 50 % des fibromes chez la moitié des femmes.9, 10
Traitement conservateur
L’hystéroscopie opératoire est l’intervention de référence pour les fibromes de type 0, 1 ou 2 (jusqu’à 5 cm et sous contrôle échographique si la distance séreuse utérine-fibrome < 5 mm). Elle est réalisée en chirurgie ambulatoire en utilisant un résectoscope de 5, 6, 7 ou 9 mm et exclusivement de l’énergie bipolaire afin de réduire le risque de complications opératoires et de synéchies. Toute patiente souhaitant conserver ses possibilités de procréation aura, 6 à 8 semaines après l’intervention, un contrôle hystéroscopique en consultation afin de valider la bonne restitution de la cavité utérine.
Pour les myomes de types 3 à 7, les myomectomies (conservatrices) peuvent être réalisées par voie abdominale, soit cœlioscopique, soit laparotomique, la voie cœlioscopique étant réservée aux fibromes symptomatiques inférieurs à 10 cm, et en nombre inférieur ou égal à 3.
Dans les autres cas (fibromes > 10 cm ou au-delà de 3), une laparotomie transversale est indiquée. Il faut prévenir la survenue d’adhérences par l’emploi de gel ou de plaques anti-adhérentiels. Le délai avant une nouvelle grossesse peut être estimé entre 3 et 12 mois en fonction de l’âge des patientes.
L’embolisation n’est indiquée que chez des femmes ne souhaitant plus procréer en raison du risque de synéchies ou de complications septiques pour les fibromes appendus à l’utérus, c’est-à-dire de type 7. L’efficacité est d’environ 80 % et le taux de complications est faible quand l’indication est respectée.11
Pour les myomes de types 3 à 7, les myomectomies (conservatrices) peuvent être réalisées par voie abdominale, soit cœlioscopique, soit laparotomique, la voie cœlioscopique étant réservée aux fibromes symptomatiques inférieurs à 10 cm, et en nombre inférieur ou égal à 3.
Dans les autres cas (fibromes > 10 cm ou au-delà de 3), une laparotomie transversale est indiquée. Il faut prévenir la survenue d’adhérences par l’emploi de gel ou de plaques anti-adhérentiels. Le délai avant une nouvelle grossesse peut être estimé entre 3 et 12 mois en fonction de l’âge des patientes.
L’embolisation n’est indiquée que chez des femmes ne souhaitant plus procréer en raison du risque de synéchies ou de complications septiques pour les fibromes appendus à l’utérus, c’est-à-dire de type 7. L’efficacité est d’environ 80 % et le taux de complications est faible quand l’indication est respectée.11
Hystérectomie : pour qui ?
Ce geste radical peut être pratiqué par voie vaginale, cœlioscopique ou laparotomique. On tente aujourd’hui de limiter le nombre de laparotomies avec des traitements préopératoires. Actuellement, on lui associe systématiquement une salpingectomie pour prévenir la survenue de tumeurs ovariennes (dont l’origine semble provenir de la trompe). Les ovaires sont habituellement laissés en place jusqu’à 60 ans afin de protéger des complications cardiovasculaires et osseuses d’une castration trop rapide.
L’hystérectomie subtotale (laissant en place le col) peut se discuter à condition que les patientes fassent leurs frottis cervico-utérins régulièrement.
L’hystérectomie subtotale (laissant en place le col) peut se discuter à condition que les patientes fassent leurs frottis cervico-utérins régulièrement.
Encadre
Fibromes et infertilité
L’infertilité est en lien avec un fibrome, essentiellement intracavitaire 0, 1 et 2, dans moins de 5 % des cas.
Dans les autres localisations, on n’a jamais montré qu’une myomectomie optimisait les chances de grossesses. Peu de fibromes sont associés à des complications durant la grossesse car la modification de volume est très variable pendant la gestation.
La complication la plus fréquente est la nécrobiose aseptique (« infarctus » d’un fibrome volontiers pédiculé donnant des douleurs pelviennes avec fièvre) survenant pendant la première moitié de la grossesse, qui ne met jamais en péril son évolution et qui nécessite simplement un traitement antalgique.
références
1. Fernandez H, Chabbert Buffet N, Allouche S. Prevalence of uterine fibroids in France and impact on quality of life: results of a survey among 2500 women between 30-55 years. J Gynecol Obstet Biol Reprod 2014;43: 721-7.
2. Parker WH. Etiology, symptomatology, and diagnosis of uterine myomas. Fertil Steril 2007;87:725-36.
3. Fernandez H, Chabbert-Buffet N, Koskas M, Nazac A. Epidemiological data for uterine fibroids in France in 2010-2012 in medical center--analysis from the French DRG-based information system. J Gynecol Obstet Biol Reprod 2014;43:616-28.
4. Munro MG, Critchley HO, Broder MS, Fraser IS, Disorders FWGoMD. FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynaecol Obstet 2011;113:3-13.
5. Thomassin-Naggara I, Dechoux S, Bonneau C, et al. How to differentiate benign from malignant myometrial tumours using MR imaging. Eur Radiol 2013;23:2306-14.
6. Koskas M, Chabbert-Buffet N, Douvier S, et al. Role of medical treatment for symptomatic leiomyoma management in premenopausal women. J Gynecol Obstet Biol Reprod 2011;40:858-74.
7. Bonnar J, Sheppard BL. Treatment of menorrhagia during menstruation: randomised controlled trial of ethamsylate, mefenamic acid, and tranexamic acid. BMJ 1996;313:579-82.
8. Seracchioli R, Venturoli S, Colombo FM, et al. GnRH agonist treatment before total laparoscopic hysterectomy for large uteri. J Am Assoc Gynecol Laparosc 2003;10:316-9.
9. Donnez J, Hudecek R, Donnez O, et al. Efficacy and safety of repeated use of ulipristal acetate in uterine fibroids. Fertil Steril 2015;103:519-27 e3.
10. Fernandez H, Schmidt T, Powell M, et al. Real world data of 1473 patients treated with ulipristal acetate for uterine fibroids: Premya study results. Eur J Obstet Gynecol Reprod Biol 2017;208:91-6.
11. Gupta JK, Sinha A, Lumsden MA, Hickey M. Uterine artery embolization for symptomatic uterine fibroids. Cochrane Database Syst Rev 2014: CD005073.
2. Parker WH. Etiology, symptomatology, and diagnosis of uterine myomas. Fertil Steril 2007;87:725-36.
3. Fernandez H, Chabbert-Buffet N, Koskas M, Nazac A. Epidemiological data for uterine fibroids in France in 2010-2012 in medical center--analysis from the French DRG-based information system. J Gynecol Obstet Biol Reprod 2014;43:616-28.
4. Munro MG, Critchley HO, Broder MS, Fraser IS, Disorders FWGoMD. FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynaecol Obstet 2011;113:3-13.
5. Thomassin-Naggara I, Dechoux S, Bonneau C, et al. How to differentiate benign from malignant myometrial tumours using MR imaging. Eur Radiol 2013;23:2306-14.
6. Koskas M, Chabbert-Buffet N, Douvier S, et al. Role of medical treatment for symptomatic leiomyoma management in premenopausal women. J Gynecol Obstet Biol Reprod 2011;40:858-74.
7. Bonnar J, Sheppard BL. Treatment of menorrhagia during menstruation: randomised controlled trial of ethamsylate, mefenamic acid, and tranexamic acid. BMJ 1996;313:579-82.
8. Seracchioli R, Venturoli S, Colombo FM, et al. GnRH agonist treatment before total laparoscopic hysterectomy for large uteri. J Am Assoc Gynecol Laparosc 2003;10:316-9.
9. Donnez J, Hudecek R, Donnez O, et al. Efficacy and safety of repeated use of ulipristal acetate in uterine fibroids. Fertil Steril 2015;103:519-27 e3.
10. Fernandez H, Schmidt T, Powell M, et al. Real world data of 1473 patients treated with ulipristal acetate for uterine fibroids: Premya study results. Eur J Obstet Gynecol Reprod Biol 2017;208:91-6.
11. Gupta JK, Sinha A, Lumsden MA, Hickey M. Uterine artery embolization for symptomatic uterine fibroids. Cochrane Database Syst Rev 2014: CD005073.

 Encadrés
Encadrés