Les fibromes utérins, tumeurs bénignes les plus fréquentes de l’appareil génital féminin, peuvent être asymptomatiques ou associés à différents signes. L’échographie pelvienne est le premier examen diagnostique. L’imagerie par résonance magnétique (IRM) pelvienne est prescrite en deuxième intention, avant chirurgie ou radiologie interventionnelle, pour préciser la cartographie des fibromes. La prise en charge dépend des signes cliniques, de la localisation, du désir ou non de conserver l’utérus et du projet parental.
Les fibromes utérins sont des tumeurs bénignes de l’utérus développées à partir des cellules musculaires lisses ; de ce fait, le terme le plus approprié pour les désigner est « myome » ou « léiomyome ». Ils sont le plus souvent multiples. Leur taille est variable, de 1 à 20 cm, voire plus. Leur croissance est classiquement observée jusqu’à la ménopause lors de laquelle leur volume, ainsi que les symptômes associés, peuvent diminuer.
Tumeurs bénignes fréquentes
Les fibromes utérins sont les tumeurs les plus fréquentes de l’appareil génital féminin. Ils concernent 20 à 30 % des femmes de plus de 30 ans et 40 % des femmes à partir de 40 ans.1,2 Il est difficile d’établir une relation de cause à effet avec des facteurs génétiques et environnementaux, en particulier les perturbateurs endocriniens régulièrement mis en cause pour leur effet oestrogene-like. Seule l’influence ethnique est démontrée, avec plus de 80 % des femmes d’origine afro-antillaise porteuses de fibrome, tous âges confondus.
Symptomatologie inconstante
Bien que fréquents, les myomes utérins ne sont pas tous symptomatiques. Beaucoup sont découverts fortuitement au cours d’examens d’imagerie réalisés pour d’autres causes.
Deux enquêtes réalisées en France en 2013 et 2023 dénombrent 9 à 13 % de femmes symptomatiques porteuses de myomes en population générale.3,4
Les symptômes les plus fréquents associés aux myomes sont les suivants :
- saignements utérins anormaux (ménorragies, métrorragies) dans 77 % des cas ;
- signes compressifs pelviens et extrapelviens (pesanteurs, lombalgies, pollakiurie, dysurie, constipation terminale) dans 64 % des cas ;
- douleurs pelviennes (dysménorrhée, dyspareunie, douleurs non cycliques) dans 55 % des cas ;
- signes d’anémie et/ou de carence martiale (fatigue, dyspnée d’effort, troubles des phanères) dans 55 % des cas.
Parfois, le diagnostic est fait chez une femme consultant pour infertilité (13 %), mais leur imputation réelle, toujours difficile à établir, ne dépasse probablement pas 2 ou 3 % des cas. Par ailleurs, l’impact des fibromes sur la reproduction est étroitement lié à sa position dans l’utérus (encadré).5 - 11
Modalités diagnostiques : échographie pelvienne en première intention
Le diagnostic des formes évoluées peut se faire par la palpation abdomino-pelvienne en objectivant une masse centropelvienne à développement latéral ou sus-ombilical. L’examen gynécologique combinant le toucher vaginal au palper sus-pubien permet de définir la forme et le volume des utérus plus petits et leur impact dans la symptomatologie en les mobilisant doucement.
Le premier examen d’imagerie à effectuer est une échographie pelvienne. Il s’agit d’un examen réalisé idéalement par un référent, c’est-à-dire un praticien expérimenté en imagerie pelvienne de la femme avec un échographe adapté et dans des conditions d’examen jugées optimales. Les myomes sont classiquement bien limités, hypoéchogènes et homogènes. Leur cartographie (situation, nombre) est établie selon la classification Figo (Fédération internationale de gynécologie et d’obstétrique).12
L’imagerie par résonance magnétique (IRM) est habituellement un examen de deuxième intention. Elle est utilisée :
- systématiquement avant tout acte de radiologie interventionnelle ;
- pour établir une cartographie des myomes interstitiels et sous-séreux avant myomectomie si l’échographie est jugée insuffisante ;
- en cas de suspicion de myome(s) à développement sous-muqueux et d’inaccessibilité à l’hystéroscopie ou à l’hystérosonographie.13
Il n’y a pas de bilan biologique spécifique à effectuer, hormis un hémogramme en cas de signes évoquant une anémie ferriprive ou un bilan hormonal en cas d’infertilité associée.
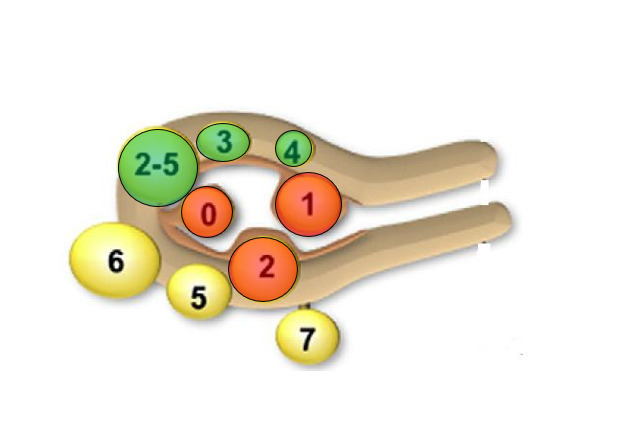
Classification Figo en huit types
L’utilisation de la classification Figo depuis 2011 a permis de standardiser le diagnostic, ce qui est essentiel pour uniformiser la prise en charge des myomes par les différents intervenants (médecins, chirurgiens, radiologues ou pathologistes [fig. 1]) :
- myomes sous-muqueux (type 0 : pédiculé intracavitaire ; type 1 : moins de 50 % intramural ; type 2 : plus de 50 % intramural) ;
- myomes intramuraux ou interstitiels (type 3 : 100 % intramural, au contact de l’endomètre ; type 4 : intramural strict) ;
- myomes sous-séreux (type 5 : sous-séreux plus de 50 % intramural ; type 6 : sous-séreux moins de 50 % intramural ; type 7 : sous-séreux pédiculé) ;
- autres myomes (type 8 : autres, lésions parasites : ligament rond ou large, col utérin).12
Prise en charge : pas de traitement sans symptômes
Les modalités de traitement sont nombreuses, variables en fonction des signes cliniques, de la cartographie des myomes, du désir ou non de conserver l’utérus et du projet parental.
Seules les femmes ayant des myomes associés à des signes cliniques doivent être traitées, à l’exception de celles prises en charge par assistance médicale à la procréation. Les autres, asymptomatiques, peuvent être simplement surveillées.
Traitement médicamenteux d’emblée
Aucun traitement médical ne peut faire disparaître les myomes.
Les médicaments sont souvent le traitement de première intention des myomes non sous-muqueux : dispositif intra-utérin au lévonorgestrel pour les ménorragies, antalgiques et anti-inflammatoires pour les douleurs. Depuis le retrait des modulateurs sélectifs des récepteurs de la progestérone (ulipristal) et en attendant la mise sur le marché français des antagonistes de la Gn-RH (gonadotropin-releasing hormone ou gonadolibérine), seuls les analogues de la Gn-RH font régresser la taille des myomes et induisent une aménorrhée, mais la durée du traitement est limitée à trois à six mois. Ils sont recommandés avant chirurgie pour améliorer l’hémoglobinémie préopératoire en cas d’anémie, diminuer le nombre de laparotomies et faciliter le geste opératoire.13
Intervention chirurgicale ou sous imagerie selon le type de myome
En cas d’échec du traitement médical, ou d’emblée en cas de myomes sous-muqueux symptomatiques, il faut recourir à une intervention chirurgicale (myomectomie, hystérectomie) ou sous imagerie (embolisation des artères utérines, myolyse par ultrasons focalisés ou radiofréquence).
Myomes de type 0 à 2
La résection hystéroscopique des myomes de type 0 à 2 permet l’arrêt des ménorragies dans 70 % des cas, avec un suivi de deux ans et l’absence de récidive du myome dans plus de 90 % des cas.14 Les myomes volumineux (plus de 4 cm) peuvent être réséqués en deux temps. Ce traitement améliore les chances de grossesse chez les femmes infertiles et diminue le nombre de fausses couches.
Myomes de type 3 et plus
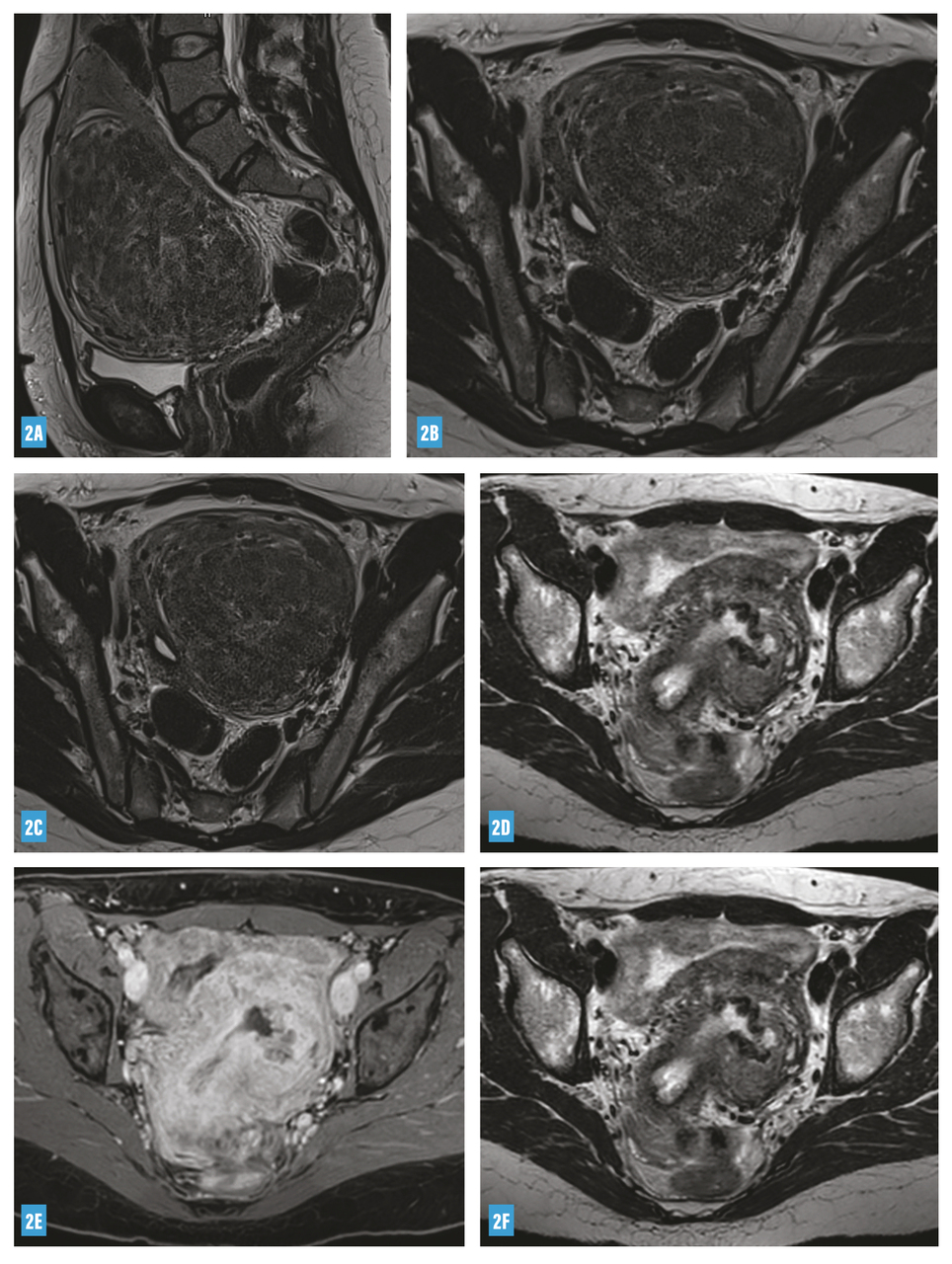
Les possibilités thérapeutiques sont nombreuses pour les myomes de type 3 et plus ; leur efficacité varie de 85 % (myomectomie, embolisation) à 100 % (hystérectomie), avec un taux de complications proportionnel à la radicalité du geste (fig. 2) ; cependant, il est difficile de privilégier un traitement plutôt qu’un autre pour une situation clinique donnée.
Ainsi, une destruction ou une résection de l’endomètre peut être proposée aux femmes ayant des ménorragies sur un utérus de taille modeste (hystérométrie inférieure ou égale à 12 cm) porteur de myomes de type 3 et plus, éligibles à une chirurgie et souhaitant une conservation utérine sans désir de procréation.13
Chez les femmes symptomatiques (saignements, douleurs, pesanteurs) ayant un ou plusieurs myome(s) de type 3 et plus, plusieurs situations se présentent :
- si elles souhaitent conserver leur utérus avec ou sans projet parental, une myomectomie ou une embolisation des artères utérines peut être proposée, en informant de la meilleure tolérance postopératoire après embolisation, mais du risque augmenté de réinterventions à long terme, des incertitudes sur la fertilité ultérieure et du risque augmenté de fausses couches ;
- chez celles pour lesquelles une hystérectomie est discutée, on peut proposer l’embolisation des artères utérines ou l’hystérectomie en les informant des mêmes conséquences postopératoires (tolérance, récidives) ;
- si elles ne souhaitent pas conserver leur utérus, une hystérectomie est proposée, réalisée par des chirurgiens entraînés dans des blocs opératoires équipés, et en privilégiant les voies d’abord mini-invasives (cœlioscopique ou vaginale).13
Concernant la myolyse, il n’est pas possible de la proposer en routine, car l’usage des ultrasons focalisés est restreint à un seul centre en France et les expériences restent limitées en matière de radiofréquence, de micro-ondes ou de cryothérapie.
Surveiller l’évolution des myomes
Lorsqu’un myome asymptomatique est diagnostiqué, il est classique de le surveiller ; cependant, il n’y a pas de recommandations sur les modalités ou le rythme de surveillance. Le potentiel de croissance des myomes est variable d’une femme à l’autre, y compris au sein d’un même utérus. Une échographie pelvienne annuelle est habituellement proposée.
Des épisodes de nécrobiose aseptique de myome peuvent provoquer un syndrome douloureux pelvien aigu et inflammatoire. Le risque de nécrobiose est augmenté pendant la grossesse et peut conduire à une menace d’accouchement prématuré, mais cela ne doit pas être un argument pour réaliser des myomectomies systématiques préconceptionnelles chez les femmes fertiles asymptomatiques.
Une douleur pelvienne aiguë peut également s’observer en cas de torsion de myome pédiculé sous-séreux (type 7) ou sous-muqueux (type 0) sous la forme d’un myome accouché par le col dans un contexte hémorragique.
Les myomes surveillés chez les femmes en période d’activité génitale ne se transforment pas en sarcome. Cependant, l’augmentation rapide du volume d’un myome ou de l’utérus chez une femme ménopausée ou à risque (antécédent d’irradiation pelvienne) doit faire suspecter un sarcome, conduire à réaliser une IRM puis une chirurgie en évitant la morcellation de l’utérus.
Fibrome et infertilité
Les fibromes sont une cause rare d’infertilité, mais leur impact sur la fertilité est toujours débattu. La parité a un effet protecteur sur le développement des fibromes. Les patientes infertiles étant souvent nullipares, il est difficile de distinguer si les fibromes sont la cause ou une conséquence de l’infertilité. Il est néanmoins reconnu que certaines localisations peuvent avoir un lien avec l’infertilité. Les fibromes sous-muqueux sont associés à des taux plus faibles de grossesses, d’implantations et d’accouchements en cas de fécondation in vitro, par rapport aux femmes infertiles sans fibrome. La résection des fibromes sous-muqueux améliore les taux de grossesses et d’accouchements d’autant plus lorsque les fibromes sont le seul facteur de risque d’infertilité retrouvé. Concernant les fibromes interstitiels, l’impact négatif sur l’implantation, le taux de grossesses et de naissances vivantes est controversé, de même que leur prise en charge chirurgicale. Cependant, les fibromes intramuraux dont la taille est supérieure à 4 cm avec distorsion de la cavité utérine doivent être opérés. Les fibromes sous-séreux n’ont pas d’impact.
2. Sparic R, Mirkovic L, Malvasi A, Tinelli A. Epidemiology of uterine myomas: A review. Int J Fertil Steril 2016;9(4):424‑35.
3. Fernandez H, Chabbert Buffet N, Allouche S. Prevalence of uterine fibroids in France and impact on quality of life: Results of a survey among 2500 women between 30-55 years. J Gynecol Obstet Biol Reprod (Paris) 2014;43(9):721‑7.
4. Enquête sur les parcours de femmes atteintes de la maladie fibromateuse utérine, IPSOS pour Gedeon Richter et Fibrome Info France, 2023.
5. Somigliana E, Reschini M, Bonanni V, Busnelli A, Li Piani L, Vercellini P. Fibroids and natural fertility: A systematic review and meta-analysis. Reprod Biomed Online 2021;43(1):100‑10.
6. Fernandez H, Sefrioui O, Virelizier C, Gervaise A, Gomel V, Frydman R. Hysteroscopic resection of submucosal myomas in patients with infertility. Hum Reprod 2001;16(7):1489‑92.
7. Goldenberg M, Sivan E, Sharabi Z, Bider D, Rabinovici J, Seidman DS. Outcome of hysteroscopic resection of submucous myomas for infertility. Fertil Steril 1995;64(4):714‑6.
8. Metwally M, Raybould G, Cheong YC, Horne AW. Surgical treatment of fibroids for subfertility. Cochrane Database Syst Rev 2020;1(1):CD003857.
9. Favilli A, Etrusco A, Chiantera V, Laganà AS, Cicinelli E, Gerli S, et al. Impact of Figo type 3 uterine fibroids on in vitro fertilization outcomes: A systematic review and meta-analysis. Int J Gynaecol Obstet 2023;163(2):528-39.
10. Erden M, Uyanik E, Polat M, Ozbek IY, Yarali H, Mumusoglu S. The effect of ≤6 cm sized noncavity-distorting intramural fibroids on in vitro fertilization outcomes: A systematic review and meta-analysis. Fertil Steril 2023;119(6):996‑1007.
11. Han Y, Yao R, Zhang Y, Yang Z, Luo H, Wang X, et al. Hysteroscopic resection of type 3 fibroids could improve the pregnancy outcomes in infertile women: A case-control study. BMC Pregnancy Childbirth 2022;22(1):522.
12. Munro MG, Critchley HOD, Fraser IS, FIGO Menstrual Disorders Working Group. The Figo classification of causes of abnormal uterine bleeding in the reproductive years. Fertil Steril 2011;95(7):2204‑8, 2208.e1-3.
13. Brun JL, Plu-Bureau G, Huchon C, Ah-Kit X, Barral M, Chauvet P, et al. Management of women with abnormal uterine bleeding: Clinical practice guidelines of the French National College of Gynecologists and Obstetricians (CNGOF). Gynecol Obstet Fertil Senol 2022;50(5):345‑73.
14. Marret H, Fritel X, Ouldamer L, Bendifallah S, Brun JL, De Jesus I, et al. Therapeutic management of uterine fibroid tumors: Updated French guidelines. Eur J Obstet Gynecol Reprod Biol 2012;165(2):156‑64.

 Encadrés
Encadrés