Seul traitement : réduire la pression intra-oculaire.
Le glaucome est une neuropathie optique d’évolution progressive, due à une apoptose accélérée des cellules du nerf optique (cellules ganglionnaires rétiniennes), se traduisant structurellement par une excavation pathologique de la papille optique, et fonctionnellement par une altération du champ visuel qui peut aboutir, au stade tardif, à la cécité.1
Les différentes formes sont définies en fonction, par exemple, de l’anatomie de l’angle irido- cornéen : « à angle ouvert » lorsque l’angle formé par l’iris et la cornée est large, permettant facilement l’écoulement de l’humeur aqueuse vers le trabéculum, ou « à angle fermé » lorsque l’iris tend à s’apposer contre le trabéculum et la cornée, empêchant l’évacuation de l’humeur aqueuse.
Autre classification selon l’étiologie : glaucome primitif sans affection oculaire ou générale associée, ou secondaire à une autre pathologie ophtalmologique ou systémique (encadré).
Le glaucome primitif à angle ouvert, de loin la forme la plus fréquente en Occident et en Afrique, est le sujet principal de ce dossier.2
La crise aiguë par fermeture de l’angle (cf. infra) est rare en Occident. Très douloureuse, elle doit être prise en charge en urgence car la vision est rapidement menacée.
Physiopathologie de la neuropathie glaucomateuse
Elle n’est pas parfaitement connue ; cependant, de nombreux critères associés à un risque élevé d’apparition ou d’aggravation sont clairement identifiés. Le facteur le plus fréquemment retrouvé, et le plus susceptible d’être corrigé, est l’élévation de la pression intra-oculaire (PIO), ou hypertonie intra-oculaire.3 D’autres sont moins facilement, voire non accessibles à une intervention curative, tels l’âge, le caractère mélanoderme (peau noire), les antécédents familiaux, la myopie, les variations de pression artérielle, des maladies génétiques comme le syndrome exfoliatif (accumulation de dépôts fibrillaires dans les tissus oculaires) ou de dispersion pigmentaire (précipités colorés issus de l’iris pouvant se loger dans les angles irido-cornéens ; hommes jeunes le plus souvent myopes).
Enfin, certaines circonstances favorisantes sont discutées : fine épaisseur cornéenne, diabète, tabagisme, hypothyroïdie ou apnées du sommeil.
La PIO normale est statistiquement comprise entre 10 et 21 mmHg (moyenne ± 2 écarts-types). Une valeur supérieure à ces normes définit l’hyper- tonie intra-oculaire.
De grandes études de cohorte ont démontré qu’elle était le principal facteur de risque d’apparition et d’aggravation d’un glaucome. Dans l’Ocular hypertension treatment study (1 636 patients hypertones suivis pendant 5 ans), la probabilité de développer un glaucome est 2 fois plus faible chez les personnes traitées ; leur PIO était inférieure de 23 % à celle du groupe non traité.4 Dans l’Early manifest glaucoma trial, en analyse multivariée, chaque diminution de 1 mmHg de la PIO abaisse de 10 % le risque d’aggravation des déficits du champ visuel chez des patients glaucomateux avérés.5
Toutefois, ce paramètre n’explique pas à lui seul la pathologie, puisque la plupart des patients ayant une hypertonie restent indemnes et que d’authentiques glaucomes surviennent chez des sujets sans hyperpression intra-oculaire.
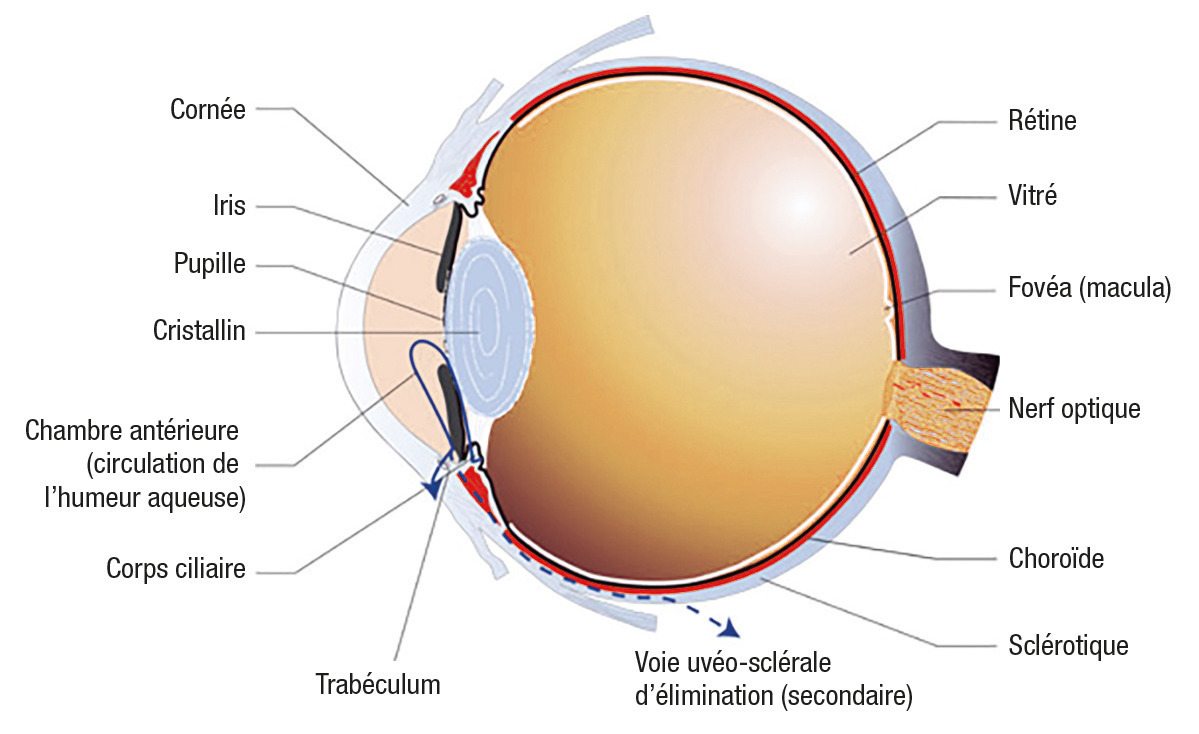
La pression interne de l’œil résulte d’une balance entre production d’humeur aqueuse qui emplit la chambre antérieure et élimination (fig. 1 et 2). Ce liquide est sécrété par les corps ciliaires disposés de façon circulaire en arrière de l’iris. Il circule ensuite entre le cristallin et l’iris (par la pupille), puis dans la partie antérieure pour être finalement résorbé au niveau du trabéculum (principale voie d’élimination). Situé à la jonction de l’iris et de la cornée (angle irido-cornéen), celui-ci joue le rôle de filtre grâce à ses mailles de collagène séparées par des espaces vides.
L’humeur aqueuse est ensuite collectée dans un canal circulaire qui épouse la circonférence de l’œil en arrière de la cornée (canal de Schlemm) et s’abouche dans de nombreuses petites veines, permettant ainsi son retour dans la circulation sanguine générale. L’élévation de la PIO est liée à une résistance accrue à l’écoulement dans les portions les plus internes du trabéculum (à proximité du canal de Schlemm).
Épidémiologie
Le glaucome est la seconde cause de cécité dans le monde : 80 à 110 millions de personnes en sont victimes dont 3 millions d’aveugles.6 La forme primitive à angle ouvert représente 60 à 80 % de cette pathologie en Occident et en Afrique, et environ la moitié dans le monde : l’autre moitié est constituée presque exclusivement des formes à angle fermé. En Asie continentale (Chine, Hong-Kong, Mongolie), ces dernières sont majoritaires (60 à 90 % des cas).
La prévalence se situe entre 0,5 et 1 % des adultes de plus de 40 ans en Europe et en Amérique du Nord. En France, le nombre de patients est estimé entre 1 et 1,5 million, dont seulement 50 à 70 % sont diagnostiqués et traités. La fréquence du glaucome augmentant avec l’âge, sa prévalence nationale devrait progresser de 30 % d’ici 2025.
À partir d’une méta-analyse d’études épidémiologiques, les cas mondiaux étaient évalués à 64,3 millions en 2013, 76 millions en 2020 et 111,8 millions en 2040.7 Le glaucome devrait affecter particulièrement l’Afrique (risque relatif de 2,8 par rapport à l’Europe).
Évolution
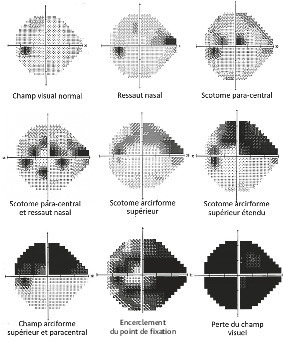
La maladie est longtemps silencieuse car l’élévation de la PIO est progressive et non ressentie par le patient (asymptomatique jusqu’à + 30- 35 mmHg). En outre, la réduction progressive du champ visuel reste longtemps méconnue, parfois jusqu’à un stade très avancé. Plusieurs raisons expliquent cette absence de perception : les déficits débutent souvent en périphérie, ils sont volontiers asymétriques et la superposition des champs visuels des 2 yeux permet une vision longtemps correcte. Enfin, le cerveau met en place des mécanismes de compensation qui font que les scotomes (portions de l’espace mal ou non perçues) n’apparaissent pas comme des zones manquantes, mais plutôt assez similaires aux portions « normales » : le cerveau comble les vides en reconstruisant une image à partir des données des parties saines.
En l’absence de traitement, la neuropathie optique évolue jusqu’à la perte complète du champ visuel et la cécité. Le délai est très variable d’un patient à l’autre, mais généralement assez long : environ 20 ou 30 ans. Le risque de cécité rapide est donc faible, sauf lors d’un glaucome diagnos-tiqué tardivement à un stade très évolué.
La neuropathie est irréversible (cf. infra). Les différents traitements ne peuvent, dans le meilleur des cas, que stabiliser sa progression. Aucune récupération de la fonction perdue n’est possible, car il n’existe pas à ce jour de thérapeutique neuro- régénératrice.
Dépistage
Le caractère peu symptomatique du glaucome, son évolution souvent silencieuse pendant plusieurs années, et l’absence de récupération visuelle justifient un dépistage généralisé et précoce, d’autant plus que des traitements efficaces existent.
Il n’est malheureusement pas systématique en France, même dans les populations à risque, expliquant en partie la proportion importante de cas méconnus (20 à 40 %).
On peut recommander sa pratique à l’occasion d’une consultation ophtalmologique tous les 2 ans à partir de 50 ans : mesure de la PIO et examen de la papille optique au fond d’œil ; et en cas de doute, analyse du champ visuel et de la papille optique par OCT (tomographie par cohérence optique).
Il peut être débuté plus tôt en cas de myopie forte, d’antécédents familiaux de glaucome, ou chez les patients mélanodermes (notamment originaires d’Afrique centrale ou des Antilles).
Diagnostic
La forme à angle ouvert étant généralement asymptomatique, l’examen ophtalmologique est indispensable au diagnostic et à l’évaluation de sa gravité.
La mesure de la PIO est réalisée avec un tonomètre. Un petit cône est appliqué sur l’œil de façon à mesurer la force nécessaire pour aplanir sa surface (tonomètre de Goldmann). Une autre technique sans contact utilise un jet d’air pour aplanir la paroi oculaire. Ce deuxième appareil est utilisable pour le dépistage non médical. Les valeurs normales sont comprises entre 10 et 21 mmHg. À elle seule, cette mesure est insuffisante pour diagnostiquer et suivre un glaucome. Comme mentionné plus haut, un patient hypertone (PIO > 21 mmHg) peut ne jamais faire de glaucome, et a contrario un glaucome à pression normale est possible (PIO < 21 mmHg).
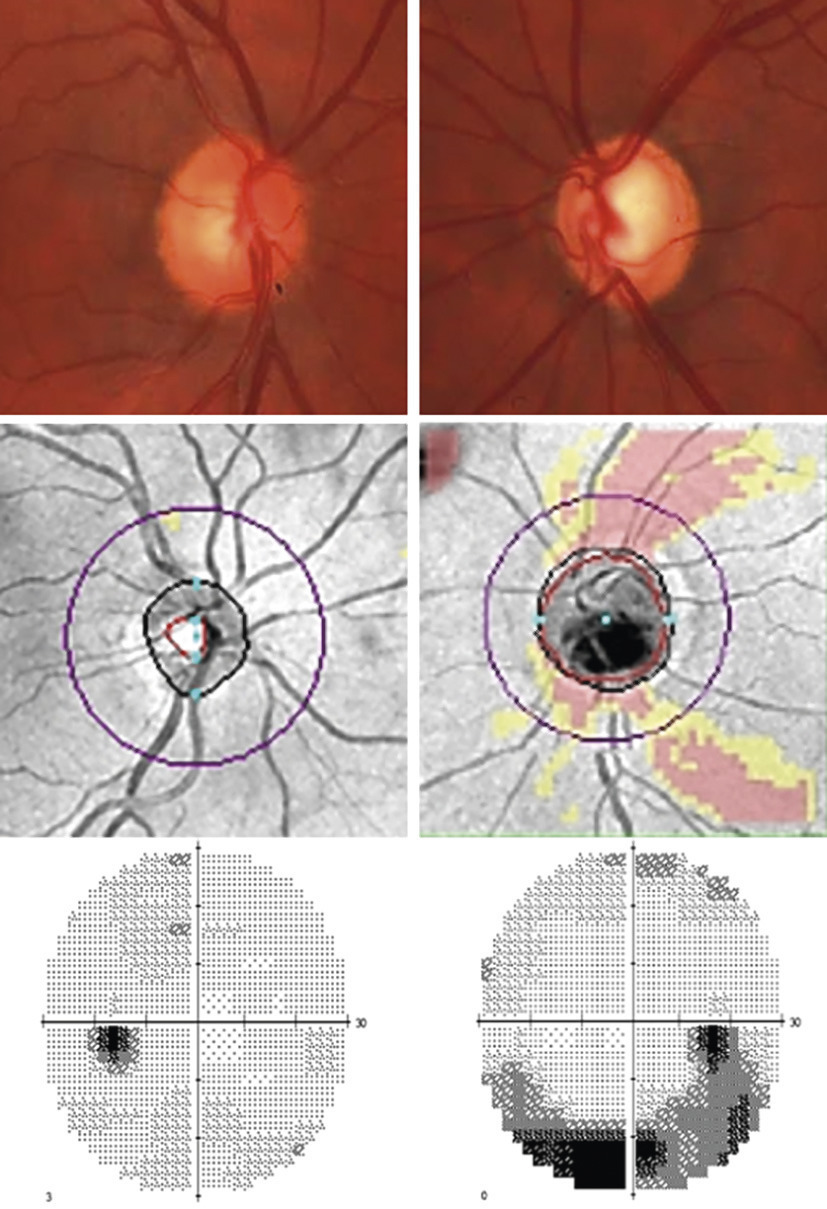
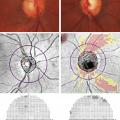
L’examen du fond de l’œil et de la papille optique montre des signes caractéristiques (fig. 3 et 4) : excavation élargie de la papille traduisant une diminution de la quantité de fibres optiques, hémorragie péripapillaire, etc. On poursuit souvent l’analyse avec une OCT qui « scanne » la tête du nerf et les fibres optiques (coupes très fines de la rétine) et précise l’importance de leur dégradation. Elle contribue à la détection des glaucomes débutants et permet de suivre l’évolution de la maladie, une fois le diagnostic confirmé.
La gonioscopie est indolore : on pose une lentille spéciale sur l’œil après anesthésie locale (instillation de collyre) afin d’observer l’angle entre iris et cornée, donc de déterminer le type de glaucome (angle ouvert ou fermé). Cet examen est indispensable au diagnostic et au choix du traitement.
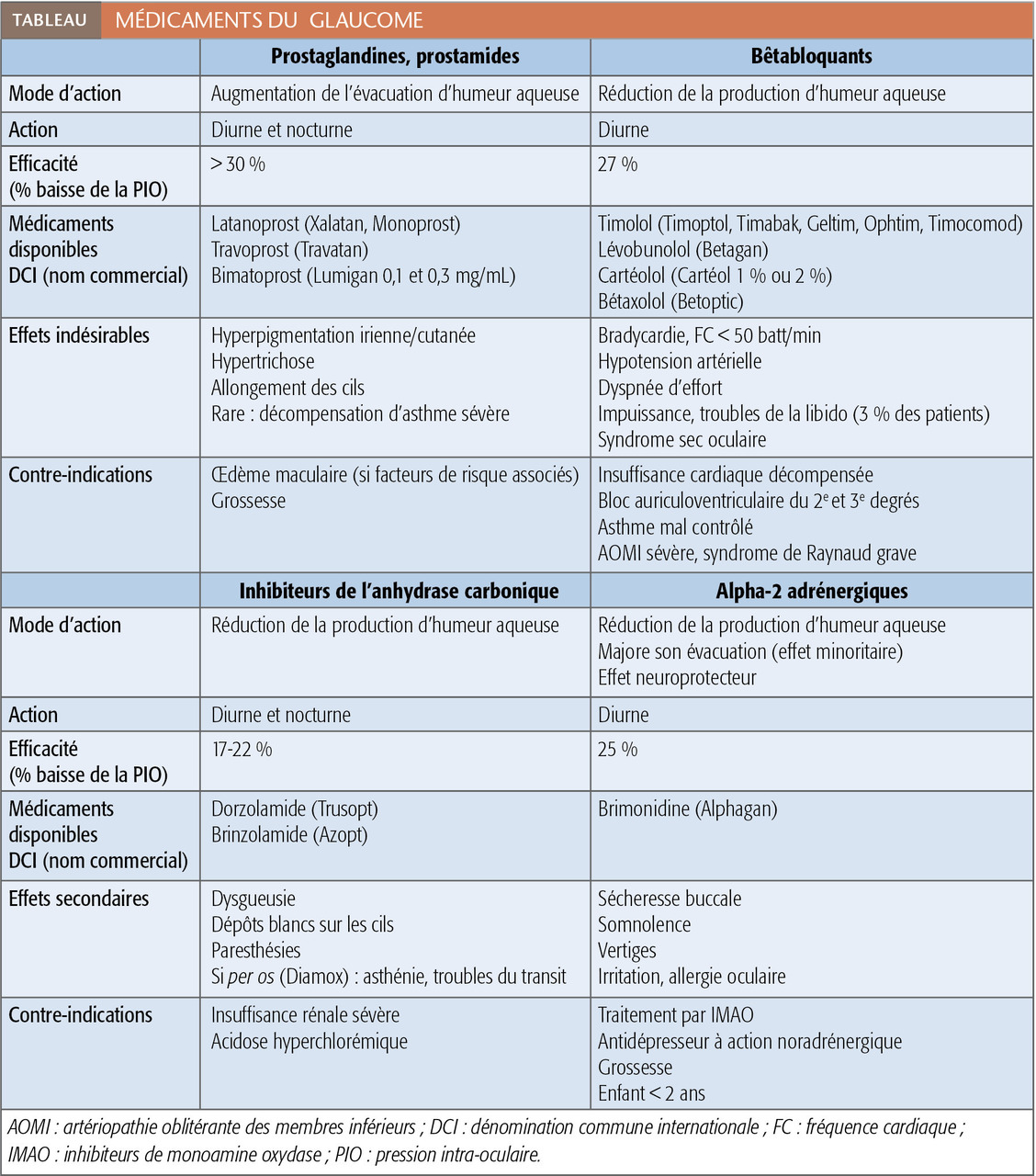
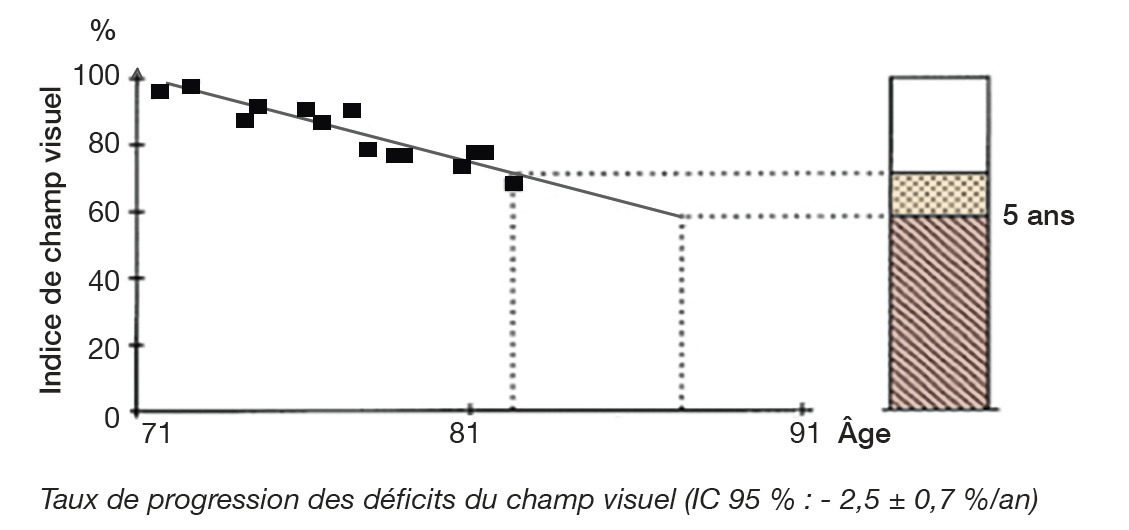
Le relevé du champ visuel détermine l’étendue de l’espace qu’un œil immobile est capable de voir (fig. 4). Appelé aussi périmétrie, il en établit une carte et quantifie la sensibilité rétinienne pour chaque point vu. Il est nécessaire au diagnostic et fondamental pour le suivi, puisque l’évaluation de la vitesse de progression du glaucome est principalement fondée sur l’évolution des déficits du champ visuel. Le « champ visuel par confrontation » (qui compare le CV du patient avec celui, normal, de l’examinateur, pour dépister des atteintes non perçues par le sujet) n’est pas assez précis pour détecter ou surveiller la maladie.
Prise en charge
Le traitement, quelle que soit la méthode, consiste à abaisser la PIO, seul facteur de risque corrigeable. Deux options : diminuer la production de l’humeur aqueuse ou faciliter son drainage hors de l’œil.
Traitement médical
En première ligne, il est pharmacologique grâce à des classes thérapeutiques aux modes d’action variés. L’administration se fait généralement par voie topique (collyre).7
Les 4 classes les plus utilisées sont, par ordre décroissant d’efficacité (tableau) : analogues des prostaglandines ou prostamides (latanoprost, travoprost, bimatoprost), bêtabloquants (timolol, lévobunolol, cartéolol, bétaxolol), alpha agonistes (brimonidine) et inhibiteurs de l’anhydrase carbonique (dorzolamide, brinzolamide).
En fonction de la sévérité et de la progression de la maladie, on peut utiliser une mono-, une bi- ou une trithérapie. La monothérapie initiale est dans la moitié des cas un analogue de prostaglandine ou un bêtabloquant. La bithérapie d’emblée, exceptionnelle, concerne les PIO très élevées. Il existe des combinaisons fixes pour faciliter l’observance : bêtabloquant et prostaglandine ou prostamide (Xalacom, Duotrav, Ganfort) ; bêtabloquant et inhibiteur de l’anhydrase carbonique (Azarga, Cosopt) ; alpha adrénergique et inhibiteur de l’anhydrase carbonique (Simbrinza).
Lorsque ce n’est pas suffisant pour stabiliser les lésions, il faut envisager un traitement par laser ou chirurgie. Selon les études, cela concerne 30 à 50 % des patients. Le recours à ces méthodes est donc fréquent : plus de 12 000 procédures chirurgicales par an en France.
Trabéculoplastie laser
Le remodelage du trabéculum est provoqué par application d’un faisceau laser à sa surface. Il diminue partiellement la résistance à l’écoulement de l’humeur aqueuse. La procédure est initialement efficace, mais l’effet s’épuise généralement avec le temps. Après quelques années, le bénéfice résiduel est limité. Les données évaluant son efficacité montrent des taux d’échec de 50 à 90 % 2 à 10 ans après.8
La trabéculoplastie laser est cependant, avec les appareils actuels, facile à réaliser, indolore et quasiment dénuée de risques. Elle est souvent faite en première intention en alternative au traitement médical, ou en deuxième intention lorsque les collyres ne sont pas suffisants pour ralentir la neuropathie glaucomateuse.
Chirurgie filtrante et de drainage
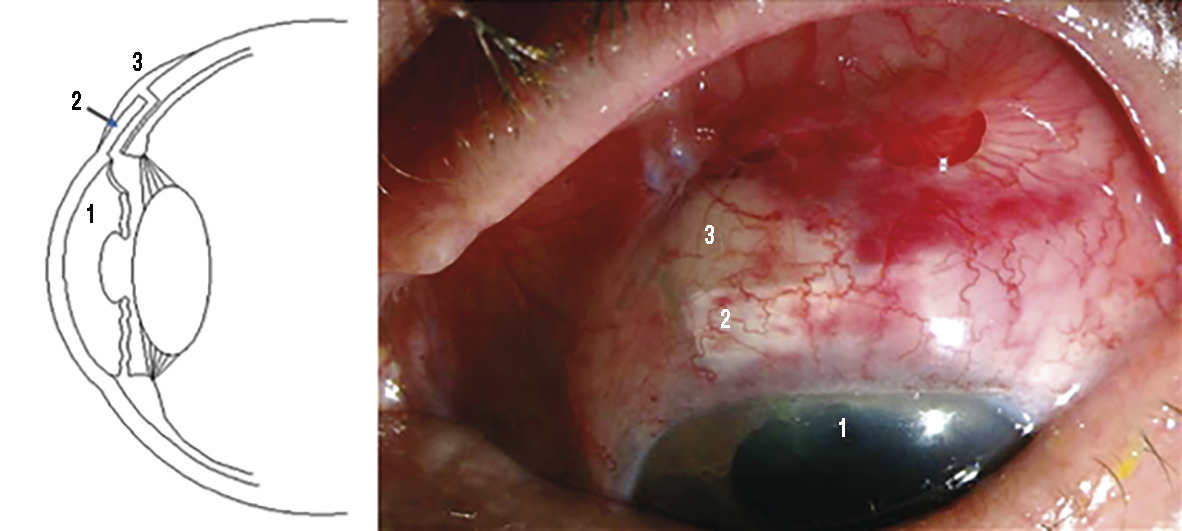
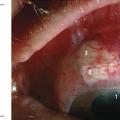
L’intervention chirurgicale consiste à créer une petite fistule au travers de la sclère (paroi blanche), afin que l’humeur aqueuse puisse s’écouler de l’intérieur jusque sous la conjonctive. Elle est ensuite drainée au travers de la conjonctive ou dans des veines. On décomprime ainsi l’œil. Le geste est réalisé sous la paupière supérieure afin que le site de résorption (bulle de filtration) soit protégé et invisible (fig. 5).
Il y a principalement 2 types de chirurgie : la sclérectomie où la paroi de l’œil est lamellisée (affinée) à l’extrême sans être ouverte totalement (chirurgie non perforante) et la trabéculectomie où la paroi de l’œil est ouverte complètement (chirurgie perforante).8
Après sclérectomie, l’humeur aqueuse filtre à travers la fine membrane résiduelle. La filtration est modérée mais progressive et régulière.
Après trabéculectomie, l’humeur aqueuse circule librement dans l’incision créée. La baisse pressionnelle est plus importante mais parfois brutale et irrégulière.
Ces procédures s’accompagnent de risques significatifs : échec, hémorragie intra-oculaire, infection, aggravation des déficits du champ visuel, baisse d’acuité, etc.). Elles sont de ce fait plutôt réservées aux glaucomes évolués et réfractaires aux traitements médicaux et lasers.
Le cyclo-affaiblissement consiste à détruire partiellement (au laser diode ou par ultrasons) le corps ciliaire qui produit l’humeur aqueuse pour en diminuer la production en proportion, donc la PIO. En cas de geste excessif, l’hypotonie induite peut aller jusqu’à l’atrophie oculaire irréversible.
Suivi
La mesure de la PIO et l’examen du nerf optique (au fond d’œil éventuellement complété d’une OCT) sont systématiques, en général 2 à 3 fois par an.
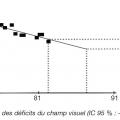
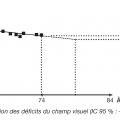
L’examen le plus important pour juger la stabilité ou quantifier la vitesse reste le relevé du champ visuel (fig. 6 et 7). Lorsque les paramètres qui témoignent de sa détérioration sont stables, la pression est suffisamment abaissée ; la PIO cible est atteinte. Lorsqu’ils se dégradent trop rapidement, le traitement doit être renforcé.
La pression cible est très variable d’un patient à un autre. En conséquence, le suivi est capital pour l’adaptation thérapeutique.
Crise aiguë PAR fermeture de l’angle (fig. 8)
Survenant chez des patients prédisposés (anatomie favorable au blocage de l’angle), avec des caractéristiques cliniques et évolutives propres, elle est plus fréquente chez les Asiatiques, les femmes, les personnes âgées et les hypermétropes, dont l’œil est de plus petite taille que la normale.
À l’occasion d’une dilatation de la pupille, physiologique (obscurité, froid, stress) ou pharmacologique, se produit un blocage : l’iris vient se plaquer contre le cristallin, fermant le passage de l’humeur aqueuse. Son accumulation en arrière de l’iris finit par pousser celui-ci contre le trabéculum, empêchant définitivement l’évacuation du liquide.
La PIO atteint 50 à 80 mmHg en quelques heures. Cette élévation rapide est généralement douloureuse (algies oculaires ou céphalées) et accompagnée de signes digestifs (nausées, vomissements, douleurs abdominales). Il se produit un œdème cornéen, parfois visible à l’œil nu (cornée blanchâtre ou grisâtre). Le blocage pupillaire est quelquefois manifeste (semi-mydriase ne réagissant pas à la lumière).
Le patient se plaint d’une baisse d’acuité visuelle souvent profonde. À la palpation, l’œil hypertone est dur.
Le pronostic visuel est engagé et le traitement est une urgence absolue. On utilise des hypotonisants locaux (collyres) et généraux intra- veineux (Diamox, mannitol) pour abaisser la PIO et des myotiques (pilocarpine en collyre) pour lever le blocage en provoquant un myosis.
Par la suite, on réalise une iridotomie au laser : perforation de l’iris de façon à éviter la survenue d’un nouvel accident. Ce traitement est souvent fait préventivement sur l’autre œil.
Quels médicaments proscrire ?
Glaucome à angle ouvert
La seule classe thérapeutique pouvant élever la PIO, donc potentiellement contre-indiquée, est celle des corticostéroïdes. L’administration locale péri-oculaire ou intra-oculaire (collyres, injection sous-conjonctivale ou intravitréenne) est à haut risque d’hypertonie (élévation rapide, importante et prolongée de la PIO). Sans avis spécialisé préalable, une conjonctivite ne doit jamais être traitée par des collyres en contenant.
Leur administration dans la sphère ORL (corticoïdes inhalés et nasaux) peut également entraîner une élévation de la PIO en raison de la proximité oculaire. Elle doit être précédée d’un avis spécialisé.
En revanche, le risque d’hypertonie est beaucoup plus faible avec ces médicaments par voie générale (orale, IV, etc.). L’élévation de la PIO est dans ce cas généralement retardée et peu importante. Un spécialiste peut être consulté lorsqu’on envisage leur prescription durant plusieurs mois ou années. Lors d’une cure courte de quelques jours le risque est quasi nul.
Glaucome par fermeture de l’angle
S’il n’a pas bénéficié d’une iridotomie au laser ou d’une chirurgie filtrante, tous les médicaments pouvant entraîner une mydriase sont contre-indiqués. Ils risquent d’élever brutalement la PIO.
Toutes les molécules à action sympathomimétique ou parasympatholytique (mydriatiques) sont concernées : anticholinergiques (atropine et dérivés), certains antihistaminiques H1, agonistes adrénergiques et vasoconstricteurs (épinéphrine, etc.), de nombreux antidépresseurs (tricycliques, IMAO, inhibiteurs de la recapture de la sérotonine), ainsi que les molécules à effet anticholinergique : neuroleptiques (phénothiazine, benzodiazépine, etc.), antiparkinsoniens et antispasmodiques anticholinergiques (Ditropan…).
En cas de doute chez un patient à risque, il est impératif de consulter le résumé des caractéristiques du produit avant prescription. Il faut par ailleurs souligner que les patients sont peu informés de la nature des traitements entrepris (lasers ou chirurgicaux). Il est bon de contacter l’ophtalmo-logiste référent systématiquement plutôt que de se fier à la seule parole du malade.
Classification des glaucomes
Nature de l’atteinte : neuropathie optique glaucomateuse (excavation de la papille optique associée à des déficits caractéristiques du champ visuel).
Selon les caractéristiques de l’angle irido-cornéen :
• ouvert : glaucome à angle ouvert ;
• fermé : glaucome par fermeture de l’angle.
Glaucome à angle ouvert isolé :
• primitif à angle ouvert (GPAO) ;
• secondaire à une affection oculaire : glaucome exfoliatif, uvéitique sans synéchies ou post-traumatique, pigmentaire, hémorragie intra-oculaire, chirurgie du décollement de rétine (par gaz ou silicone) ou bien tumeurs oculaires ;
• secondaire à une affection générale : glaucome cortico-induit, maladies métaboliques de surcharge, orbitopathie dysthyroïdienne, augmentation de la pression veineuse épisclérale (fistule carotido-caverneuse, syndrome de Sturge-Weber).
Glaucome par fermeture de l’angle :
• isolé : primitif sporadique ou génétique récessif ;
• secondaire à une pathologie oculaire : glaucomes uvéitiques avec synéchies, luxation cristallinienne, anomalie morphologique du cristallin, glaucome néovasculaire, kystes du corps ciliaire, tumeur de l’iris ou du corps ciliaire, hématome choroïdien, glaucome malin, rétinopathie des prématurés.
1. Weinreb RN, Khaw PT. Primary open-angle glaucoma. Lancet 2004;363:1711-20.
2. Quigley HA. Number of people with glaucoma world-wide. Br J Ophthalmol 1996;80:389-93.
3. Société française d’ophtalmologie. Glaucome primitif à angle ouvert. Rapport 2014. Paris: Elsevier Masson; 2014.
4. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Study: a randomized trial determines that ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol 2002;120:701-13.
5. Leske MC, Heijl A, Hussein M, et al; Early Manifest Glaucoma Trial Group. Factors for glaucoma progression and the effect of treatment: the early manifest glaucoma trial. Arch Ophthalmol 2003;121:48-56.
6. Congdon N, O’Colmain B, Klaver CC, et al.; Eye Diseases Prevalence Research Group. Causes and prevalence of visual impairment among adults in the United States. Arch Ophthalmol 2004;122:477-85.
7. Tham YC, Li X, Wong TY, Quigley HA, Aung T, Cheng CY. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology 2014;121:2081-90.
8. European Glaucoma Society. Guide pour les glaucomes. 4e édition; 2012. http://www.eugs.org/preview/fra.pdf

 Encadrés
Encadrés