Dans le contexte du traitement du cancer, la gestion multidisciplinaire s’avère essentielle pour améliorer les diagnostics et les soins apportés aux patients. Cette approche collaborative implique une variété de spécialistes incluant oncologues médicaux, chirurgiens, médecins traitants et oncologues-radiothérapeutes, ainsi que des physiciens médicaux et des radiologues qui, ensemble, garantissent une prise en charge exhaustive. Les équipes multidisciplinaires élargissent également leur champ d’action en intégrant des non-oncologues qui, bien que moins impliqués dans les détails techniques de la radiothérapie, participent activement à différentes phases du parcours thérapeutique des patients. Cette intégration peut parfois mener à des malentendus relatifs aux informations techniques, d’où l’importance de clarifier et de démystifier ces aspects pour tous les intervenants.1
Principales indications de la radiothérapie
Le parcours du patient en oncologie-radiothérapie commence souvent par une consultation d’annonce lors de laquelle l’oncologue-radiothérapeute rencontre le patient pour la première fois. Cette consultation a pour but de l’informer sur les raisons du traitement proposé, le déroulement des préparations et les potentiels effets indésirables, qu’ils soient immédiats ou différés. Il est crucial de distinguer les indications curatives et palliatives de traitement. La dose irradiée, le nombre de séances et les techniques employées varient, en effet, selon ces indications. Par exemple, un traitement curatif pour un carcinome épidermoïde non opérable pourrait comprendre 35 séances, souvent associées à une chimiothérapie. À l’inverse, un traitement palliatif pour apaiser les douleurs d’une métastase vertébrale pourrait se limiter à une à dix séances. Il est également à noter que, dans le cadre des traitements curatifs, une irradiation postopératoire est parfois nécessaire, comme c’est le cas à la suite d’une chirurgie conservatrice pour un carcinome du sein infiltrant, où la radiothérapie joue un rôle prophylactique contre les récidives locales. Les doses administrées postopération sont inférieures à celles utilisées pour traiter une tumeur en place, mais demeurent nettement supérieures à celles employées dans un contexte palliatif. Le tableau illustre divers exemples de doses et de fractionnements selon les indications de traitement.
Étapes de la planification du traitement
Scanner de positionnement
Immédiatement après la consultation initiale, le patient est convié à effectuer un scanner de positionnement au sein du département de radiothérapie. Cette étape importante sert de base à toute la planification du traitement. Le patient est positionné de manière précise dans la posture qu’il adoptera lors de chaque séance de traitement. Des dispositifs de contention, parfois rigides, sont utilisés pour assurer l’immobilité et la reproductibilité de la position, particulièrement pour les traitements des tumeurs cérébrales, thoraciques ou des voies aérodigestives supérieures. Pour les tumeurs sujettes à des mouvements, comme celles intrathoraciques, des techniques avancées telles que le scanner 4D sont employées pour capturer plusieurs images selon les phases respiratoires du patient.2 Parfois, des marqueurs internes, comme des fiduciaires pour les tumeurs pulmonaires ou hépatiques, ou des grains d’or pour la prostate, sont implantés avant le scanner pour faciliter le repositionnement précis durant le traitement.
Définition des volumes cibles et des organes à risque
Après le scanner de positionnement, l’oncologue-radiothérapeute prend en charge le dossier pour délimiter les volumes cibles et les organes à risque (OAR). Selon les directives de l’International Commission on Radiation Units and Measurements (Commission internationale des unités et mesures radiologiques [ICRU]), pour les tumeurs non opérées, le volume tumoral macroscopique (GTV) est d’abord identifié.3 Le GTV inclut toute la masse tumorale visible à partir de l’examen clinique et des images diagnostiques comme l’imagerie par résonance magnétique (IRM) ou la tomodensitométrie par émission de positons (TEP), souvent fusionnées avec le scanner de positionnement. Une marge est ajoutée autour du GTV pour tenir compte de l’extension microscopique potentielle, formant ainsi le volume cible clinique (CTV). Cette marge, généralement isotropique et ajustée aux données histologiques indiquant les voies d’extension de la tumeur, est complétée par une marge supplémentaire définie en concertation avec le physicien médical pour compenser les incertitudes de repositionnement du patient. Cette marge technique est réduite grâce à l’utilisation de dispositifs de contention précis, comme le cadre de stéréotaxie Leksell pour les traitements cérébraux qui nécessitent des doses élevées administrées avec précision. De plus, les algorithmes de contourage automatique sont de plus en plus utilisés pour le contourage des cibles et des OAR, améliorant ainsi la précision et l’efficacité du processus. Autour du CTV, on applique une marge physique pour prendre en compte les incertitudes de repositionnement (volume cible planifié ou PTV). Enfin, cette phase de délinéation inclut aussi l’identification précise de tous les tissus sains environnants, désignés comme OAR, afin de les protéger efficacement durant le traitement.
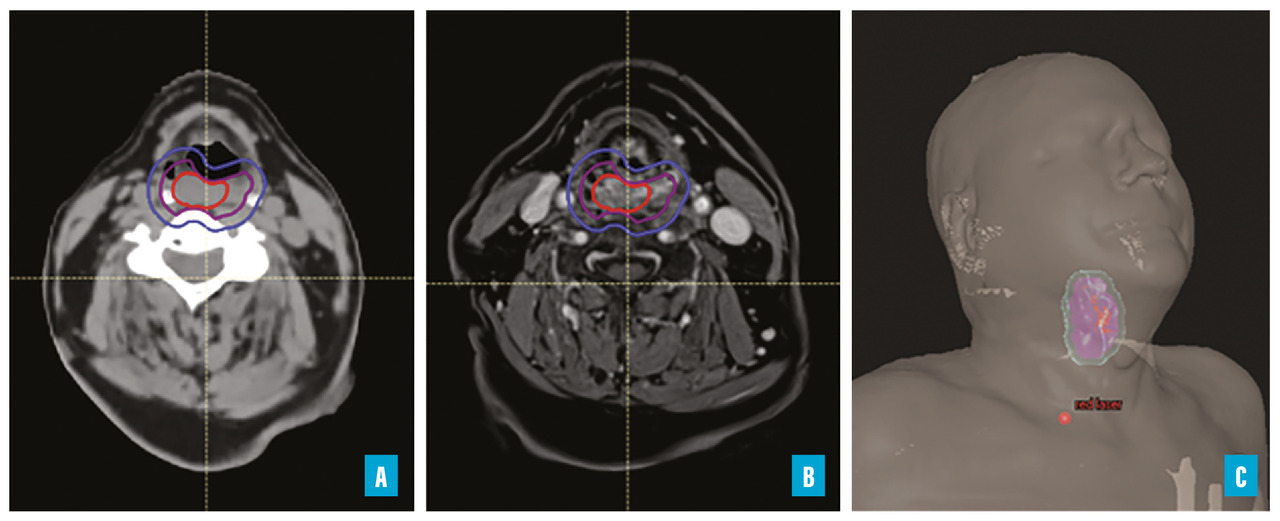
La figure 1 illustre les volumes cibles définis sur le scanner de positionnement (A) fusionné avec une IRM préthérapeutique (B) pour un patient devant être irradié à visée curative pour un carcinome épidermoïde hypopharyngé. Les lignes rouge, violette et bleue représentent respectivement le GTV, le CTV et le PTV (volume cible planifié). La vue en 3D (C) permet d’apprécier la position du patient et la localisation du volume cible tenant compte de cette position.
Techniques de radiothérapie
Après que l’oncologue-radiothérapeute a achevé la délinéation des volumes cibles et des OAR, le dossier patient est transmis à l’unité de physique médicale. Les dosimétristes et les physiciens médicaux emploient des logiciels sophistiqués pour simuler le dépôt de dose dans les tissus et élaborer un plan de traitement. Le but est de délivrer la dose prescrite de manière aussi homogène que possible tout en assurant une protection optimale des OAR. Pour ce faire, différentes techniques de radiothérapie sont utilisées.
Radiothérapie conformationnelle tridimensionnelle
La radiothérapie conformationnelle tridimensionnelle (RC3D) est la technique traditionnelle et la plus rapide à mettre en œuvre, idéale pour les traitements urgents, comme les cas d’épidurite métastatique. Cette méthode, utilisant un nombre limité de faisceaux, peut cependant être insuffisante pour protéger efficacement les OAR proches du volume cible. Elle est fréquemment utilisée pour des traitements simples, tels que l’irradiation postopératoire mammaire, où deux faisceaux tangentiels suffisent à irradier le sein tout en préservant au mieux les poumons et le cœur.
Radiothérapie conformationnelle avec modulation d’intensité
Pour des traitements nécessitant une précision accrue en raison de la complexité des localisations et de la proximité de nombreux OAR, comme dans le cas des tumeurs nasopharyngées, le recours à la radiothérapie conformationnelle avec modulation d’intensité (RCMI ou Intensity-modulated radiation therapy :IMRT) est préféré. Cette technique bénéficie des progrès des technologies informatiques et des avancées techniques telles que les collimateurs multilames et l’utilisation de nombreux faisceaux, voire d’une rotation continue de la tête de l’accélérateur, permettant un ajustement précis du faisceau en temps réel. L’approche de la radiothérapie stéréotaxique ou radiochirurgie permet d’appliquer un hypofractionnement extrême, distribuant des doses élevées par séance (jusqu’à 27 Gy en une seule fraction pour des tumeurs cérébrales). Adaptée à de petits volumes ciblés, cette méthode requiert l’utilisation de dispositifs de contention très rigides pour minimiser les incertitudes de repositionnement et réduire ainsi les marges autour du volume cible.
Protonthérapie
Dans les situations où la tumeur est extrêmement proche d’OAR sensibles ou dans des contextes particuliers comme la pédiatrie ou la réirradiation, la protection de ces OAR est cruciale. L’utilisation de la protonthérapie, qui libère l’énergie de manière très localisée (pic de Bragg), devient alors indispensable.4 Trois centres en France proposent cette technologie (Orsay, Nice, Caen), fournissant une option privilégiée pour ces cas complexes.
Curiethérapie
La curiethérapie, dans laquelle le radiothérapeute place directement une source radioactive au contact de la tumeur, est également utilisée pour des tumeurs accessibles, très employée pour les cancers de la prostate localisés, et peut être adaptée pour certaines localisations ORL comme la lèvre, ou en gynécologie.5
Définition et validation du plan de traitement
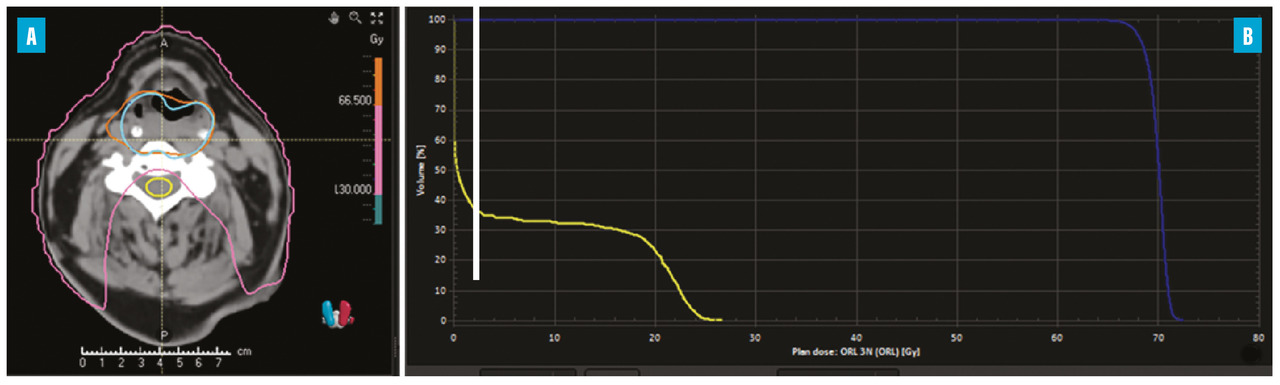
Après son optimisation par le dosimétriste et le physicien, le plan de traitement est présenté à l’oncologue-radiothérapeute pour validation finale. Il est essentiel que 95 % du volume cible reçoive au moins 95 % de la dose prescrite, assurant ainsi une couverture optimale. Il est également crucial de respecter les contraintes de dose pour les OAR, telles que définies dans les rapports QUANTEC.7 Elles varient selon le type d’OAR impliqué : pour les OAR en série, une dose maximale même dans un petit volume peut entraîner une perte de fonction, comme pour la moelle épinière ; pour les OAR en parallèle, un certain volume recevant une dose spécifique (souvent désigné par V x Gy, indiquant un volume recevant x Gy) peut aussi entraîner une perte de fonction, comme pour le poumon. L’oncologue-radiothérapeute utilise un histogramme dose-volume (HDV) [fig. 2] pour visualiser ces données. Le choix de la technique d’irradiation dépend souvent de chaque situation spécifique : par exemple, lors du choix entre une irradiation complète du volume cible avec un risque de sécheresse buccale sévère ou une meilleure protection de la glande parotide avec un risque accru de récidive locale.
Une fois le plan approuvé, des contrôles de qualité sont effectués sur l’appareil de traitement pour s’assurer de la précision du traitement prévu. Ces contrôles comprennent des calibrages et des vérifications pour prévenir les erreurs de collision, dues à un éventuel choc entre la table sur laquelle est allongé le patient pendant le traitement et la machine qui sert à traiter.
Après ces validations, le traitement peut débuter.
Délivrance du traitement
Lors de l’administration de la radiothérapie, il convient de s’assurer de la bonne délivrance par imagerie et de la gestion des effets indésirables aigus.
Ajustements en temps réel
Lors du traitement, les techniques de radiothérapie guidée par l’image (image-guided radiation therapy [IGRT]) sont utilisées pour affiner le positionnement du patient et minimiser les risques d’erreur.8 Les dispositifs modernes permettent des ajustements en temps réel grâce à des technologies comme la tomographie à faisceau conique (CBCT) autorisant des adaptations quotidiennes pour protéger les OAR et ajuster la dose en fonction des modifications anatomiques du patient durant le traitement.
Les manipulateurs en électroradiologie médicale jouent également un rôle crucial dans le succès des protocoles de radiothérapie. Ils garantissent un positionnement précis des patients et une délivrance exacte de la dose de radiation, en utilisant des équipements complexes et en effectuant des ajustements en temps réel pour les variations anatomiques. Leur expertise est essentielle à l’efficacité du traitement et à la sécurité des patients.
Gestion des effets indésirables
Pendant la phase de traitement, il revient à l’oncologue-radiothérapeute de suivre de près et de gérer les effets indésirables aigus qui peuvent survenir. Ces toxicités aiguës apparaissent généralement au cours de la radiothérapie et sont généralement résolues dans un délai de trois mois après le traitement. Souvent résultant de la mort de cellules à division rapide, comme celles de la peau ou des membranes muqueuses, ces toxicités présentent une relation dose-dépendante.9 Bien que divers systèmes de notation existent, menant à certaines incohérences dans les études rétrospectives, les Critères terminologiques communs pour les événements indésirables version 5 (CTCAE v5) sont les plus couramment utilisés.10 Une intervention rapide est essentielle pour minimiser le risque de complications graves. Par exemple, une toxicité cutanée de grade 2 en phase tardive peut être gérable dans les cas de cancer de la tête et du cou, tandis que les toxicités de grade 4 (« menaçantes pour la vie ») ou de grade 5 (mortelles) ne sont jamais acceptables car elles causent une douleur significative au patient, nécessitent souvent une interruption du traitement, augmentant ainsi le risque de repopulation tumorale et réduisant l’efficacité du traitement.
Résumé de traitement transmis à tous les médecins du patient
À l’issue de la radiothérapie, le radiothérapeute doit préparer un résumé de traitement, détaillant son indication, ses caractéristiques techniques, les toxicités aiguës survenues et les doses reçues par les OAR susceptibles d’induire des toxicités tardives.11 Ce résumé doit être communiqué au médecin traitant et à tous les confrères non oncologues impliqués dans le diagnostic du cancer, pour initier un suivi à long terme. Ce document est essentiel et doit être clairement compréhensible par tous les médecins concernés afin d’assurer une gestion optimale post-traitement.
Surveillance des patients à long terme
Après la fin du traitement, il est crucial que les patients soient suivis par l’oncologue-radiothérapeute, en collaboration avec l’oncologue médical et le médecin traitant.
Les objectifs de ce suivi sont multiples :
- détecter le plus tôt possible toute récidive locorégionale ;
- identifier et gérer les complications liées au traitement ;
- encourager les patients à poursuivre les traitements adjuvants (comme la thérapie hormonale pour le cancer du sein) ;
- offrir un soutien psychologique et des informations pour aider les patients à retrouver une vie normale après le cancer.
2. Giraud P, De Rycke Y, Dubray B, et al. Conformal radiotherapy (CRT) planning for lung cancer: Analysis of intrathoracic organ motion during extreme phases of breathing. International Journal of Radiation Oncology*Biology*Physics 2001;51(4):1081‑92.
3. Chavaudra J, Bridier A. Définition des volumes en radiothérapie externe : rapports ICRU 50 et 62. Cancer/Radiothérapie 2001;5(5):472‑8.
4. Adeberg S, Harrabi SB, Bougatf N, et al. Dosimetric comparison of proton radiation therapy, volumetric modulated arc therapy, and three-dimensional conformal radiotherapy based on intracranial tumor location. Cancers (Basel) 2018;10(11):E401.
5. Chargari C, Deutsch E, Blanchard P, et al. Brachytherapy: An overview for clinicians. CA Cancer J Clin 2019;69(5):386‑401.
6. Bourhis J, Montay-Gruel P, Gonçalves Jorge P, et al. Clinical translation of FLASH radiotherapy: Why and how? Radiotherapy and Oncology 2019;139:11‑7.
7. Brodin NP, Kabarriti R, Garg MK, et al. Systematic review of normal tissue complication models relevant to standard fractionation radiation therapy of the head and neck region published after the QUANTEC reports. Int J Radiat Oncol Biol Phys 2018;100(2):391‑407.
8. Vanherk M. Errors and margins in radiotherapy. Seminars in Radiation Oncology 2004;14(1):52‑64.
9. Cosset JM. Effets secondaires des rayonnements sur les tissus sains et organes à risque. Cancer/Radiothérapie 2010;14(4):228‑31.
10. Ho KF, Farnell DJ, Routledge JA, et al. Developing a CTCAEs patient questionnaire for late toxicity after head and neck radiotherapy. Eur J Cancer 2009;45(11):1992‑8.
11. Hayman JA. Treatment summaries in radiation oncology and their role in improving patients’ quality of care: Past present, and future. J Oncol Pract 2009;5(3):108‑9.