L’hidradénite suppurée, ou maladie de Verneuil, est une dermatose inflammatoire chronique. Sa présentation clinique est hétérogène, avec des phénotypes et des grades de sévérité distincts. Le traitement médicochirurgical reste difficile à ce jour. Il doit être personnalisé, en tenant compte du phénotype, de la sévérité et des maladies associées.
Double hétérogénéité clinique
L’hidradénite suppurée est une dermatose inflammatoire chronique définie en 2009 cliniquement par trois critères :
- la présence de lésions typiques, c’est-à-dire des nodules profonds douloureux ou abcédés, des trajets fistuleux, des cicatrices fibreuses en pont et des comédons ouverts ;
- une atteinte des régions axillaires, mammaires, inguinales, périnéo-fessière ;
- des lésions chroniques et récurrentes (au moins deux poussées en six mois).1
Aucun examen complémentaire n’est utile au diagnostic.
Malgré ces critères cliniques bien établis, le délai diagnostique moyen est long, de l’ordre de huit ans.
Toute lésion nodulaire ou abcès situé dans les régions axillaires, inguinales, périnéale ou mammaires, doit faire évoquer le diagnostic d’hidradénite suppurée et conduire à un examen clinique complet. À noter qu’il n’y a ni adénopathie ni fièvre associée.
Une prévalence de 1 % dans la population française a été rapportée.2 Les femmes sont 3,3 fois plus souvent concernées que les hommes. L’âge moyen de début de la maladie est de 22,1 ans et la durée moyenne de son activité est de 18,8 ans.
Hétérogénéité phénotypique
L’HS a été définie en 2009 par la présence de critères typiques, mais sa présentation est en réalité très hétérogène de par ses localisations, ses différents types de lésion, sa sévérité et du fait de son association à d’autres pathologies inflammatoires.
Des lésions non typiques sont possibles (folliculite, bourgeons charnus, cicatrices vermoulues, cicatrices à l’emporte-pièce, kystes épidermiques), et des régions atypiques peuvent être atteintes (visage, nuque, dos).
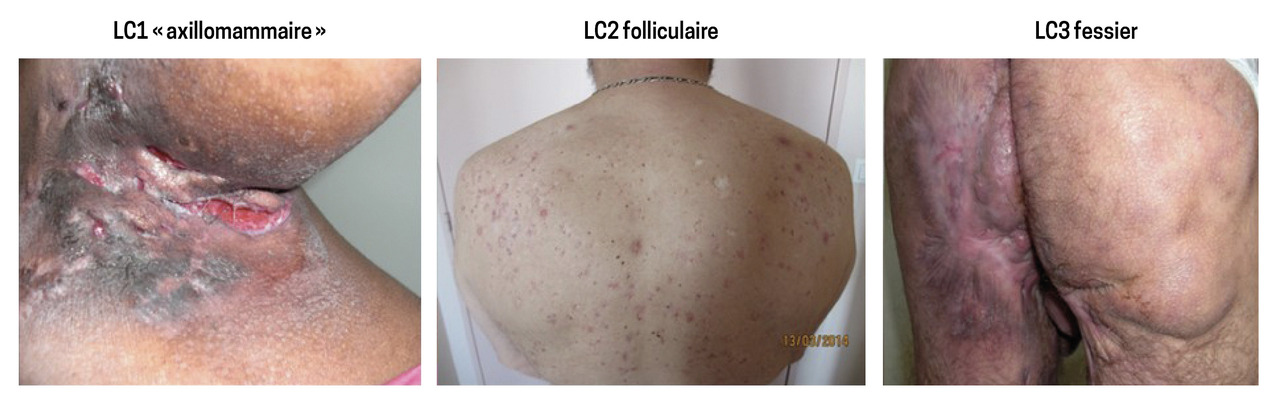
Une étude transversale portant sur 618 patients ayant une hidradénite suppurée a montré l’existence de trois types de phénotype (fig. 1) :3
- le phénotype « axillomammaire » (48 % de la population étudiée), ou LC1, caractérisé par des atteintes mammaires, axillaires et des lésions de type nodules ainsi que des cicatrices en pont. Ce phénotype « typique » est principalement retrouvé chez des femmes ayant un indice de masse corporelle élevé ;
- le phénotype « folliculaire » (26 %), ou LC2, avec des atteintes axillaires, mammaires, rétro-auriculaires, thoraciques et dorsales et une probabilité élevée de développer des lésions folliculaires (kystes épidermiques, comédons, sinus pilo-nidal). Cette forme sévère est plus fréquente chez les hommes fumeurs ;
- le phénotype « fessier » (26 %), ou LC3, dont l’atteinte est de localisation fessière.
D’autres classifications phénotypiques ont été décrites depuis, distinguant notamment les phénotypes typiques et atypiques, les atteintes inflammatoires et rétentionnelles, les atteintes faciales.
Il est parfois difficile de classer certains patients compte tenu des atteintes multiples et/ou atypiques. L’hidradénite suppurée est ainsi une maladie très hétérogène, avec des phénotypes parfois inclassables.
Sévérité variable, à évaluer
Différents outils permettent d’évaluer la sévérité de l’hidradénite suppurée.
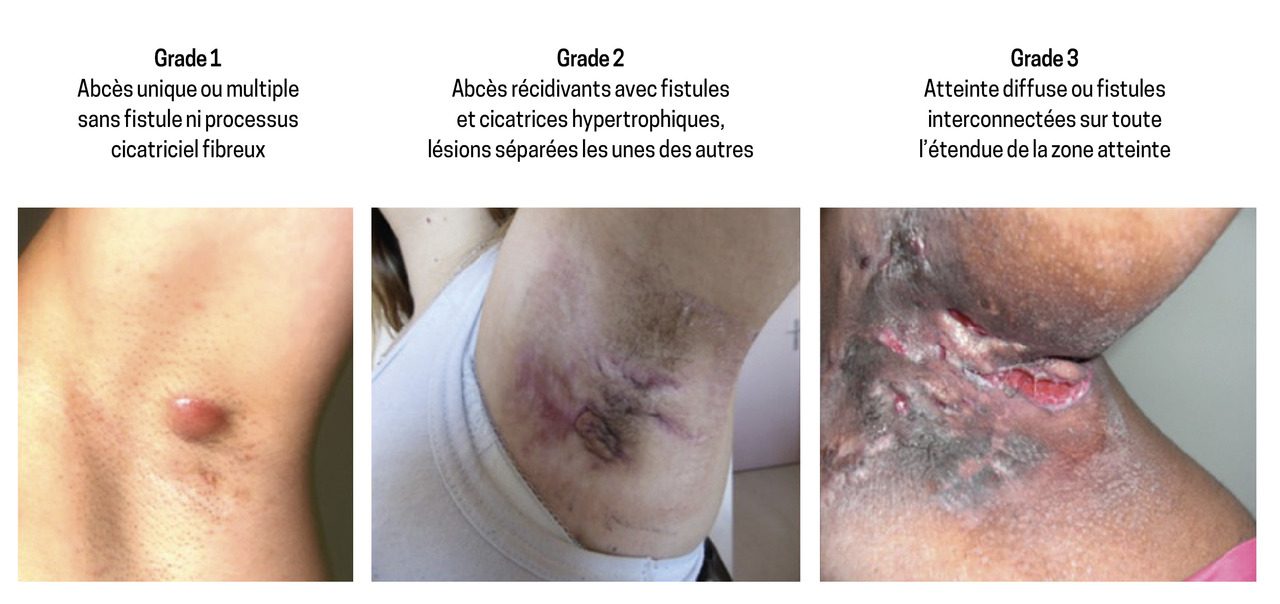
La classification de Hurley (1989) est un score statique qui cote la sévérité de la maladie en trois groupes (fig. 2). Dans une étude française portant sur 302 patients ayant une hidradénite suppurée, 68,2 % d’entre eux étaient classés en grade 1, 27,6 % en grade 2 et 3,9 % en grade 3.4
Des modifications ont été apportées, distinguant trois catégories (A : minime, B : modéré, C : sévère) dans chaque grade de Hurley.
Le score HiSCR50 (Hidradenitis suppurativa clinical response) est défini par une amélioration de 50 % du nombre de nodules inflammatoires et d’abcès par rapport à la valeur de référence, sans nouvel abcès et/ou fistule.
L’IHS4 (International Hidradenitis suppurativa severity score system) cote le nombre de nodules, d’abcès et de fistules avec une pondération.
Le DLQI (Dermatology life quality index) permet d’évaluer le retentissement de la dermatose sur la qualité de vie du patient.
Enfin, la cotation de l’importance de l’écoulement et de la douleur des lésions par une échelle visuelle analogique (EVA) est utile dans le suivi des patients.
Une physiopathologie complexe
Les différents phénotypes pourraient être le reflet de voies physiopathologiques différentes. La physiopathologie reste complexe et plurifactorielle, impliquant un trouble de la kératinisation et mettant en jeu des facteurs microbiologiques, hormonaux, génétiques, immunologiques et environnementaux.
Une maladie folliculaire
La topographie typique des lésions dans les régions riches en glandes apocrines et l’association avec des maladies folliculaires suggèrent une anomalie du follicule pilosébacé apocrine.
Particularités du microbiote cutané
Les lésions suppuratives, l’efficacité transitoire des antibiotiques et les données microbiologiques plaident en faveur d’un rôle important du microbiome cutané.
Probable part hormonale
Les femmes sont plus fréquemment atteintes, avec des poussées parfois prémenstruelles. Les lésions débutent lors de la puberté, et une amélioration peut être notée à la ménopause.
Susceptibilité génétique
Environ un tiers des patients rapportent des cas familiaux. Des mutations hétérozygotes de la γ-sécrétase (complexe de protéases clivant des protéines transmembranaires) ont été décrites.Ces mutations, peu fréquentes dans la population caucasienne (5 %), entraîneraient une stimulation immunitaire.5,6
Rôles de l’inflammation et de l’immunité
Plusieurs anomalies des réponses immunitaires innées et adaptatives ont été rapportées dans la littérature.7,8
Des comorbidités multiples
Des facteurs et plusieurs maladies folliculaires inflammatoires rhumatologiques, digestives, peuvent être associés à l’hidradénite suppurée et doivent être recherchés.
Facteurs neurocardiovasculaires associés
Le tabagisme et le surpoids sont significativement associés à l’hidradénite suppurée en analyse multivariée.3
Les comorbidités cardiovasculaires sont plus fréquentes qu’en population générale. Une association entre hidradénite suppurée et syndrome métabolique a été rapportée.
Le diabète doit être systématiquement dépisté.
Une méta-analyse récente a montré une augmentation significative du risque d’accident vasculaire cérébral et de syndrome coronaire aigu chez ces patients.9,10
Maladies folliculaires
La cellulite disséquante, le sinus pilonidal et, de manière plus controversée, l’acné peuvent être associés à l’hidradénite suppurée. La distinction entre acné conglobata et hidradénite suppurée folliculaire peut être difficile. Les lésions en pic à glace, les cicatrices en corde, l’atteinte pré- ou rétro-auriculaire et les lésions à type de poche doivent faire plutôt évoquer une hidradénite suppurée et conduire à un examen complet.
Maladies inflammatoires digestives
La maladie de Crohn est à la fois un diagnostic différentiel et une maladie associée. Dans une cohorte danoise, la prévalence de cette maladie chez les patients avec hidradénite suppurée était de 0,8 % versus 0,3 % chez les témoins ; celle de la recto-colite hémorragique était de 1,3 % chez les patients avec hidradénite suppurée versus 0,7 % chez les témoins.11
Une méta-analyse confirme l’association entre hidradénite suppurée et maladies inflammatoires chroniques de l’intestin (MICI).12
En cas de signes cliniques de MICI (fissures ou rhagades, fistules complexes anales ou rectales, signes fonctionnels digestifs), le dosage de la calprotectine fécale, un examen clinique spécialisé et des explorations (endoscopie digestive, IRM pelvienne) sont préconisés.
Maladies inflammatoires rhumatologiques
Dans une étude française sur 640 patients avec hidradénite suppurée, la prévalence de spondylarthrite a été estimée à 3,7 % (versus 0,3 % dans la population générale).13 Des explorations et avis spécialisés peuvent être demandés en cas de manifestations rhumatologiques inflammatoires.
Maladies auto-inflammatoires
De nouveaux syndromes associant pyoderma gangrenosum (PG), acné, hidradénite suppurée et arthrite, ont récemment été décrits : PASH (PG, acné, hidradénite suppurée), PAPASH (arthrite purulente, PG, acné, hidradénite suppurée), PASS (PG, acné, hidradénite suppurée, spondylarthrite ankylosante), PsAPASH (arthrite psoriasique, PG, acné, hidradénite suppurée ).
Autres comorbidités
D’autres associations ont été rapportées, notamment avec le syndrome des ovaires polykystiques, la trisomie 21, la fièvre méditerranéenne familiale et la maladie de Dowling-Degos.
Complications
L’inflammation chronique de l’hidradénite suppurée peut entraîner un lymphœdème.
Des cancers épidermoïdes ont pu être observés après une évolution prolongée dans les localisations périnéales chez l’homme.
Les infections à pyogènes sont rares.
Le retentissement socio-professionnel et psychologique est majeur. Parmi les affections dermatologiques, la qualité de vie chez ces patients est l’une des plus altérées.
Prise en charge et traitement
La prise en charge de l’hidradénite suppurée est médico-chirurgicale mais reste difficile et non consensuelle. Le traitement est le plus souvent suspensif, faisant de la recherche de nouvelles thérapeutiques un enjeu majeur. Néanmoins, la combinaison simultanée ou successive de traitements médicaux et chirurgicaux peut améliorer les symptômes et la qualité de vie des patients.
Du fait des nombreux tableaux cliniques possibles, le traitement doit être personnalisé en tenant compte du phénotype et de la sévérité de l’atteinte. La prise en charge est multidisciplinaire pour les versants médical (dermatologue, proctologue, gastroentérologue, rhumatologue, médecin traitant, gynécologue, endocrinologue, addictologue, nutritionniste), chirurgical et paramédical (psychologue, diététicien, infirmier, kinésithérapeute, éducation thérapeutique), avec comme coordinateur principal le médecin généraliste.
Les associations de malades jouent également un rôle de soutien important.
Par ailleurs, les facteurs et maladies associés doivent être dépistés et pris en charge. Le retentissement sur la qualité de vie est majeur dans l’hidradénite suppurée, avec un fort impact psychosocial, qui doit être évalué. Lorsque cela est nécessaire, des mesures hygiénodiététiques (arrêt du tabac, perte de poids...) sont mises en place.
Recommandations françaises
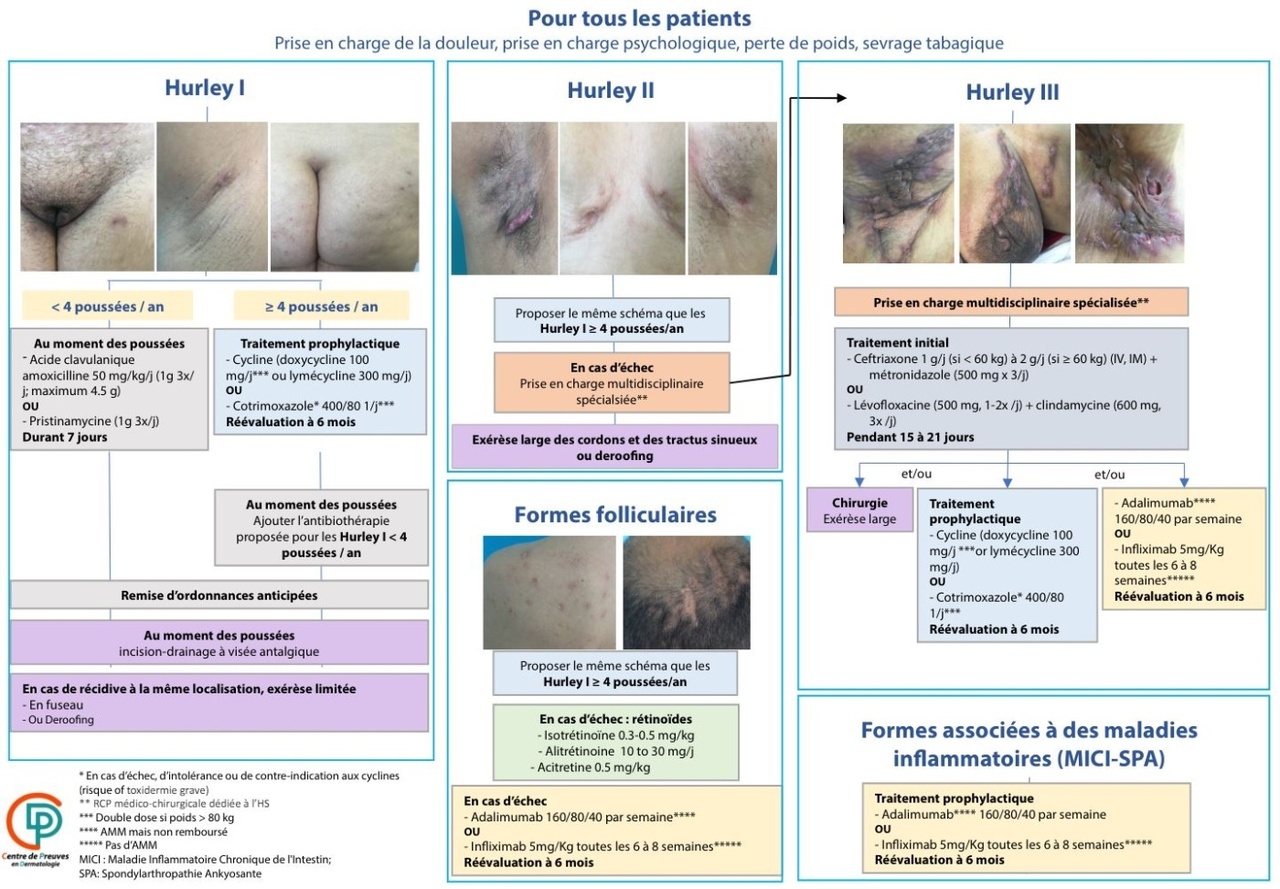
Les recommandations françaises (fig. 3) proposent des modalités thérapeutiques médico-chirurgicales, en fonction de la sévérité et de l’activité de la pathologie, du phénotype et des pathologies inflammatoires associées. Ces recommandations sont une aide utile, même si certains schémas restent à valider. Elles doivent être proposées et expliquées au patient, véritable acteur pour le choix du traitement.
Première base pour guider les soins, ces recommandations, publiées en 2021,14 sont cependant amenées à être modifiées du fait du développement de nouvelles thérapeutiques, des controverses sur les antibiothérapies et de l’absence de combothérapie proposée.
Antibiothérapie recommandée sans données robustes
Des antibiothérapies au long cours reposant sur les cyclines ou le cotrimoxazole sont proposées dans les formes récidivantes chez les patients de grades 1 et 2 du score de Hurley. En cas de poussées inflammatoires, des cures courtes d’antibiotiques par amoxicilline-acide clavulanique ou pristinamycine durant sept jours sont indiquées. Pour les formes sévères d’hidradénite suppurée (grade 2 ou 3 du score de Hurley), des cures d’antibiotiques à large spectre telles que ceftri-axone-métronidazole ou lévofloxacine-clindamycine sont proposées. En relais, une antibiothérapie (cyclines ou cotrimoxazole), une biothérapie ou un traitement chirurgical sont discutés.
Pourtant, aucune antibiothérapie n’a été validée par des études robustes de grande ampleur.
Traitement chirurgical et interventionnel
Le traitement chirurgical large est un pilier de la prise en charge de l’hidradénite suppurée, notamment dans les formes sévères. En cas de lésion récidivante, une exérèse limitée ou un deroofing peuvent être pratiqués. Des injections intralésionnelles de corticoïdes dans les nodules inflammatoires peuvent également être réalisées. L’épilation au laser peut être proposée comme mesure préventive.
Biothérapies
L’adalimumab, anticorps anti-TNF alpha, a été le premier traitement à obtenir une autorisation de mise sur le marché (AMM) en France pour l’hidradénite suppurée, en 2016. Il est indiqué dans les formes modérées à sévères, en alternative aux antibiotiques, en traitement de fond.15
Les anticorps anti-IL- 17 constituent une nouvelle ligne thérapeutique disponible :
- le sécukinumab (anticorps anti-IL- 17A) a obtenu l’AMM et le remboursement en 2023 pour le traitement de l’hidradénite suppurée modérée à sévère de l’adulte, en deuxième intention, après échec des antibiotiques ;16
- le bimékizumab (anticorps anti-IL- 17A et IL- 17F) a obtenu l’AMM en 2024 et le remboursement en 2025, pour le traitement de l’hidradénite suppurée modérée à sévère de l’adulte, en cas de réponse insuffisante au traitement systémique conventionnel.17
Les données au long cours dans les études de phase III sur les anticorps anti-IL- 17, avec un maintien de la réponse à un an, méritent attention :18,19 en effet, l’un des problèmes majeurs est l’échappement thérapeutique sous antibiothérapie et anti-TNF alpha ; or, le maintien de la réponse clinique au long cours est primordial dans cette maladie chronique.
Il est à noter que l’efficacité des biothérapies dans l’hidradénite suppurée n’est malheureusement pas comparable à celle obtenue dans le psoriasis.
Plusieurs études plaident en faveur d’un bénéfice à l’introduction plus précoce d’une biothérapie dans l’hidradénite suppurée.20 - 22 Réduire l’inflammation pourrait permettre de diminuer le développement des lésions cicatricielles et des fistules, dont le traitement est chirurgical.
Des études randomisées portant sur d’autres biothérapies ou inhibiteurs de JAK sont en cours.
Alternatives thérapeutiques
Pour le phénotype folliculaire de l’hidradénite suppurée se discute l’intérêt des rétinoïdes à faible dose, en association avec les biothérapies dans les formes diffuses inflammatoires.
De même, la spironolactone pourrait être utilisée dans les formes peu sévères de la femme adulte.
Nouvelles recommandations européennes
Les dernières recommandations européennes publiées en 2024 distinguent les formes inflammatoires des formes non inflammatoires. En fonction de la sévérité cotée selon l’IHS4, plusieurs options thérapeutiques sont proposées : antibiothérapie (tétracyclines, clindamycine), biothérapie (adalimumab, sécukinumab ou bimékizumab), traitement hormonal.
Au total, l’hidradénite suppurée est une dermatose inflammatoire chronique de présentation clinique hétérogène. Le traitement médico-chirurgical reste difficile à ce jour. La prise en charge est multidisciplinaire et doit s’appuyer sur les recommandations françaises et européennes. Le médecin généraliste tient une place importante dans la coordination des soins.
Que dire à vos patients ?
- L’hidradénite suppurée est une maladie chronique, mais la combinaison simultanée ou successive de traitements médicaux et chirurgicaux peut améliorer les symptômes et la qualité de vie des patients.
- La recherche fondamentale et clinique est active : de nouveaux traitements sont disponibles ou en cours de développement.
- La prise en charge optimale est multidisciplinaire.
- Il existe de dynamiques associations de patients.
2. Revuz JE, Canoui-Poitrine F, Wolkenstein P, et al. Prevalence and factors associated with hidradenitis suppurativa: Results from two case-control studies. J Am Acad Dermatol 2008;59(4):596‑601.
3. Canoui-Poitrine F, Le Thuaut A, Revuz JE, et al. Identification of three hidradenitis suppurativa phenotypes: Latent class analysis of a cross-sectional study. J Invest Dermatol2013;133(6):1506‑11.
4. Canoui-Poitrine F, Revuz JE, Wolkenstein P, et al. Clinical characteristics of a series of 302 French patients with hidradenitis suppurativa, with an analysis of factors associated with disease severity. J Am Acad Dermatol 2009;61(1):51-7.
5. Wang B, Yang W, Wen W, et al. Gamma-secretase gene mutations in familial acne inversa. Science 2010;330(6007):1065.
6. Pink AE, Simpson MA, Brice GW, et al. PSENEN and NCSTN mutations in familial hidradenitis suppurativa (Acne Inversa). J Invest Dermatol 2011;131(7):1568-70.
7. Hotz C, Boniotto M, Guguin A, et al. Intrinsic Defect in Keratinocyte Function Leads to Inflammation in Hidradenitis Suppurativa. J Invest Dermatol 2016;136(9):1768-80.
8. Sabat R, Alavi A, Wolk K, et al. Hidradenitis suppurativa. Lancet 2025;405(10476):420-38.
9. Tzellos T, Zouboulis CC, Gulliver W, et al. Cardiovascular disease risk factors in patients with hidradenitis suppurativa: A systematic review and meta-analysis of observational studies. Br J Dermatol 2015;173(5):1142-55.
10. Bailey AMJ, Li HOY, Tan MG, et al. Hidradenitis suppurativa and major adverse cardiac events: A systematic review and meta-analysis. J Am Acad Dermatol 2021;84(3):844-8.
11. Chen WT, Chi CC. Association of Hidradenitis Suppurativa With Inflammatory Bowel Disease: A Systematic Review and Meta-analysis. JAMA Dermatol 2019;155(9):1022‑7.
12. Richette P, Molto A, Viguier M, et al. Hidradenitis suppurativa associated with spondyloarthritis results from a multicenter national prospective study. J Rheumatol 2014;41(3):490‑4.
13. Bertolotti A, Sbidian E, Join-Lambert O, et al. Guidelines for the management of hidradenitis suppurativa: Recommendations supported by the Centre of Evidence of the French Society of Dermatology. Br J Dermatol 2021;184(5):963‑5. https://reco.sfdermato.org/fr/recommandations-hidradénite-suppurée
14. Kimball AB, Okun MM, Williams DA, et al. Two Phase 3 Trials of Adalimumab for Hidradenitis Suppurativa. N Engl J Med 2016;375(5):422‑34.
15. Kimball AB, Jemec GBE, Alavi A, et al. Secukinumab in moderate-to-severe hidradenitis suppurativa (SUNSHINE and SUNRISE): Week 16 and week 52 results of two identical, multicentre, randomised, placebo-controlled, double-blind phase 3 trials. Lancet 2023;401(10378):747‑61.
16. Kimball AB, Jemec GBE, Sayed CJ, et al. Efficacy and safety of bimekizumab in patients with moderate-to-severe hidradenitis suppurativa (BE HEARD I and BE HEARD II): Two 48-week, randomised, double-blind, placebo-controlled, multicentre phase 3 trials. Lancet 2024;403(10443):2504‑19.
17. Kimball AB, Bechara FG, Badat A, et al. Long-term efficacy and safety of secukinumab in patients with moderate-to-severe hidradenitis suppurativa: Week 104 results from the SUNSHINE and SUNRISE extension trial. Br J Dermatol 2025;192(4):629-40.
18. Roccuzzo G, Repetto F, Giordano S, et al. Anti-IL17 Secukinumab in hidradenitis suppurativa: A long-term drug survival analysis. Exp Dermatol 2024;33(7):e15140.
19. Marzano AV, Genovese G, Casazza G, et al. Evidence for a ‘window of opportunity’ in hidradenitis suppurativa treated with adalimumab: a retrospective, real-life multicentre cohort study. Br J Dermatol 2021;184(1):133-40.
20. Caposiena Caro RD, Chiricozzi A, Sechi A, et al. Factors related to the onset and recurrence of flares in hidradenitis suppurativa patients treated with adalimumab. Ital J Dermatol Venerol 2022;157(2):137‑41.
21. Maronese CA, Marzano AV. Identifying candidates for early intervention in hidradenitis suppurativa. Br J Dermatol 2024;190(6):787‑8.
22. Kjærsgaard Andersen R, Pedersen O, Eidsmo L, al. Initial steps towards developing a predictive algorithm of disease progression for hidradenitis suppurativa (HS): Results from a Cox proportional hazard regression analysis on disease progression among a cohort of 335 Danish patients with HS. Br J Dermatol 2024;190(6):904‑14.
23. Bertolotti A, Sbidian E, Join-Lambert O, et al. Recommandations françaises sur la prise en charge de l’hidradénite suppurée. Ann Dermatol Venereol 2022;2(3):170-82.
24. Centre de preuves en dermatologie. Les recommandations du CDP : hidradénite suppurée. Prise en charge de l’hidradénite suppurée (2019). https://centredepreuves.sfdermato.org/recommandation-cdp/45-hidradenite-suppuree

 Encadrés
Encadrés