Le placenta est un organe multifonctionnel et transitoire qui assure quatre fonctions clés au cours de la grossesse : mécanique, immunitaire, nutritionnelle et endocrinienne. Composé de cellules maternelles et fœtales, il ancre l’embryon à la paroi utérine et assure la tolérance immunitaire maternelle à la nidation, la protection immunitaire du fœtus par les anticorps maternels, les échanges gazeux pour la respiration, le transport des nutriments et l’élimination des déchets. Il produit également une variété de médiateurs moléculaires, stéroïdes, hormones et cytokines, qui jouent un rôle crucial dans le développement fœtal. La fonction endocrinienne du placenta est très importante au cours de la grossesse. L’axe fœtus-placenta assure la production d’hormones en complément ou en relais de la production maternelle au cours du temps, comme c’est le cas pour les hormones stéroïdes (progestérone et estrogènes), le cortisol ou la leptine. Le placenta produit également des hormones spécifiques comme le lactogène placentaire, la gonadotrophine chorionique humaine (hCG) ou encore l’hormone de croissance placentaire.
Développement placentaire et complications de la grossesse
La grossesse est une période de vulnérabilité pour la santé du fœtus et celle de la mère, en raison de la nature dynamique des processus de développement fœtal et de l’intense remodelage des tissus placentaires. Des facteurs tels que la nutrition, le stress, les maladies maternelles et les perturbateurs endocriniens (PE) peuvent entraîner un développement placentaire inadéquat, avec des effets à long terme sur le fœtus qui peuvent se traduire par la survenue de maladies infantiles ou de pathologies diverses à l’âge adulte.
Environ 19 % des grossesses sont confrontées à des complications telles que le diabète gestationnel, l’hypertension gestationnelle, la prééclampsie, l’éclampsie, la prématurité et les troubles du spectre du placenta percreta. L’augmentation, au cours des dernières décennies, de la prévalence des complications de la grossesse suggère l’influence des expositions environnementales et l’impact majeur des PE, l’abondance des récepteurs hormonaux au niveau du placenta le rendant particulièrement vulnérable aux perturbations endocriniennes.
Perturbateurs endocriniens et placenta
Les PE peuvent imiter ou imiter partiellement les hormones naturelles mais aussi bloquer l’interaction hormones-récepteurs, ou encore perturber la liaison de l’hormone sur son récepteur au niveau intracellulaire. Les PE peuvent également agir de façon indirecte sur le système hormonal en modifiant la production, le stockage, le transport, la diffusion et l’élimination des hormones naturelles.
Ils comprennent une très large famille de composés chimiques naturels et synthétiques pour lesquels l’exposition humaine est quotidienne. Ils peuvent être classés en fonction de leur persistance dans l’environnement et dans le corps humain. Celle-ci peut aller de quel-ques heures (bisphénols, parabènes, triclosan, phtalates) à plusieurs années (substances per- et polyfluoroalkylées [PFAS]), composés polybromés, pesticides ou fongicides (méthoxychlore, chlorpyrifos, dichlorodiphényltrichloroéthane [DDT]), composés de polychloro-biphényles (PCB), hydrocarbures polyaromatiques (HAP), métaux et métalloïdes [tableau].
Les PE sont susceptibles d’induire de nombreux effets délétères sur la santé tout au long de la vie d’un individu, de la période in utero à l’enfance et jusqu’à l’âge adulte, voire sur plusieurs générations. La grossesse s’inscrit donc comme une période de très grande vulnérabilité face aux risques toxiques des PE.1
De nombreux PE sont capables de franchir la barrière placentaire et ont pu être détectés à des taux élevés dans le sang ou l’urine maternelle, dans le sang du cordon ombilical ainsi que dans le liquide amniotique, même en début de grossesse.2 Si le placenta exerce un véritable rôle de barrière physique limitant le passage de certains PE, il peut également contribuer à la régulation métabolique des apports fœtaux par le biais de réactions chimiques, telles que la glucuronidation, et piéger ainsi certains PE comme le bisphénol A (BPA) dans le compartiment fœtal.3 De plus, aux stades les plus précoces du développement, le système de détoxification du foie fœtal n’est pas mature et est incapable de convertir ces métabolites, qui peuvent alors exercer leurs effets délétères sur le développement du fœtus.4
Actions des phtalates
Structure, exposition et métabolisme
Les phtalates sont des composés chimiques présents dans de nombreux produits plastiques afin de les rendre plus malléables, plus transparents et plus durables.
Ces additifs chimiques ne sont pas liés de façon covalente avec les polymères de plastique. Sous l’effet de la chaleur ou de la variation de pH, ils peuvent migrer facilement de leur matrice et pénétrer dans le corps humain par les voies respiratoires, digestives et cutanées. L’exposition humaine adulte aux phtalates est de l’ordre de 3 à 30 µg/kg/j, avec une détection de leurs métabolites dans la quasi-totalité des échantillons urinaires testés.5,6
L’ingestion de poussière est une voie majeure d’exposition chez les nourrissons et les jeunes enfants6. C’est aussi le cas de l’alimentation, notamment pour le DEHP, qui peut représenter jusqu’à 67 % de l’exposition totale aux phtalates chez l’homme.8
L’exposition cutanée aux pertur–bateurs endocriniens via les produits cosmétiques ou les textiles s’avère problématique en raison du nombre de composés chimiques présents dans ces produits, de leur utilisation quotidienne (ou pluriquotidienne) et de la surface d’application. Les phtalates entrent dans la composition de très nombreux produits cosmétiques et pharmaceutiques, notamment les solvants, agents de suspension pour aérosols, agents hydratants et adoucissants pour la peau, agents antifissuration dans les vernis à ongles et agents fixateurs d’odeur dans les parfums.
En général, les phtalates de poids moléculaire élevé comme le DEHP, le phtalate de di-isononyl (DiNP), le phtalate de di-isodécyl (DiDP) et le phtalate de benzylbutyl (BzBP) sont utilisés comme plastifiants, tandis que les phtalates de plus faible poids moléculaire comme le phtalate de diméthyle (DMP), le phtalate de diéthyle (DEP) et le phtalate de dibutyle (DBP) sont plutôt utilisés dans les cosmétiques et les produits de soins (tableau).4
Si la peau exerce un effet barrière et est peu perméable aux composés de grosse taille en général, la formulation des principes actifs peut grandement augmenter leur pénétration et leur accumulation au niveau du derme où ils vont subir les premières modifications métaboliques (hydrolyse et oxydation, par exemple) avant d’être pris en charge par la circulation sanguine. Pour certains produits chimiques, l’absorption cutanée peut donc conduire à des concentrations plus élevées dans les organes cibles que l’absorption par ingestion, car la voie d’exposition cutanée contourne le foie et son effet détoxifiant.
Les phtalates sont ensuite rapidement distribués dans le corps humain et métabolisés en métabolites secondaires qui exercent des effets biologiques plus importants que les composés d’origine. Ils subissent diverses transformations biochimiques et sont excrétés dans les urines, la salive, le sperme, la sueur, le méconium et le lait maternel.9 En raison de la demi-vie courte de ces composés ( moins de vingt-quatre heures), le contenu en métabolites de phtalates dans l’urine représente la mesure de l’exposi-tion au composé parent qui a eu lieu dans les dernières vingt-quatre heures.
Action cellulaire des phtalates dans le placenta
Dans les cellules du trophoblaste,10 les phtalates agissent sur plusieurs voies de signalisation, notamment la voie des MAP kinases et celle du facteur de transcription PPARγ.11 Ils perturbent in fine divers processus cellulaires tels que l’homéostasie des lipides,12 la différenciation des trophoblastes villeux en syncytiotrophoblastes,12 l’invasion des trophoblastes extravilleux dans la matrice utérine11 et la prolifération cellulaire.
En interférant avec la voie des MAP kinases, ils peuvent également induire un stress oxydatif,13 qui se traduit par un dysfonctionnement mitochondrial, provoquant des lésions au niveau de l’ADN et impactant l’expression génique, ce qui conduit à l’apoptose et à un développement placentaire altéré.12
L’activation du facteur de transcription PPARγ perturbe directement le métabolisme des lipides et conduit également à l’inhibition de l’activité de la métalloprotéinase matricielle- 9 (MMP- 9), une protéine importante pour l’invasion des trophoblastes extravilleux, et à l’augmentation de l’expression de l’inhibiteur tissulaire de la métalloprotéinase matricielle- 1 (TIMP- 1), un régulateur négatif de l’invasion des trophoblastes extravilleux.11 L’inhibition des processus d’invasion des trophoblastes est particulièrement incriminée dans les mécanismes de fausse couche en début de grossesse.
Il est par ailleurs important de noter que d’autres perturbateurs, comme le cadmium et le bisphénol A, agissent de concert sur les cellules placentaires et contribuent à l’altération du fonctionnement des cellules placentaires et de la physiologie du placenta.
Processus biologiques du placenta altérés par les phtalates
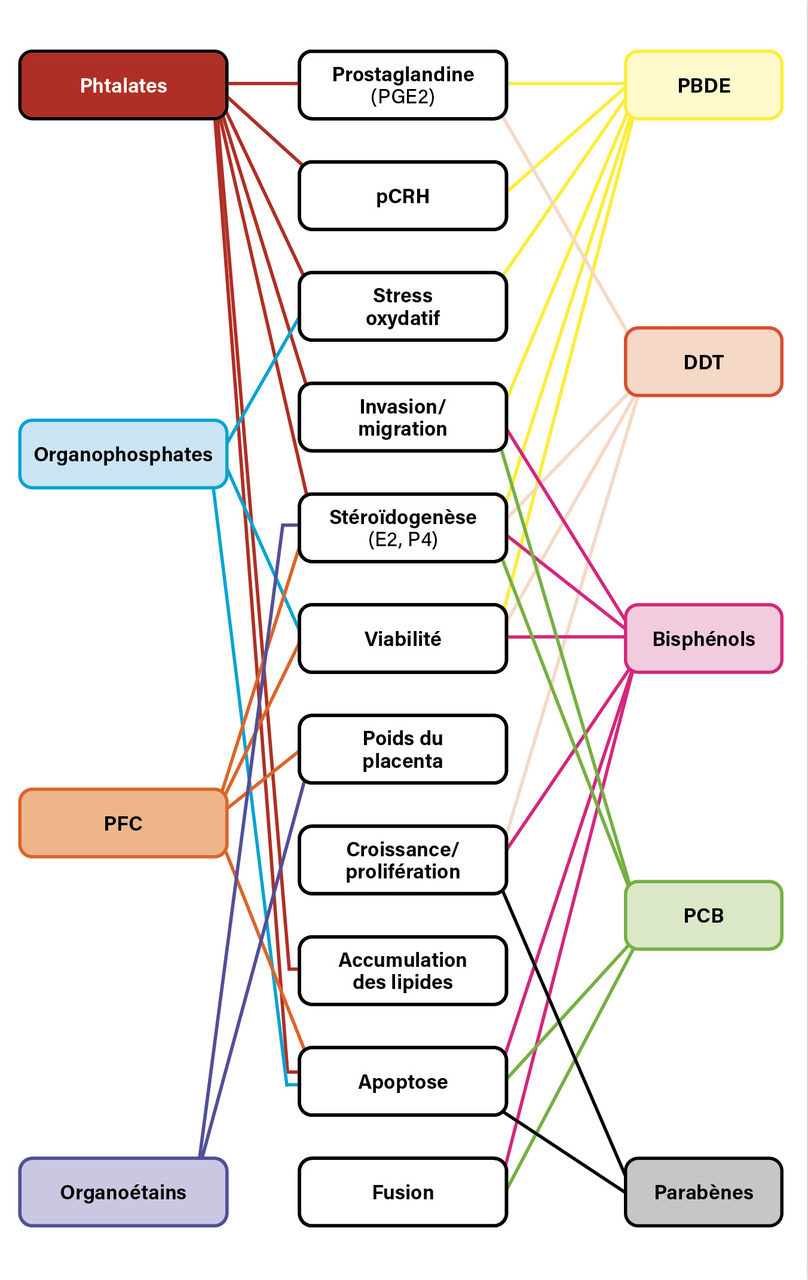
Des travaux récents ont permis de mieux caractériser les effets combinés et cumulatifs de très nombreux PE, et notamment des phtalates, sur les processus biologiques qui sous-tendent les fonctions placentaires (fig. 1).
Activation de la synthèse des prostaglandines
Les phtalates sont ainsi capables d’activer la synthèse des prostaglandines impliquées dans le déclenchement de l’accouchement en régulant les contractions myométriales et le remodelage des tissus dans l’utérus gravide. Une synthèse précoce des prostaglandines PGE2 et PGF2α est associée à un travail prématuré chez la femme enceinte.14
Perturbation des voies endocriniennes
Les phtalates peuvent également perturber les voies endocriniennes maternelles, fœtales et placentaires. Ainsi l’hormone de libération de la corticotrophine placentaire (pCRH) est essentielle au bon déroulement de la grossesse et au développement de l’enfant. Les associations entre les concentrations de phtalates et le pCRH varient au cours de la grossesse et en fonction des complications.15 En plus des risques liés au retard de croissance du fœtus et aux naissances prématurées, les expositions gestationnelles au pCRH peuvent avoir un impact sur la santé psychique de la mère après l’accouchement, ainsi que sur le tempérament, le comportement du nourrisson et de l’enfant.
En début de grossesse, la production de progestérone est principalement assurée par la gonadotrophine chorionique humaine (hCG), qui sous-tend également l’angiogenèse, la différenciation du placenta, la croissance utérine et fœtale, qui joue un rôle dans la tolérance fœtale par le système immunitaire et qui empêche les contractions utérines. L’exposition à différents phtalates, au DEHP et à ses métabolites ainsi qu’à l’ensemble des phtalates de faible poids moléculaire est associée à une diminution significative de la production d’hCG, tandis qu’il existe une association en forme de U entre les métabolites du DINP et du DIDP et l’hCG.16 Ces résultats sont corroborés par les résultats d’études expérimentales pour lesquelles la sécrétion de β-hCG diminue dans des cellules placentaires primaires exposées à un mélange de phtalates.17
Altération de la fonction stéroïdienne
Les phtalates exercent des effets antiandrogéniques, comme cela a pu être mis en évidence sur des modèles animaux, et sont associés, pendant la grossesse, à une altération de la fonction stéroïdienne.18 Des modifications du taux de plusieurs hormones stéroïdiennes, d’enzymes impliquées dans la stéroïdogenèse ou d’hormones telles que la leptine ou de récepteurs d’hormones thyroïdiennes ont été associées à l’exposition aux phtalates, en particulier pour le DEHP, le DINP ou même des substituts qui sont introduits en remplacement de certains phtalates.18,19,20 Les résultats obtenus indiquent que l’exposition aux phtalates est majoritairement associée à une réduction de la croissance fœtale ou une prématurité accrue,21 avec certains effets dépendant du sexe du fœtus.
Induction d’un stress oxydatif
Les phtalates induisent un stress oxydatif via notamment la production d’espèces réactives de l’oxygène* au niveau des cellules du placenta, comme décrit précédemment. Au début de la grossesse, le stress oxydatif pourrait interférer avec l’invasion normale du trophoblaste et l’élargissement des artérioles spirales, entraînant une vascularisation insuffisante du placenta.22
Modifications épigénétiques
Les processus d’invasion/migration lors du développement du placenta pourraient être profondément impactés par l’exposition aux phtalates. En effet, la placentation précoce est soumise à un contrôle épigénétique strict, ce qui en fait un processus sensible aux expositions environnementales de la mère. Au fur et à mesure que la grossesse progresse, les modifications épigénétiques induites par les phtalates peuvent significativement altérer le développement du placenta.23 L’exposition aux phtalates pendant la grossesse est associée à des modifications des profils de méthylation des cellules placentaires sur l’ensemble du génome. Ces modifications épigénétiques sont ainsi susceptibles d’affecter le déroulement de la grossesse mais aussi le développement du fœtus et, à plus long terme, la santé de l’enfant et de l’adulte au cours du temps, voire d’impacter les générations suivantes (effets transgénérationnels).24
Conséquences physiologiques sur le placenta et la grossesse
La morphologie du placenta (taille, forme et poids) est fortement associée au devenir du fœtus et constitue donc un marqueur important des effets sur sa santé. Ces caractéristiques morphologiques fournissent des indications pertinentes sur le fonctionnement placentaire, y compris en matière de flux de nutriments et d’oxygène, et sont indicateurs de la présence de certaines pathologies.25
Des études épidémiologiques suggèrent que l’exposition néonatale aux phtalates est associée à une diminution du poids du placenta. Des associations négatives entre l’exposition aux phtalates et l’intégrité vasculaire du placenta ont été mises en évidence. Les phtalates, en particulier le DEHP et son métabolite majoritaire, le MEHP, induisent des altérations significatives de l’angiogenèse dans le tissu placentaire chez l’humain et chez l’animal, avec une diminution marquée de biomarqueurs de l’angiogenèse chez l’humain et des altérations fonctionnelles, telles qu’une diminution de la densité en microvaisseaux des placentas chez les animaux traités au DEHP.19,26
L’exposition au DEHP pendant la grossesse est associée à un raccourcissement du cycle de grossesse, ce qui suggère que l’exposition des femmes enceintes aux phtalates et au DEHP notamment pourrait augmenter très significativement le risque de naissance prématurée et de complications de grossesse telles que prééclampsie, restriction de croissance fœtale...21,27,28,29 De récentes études indiquent qu’une naissance prématurée sur dix aux États-Unis serait associée à l’exposition maternelle à ces substances chimiques19 et que, pour les femmes qui présentent les plus fortes expositions aux phtalates (notamment au DEHP, au DiNP, au DiDP et au DnOP), le risque de naissance prématurée est accru de 50 %.29 Des modélisations statistiques issues de données épidémiologiques suggèrent qu’en revanche, une réduction de 50 % de la contamination des femmes enceintes aux phtalates permettrait de réduire de 12 % les taux de prématurité.21
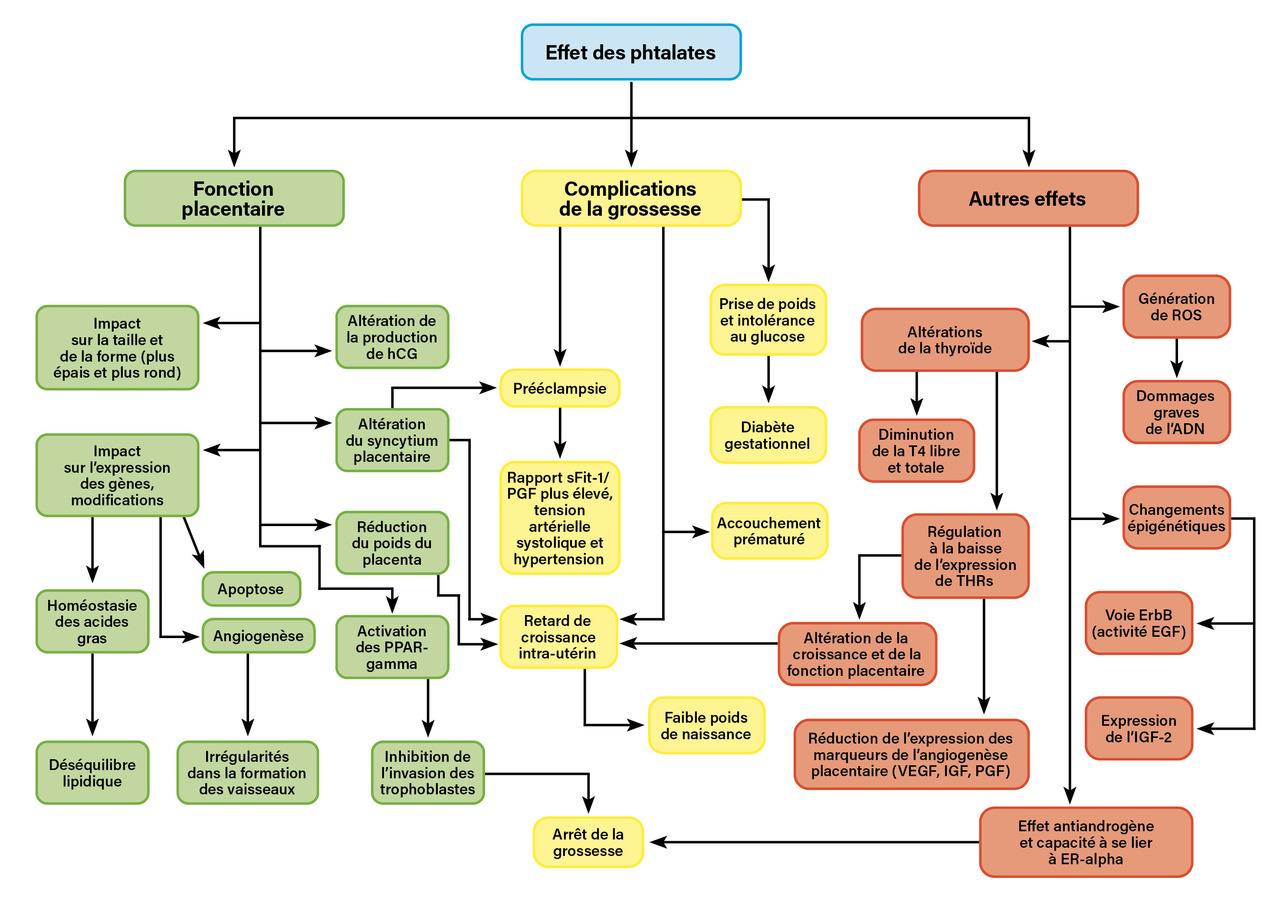
La figure 2 récapitule l’ensemble des effets biologiques induits par les phtalates sur le placenta et les conséquences de leur exposition sur les complications de la grossesse ainsi que sur les effets physiologiques associées (stress oxydatif et fonctionnement thyroïdien).
Éliminer les PE, dont les phtalates, de l’environnement des femmes enceintes
De nombreuses études incriminent les effets délétères des phtalates et des PE sur le développement et la physiologie du placenta, ce qui constitue une préoccupation majeure en matière de santé publique.30,31
Les modifications dans l’environnement maternel et l’exposition en continu à de nombreux PE peuvent exercer une influence majeure sur l’implantation, la croissance, le transfert de nutriments et l’activité hormonale du placenta. Par exemple, le stress oxydatif au début de la grossesse peut interférer avec l’invasion normale du trophoblaste et l’élargissement des artérioles spirales, entraînant une vascularisation insuffisante du placenta. Ceci est extrêmement important car un faible apport en nutriments au fœtus est la première cause de retard de croissance fœtale, et le placenta est le facteur limitant la vitesse de transfert des nutriments. Les facteurs épigénétiques, qui affectent la transcription et l’expression des gènes, pourraient constituer une cible majeure des expositions environnementales dans le placenta. Il est donc nécessaire d’approfondir les connaissances sur le placenta qui « est l’organe humain le moins bien compris, mais sans doute l’un des plus importants » selon David Weinberg, responsable de l’Human Placenta Project (https ://tinyurl.com/4cmkwz2m).
Parallèlement, il s’avère indispensable de sensibiliser l’ensemble de la communauté médicale aux risques associés à l’exposition des femmes enceintes aux PE et aux phtalates en particulier. Étant donné que ces derniers sont rapidement éliminés, la mise en place des stratégies d’éviction permettrait d’obtenir des effets bénéfiques rapides et sensibles sur la santé de la mère et celle de l’enfant (encadré).
Abréviations
ADHD : attention deficit hyperactivity disorder (TDAH : trouble de l’attention et hyperactivité)
AG : acide gras
BPA : bisphénol A
Cd : cadmium
DDT : dichlorodiphényltrichloroéthane
DEHP : di(2 -éthylhexyl) phtalate
EDC : endocrine disruptor compound
hCG : gonadotrophine chorionique humaine
HAP : hydrocarbures polyaromatiques
MAP kinases : mitogen-activated protein kinase
MEHP : mono(2 -éthylhexyl) phtalate
MIH : molar incisor hypomineralisation (hypominéralisation des molaires et incisives)
MMP- 9 : matrix metallopeptidase- 9
PCB : polychlorobiphényles
PGE2 : prostaglandine E2
PGF2α : prostaglandine F2α
PE : perturbateurs endocriniens
PFAS : substances per- et polyfluoroalkylées
PPARγ : peroxisome proliferator-activated receptor gamma
pCRH : corticotrophine placentaire
ROS : reactive oxygen species
TGFb : transforming growth factor b
TIMP- 1 : tissue inhibitor of metalloproteinase - 1
Conseils pratiques à destination des femmes enceintes pour se protéger des perturbateurs endocriniens
Alimentation
- Privilégier les aliments d’origine biologique et le « fait maison » en utilisant des produits frais ou des aliments surgelés non préparés. Veiller à rincer les fruits et légumes avant de les préparer ou de les manger.
- Les pesticides utilisés en agriculture contaminent fruits, légumes et environnement. Ce sont eux aussi des perturbateurs endocriniens. Au niveau domestique, les pesticides sont présents dans certains produits anti-poux, dans les produits anti-puces pour chiens et chats mais aussi dans les insecticides utilisés pour jardiner.
- Éviter les plats préparés et les autres produits ultratransformés comme les biscuits, les barres chocolatées, les en-cas sucrés et salés, les sodas.
- Limiter les emballages plastiques et les ustensiles de cuisine anti-adhésifs en préférant les matières pérennes, telles que le verre, plutôt que jetables. Si vous êtes adeptes des plats préparés, pensez à les retirer du plat en plastique avant de les faire chauffer.
- Consommer du poisson, mais pas plus de deux fois par semaine du fait de leur haute teneur en polluants et métaux lourds. Par ailleurs, diversifier les espèces consommées et les zones de provenance.
Soins corporels
- Limiter l’utilisation de produits cosmétiques et de lotions pendant la grossesse et l’allaitement.
- Choisir des produits sans parfum, et ne pas se parfumer pendant cette période.
- Ne pas colorer ses cheveux pendant la grossesse ou l’allaitement avec des teintures chimiques.
Après l’accouchement
- Éviter au maximum d’utiliser des produits cosmétiques sur les bébés et enfants en général. Plutôt que les lingettes, privilégiez simplement de l’eau savonneuse pour le change.
Conseils ménagers et sur l’air intérieur
- L’air des logements est souvent plus pollué que l’air extérieur, car les intérieurs concentrent de multiples sources de produits chimiques. Ainsi, les produits ménagers, les meubles et les tissus des canapés, ou encore certaines peintures, sont chargés en perturbateurs endocriniens.
- Aérer de préférence deux fois dix minutes par jour votre logement pour renouveler l’air intérieur.
- Augmenter l’aération pendant et après les travaux de peinture/aménagement de la chambre du bébé.
- Limiter l’usage en nombre et en quantité des produits d’entretien et respecter leurs conditions d’utilisation ; ne jamais mélanger plusieurs produits d’entretien ; préférer les produits comme le vinaigre blanc, le bicarbonate de soude et le savon noir.
- Éviter les sources de polluants de l’air intérieur (diffuseur d’odeurs, sprays, encens, bougies parfumées, vaporisateurs de parfum).
- Utiliser des peintures et des produits bénéficiant d’un label écologique, moins émetteurs de produits chimiques (Ecolabel européen). Pour l’ameublement, préférer les meubles en bois massif.
- Éviter de participer aux travaux d’aménagement et de peinture pendant la grossesse et attendre au moins trois mois avant de faire dormir le bébé dans une chambre rénovée.
- Laver les vêtements et le linge de maison neufs avant de les utiliser.
Après l’accouchement
- Laver les objets à destination du bébé : vêtements, tissus et jouets.
- N’acheter pour le bébé que des jouets répondant aux normes françaises et conçus pour son âge. En effet, les jouets pour les enfants de plus de 3 ans peuvent contenir des phtalates.
Sources :
2. Goodrich JM, Ingle ME, Domine SE, et al. First trimester maternal exposures to endocrine disrupting chemicals and metals and fetal size in the Michigan Mother-Infant Pairs study. J Dev Orig Health Dis 2019;10(4):447-58.
3. Gauderat G, Picard-Hagen N, Toutain PL, et al. Bisphenol A glucuronide deconjugation is a determining factor of fetal exposure to bisphenol A. Environ Int 2016;86:52-9.
4. Warner GR, Dettogni RS, Bagchi IC, et al. Placental outcomes of phthalate exposure. Reproductive Toxicology 2021;103:1-17.
5. Wang Y, Zhu H, Kannan K. A review of biomonitoring of phthalate exposures. Toxics 2019;7(2):21. Preprint at https://doi.org/10.3390/TOXICS7020021.
6. Zeng F, Zhang L, Deng F, et al. Early-life exposure to di (2-ethyl-hexyl) phthalate: Role in children with endocrine disorders. Frontiers in Cell and Developmental Biology 2023;11.
7. Tran TM, Kannan K. Occurrence of phthalate diesters in particulate and vapor phases in indoor air and implications for human exposure in Albany, New York, USA. Arch Environ Contam Toxicol 2015;68:489-99.
8. Giuliani A, Zuccarini M, Cichelli A, et al. Critical review on the presence of phthalates in food and evidence of their biological impact. International Journal of Environmental Research and Public Health 2015;17:1-43.
9. Zhang YJ, Guo JL, Xue JC, et al. Phthalate metabolites: Characterization, toxicities, global distribution, and exposure assessment. Environ Pollut 2021;291:118106.
10. Yang C, Song G, Lim W. A mechanism for the effect of endocrine disrupting chemicals on placentation. Chemosphere 2019;231:326-36.
11. Gao F, Hu W, Li Y, et al. Mono-2-ethylhexyl phthalate inhibits human extravillous trophoblast invasion via the PPARγ pathway. Toxicol Appl Pharmacol 2017;327:23-9.
12. Shoaito H, Petit J, Chissey A, et al. The role of peroxisome proliferator–activated receptor gamma (PPARγ) in mono(2-ethylhexyl) phthalate (MEHP)-mediated cytotrophoblast differentiation. Environ Health Perspect 2019;127(2):27003.
13. Tetz LM, Cheng AA, Korte CS, et al. Mono-2-ethylhexyl phthalate induces oxidative stress responses in human placental cells in vitro. Toxicol Appl Pharmacol 2013;268(1):47-54.
14. Tetz LM, Aronoff DM, Loch-Caruso R. Mono-ethylhexyl phthalate stimulates prostaglandin secretion in human placental macrophages and THP-1 cells. Reproductive Biology and Endocrinology 2015;13:56.
15. Barrett ES, Corsetti M, Day D, et al. Prenatal phthalate exposure in relation to placental corticotropin releasing hormone (pCRH) in the CANDLE cohort. Environ Int 2022;160:107078.
16. Derakhshan A, Shu H, Broeren MAC, et al. Association of endocrine disrupting chemicals exposure with human chorionic gonadotropin concentrations in pregnancy. Environ Int 2023;178:10809.
17. Adibi J , Zhao Y, Zhan LV, et al. An investigation of the single and combined phthalate metabolite effects on human chorionic gonadotropin expression in placental cells. Environ Health Perspect 2017;125(10):107010.
18. Vrachnis N, Loukas N, Vrachnis D, et al. Phthalates and fetal growth velocity: Tracking down the suspected links. Journal of Maternal-Fetal & Neonatal Medicine 2022;35(25):4985-93.
19. Seymore TN, Rivera-Núñez Z, Stapleton PA, et al. Phthalate exposures and placental health in animal models and humans: A systematic review. Toxicological Sciences 2022;188:153-79.
20. Derakhshan A, Shu H, Broeren MAC, et al. Association of phthalate exposure with thyroid function during pregnancy. Environ Int 2021;157:106795.
21. Welch BM, Keil AP, Buckley JP, et al. Associations between prenatal urinary biomarkers of phthalate exposure and preterm birth. JAMA Pediatr 2022;176(9):895-905.
22. Jauniaux E, Poston L, Burton GJ. Placental-related diseases of pregnancy: Involvement of oxidative stress and implications in human evolution. Hum Reprod Update 2006;12(6):747-55.
23. Strakovsky RS, Schantz SL. Impacts of bisphenol A (BPA) and phthalate exposures on epigenetic outcomes in the human placenta. Environ Epigenet 2018;4(3):dvy022.
24. Jedynak P, Tost J, Calafat AM, et al. Pregnancy exposure to phthalates and DNA methylation in male placenta. An epigenome-wide association study. Environ Int 2022;160:107054.
25. Gingrich J, Ticiani E, Veiga-Lopez A. Placenta disrupted: Endocrine disrupting chemicals and pregnancy. Trends in Endocrinology and Metabolism 2020;31(7):508-24.
26. Martínez-Razo LD, Martínez-Ibarra A, Vázquez-Martínez ER, et al. The impact of di-(2-ethylhexyl) phthalate and mono(2-ethylhexyl) phthalate in placental development, function, and pathophysiology. Environment International 2021;146:106228.
27. Ferguson KK, Rosen EM, Rosario A, et al. Environmental phthalate exposure and preterm birth in the PROTECT birth cohort. Environ Int 2019;132:105099.
28. Yu Z, Han Y, Shen R, et al. Gestational di-(2-ethylhexyl) phthalate exposure causes fetal intrauterine growth restriction through disturbing placental thyroid hormone receptor signaling. Toxicol Lett 2018;294:1-10.
29. Trasande L, Nelson ME, Alshawabkeh A, et al. Prenatal phthalate exposure and adverse birth outcomes in the USA: A prospective analysis of births and estimates of attributable burden and costs. Lancet Planet Health 2024;8(2):e74-e85.
30. Padmanabhan V, Song W, Puttabyatappa M. Praegnatio perturbatio. Impact of endocrine-disrupting chemicals. Endocr Rev 2021;42(3): 295-353.
31. Plante I, Winn LM, Vaillancourt C, et al. Killing two birds with one stone: Pregnancy is a sensitive window for endocrine effects on both the mother and the fetus. Environ Res 2022;205:112435.
32. Puche-Juarez M, Toledano JM, Moreno-Fernandez J, et al. The role of endocrine disrupting chemicals in gestation and pregnancy outcomes. Nutrients 2023;15(21):4657.

 Encadrés
Encadrés