L’infarctus du myocarde à coronaires saines (IMCS) est un infarctus du myocarde survenant en l’absence de sténose significative des artères coronaires (inférieure à 50 % du diamètre). Il représente environ 5 à 10 % de tous les infarctus du myocarde.1
Bien que l’on sache depuis longtemps qu’un infarctus du myocarde peut se produire sans maladie coronarienne obstructive, l’intérêt des cliniciens pour ce phénomène est véritablement apparu avec l’émergence de l’angioplastie coronaire dans le traitement des syndromes coronariens aigus.2
Malgré l’augmentation rapide des connaissances sur l’IMCS, des lacunes fondamentales persistent, et sa prise en charge est souvent suboptimale.3
Les femmes plus souvent touchées
Contrairement à la maladie coronarienne, les femmes sont plus fréquemment touchées que les hommes : elles sont concernées dans plus de la moitié des cas d’IMCS.1
Les patients atteints d’IMCS sont légèrement plus jeunes (d’environ dix ans) que ceux atteints d’infarctus du myocarde sur lésion coronarienne obstructive et ont moins de facteurs de risque de maladies cardiovasculaires, à l’exception de l’hypertension artérielle.3
Initialement, les patients atteints d’IMCS étaient considérés comme ayant un pronostic favorable. Cependant, des études à plus grande échelle ont montré un risque accru de décès et de nouveaux événements cardiovasculaires à moyen et long termes.4
Diagnostic grâce à l’imagerie
Pour diagnostiquer l’IMCS, les critères habituels d’infarctus du myocarde doivent être présents avec l’absence de sténose coronarienne obstructive à l’angiographie coronarienne.5
L’infarctus du myocarde est défini par une nécrose des cellules myocardiques due à une ischémie prolongée. En pratique, l’élévation de la troponine est utilisée comme indicateur de cette mort cellulaire.6
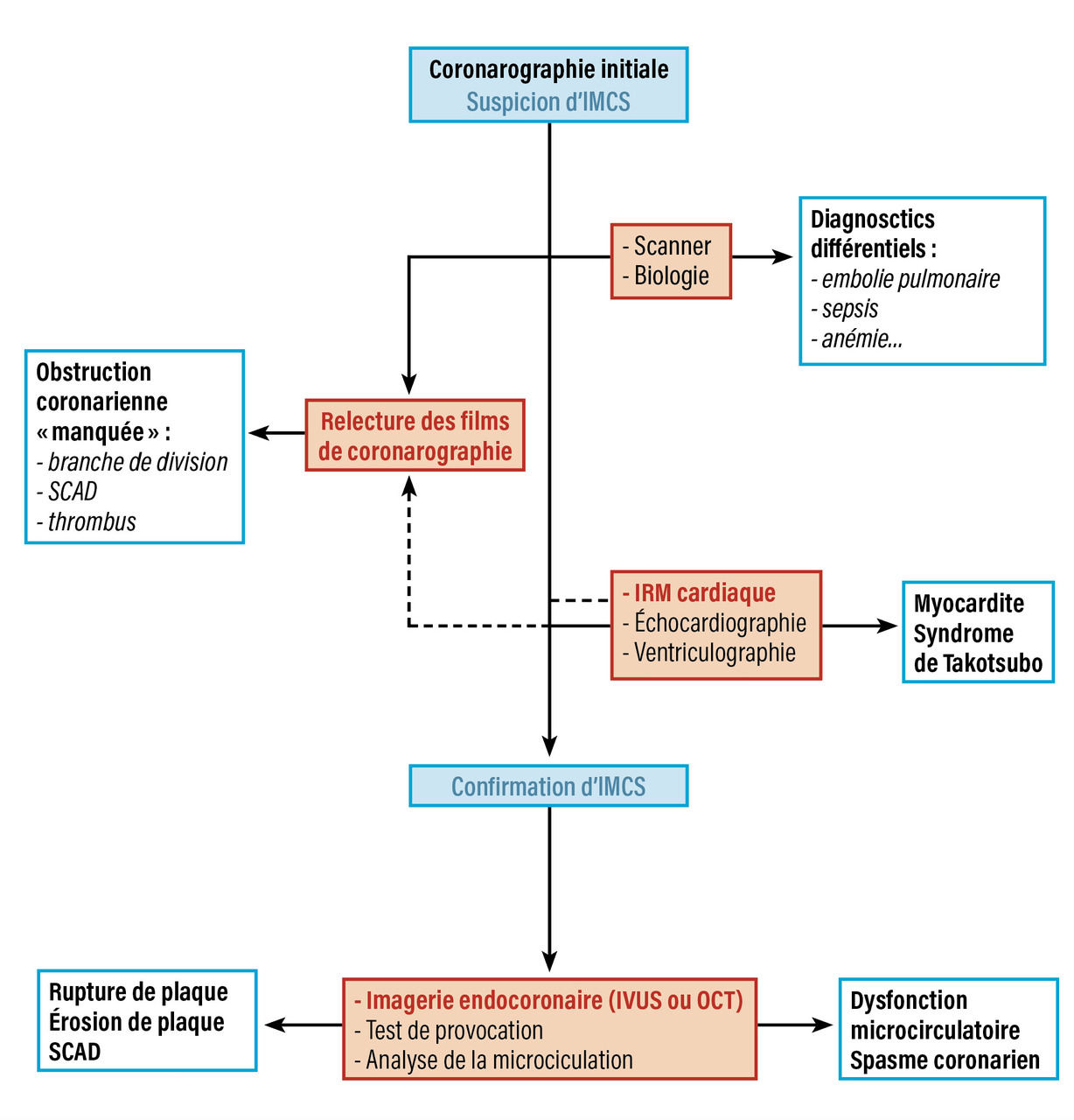
La stratégie diagnostique comporte l’exclusion d’une sténose coronarienne à l’angiographie coronarienne ainsi que l’exclusion des autres causes non ischémiques comme la myocardite et le syndrome de Takotsubo, qui ne sont plus inclus dans les causes d’IMCS dans les nouvelles recommandations.5
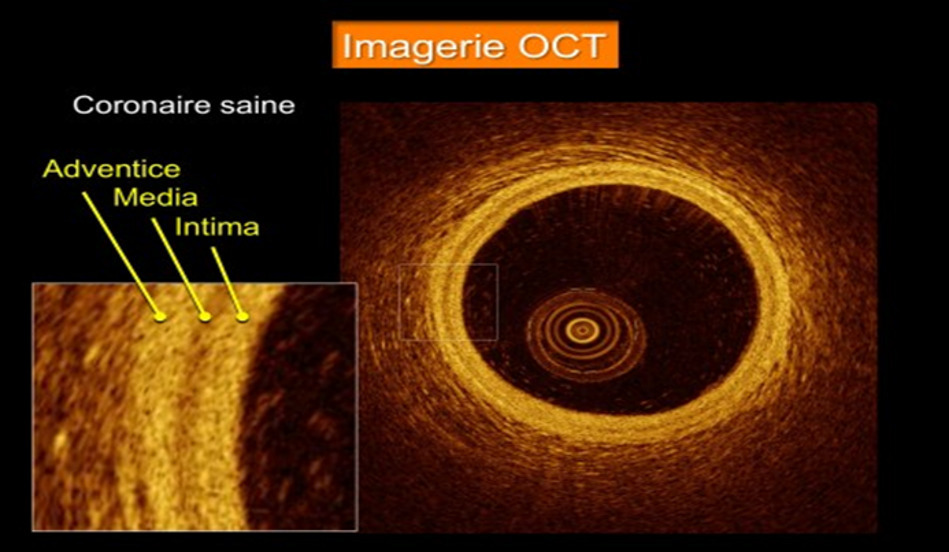
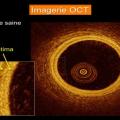
Le seuil de sténose coronarienne utilisé pour définir une atteinte obstructive est de 50 % de réduction de la lumière endocoronarienne. L’angiographie coronarienne est donc indispensable dans le processus diagnostique de l’ICMS ; néanmoins, elle présente des limites, avec le risque de sous-estimer ou de surestimer le degré de sténose coronarienne. L’imagerie endocoronarienne par tomographie par cohérence optique (OCT) ou l’échographie intravasculaire (IVUS) offrent des informations supplémentaires pour évaluer les plaques coronariennes (fig. 1).7,8
En pratique, la distinction entre le diagnostic d’IMCS et celui d’infarctus du myocarde avec maladie coronarienne obstructive est parfois difficile en raison du manque de spécificité des symptômes, des modifications électrocardiographiques et de la difficulté à mesurer précisément le degré de sténose à l’angiographie coronarienne. Il est indispensable d’éliminer d’autres causes pouvant entraîner des tableaux cliniques identiques, comme la myocardite. La réalisation précoce d’une imagerie par résonance magnétique (IRM) est donc indispensable.5
Physiopathologie non complètement élucidée
Les mécanismes exacts de l’IMCS ne sont pas entièrement compris.9 Cependant, plusieurs causes sont reconnues.
Pathologies coronariennes épicardiques
Quatre types de pathologies coronariennes épicardiques sont connues :
- la rupture de plaque endothéliale est probablement une cause fréquente de l’IMCS.9 Elle est caractérisée par une discontinuité de la chape fibreuse surmontant un noyau riche en lipides et se produit typiquement avec une thrombose transitoire sus-jacente.10 L’imagerie endocoronarienne joue un rôle important dans la recherche étiologique. L’OCT, avec sa haute résolution de 10 à 20 μm, est la modalité la plus prometteuse ;7
- la dissection coronarienne spontanée est une cause rare observée surtout chez les femmes jeunes. Elle se caractérise par le développement d’une fausse lumière dans la paroi de l’artère coronaire pouvant comprimer la vraie lumière et causer une ischémie.11 Le diagnostic est d’abord angiographique. L’utilisation de l’imagerie endocoronarienne permet d’affirmer le diagnostic et de déterminer le site de la rupture intimale et l’extension de l’hématome. Son utilisation est cependant limitée dans ce contexte, en raison d’un risque d’aggravation de la dissection lors de sa réalisation.12 La dysplasie fibromusculaire est fréquemment associée à la dissection coronarienne spontanée. Il existe également une association avec les pathologies vasculaires systémiques (syndrome de Marfan, syndrome d’Ehlers-Danlos...). La prise en charge est réalisée de préférence dans des centres spécialisés. Le péri-partum est une condition prédisposante, faisant de la dissection coronarienne spontanée la principale cause d’infarctus aigu du myocarde pendant la grossesse et le péri-partum ;13
- le spasme d’une artère coronaire épicardique peut provoquer une ischémie transitoire et, dans certains cas, une ischémie persistante pouvant entraîner un IMCS.14 Il est souvent associé à des facteurs tels que le tabagisme, la prise de cocaïne, l’hypertension artérielle et le stress émotionnel.15 Les tests de provocation pour le spasme sont utilisés dans le cadre de la recherche étiologique (coronarographie avec injection de méthylergométrine ou d’acétylcholine) ;16
- la thrombose in situ associée à des troubles de la coagulation et l’embolie extracardiaque sont des causes rares d’IMCS. L’embolie peut être due à une fibrillation atriale, une endocardite infectieuse ou une thrombose veineuse profonde associée à des pathologies congénitales telles que la communication interatriale (CIA) et le foramen ovale perméable (FOP).17 Un bilan de thrombophilie entre dans la démarche diagnostique de l’IMCS chez le sujet jeune.18
Atteinte microvasculaire coronarienne
L’atteinte microvasculaire coronarienne est considérée comme une cause fréquente de l’IMCS.9 Près de la moitié des patients avec des douleurs thoraciques stables ont une coronarographie sans lésions coronariennes obstructives. Une proportion importante de ces patients a des anomalies dans la fonction et la structure de la microcirculation coronarienne dues à une dysfonction endothéliale et des cellules musculaires lisses, définie comme une atteinte microvasculaire coronarienne.19 Le diagnostic d’une atteinte microvasculaire coronarienne repose sur une évaluation fonctionnelle de la microcirculation, qui peut être réalisée par des méthodes invasives et non invasives. Bien qu’étant la norme de référence pour le diagnostic d’atteinte microvasculaire coronarienne, les tests invasifs de la fonction des artères coronaires ne sont pas largement utilisés en pratique clinique en raison de leur complexité et, dans de nombreux sites, d’un manque d’expérience clinique.20 De manière non invasive, la perfusion myocardique peut être évaluée par tomographie par émission de photons (TEP) et par IRM.21 Sa faible disponibilité, son coût et l’exposition aux radiations sont des facteurs limitant une utilisation large de la TEP. L’IRM de stress est également utilisée pour évaluer la perfusion myocardique et la microcirculation.9
Déséquilibre entre la demande et l’apport en oxygène
Une augmentation de la demande en oxygène et/ou une diminution de l’apport en oxygène peuvent entraîner une ischémie et une nécrose myocardiques, c’est-à-dire un infarctus du myocarde de type 2.6 Les études montrent qu’environ la moitié des patients atteints d’infarctus de type 2 n’ont pas de maladie coronarienne significative, ce qui les classe dans la catégorie des IMCS.
L’atteinte coronarienne non significative est susceptible de contribuer à une ischémie secondaire déclenchée par des arythmies, une anémie marquée ou une hypoxie. Ce mécanisme d’ischémie coronarienne est relativement courant chez les personnes âgées, en particulier en présence d’une hypertrophie ventriculaire gauche.
Dans une proportion significative d’IMCS, le mécanisme sous-jacent ne peut être fermement établi, même après des investigations approfondies.9
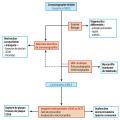
La démarche diagnostique est résumée dans la figure 2.
Prise en charge selon la cause
Les recommandations de traitement dans les directives actuelles reposent principalement sur les avis d’experts et dépendent de la cause sous-jacente.22 La prise en charge de l’IMCS est similaire à celle de l’infarctus du myocarde classique.
Traitement médicamenteux
Dans le cas de la dissection coronarienne spontanée, une faible dose d’aspirine est recommandée à vie (de 75 à 150 mg/j).
Le traitement par une double anti-agrégation plaquettaire est controversé.23
Le traitement par statines est associé à une mortalité plus faible et à un taux réduit d’événements intercurrents.24
De même, des résultats principalement positifs ont été montrés pour les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) ou les antagonistes des récepteurs de l’angiotensine II (ARA II). En revanche, la plupart des études sur les bêtabloquants n’ont pas trouvé d’effet bénéfique.12
Dans le cadre du spasme coronarien, le traitement par inhibiteurs calciques réduit le risque de récidive.25
Traitements non pharmacologiques
Pour les traitements non pharmacologiques, les données sont encore plus rares ; cependant, une étude a indiqué un effet positif de la réadaptation cardiaque dans l’IMCS.
Les données sur l’efficacité de l’angioplastie coronarienne pour le traitement des lésions responsables de l’IMCS dues à une ulcération ou une érosion de plaque sont rares.26
Dans tous les cas, un suivi médical régulier est nécessaire, en insistant sur la prévention secondaire (arrêt du tabagisme), l’observance thérapeutique et l’éducation en cas de récidive douloureuse.27
Bon pronostic mais récidive fréquente
L’IMCS est une entité clinique importante et méconnue. La connaissance de son incidence, de ses facteurs de risque et de son pronostic, ainsi que des mécanismes physiopathologiques sous-jacents, s’est considérablement accrue au cours de la dernière décennie.
L’imagerie non invasive, en particulier l’angioscanner des artères coronaires, pourrait à l’avenir devenir un outil de premier plan pour le diagnostic non invasif de l’IMCS.
Le pronostic des patients atteints d’IMCS est généralement bon, mais le risque de récidive est élevé.
Il reste encore des lacunes fondamentales dans la compréhension de cette entité hétérogène, d’où la nécessité d’études prospectives pour mieux comprendre la physiopathologie de l’IMCS et l’efficacité des thérapies médicales.
Cas clinique
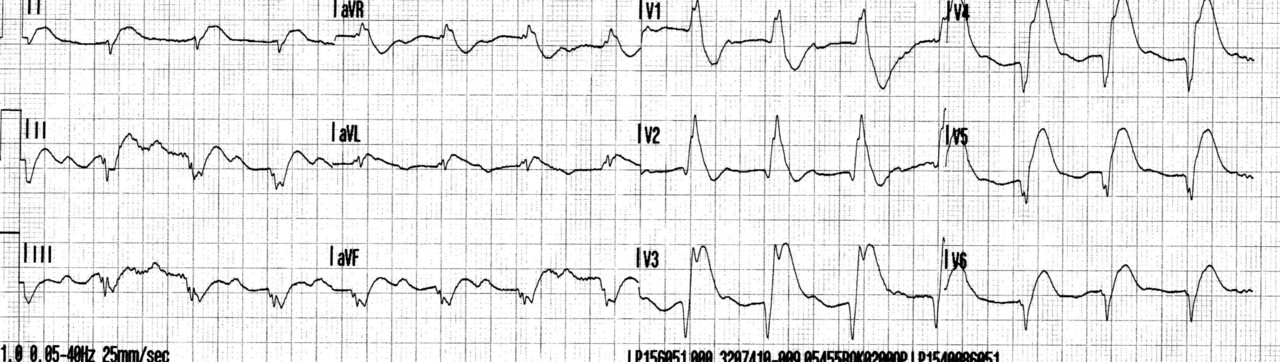
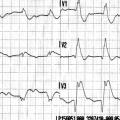
Une femme de 39 ans, tabagique, se présente aux urgences pour une douleur thoracique évoluant depuis quarante-cinq minutes. L’électrocardiogramme met en évidence un sus-décalage du segment ST dans le territoire antérieur (fig. 3). Une coronarographie est réalisée quarante-cinq minutes après, alors que la douleur et le sus-décalage ont disparu. La coronarographie montre des artères coronaires perméables et normales à l’angiographie. La troponine est augmentée. Le diagnostic d’infarctus à coronaires saines est posé.
Au cours de l’hospitalisation, un traitement par statines, aspirine et inhibiteurs calciques est débuté. Une IRM confirme l’existence d’un infarctus dans le territoire antérieur. La patiente sort avec une aide pour le sevrage tabagique.
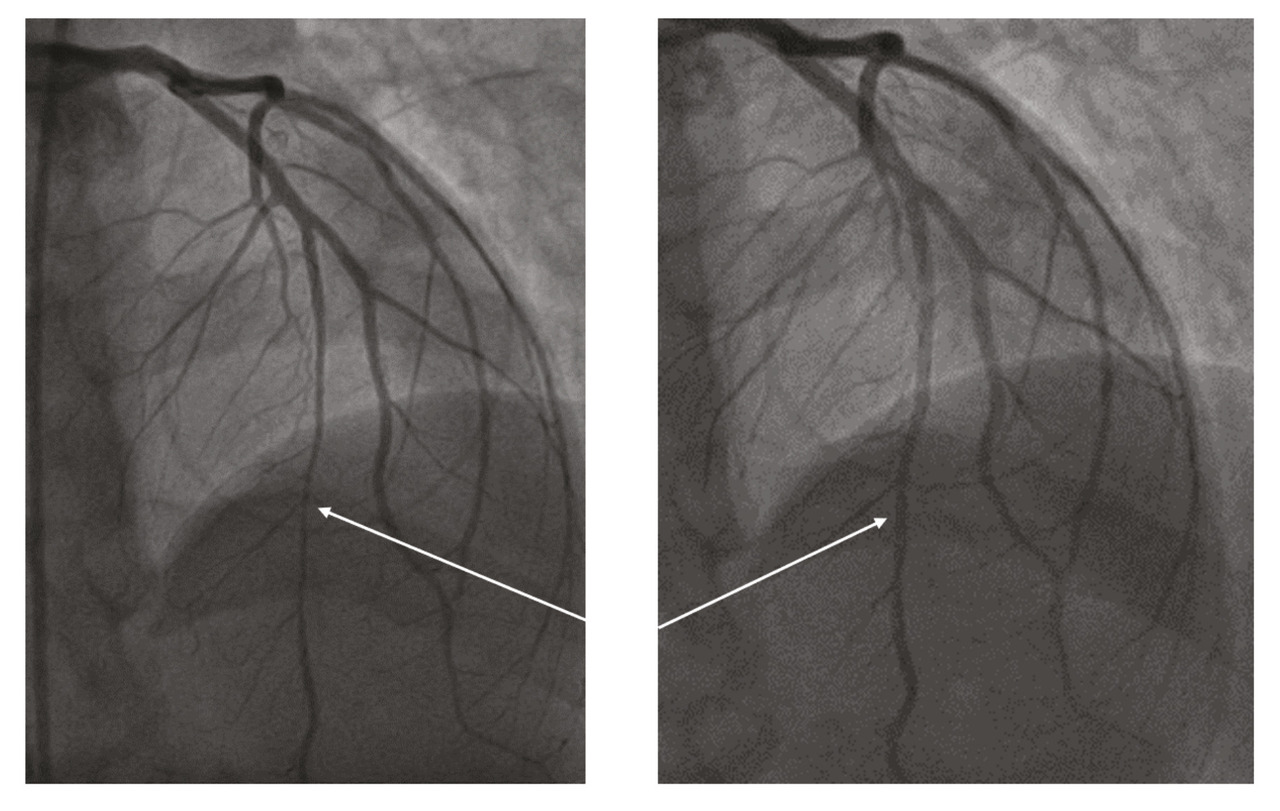
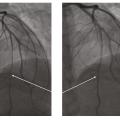
Elle revient de façon programmée deux mois plus tard pour une nouvelle coronarographie avec imagerie intracoronaire et test de provocation pour spasme coronarien. L’imagerie intracoronaire retrouve un athérome au niveau du segment proximal et moyen de l’artère interventriculaire antérieure (IVA). Le test de provocation (injection de méthylergométrine) provoque un spasme coronarien au niveau de I’IVA, résolutif après injection de dérivés nitrés (fig. 4). Le traitement est renforcé par ajout d’un deuxième dérivé nitré.
Une nouvelle coronarographie est réalisée deux mois après avoir débuté ce traitement et après sevrage tabagique complet. Le test de provocation n’entraîne plus de spasme coronarien.
Trois ans après, sous traitement et sevrage tabagique maintenu, la patiente n’a pas présenté de récidive douloureuse.
2. Beltrame JF. Assessing patients with myocardial infarction and nonobstructed coronary arteries (MINOCA). J Intern Med 2013;273(2):182‑5.
3. Pasupathy S, Lindahl B, Litwin P, et al. Survival in patients with suspected myocardial infarction with nonobstructive coronary arteries: A comprehensive systematic review and meta-analysis from the MINOCA global collaboration. Circulation Cardiovascular Quality and Outcomes 2021;14(11):e007880.
4. Eggers KM, Hjort M, Baron T, et al. Morbidity and cause-specific mortality in first-time myocardial infarction with nonobstructive coronary arteries. J Intern Med 2019;285(4):419‑28.
5. Agewall S, Beltrame JF, Reynolds HR, et al. ESC working group position paper on myocardial infarction with non-obstructive coronary arteries. Eur Heart J 2017;38(3):143‑53.
6. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018). Eur Heart J 2019;40(3):237‑69.
7. Reynolds HR, Maehara A, Kwong RY et al. Coronary optical coherence tomography and cardiac magnetic resonance imaging to determine underlying causes of myocardial infarction with nonobstructive coronary arteries in women. Circulation 2021;143(7):624‑40.
8. Reynolds HR, Srichai MB, Iqbal SN, et al. Mechanisms of myocardial infarction in women without angiographically obstructive coronary artery disease. Circulation 2011;124(13):1414‑25.
9. Yildiz M, Ashokprabhu N, Shewale A, et al. Myocardial infarction with non-obstructive coronary arteries (MINOCA). Front Cardiovasc Med 2022;9:1032436.
10. Bentzon JF, Otsuka F, Virmani R, et al. Mechanisms of plaque formation and rupture. Circulation Research. 2014;114(12):1852‑66.
11. Di Fusco SA, Rossini R, Zilio F. et al. Spontaneous coronary artery dissection: Overview of pathophysiology. Trends Cardiovasc Med 2022;32(2):92‑100.
12. Hayes SN, Kim ESH, Saw J, et al. Spontaneous coronary artery dissection: Current state of the science: A scientific statement from the American Heart Association. Circulation 2018;137(19):e523‑57.
13. Adlam D, Alfonso F, Maas A, et al, Writing Committee. European Society of Cardiology, acute cardiovascular care association, SCAD study group: A position paper on spontaneous coronary artery dissection. Eur Heart J 2018;39(36):3353‑68.
14. Shimokawa H. 2014 Williams Harvey Lecture:importance of coronary vasomotion abnormalities from bench to bedside. Eur Heart J 2014;35(45):3180‑93.
15. Nobuyoshi M, Abe M, Nosaka H, et al. Statistical analysis of clinical risk factors for coronary artery spasm: Identification of the most important determinant. Am Heart J 1992;124(1):32‑8.
16. Beltrame JF, Crea F, Kaski JC, et al. International standardization of diagnostic criteria for vasospastic angina. Eur Heart J 2017;38(33):2565‑8.
17. Shibata T, Kawakami S, Noguchi T, et al. Prevalence, clinical features, and prognosis of acute myocardial infarction attributable to coronary artery embolism. Circulation 2015;132(4):241‑50.
18. Scalone G, Niccoli G, Crea F. Editor’s choice. Pathophysiology, diagnosis and management of MINOCA: An update. Eur Heart J Acute Cardiovasc Care 2019;8(1):54‑62.
19. Crea F, Montone RA, Rinaldi R. Pathophysiology of coronary microvascular dysfunction. Circulation 2022;86(9):1319‑28.
20. Mileva N, Nagumo S, Mizukami T, et al. Prevalence of coronary microvascular disease and coronary vasospasm in patients with nonobstructive coronary artery disease: Systematic review and meta-analysis. J Am Heart Assoc 2022;11(7):e023207.
21. Mauricio R, Srichai MB, Axel L, et al. Stress cardiac MRI in women with myocardial infarction and nonobstructive coronary artery disease. Clinical Cardiology 2016;39(10):596‑602.
22. Mukherjee D. Myocardial infarction with nonobstructive coronary arteries: A call for individualized treatment. J Am Heart Assoc 2019;8(14):e013361.
23. Cerrato E, Giacobbe F, Quadri G, et al. Antiplatelet therapy in patients with conservatively managed spontaneous coronary artery dissection from the multicentre DISCO registry. Eur Heart J 2021;42(33):3161‑71.
24. Masson W, Lobo M, Barbagelata L, et al. Prognostic value of statin therapy in patients with myocardial infarction with nonobstructive coronary arteries (MINOCA): A meta-analysis. Acta Cardiologica 2022;77(6):480‑7.
25. Slavich M, Patel RS. Coronary artery spasm: Current knowledge and residual uncertainties. Int J Cardiol, Heart Vasc 2016;10:47.
26. Collet JP, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2021;42(14):1289‑367.
27. Lindahl B, Baron T, Erlinge D, et al. Medical therapy for secondary prevention and long-term outcome in patients with myocardial infarction with nonobstructive coronary artery disease. Circulation 2017;135(16):1481‑9.

 Encadrés
Encadrés