Afin de toujours améliorer les traitements et la prise en charge des cancers, les disciplines oncologiques sont animées par une culture de l’innovation, dans tous les domaines, en anticipant et déployant les principales avancées, qu’elles soient d’ordre médical, organisationnel, en investissant dans les équipements technologiques les plus innovants et en testant les nouvelles possibilités de santé connectée.
Les patients traités pour un cancer peuvent bénéficier de traitements particulièrement innovants – tels que la chirurgie robotique, la radiothérapie adaptative, la radiologie et l’oncologie interventionnelle de précision – grâce à des équipements de pointe.
La chirurgie robotique en France connaît une croissance constante, avec une implantation majoritaire dans les grands centres hospitaliers universitaires et les établissements privés, où les ressources financières et l’activité chirurgicale soutenue justifient ces investissements. Ces équipements sont principalement financés par les établissements eux-mêmes via leurs budgets d’investissement, parfois soutenus par des subventions publiques octroyées par les agences régionales de santé (ARS) ou par des partenariats public-privé. Les hôpitaux généraux et les cliniques de taille moyenne commencent également à s’équiper, bien que de façon moins systématique. Toutefois, des disparités subsistent entre les territoires, certaines zones périphériques ayant un accès limité à la chirurgie robotique. Cette inégalité est liée à la fois aux coûts élevés d’achat et de maintenance des équipements, souvent pris en charge par des contrats de service avec les fabricants, et à la concentration des chirurgiens spécialisés dans les zones urbaines.
Huit patients atteints d’un cancer sur dix auront besoin d’une intervention chirurgicale au cours de leur maladie. La chirurgie oncologique tient donc une place essentielle, avec de multiples rôles : la résection tumorale chirurgicale reste la meilleure chance de guérison pour les tumeurs solides en cas de diagnostic précoce ; elle permet la réduction de risque de contracter un cancer lié aux prédispositions génétiques et aux syndromes héréditaires ; elle permet de diagnostiquer et stadifier le cancer ; elle peut également traiter les cancers localement avancés et les maladies métastatiques ; elle préserve la qualité de vie et permet de pallier les symptômes de la maladie. La chirurgie oncologique peut guérir les cancers les plus répandus et les plus graves, notamment les cancers du sein, du poumon, de la peau, de la prostate ou encore du côlon.
La recherche continue d’affiner les technologies, les techniques et les processus de chirurgie oncologique afin de permettre à un plus grand nombre de patients de bénéficier d’un traitement efficace, sûr, peu invasif et plus économique. Des innovations telles que la chirurgie robotique, couplée à l’imagerie et l’intelligence artificielle (IA) ouvrent de nouveaux horizons pour l’amélioration de la chirurgie oncologique.
Innovations au bloc opératoire : chirurgie cœlioscopique robot-assistée
La chirurgie robotique est aujourd’hui reconnue comme une évolution majeure de la chirurgie moderne au même titre que la cœlioscopie il y a vingt ans. À cette époque, la cœlioscopie avait bouleversé la chirurgie en réduisant la taille des incisions et donc les traumatismes opératoires. L’utilisation du robot chirurgical prolonge ces progrès. Son utilisation est de plus en plus répandue dans les procédures mini-invasives, transcendant les limites des approches chirurgicales traditionnelles.
Avantages pour le chirurgien
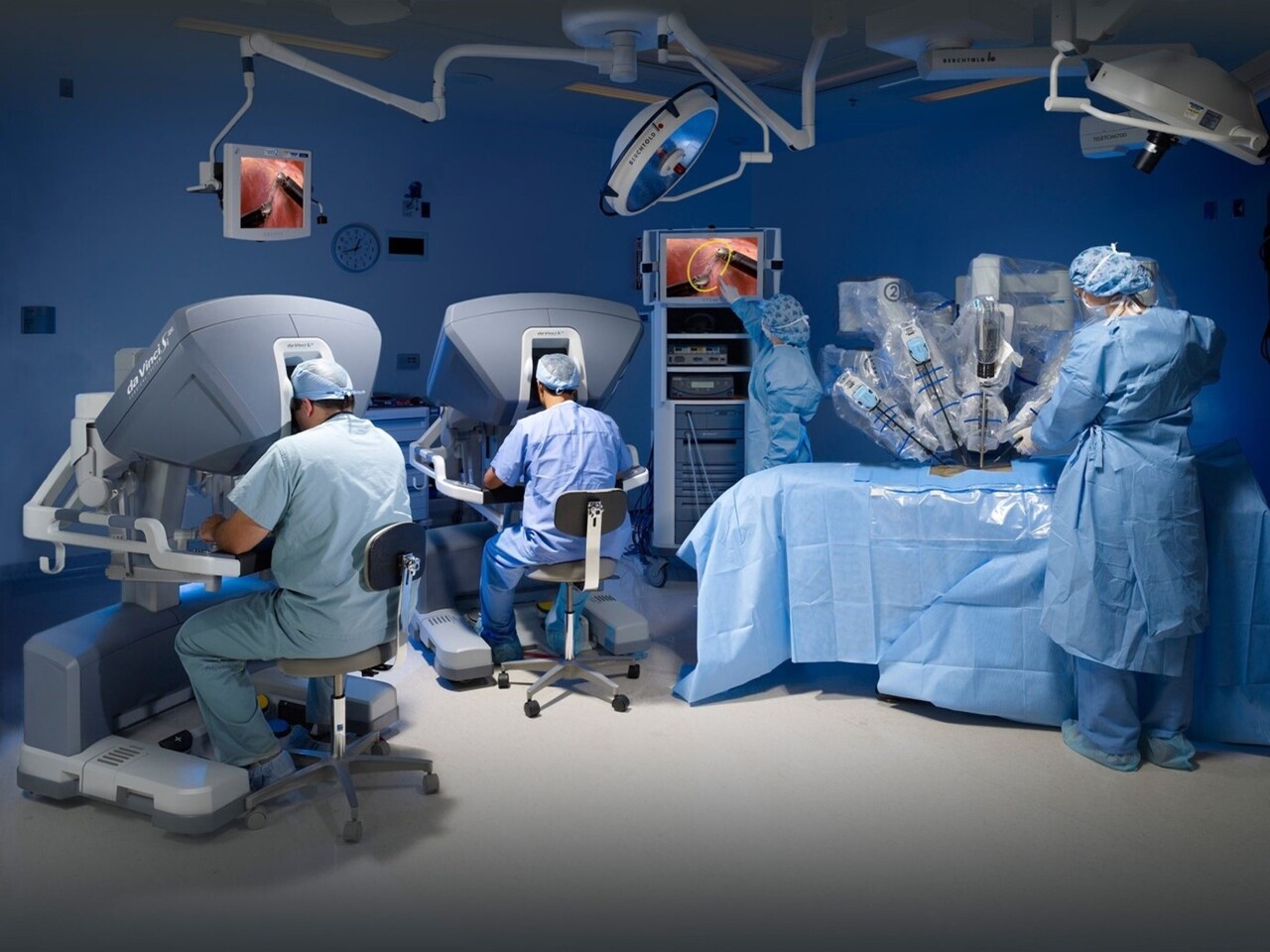
La chirurgie robotique présente de nombreux avantages pour le chirurgien. Elle permet de cumuler les avantages de la cœlioscopie et de la chirurgie ouverte. La technologie du robot s’appuie sur un système de télémanipulation constitué de trois modules interconnectés : une console de commande permet une exposition contrôlée par le chirurgien, qui y est placé en immersion, une caméra offre une vue détaillée binoculaire tridimensionnelle haute définition du champ opératoire grossie jusqu’à vingt fois, et quatre bras articulés accordent au chirurgien une plus grande précision du geste chirurgical, accrue grâce à des instruments entièrement articulés (sept degrés de liberté de mouvement ; mobilité plus importante que la main de l’homme), avec une plus grande amplitude de mouvement. Les bras du robot, commandés à distance, reproduisent tous les gestes du chirurgien en éliminant les tremblements parasites (fig. 1). Le robot offre également la possibilité de connecter en série deux consoles chirurgicales. Cette technologie permet de réaliser des chirurgies à double équipe (3 ou 4 mains) associant par exemple un chirurgien colorectal et un chirurgien gynécologue ou urologue.
Les avantages apportés par le robot chirurgical permettent à son utilisateur de repousser les limites de la chirurgie mini-invasive pour réaliser des opérations de plus en plus complexes et techniquement exigeantes. Le robot chirurgical permet la dissection, l’ablation et la reconstruction de structures situées dans des endroits peu accessibles par un abord conventionnel. L’évolution d’activité et la courbe d’apprentissage des chirurgiens sont rapides. De ce fait, le robot permet d’augmenter les indications de chirurgies mini-invasives dans des zones difficiles d’accès, quelle que soit la spécialité chirurgicale concernée.
Dans la chirurgie pelvienne des cancers gynécologiques ou colorectaux, les atouts du robot permettent de réaliser des tâches comme les dissections vasculaires, les lymphadénectomies ou encore les anastomoses intracorporelles, en particulier dans des espaces complexes tels que les zones proches des structures vasculaires vitales ou les parois latérales du bassin.
Des résultats d’études récentes démontrent que, dans ces indications, la chirurgie robotique est aussi efficace que la chirurgie ouverte,1 sans différence significative en matière de résultats oncologiques, de marges saines et de survie globale et sans récidive.
D’autres chirurgies complexes hépatobiliaires ou pancréatiques bénéficient également de l’assistance robotique. Une étude portant sur 250 résections pancréatiques robotisées a montré que ce geste est réalisable pour les pathologies oncologiques, avec également un faible taux de conversion.2
La chirurgie robotique est aussi largement utilisée en urologie et a révolutionné la prostatectomie radicale. Des recherches approfondies ont montré que la prostatectomie assistée par robot présente plusieurs avantages par rapport à la chirurgie ouverte, notamment de meilleurs résultats fonctionnels.3 En effet, la préservation des nerfs pendant la prostatectomie radicale assistée par robot en fait l’une des techniques les plus importantes pour respecter la fonction génito-urinaire en postopératoire, permettant de préserver à la fois la fonction érectile et celle des voies urinaires inférieures après l’opération.4
De nombreuses études soulignent l’intérêt de l’utilisation de la chirurgie robotique dans la prise en charge des cancers gynécologiques dans des populations particulières : les patientes en obésité morbide5 ou encore les personnes âgées.6
La chirurgie robotique transorale a gagné en popularité grâce à ses instruments à poignet et à sa vue tridimensionnelle agrandie, ce qui améliore le confort chirurgical dans les zones d’accès éloigné. Ses indications s’étendent au traitement des cancers de la tête et du cou, c’est-à-dire à la résection des tumeurs du larynx, de l’hypopharynx ou de l’espace parapharyngé.
Cette technologie apporte également une meilleure ergonomie au chirurgien. La cœlioscopie standard peut être responsable de la survenue de troubles musculo-squelettiques (TMS) en raison de mauvaises positions ergonomiques des chirurgiens, qui pourraient être réduites par la cœlioscopie robot-assistée grâce à la position assise. Un des objectifs secondaires de l’essai français ROBOGYN- 1004 (NCT01247779) était d’évaluer la charge de travail des chirurgiens lors de procédures en temps réel de chirurgie gynécologique oncologique.7 La chirurgie robotique améliore la perception de la charge de travail physique, et il est démontré qu’elle demande moins d’efforts pour toutes les parties du corps et, en particulier, pour les cervicales et les épaules, par rapport à la cœlioscopie standard. La chirurgie robotique réduit ainsi l’inconfort et la fatigue des chirurgiens, ainsi que le risque de TMS, grâce à une activité musculaire et une fatigue moindre, et à une position plus confortable. Moins de fatigabilité, donc davantage de concentration chirurgicale, la chirurgie robot-assistée pourrait réduire aussi les potentielles erreurs chirurgicales.
Avantages pour le patient
Les études démontrent que la chirurgie robot-assistée apporte de nombreux avantages également pour les patients. La majorité des données rapportent une diminution des pertes sanguines, la réduction des complications et des douleurs postopératoires, une reprise du transit plus précoce, une récupération postopératoire plus rapide et une durée d’hospitalisation plus courte, voire ambulatoire, facilitée. L’abord mini-invasif limite également les séquelles esthétiques, avec une diminution de la rançon cicatricielle et des cicatrices quasi invisibles dans certaines indications (chirurgie mammaire sans cicatrice sur la poitrine ; cicatrice de chirurgie thyroïdienne quasi invisible). L’ensemble de ces avantages permet au patient une reprise de ses activités plus précoce et une réinsertion professionnelle plus rapide.
Apports de la fluorescence
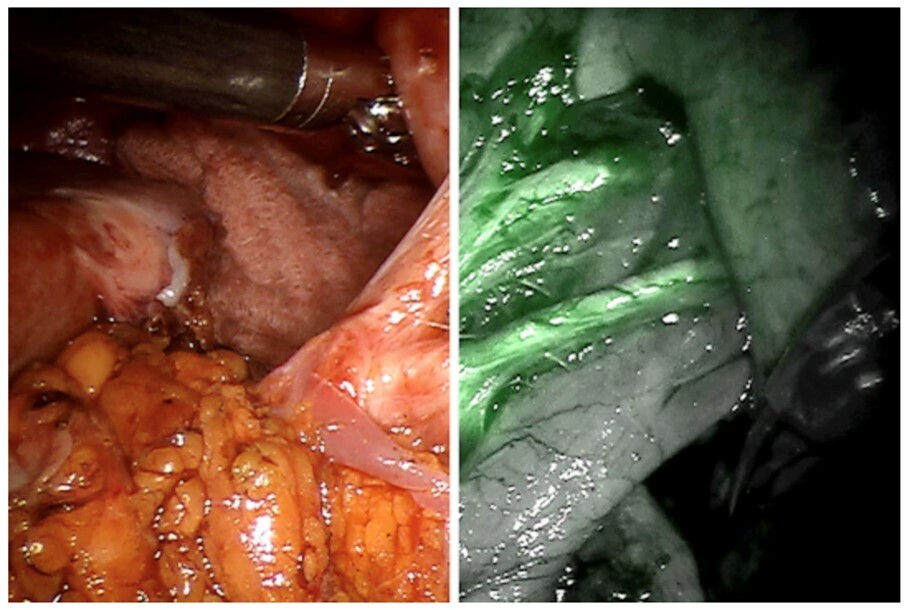
Le robot chirurgical peut également fournir une imagerie endoscopique par fluorescence en temps réel. Grâce à cette technologie, le chirurgien peut procéder, lors de l’acte chirurgical, à une évaluation visuelle des vaisseaux, du flux sanguin et de la perfusion tissulaire par une image dans le proche infrarouge (fig. 2). La biopsie du ganglion sentinelle pelvien par fluorescence constitue l’une des avancées possibles.8 Cette procédure s’effectue sous cœlioscopie classique ou robotique. La méthode la plus courante consiste à injecter un produit de contraste fluorescent – le vert d’indocyanine – dans le col utérin avant le début de l’intervention. Les ganglions sentinelles pelviens deviennent fluorescents et peuvent être prélevés de manière sélective grâce à un module spécifique intégré au robot chirurgical. La fluorescence peut aussi être utilisée dans les actes de résection rectale. Elle présente un intérêt en particulier pour évaluer la vascularisation des anastomoses digestives en cours d’intervention et prévenir le risque de fuite anastomotique.9 Un autre aspect prometteur est l’utilisation de ce traceur sanguin pour repérer le réseau vasculaire propre à la tumeur durant l’intervention. Plus particulièrement lors d’un geste de néphrectomie partielle, le chirurgien bénéficie en direct d’une vision en réalité augmentée, avec des renseignements issus de la fusion des images réelles et des images virtuelles en fluorescence. Lorsque les vaisseaux sont liés, la tumeur devient noire et le reste du parenchyme rénal normal vascularisé apparaît en fluorescence. Cette technique permet de préserver un maximum de parenchyme rénal sain.
Chirurgie guidée par l’image et modélisation tridimensionnelle
Le robot chirurgical permet aussi d’intégrer l’imagerie médicale pour mieux visualiser l’espace réduit dans lequel il est possible d’opérer. Mais, surtout, il applique des algorithmes pour visualiser les images acquises en préopératoire afin de guider le déroulement de l’intervention. En effet, la chirurgie robotique tient compte de multiples flux d’information, y compris des techniques d’imagerie avancées, dans une expérience immersive au niveau de la console robotique. La modélisation et l’intégration des images dans le champ opératoire ont été ajoutées dans la console chirurgicale. Cette technologie facilite la réalisation de gestes de segmentectomie pulmonaire robotisés guidés par l’image, améliorant la sécurité et la fiabilité des procédures, avec une parfaite précision anatomique opératoire.10 Des procédés similaires d’impression tridimensionnelle et de réalité augmentée sont développés en chirurgie urologique carcinologique. La chirurgie conservatrice pour tumeur du rein impose, pour une préservation optimale du parenchyme sain et une exérèse tumorale en marges saines, une bonne appréhension de l’anatomie spécifique du cas. Il existe des méthodes de modélisation en 3D du rein tumoral, et son utilisation peropératoire guide l’acte chirurgical. Cette modélisation en 3D est un outil utile fournissant une planification préopératoire et une visualisation avec une navigation peropératoire avancée pour influencer la prise de décision lors de néphrectomies partielles par voie robotique.11
Innovations périopératoires : réhabilitation accélérée après chirurgie
La plupart de ces interventions en chirurgie robotique sont encadrées par un programme de réhabilitation accélérée après chirurgie (RAAC). Celle-ci a été décrite dans les années 1990 par le Pr Henrik Kehlet, chirurgien digestif danois, d’abord en chirurgie colique. Cette prise en charge périopératoire s’est rapidement étendue à toutes les spécialités. Il s’agit d’une approche pluridisciplinaire autour des périodes pré-, per- et postopératoires. En 2016, la Haute Autorité de santé définissait la RAAC comme une approche de prise en charge globale du patient favorisant un rétablissement précoce de ses capacités après la chirurgie. Il s’agit d’un protocole pour lequel toutes les étapes sont rédigées préalablement et dont l’application suit un parcours précis. Durant la totalité de ce parcours clinique, le patient est acteur de ses soins. Les principaux objectifs de la RAAC sont d’améliorer les suites opératoires et le vécu des patients tout en diminuant les complications, en raccourcissant les durées de séjour et en accélérant le retour à l’état physique et psychologique initial.12 Tous les patients opérés suivent un parcours clinique standard, débutant en consultation de chirurgie. En postopératoire, ils bénéficient du protocole RAAC quelle que soit l’intervention ou la voie d’abord utilisée (vidéochirurgie ou voie ouverte). Les équipes médicales et paramédicales sont formées et organisent la mobilisation précoce, la réalimentation rapide, le contrôle de la douleur pour un retour à l’état physiologique rapide et bien toléré. Ce sont les étapes clés du parcours postopératoire du patient. La littérature concernant la RAAC a établi une supériorité de l’application de cette procédure par rapport aux soins conventionnels pour une grande variété d’interventions chirurgicales (chirurgie colorectale, gynécologique, thoracique, orthopédique…), avec des avantages économiques substantiels.
Innovations pédagogiques : simulation chirurgicale
La simulation en santé correspond à l’utilisation d’un matériel, de la réalité virtuelle ou d’un patient dit « standardisé » pour reproduire des situations ou des environnements de soins, pour enseigner des procédures diagnostiques et thérapeutiques et permettre de répéter des processus, des situations cliniques ou des prises de décision par un professionnel de santé ou une équipe professionnelle. L’ensemble des gestes chirurgicaux est accessible à la simulation, du plus simple au plus complexe, en chirurgie ouverte, en cœlioscopie et en robotique.
Le robot chirurgical est équipé d’un logiciel qui permet d’élaborer des programmes d’apprentissage en chirurgie robotique de sorte que les étudiants chirurgiens puissent acquérir cette compétence dès leur formation initiale.13
Les nouvelles plateformes d’assistance robotique favorisent l’apprentissage des internes et des assistants grâce à la double console et au simulateur. Elles facilitent également la formation chirurgicale et accélèrent l’apprentissage des chirurgiens.
Apports indéniables du robot chirurgical en oncologie
Dans le domaine de la chirurgie oncologique, le robot chirurgical permet de repousser les limites de la cœlioscopie, d’optimiser et démocratiser cette chirurgie difficile et de faciliter son accès aux plus jeunes chirurgiens.
2. Zureikat AH, Moser AJ, Boone BA, et al. 250 robotic pancreatic resections: Safety and feasibility. Ann Surg 2013;258(4):554‑9; discussion:559-62.
3. Ficarra V, Novara G, Artibani W, et al. Retropubic, laparoscopic, and robot-assisted radical prostatectomy: A systematic review and cumulative analysis of comparative studies. Eur Urol 2009;55(5):1037‑63.
4. Haga N, Miyazaki T, Tsubouchi K, et al. Comprehensive approach for preserving cavernous nerves and erectile function after radical prostatectomy in the era of robotic surgery. Int J Urol 2021;28(4):360‑8.
5. Hinshaw SJ, Gunderson S, Eastwood D, et al. Endometrial carcinoma: The perioperative and long-term outcomes of robotic surgery in the morbidly obese. J Surg Oncol 2016;114(7):884‑7.
6. Lindfors A, Åkesson Å, Staf C, et al. Robotic vs open surgery for endometrial cancer in elderly patients: Surgical outcome, survival, and cost analysis. Int J Gynecol Cancer 2018;28(4):692‑9.
7. Hotton J, Bogart E, Le Deley MC, et al. Ergonomic assessment of the surgeon’s physical workload during robot-assisted versus standard laparoscopy in a french multicenter randomized trial (ROBOGYN-1004 Trial). Ann Surg Oncol 2023;30(2):916‑23.
8. Rossi EC, Kowalski LD, Scalici J, et al. A comparison of sentinel lymph node biopsy to lymphadenectomy for endometrial cancer staging (FIRES trial): A multicentre, prospective, cohort study. Lancet Oncol 2017;18(3):384‑92.
9. Lucarini A, Guida AM, Orville M, et al. Indocyanine green fluorescence angiography could reduce the risk of anastomotic leakage in rectal cancer surgery: A systematic review and meta-analysis of randomized controlled trials. Colorectal Dis 2024;26(3):408‑16.
10. Baste JM, Soldea V, Lachkar S, et al. Development of a precision multimodal surgical navigation system for lung robotic segmentectomy. J Thorac Dis 2018;10(Suppl 10):S1195‑204.
11. Wake N, Bjurlin MA, Rostami P, et al. Three-dimensional printing and augmented reality: Enhanced precision for robotic assisted partial nephrectomy. Urology 2018;116:227‑8.
12. Lambaudie E, de Nonneville A, Brun C, et al. Enhanced recovery after surgery program in gynaecologic oncological surgery in a minimally invasive techniques expert center. BMC Surg 2017;17(1):136.
13. Hubert J. Chirurgie assistée par robot : principes et indications ; formation et évaluation des compétences. Bulletin de l’Académie nationale de médecine 2017;201(7):1045‑57.