Dans le cadre de la prise en charge des cancers, la radiothérapie joue un rôle central, constituant une modalité de traitement utilisée chez plus de la moitié des patients à un moment de leur parcours thérapeutique. Bien qu’elle soit une composante essentielle des soins oncologiques, ses aspects techniques et ses évolutions récentes demeurent souvent méconnus des médecins non oncologues, qui participent pourtant activement à l’accompagnement des patients, notamment dans les phases de diagnostic, de suivi et de gestion des effets indésirables. Les innovations majeures en radiothérapie reposent sur des avancées technologiques. Renforcer les connaissances des professionnels de santé non oncologues améliore la communication et la coordination au sein des équipes multidisciplinaires, garantissant ainsi une prise en charge plus cohérente et centrée sur les besoins des patients.
Nouvelles indications de la radiothérapie
En complément des indications classiques de la radiothérapie,1 deux indications innovantes ont émergé ces dernières années : la prise en charge des maladies oligométastatiques et la réirradiation.
Maladies oligométastatiques
La maladie oligométastatique concerne des patients ayant, en plus de leur maladie primitive, un nombre limité de métastases (classiquement 5 ou moins), soit dès le diagnostic, soit au cours de l’évolution. Le paradigme oligométastatique suppose qu’un contrôle durable de la maladie puisse être obtenu si toutes les localisations métastatiques sont traitées localement. L’essai COMET, étude randomisée de phase II avec suivi prolongé, a démontré que l’ajout de la radiothérapie aux traitements systémiques standard permet une amélioration significative de la survie globale à cinq ans (42,3 % contre 17,7 % ; p = 0,006), sans compromis sur la qualité de vie ni effets indésirables supplémentaires.2 Ces résultats renforcent l’intérêt de cette approche, bien que son application doive être nuancée selon les localisations.
Réirradiation
La réirradiation constitue une autre indication innovante, bien que peu récente, ses premières applications remontant à plus de trente ans. Cette pratique consiste à irradier une même région plusieurs fois. Elle connaît une montée en fréquence grâce aux avancées technologiques qui permettent de mieux épargner les tissus sains tout en ciblant efficacement la tumeur. La réirradiation est particulièrement pertinente pour traiter des récidives locales ou des cancers primitifs secondaires survenant dans des régions déjà irradiées, en l’absence de métastases évolutives. Cependant, elle s’accompagne de défis importants : sélection des patients, définition précise des volumes cibles, sommation des doses des irradiations successives et choix des techniques les plus adaptées.1
Innovations pour la définition des volumes cibles et des tissus sains
Il existe des atlas de contourage issus de consensus internationaux, servant de guides pour la délinéation des volumes cibles et des tissus sains.3,4 Pourtant, la définition précise de ces volumes reste une tâche complexe. La variabilité entre observateurs constitue encore une problématique importante.5 Pour répondre aux défis du contourage manuel, la dernière décennie a vu l’émergence d’algorithmes fondés sur l’intelligence artificielle (en particulier le « deep learning ») qui visent à automatiser et améliorer la segmentation des volumes cibles et des tissus sains.6 Ces innovations offrent un bénéfice notable pour la radiothérapie, car elles permettent de renforcer la précision et la reproductibilité dans la délinéation de ces structures. Par exemple, une étude récente a développé un algorithme de « deep learning » en utilisant les données de 150 patients atteints de cancer de l’oropharynx. Cet algorithme a été conçu pour segmenter les volumes tumoraux à partir de différentes modalités d’imagerie, notamment la tomodensitométrie par émission de positons (TEP), et a atteint une performance impressionnante, avec un indice de similarité de 81 % comparé aux contours réalisés par des experts.7 De plus, une étude randomisée récente a démontré que l’utilisation d’un modèle personnalisé de « deep learning » pour la segmentation automatique des tissus sains permet de réduire le temps de contourage de 76 %, tout en offrant une précision améliorée par rapport aux méthodes manuelles.8 La supervision humaine reste néanmoins essentielle pour garantir que les volumes segmentés sont adaptés à la situation clinique de chaque patient, réduisant ainsi le risque d’erreurs et de sous- ou surestimation des volumes à traiter.
Prise en compte des mouvements de la tumeur liés à la respiration
Certaines tumeurs sont sensibles aux mouvements respiratoires, comme celles du poumon, du sein ou du foie. Pour prendre en compte les déplacements tumoraux liés à la respiration, plusieurs techniques ont été développées au cours des vingt dernières années .9
La première méthode consiste à réaliser plusieurs scanners à différents moments du cycle respiratoire, une technique appelée scanner 4D ou 4D-CT. Cette approche permet de cartographier les positions de la tumeur au cours du cycle respiratoire et d’intégrer ces informations lors de la définition des volumes cibles. Le 4D-CT peut également être utilisé pour traiter la tumeur uniquement à certains moments précis du cycle respiratoire, une technique appelée « gating » respiratoire.
Une autre méthode repose sur l’apprentissage par le patient d’un blocage respiratoire à un moment spécifique du cycle respiratoire, technique connue sous le nom de blocage respiratoire en inspiration profonde (« deep inspiration breath hold », DIBH). Cette méthode est particulièrement utilisée pour les cancers du sein gauche10 et les lymphomes de Hodgkin afin de réduire l’exposition du cœur et des poumons aux radiations.
Enfin, des techniques modernes permettent de suivre la tumeur en temps réel pendant le traitement, une approche appelée « tracking ».11 Ces systèmes d’asservissement respiratoire ajustent en permanence le faisceau de traitement pour cibler la tumeur malgré ses mouvements, offrant ainsi une précision accrue et une meilleure préservation des tissus sains environnants.
Avancées des techniques de radiothérapie
Les techniques de radiothérapie ont considérablement évolué au cours des dernières décennies, permettant le développement de techniques avancées visant à améliorer la précision des traitements tout en réduisant les complications.
Radiothérapie conformationnelle avec modulation d’intensité
La radiothérapie conformationnelle avec modulation d’intensité (RCMI, « intensity-modulated radiation therapy », IMRT) permet de moduler l’intensité du faisceau de rayonnement pour l’adapter précisément à la forme de la tumeur. Cette technique offre la possibilité d’administrer des doses élevées tout en épargnant les organes voisins. Par exemple, dans les cancers de la tête et du cou, l’IMRT a démontré sa capacité à réduire les complications en limitant l’exposition des structures critiques comme les glandes salivaires et la moelle épinière. Une étude randomisée récente a montré l’intérêt clinique de cette technique pour protéger de façon optimale les muscles constricteurs du pharynx et ainsi réduire le risque de dysphagie chez les patients traités pour un cancer de l’oropharynx.12
Radiothérapie stéréotaxique
La radiothérapie stéréotaxique, utilisée pour des cibles tumorales petites et bien définies, offre une précision submillimétrique et nécessite un nombre réduit de séances. On distingue la radiothérapie stéréotaxique extracrânienne (SBRT), adaptée aux tumeurs localisées dans les poumons ou le foie, et la radiochirurgie stéréotaxique, pour les cibles intracrâniennes telles que les tumeurs cérébrales. Cette technique d’irradiation est en particulier utilisée, comme mentionné précédemment, pour le traitement des patients ayant une maladie oligométastatique.2
Curiethérapie
La curiethérapie reste une technique essentielle, particulièrement dans le traitement des cancers gynécologiques. Cette approche consiste à placer des sources radioactives directement dans ou à proximité de la tumeur. La curiethérapie offre une distribution de dose hautement localisée, minimisant l’exposition des tissus environnants. Elle peut être administrée en mode haute dose (HDR), sur plusieurs courtes séances, ou basse dose (LDR), avec une exposition prolongée sur plusieurs jours.13
Radiothérapie FLASH dans un futur proche ?
Une innovation prometteuse, encore en phase expérimentale, est la radiothérapie FLASH, qui délivre des doses de rayonnement ultra-élevées en une fraction de seconde. Cette technologie pourrait considérablement réduire les toxicités sur les tissus sains tout en maintenant une efficacité tumorale élevée. Des études précliniques ont montré que FLASH pourrait élargir la fenêtre thérapeutique, permettant de délivrer des doses plus élevées sans accroître les complications.14 Si elle est encore en phase de recherche, la radiothérapie FLASH pourrait devenir une avancée majeure, notamment pour les cancers situés à proximité d’organes critiques, comme les tumeurs cérébrales, pulmonaires ou de la tête et du cou.
Délivrance du traitement de plus en plus précise
La délivrance du traitement en radiothérapie repose sur une précision millimétrique, indispensable pour maximiser l’efficacité sur la tumeur tout en minimisant l’exposition des tissus sains. Les incertitudes liées au repositionnement quotidien, dues aux mouvements du patient ou à des variations anatomiques, représentent un défi majeur dans la pratique clinique. Pour y répondre, des innovations récentes dans les systèmes de radiothérapie guidée par l’image ont révolutionné la prise en charge, en permettant une localisation et un alignement précis des volumes avant chaque séance.
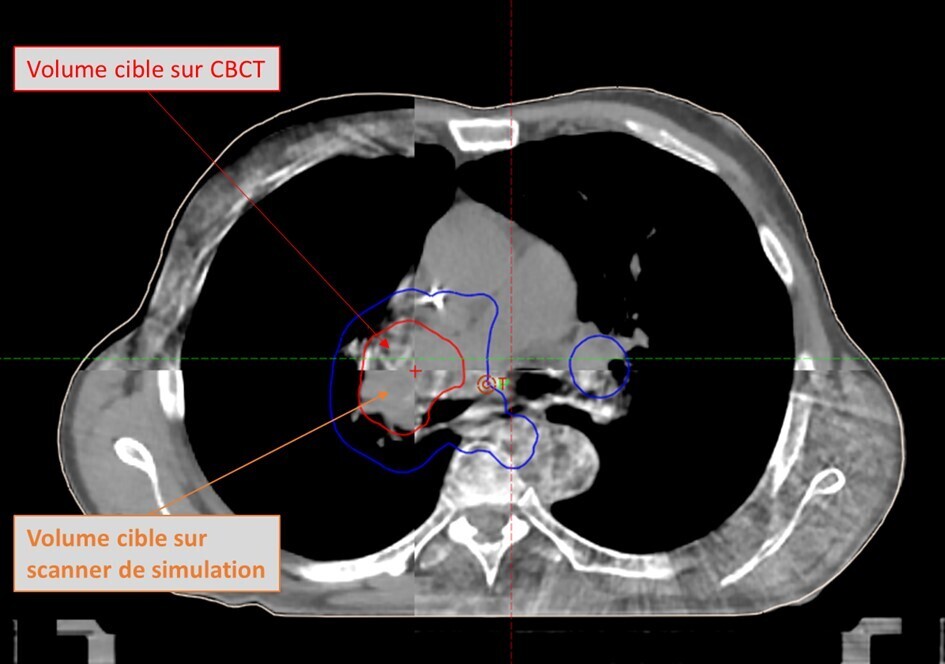
Tomographie par faisceau conique
Parmi ces avancées, la tomographie par faisceau conique (CBCT : Cone beam computed tomography) joue un rôle central en réduisant les marges entre le volume cible clinique (CTV) et le volume cible planifié (PTV).1 Cette réduction des marges permet de diminuer la dose au niveau des tissus sains tout en assurant une couverture optimale de la tumeur. Historiquement, la qualité d’image des CBCT classiques était inférieure à celle des scanners pour la planification. Cette limite entravait une délinéation précise des tumeurs et des tissus sains ainsi qu’un calcul optimal des doses. Les technologies CBCT de nouvelle génération (figure) ont considérablement amélioré la qualité d’image en matière de résolution spatiale, de réduction des artefacts et de précision des calculs de dose, rendant ces systèmes désormais adaptés à la personnalisation quotidienne des traitements.15
Radiothérapie guidée par IRM
Parallèlement, la radiothérapie guidée par imagerie par résonance magnétique (IRM) [MRgRT] représente une autre avancée majeure, intégrant une IRM en temps réel à la délivrance des rayons. Cette technologie permet des adaptations quotidiennes encore plus précises, notamment pour les tumeurs situées près d’organes critiques ou dans des zones sujettes à des variations anatomiques importantes, comme les cancers de la tête et du cou16 ou les adénocarcinomes de la prostate. La MRgRT se distingue par une qualité d’image supérieure pour les tissus mous, permettant une délinéation précise des volumes et une réduction significative de l’exposition des tissus sains grâce à des ajustements journaliers. Bien que la MRgRT nécessite des ressources importantes et soit plus chronophage, ses bénéfices en matière de personnalisation des traitements et de réduction des effets indésirables en font une technologie intéressante, notamment dans les situations complexes comme la réirradiation.
Gains en précision et personnalisation de la radiothérapie
Les avancées technologiques en radiothérapie ont transformé cette modalité de traitement, offrant des solutions toujours plus précises et personnalisées pour la prise en charge des patients atteints de cancer. Qu’il s’agisse de nouvelles indications comme la maladie oligométastatique ou la réirradiation, des innovations dans la définition des volumes cibles, la prise en compte des mouvements respiratoires ou encore les systèmes de délivrance tels que le CBCT et la MRgRT, ces progrès permettent de maximiser l’efficacité tout en minimisant les toxicités.
2. Palma DA, Olson R, Harrow S, et al. Stereotactic ablative radiotherapy for the comprehensive treatment of oligometastatic cancers: Long-term results of the SABR-COMET phase II randomized trial. J Clin Oncol 2020;38(25):2830‑8.
3. Grégoire V, Evans M, Le QT, et al. Delineation of the primary tumour Clinical Target Volumes (CTV-P) inlaryngeal, hypopharyngeal, oropharyngeal and oral cavity squamous cell carcinoma: AIRO, CACA, DAHANCA, EORTC, GEORCC, GORTEC, HKNPCSG, HNCIG, IAG-KHT, LPRHHT, NCIC CTG, NCRI, NRG Oncology, PHNS, SBRT, SOMERA, SRO, SSHNO, TROG consensus guidelines. Radiother Oncol 2018;126(1):3‑24.
4. Brouwer CL, Steenbakkers RJHM, Bourhis J, et al. CT-based delineation of organs at risk in the head and neck region: DAHANCA, EORTC, GORTEC, HKNPCSG, NCIC CTG, NCRI, NRG Oncology and TROG consensus guidelines. Radiother Oncol 2015;117(1):83‑90.
5. Guzene L, Beddok A, Nioche C, et al. Assessing interobserver variability in the delineation of structures in radiation oncology: A systematic review. Int J Radiat Oncol Biol Phys 2022;S0360-3016(22)03551-9.
6. Savjani RR, Lauria M, Bose S, et al. Automated tumor segmentation in radiotherapy. Semin Radiat Oncol 2022;32(4):319‑29.
7. Bollen H, Willems S, Wegge M, et al. Benefits of automated gross tumor volume segmentation in head and neck cancer using multi-modality information. Radiother Oncol 2023;182:109574.
8. Lucido JJ, DeWees TA, Leavitt TR, et al. Validation of clinical acceptability of deep-learning-based automated segmentation of organs-at-risk for head-and-neck radiotherapy treatment planning. Front Oncol 2023;13:1137803.
9. Dieterich S, Green O, Booth J. SBRT targets that move with respiration. Phys Med 2018;56:19‑24.
10. Bergom C, Currey A, Desai N, et al. Deep inspiration breath hold: Techniques and advantages for cardiac sparing during breast cancer irradiation. Front Oncol 2018;8:87.
11. Salari E, Wang J, Wynne JF, et al. Artificial intelligence-based motion tracking in cancer radiotherapy: A review. J Appl Clin Med Phys 2024;25(11):e14500.
12. Nutting C, Finneran L, Roe J, et al. Dysphagia-optimised intensity-modulated radiotherapy versus standard intensity-modulated radiotherapy in patients with head and neck cancer (DARS): A phase 3, multicentre, randomised, controlled trial. Lancet Oncol 2023;24(8):868‑80.
13. Chargari C, Deutsch E, Blanchard P, et al. Brachytherapy: An overview for clinicians. CA Cancer J Clin 2019;69(5):386‑401.
14. Favaudon V, Caplier L, Monceau V, et al. Ultrahigh dose-rate FLASH irradiation increases the differential response between normal and tumor tissue in mice. Science Translational Medicine 2014;6(245):245ra93-245ra93.
15. Kunnen B, van de Schoot AJAJ, Fremeijer KP, et al. The added value of a new high-performance ring-gantry CBCT imaging system for prostate cancer patients. Radiother Oncol 2024;200:110458.
16. Bruijnen T, Stemkens B, Terhaard CHJ, et al. Intrafraction motion quantification and planning target volume margin determination of head-and-neck tumors using cine magnetic resonance imaging. Radiother Oncol 2019;130:82‑8.
Dans cet article
- Nouvelles indications de la radiothérapie
- Innovations pour la définition des volumes cibles et des tissus sains
- Prise en compte des mouvements de la tumeur liés à la respiration
- Avancées des techniques de radiothérapie
- Délivrance du traitement de plus en plus précise
- Gains en précision et personnalisation de la radiothérapie