La maladie rénale chronique (MRC) étant une maladie silencieuse, le nombre de patients qui en sont atteints est sous-estimé. Pourtant, son dépistage et son diagnostic par le médecin généraliste permettent de mettre en place un suivi adapté – la « néphroprotection » – et ainsi retarder le moment, pour les cas les plus sévères, où il sera nécessaire de débuter un traitement de suppléance. Cet article propose un tour d’horizon des différentes options thérapeutiques et propose de s’appuyer sur le réseau ville-hôpital, en s’accordant sur une prise en soins multidisciplinaire centrée sur le patient et adaptée aux différentes étapes de la maladie.
Accompagnement multidisciplinaire
Dans son guide du parcours de soins, la Haute Autorité de santé (HAS) a émis des recommandations de suivi des patients atteints de MRC :
- aux stades précoces ou pour les formes stables, une prise en charge par le médecin généraliste avec un suivi clinique et biologique (créatininémie, ionogramme sanguin à la recherche d’hyperkaliémie et d’acidose métabolique, calcémie, phosphorémie, rapport protéinurie/créatinurie dans un échantillon urinaire, hémogramme à la recherche d’une anémie) ;
- aux stades avancés ou dans les formes progressives avec risque d’évolution vers le stade 5 de l’insuffisance rénale chronique (le plus sévère), la prise en charge est coordonnée par le néphrologue en lien avec une équipe pluridisciplinaire (infirmier en pratique avancée [IPA], psychologue, diététicien, assistant social, gériatre parfois et infirmier coordinateur de greffe s’il y a un projet de transplantation) et même un système de télésurveillance (dès le stade 4, correspondant à un débit de filtration glomérulaire [DFG] inférieur à 30 mL/min).
Alors que, pour la majorité des patients, la MRC est liée à une pathologie chronique connue (hypertension artérielle, diabète, polykystose rénale, etc.), dans les faits, la dialyse est démarrée en urgence dans près d’un tiers des cas en France. Cela montre la marge importante de progression de l’ensemble des acteurs et du parcours de soins.
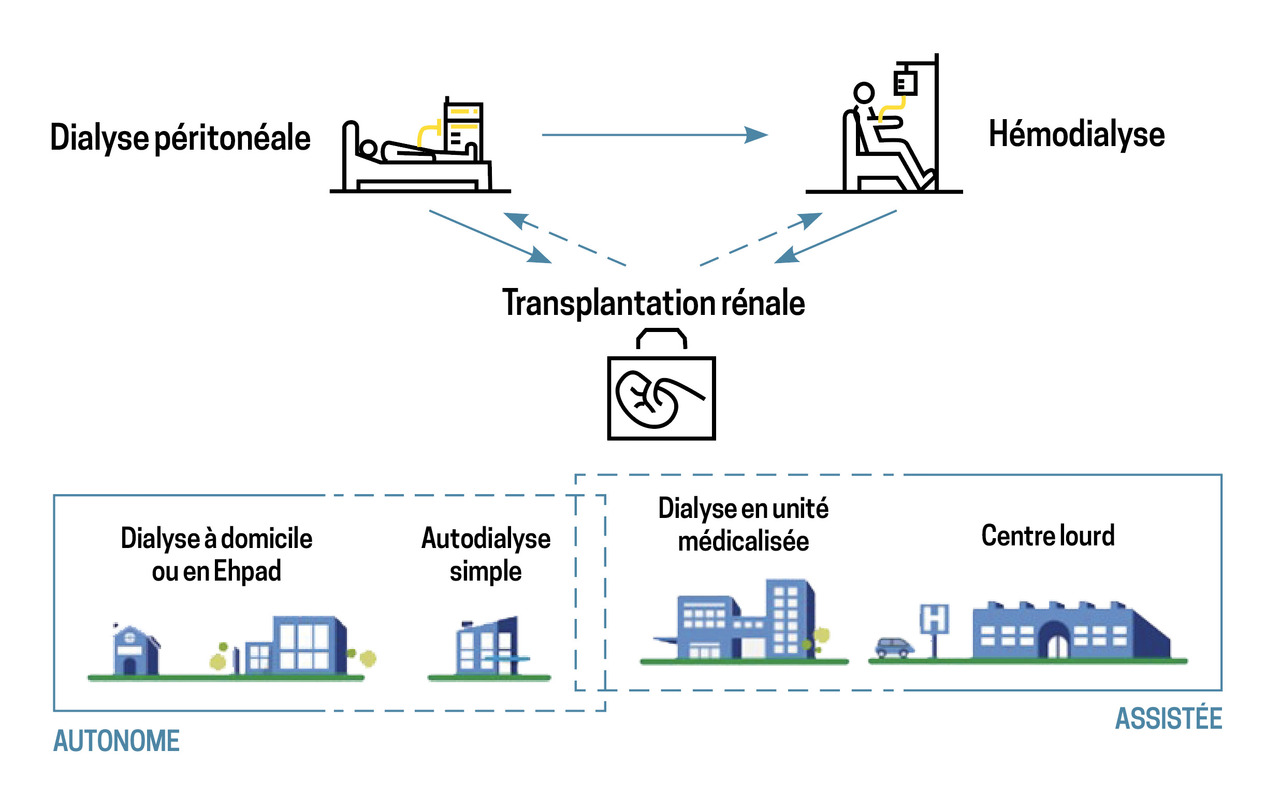
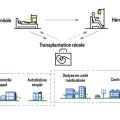
Le médecin généraliste joue un rôle central dans ce parcours de MRC, par exemple en orientant les patients au bon moment vers les équipes spécialisées en néphrologie et en assurant un lien continu avec elles. Il devrait aussi prendre toute sa place dans la concertation pluridisciplinaire sur le choix du traitement de suppléance : dialyse, transplantation rénale ou traitement conservateur (fig. 1).1
Quel mode de suppléance pour qui ?
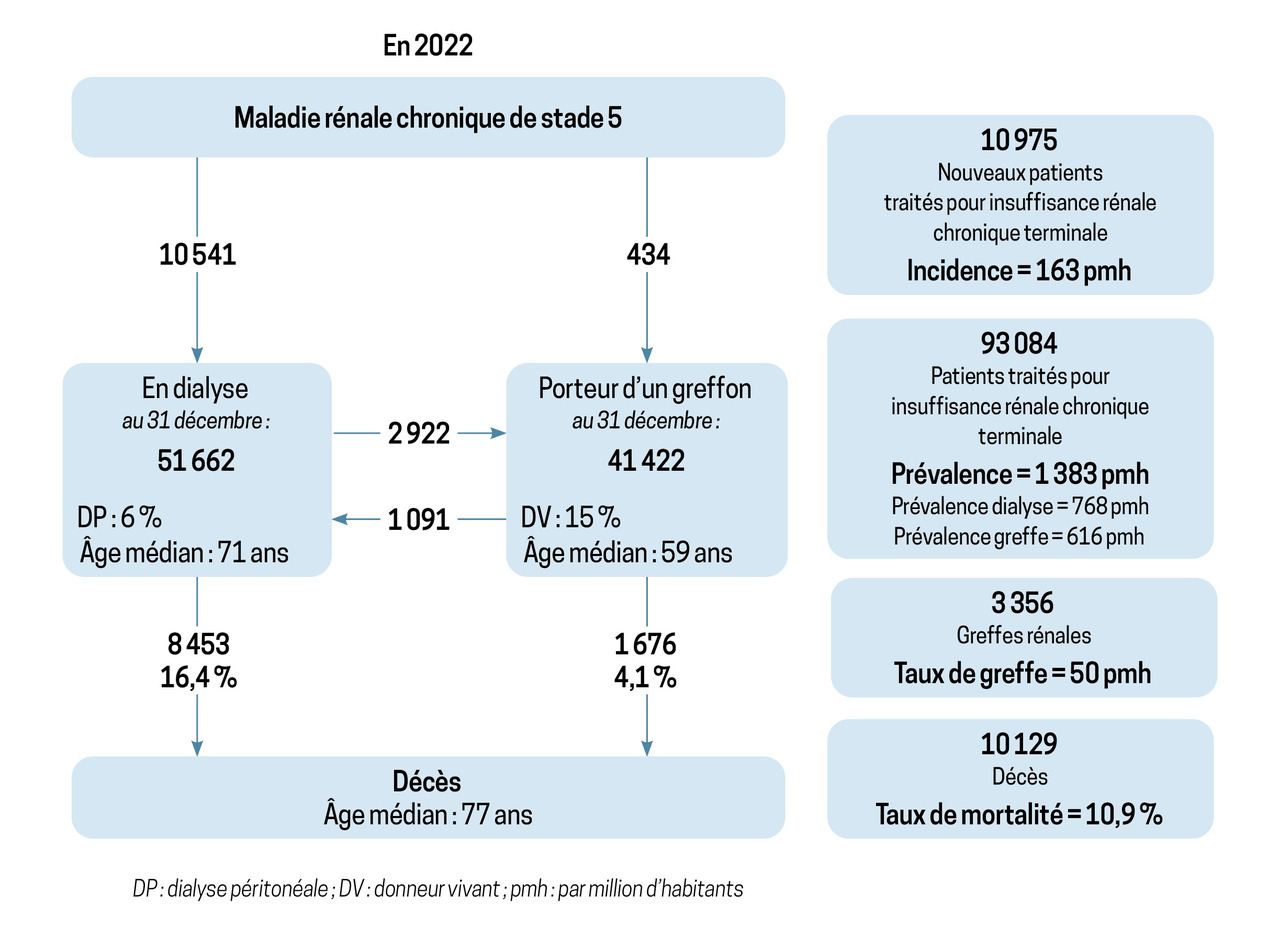
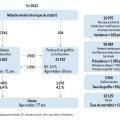
Deux types de dialyse sont possibles : l’hémodialyse et la dialyse péritonéale. Elles sont aussi efficaces l’une que l’autre. D’après le rapport annuel du registre REIN, il y avait 51 662 patients dialysés en 2022 (fig. 2). La première modalité de traitement restait de loin l’hémodialyse (94 % contre 6 % pour la dialyse péritonéale). Parmi les patients hémodialysés, seuls 16,8 % avaient adopté une technique dite « autonome » (autodialyse, dialyse à domicile).
À l’approche du besoin de suppléance, il est proposé de mettre en place :
- une information impartiale sur les différentes techniques de suppléance ;
- un soutien psychologique et social chaque fois que nécessaire ;
- une concertation pluridisciplinaire collégiale pour aider le patient à choisir le meilleur projet de soin.2
Les différentes modalités de dialyse se différencient par la voie d’abord, le lieu de réalisation de la dialyse et le degré d’autonomie du patient.
Hémodialyse : largement répandue
L’hémodialyse peut être réalisée selon différentes modalités, de la plus médicalisée à la plus autonome :
- l’hémodialyse « en centre » est réservée aux patients dont l’état de santé nécessite la présence permanente d’un médecin au cours de la séance. Le centre se situe au sein ou près d’un établissement de santé dit de « repli », permettant si besoin l’hospitalisation à temps complet du patient dans des lits de médecine (ou éventuellement de chirurgie) avec un accès à un service de réanimation et de radiologie. Elle constitue le mode le plus habituel (51,7 % des patients étaient hémodialysés en centre en 2022) ;
- l’hémodialyse en unité de dialyse médicalisée (UDM) est réservée aux patients dont l’état de santé nécessite une présence médicale non continue (une fois par semaine) ou qui ne peuvent ou ne souhaitent pas être pris en charge à domicile ou en unité d’autodialyse. En 2022, 26 % des patients étaient hémodialysés en UDM ;
- l’hémodialyse en unité d’autodialyse (UAD), technique simple, est réservée aux patients formés à la technique et en mesure d’assurer eux-mêmes les gestes nécessaires au traitement, avec l’assistance d’un infirmier. Il y avait 15,2 % des patients hémodialysés en UAD en 2022 ;
- l’hémodialyse à domicile est réservée aux patient formés, en mesure d’assurer couramment tous les gestes nécessaires à leur traitement en présence d’un aidant, à la condition d’une capacité suffisante de stockage du matériel de dialyse à domicile. Il y avait 1,5 % des patients hémodialysés ainsi en 2022.
Le choix des modalités d’hémodialyse les plus adaptées pour un patient donné est idéalement fait en concertation avec le patient lui-même, en tenant compte de son autonomie et de son mode de vie. La voie d’abord de référence est la fistule artérioveineuse (FAV), créée chirurgicalement sous anesthésie locale en anastomosant une artère et une veine du membre supérieur. Elle est réalisée par un chirurgien vasculaire au vu des résultats d’une cartographie doppler – effectuée par un radiologue spécialisé – en un ou deux temps. Elle doit être confectionnée suffisamment en amont du moment de la mise en place de la dialyse (plusieurs semaines avant). Elle permet de créer une veine de calibre et de débit suffisants (équivalents à une veine centrale) à l’efficacité de la dialyse.
L’alternative est la pose d’un cathéter d’hémodialyse transitoire (en cas d’urgence ou le temps que la fistule se développe) ou pérenne (tunnélisé sous la peau : l’orifice de sortie du cathéter est situé à distance de l’orifice de ponction de la veine jugulaire interne, pour diminuer le risque infectieux).
Une fistule artérioveineuse est définitive ; pour cette raison, elle n’est pas la voie d’abord de choix s’il existe un projet à court terme de transplantation rénale (c’est-à-dire, en pratique, si le patient a dans son entourage un candidat réaliste au don de rein).3
Dialyse péritonéale
La dialyse péritonéale (DP) concernait 5,6 % des patients dialysés en 2022. Elle utilise les capacités de filtration du péritoine pour filtrer le sang. Elle consiste à introduire (infuser) du liquide de dialyse (dialysat) dans la cavité péritonéale, d’attendre que les échanges s’effectuent (stase) à travers la membrane péritonéale, puis à vidanger (drainer) le dialysat avant de recommencer le cycle. Elle est réalisée de manière quotidienne par le patient lui-même, avec ou sans l’aide d’un tiers (aidant, infirmière), selon deux modalités :
- continue ambulatoire (DPCA) ou DP manuelle, avec quatre échanges par jour ;
- automatisée (DPA) réalisée la nuit grâce à une machine appelée cycleur et dont la mission est de remplir et vidanger l’abdomen du patient durant le sommeil.
La DP est une technique de domicile au sens large : il est tout à fait possible de la mettre en œuvre en Ehpad.1
Plusieurs raisons expliquent la faible proportion de patients traités par DP en France : peu de néphrologues en ont l’expertise (il y a donc un besoin de formation professionnelle) ; il existe des contre-indications (en cas d’antécédent de chirurgie abdominale lourde, par exemple) ; enfin, elle nécessite que le patient soit autonome et dispose d’un domicile permettant le stockage de matériel. Cette technique est néanmoins plus économique et plus à même de préserver l’autonomie des patients. Elle a vocation à se développer ; dans d’autres pays, elle est le premier recours exigé par les autorités de santé pour l’accès au remboursement du traitement de la MRC de stade 5.
Critères d’initiation de la dialyse
« À quel moment initier la dialyse ? » est souvent la première question posée par les patients en insuffisance rénale sévère, mais il est difficile d’y répondre. Il est aujourd’hui recommandé de ne l’initier qu’en présence de symptômes dits urémiques : intolérance alimentaire, polynévrite urémique, péricardite urémique, hyper-hydratation extracellulaire menaçante. Tous ces signes surviennent le plus souvent en dessous d’un DFG estimé inférieur à 6 - 10 mL/min/1,73 m².1
En pratique, ce sont rarement les chiffres qui déterminent le moment de l’initiation de la dialyse, mais plutôt un ensemble de signes biologiques et cliniques. Il est important de rappeler que le DFG est estimé sur la base de la concentration d’un marqueur – la créatininémie – qui dépend de la masse musculaire ; il convient ainsi d’être à l’écoute de ces signes plutôt que de se fier uniquement à un chiffre de DFG estimé qui n’est pas toujours le reflet de la réalité des besoins du patient.1
Choisir la non-dialyse ?
En 2015, la publication des recommandations KDIGO (Kidney Disease : Improving Global Outcomes) sur la prise en charge de la MRC de stade 5 a redonné une vraie place au traitement conservateur, au même titre que la suppléance par dialyse ou transplantation. Il n’y a pas de seuil d’âge pour lequel le choix de la non-dialyse ne peut être envisagé. Selon les recommandations KDIGO 2015, le traitement conservateur est indiqué lorsque l’espérance de vie est inférieure à trois à six mois et lorsque le néphrologue anticipe une intolérance au traitement par dialyse. Ce choix doit être fait par le patient, aidé de ses proches, après avoir reçu une information éclairée sur les différentes options de suppléance.
En 2021, la Société francophone de néphrologie, dialyse et transplantation (SFNDT) a formé un groupe de travail pour explorer toutes les dimensions du traitement conservateur et rédiger un guide aidant à la prise en charge de la maladie rénale chronique de stade 5 sans avoir recours à la dialyse ni à la transplantation. L’objectif était de prévenir et traiter les complications de l’insuffisance rénale sévère, notamment le syndrome urémique, et de proposer un accompagnement global du patient et de ses proches en mettant en place des soins à domicile adaptés à la situation. Cet accompagnement vise à améliorer la qualité de vie des patients à leur domicile grâce à une prise en charge active et pluri-disciplinaire (néphrologues, gériatres, médecins généralistes, médecins spécialisés en soins palliatifs, infirmiers, psychologues…).4
Transplantation rénale : sur quels critères ?
En l’absence de contre-indication, la transplantation est le traitement de suppléance le plus efficace et il s’avère rapidement moins coûteux que les techniques de dialyse. L’accès à la greffe ne fait pas intervenir la seule limite d’âge. Un bilan exhaustif et des consultations spécialisées permettent d’en évaluer la faisabilité et les risques. Le patient doit être en mesure de supporter une intervention chirurgicale ainsi qu’un traitement immunosuppresseur prescrit à vie. Ce traitement augmente le risque infectieux et tumoral : la balance bénéfice/risque doit donc être analysée au cas par cas. Le greffon peut provenir d’un donneur décédé (en mort cérébrale, ou en cas d’arrêt cardiaque programmé après une limitation des thérapeutiques actives en réanimation en raison d’un pronostic dépassé) ou d’un donneur vivant (apparenté ou non ; une personne pouvant justifier d’un lien étroit et stable avec le receveur depuis plus de deux ans peut se porter candidate). Si un donneur vivant est sélectionné car son état de santé le permet mais qu’il existe une incompatibilité immunologique avec le receveur, un don « croisé » peut être envisagé, chaque fois qu’un autre couple en France se trouve dans la même situation et que chacun des deux donneurs est compatible avec l’autre receveur.
Le patient peut être orienté vers une cellule de coordination prégreffe à tout moment :
- dès le stade 4 de la MRC, donc avant toute dialyse, et en pratique quand le DFG est inférieur à 20 mL/min /1,73 m², en vue d’une greffe préemptive (recommandations de la HAS) ;
- après le début de la dialyse ;
- après une greffe si le greffon n’est plus fonctionnel ou bientôt plus fonctionnel (réinscription préemptive).
Les patients volontaires avec une MRC irréversible, de stade 4 évolutif ou de stade 5, dialysés ou non, peuvent s’engager dans un parcours d’accès à la transplantation, sauf s’il existe une contre-indication absolue à la chirurgie vasculaire ou à un traitement immunosuppresseur.
Le recours à la transplantation n’est pas envisageable si les comorbidités entraînent un risque trop élevé et/ou si le bénéfice de la transplantation en matière d’espérance et de qualité de vie n’est pas attendu, ou si l’espérance de vie est limitée (âge très avancé, comorbidité sévère ou, le plus fréquemment, association de comorbidités). À l’issue du bilan prégreffe, l’équipe de transplantation rend un avis d’indication ou de contre-indication temporaire ou définitive à la transplantation.
Pour pouvoir bénéficier d’une transplantation rénale, l’inscription sur la liste nationale doit être effectuée par l’équipe du centre de transplantation. Des événements intercurrents dans le parcours médical du patient peuvent modifier son statut sur la liste (et être à l’origine d’une contre-indication temporaire, ou définitive). Chaque changement de statut sur la liste doit faire l’objet d’une information au patient.
L’actualisation des examens et consultations prétransplantation est programmée par la cellule de coordination prégreffe.1
Dialyse versus greffe : quels avantages et quels inconvénients ?
Considérations économiques mais aussi de qualité et d’espérance de vie : quelles sont les différences entre dialyse et greffe ?
Greffe de rein : la solution la plus économique
L’insuffisance rénale chronique terminale (IRCT) est une pathologie classée parmi les affections de longue durée : les patients qui en sont atteints bénéficient d’une prise en charge à 100 %.
Le montant moyen des dépenses par patient diffère beaucoup selon que celui-ci est dialysé ou porteur d’un greffon rénal. Si le patient est hémodialysé, la MRC de stade 5 est la pathologie la plus onéreuse pour le système de santé, devant la mucoviscidose, le cancer du poumon et l’accident vasculaire cérébral aigu.
En 2017, les dépenses d’assurance maladie liées à l’IRCT ont atteint 4,18 milliards d’euros, dont 3,36 milliards en lien avec la dialyse. Par comparaison, la transplantation rénale est à l’origine de 0,8 milliard d’euros de dépenses annuelles de santé, soit quatre fois moins ; or moins de la moitié des patients sont transplantés. Une fois passée la première année de transplantation, la surveillance et le suivi du patient stable sont beaucoup plus simples et moins coûteux (fig. 3).5
Qualité de vie
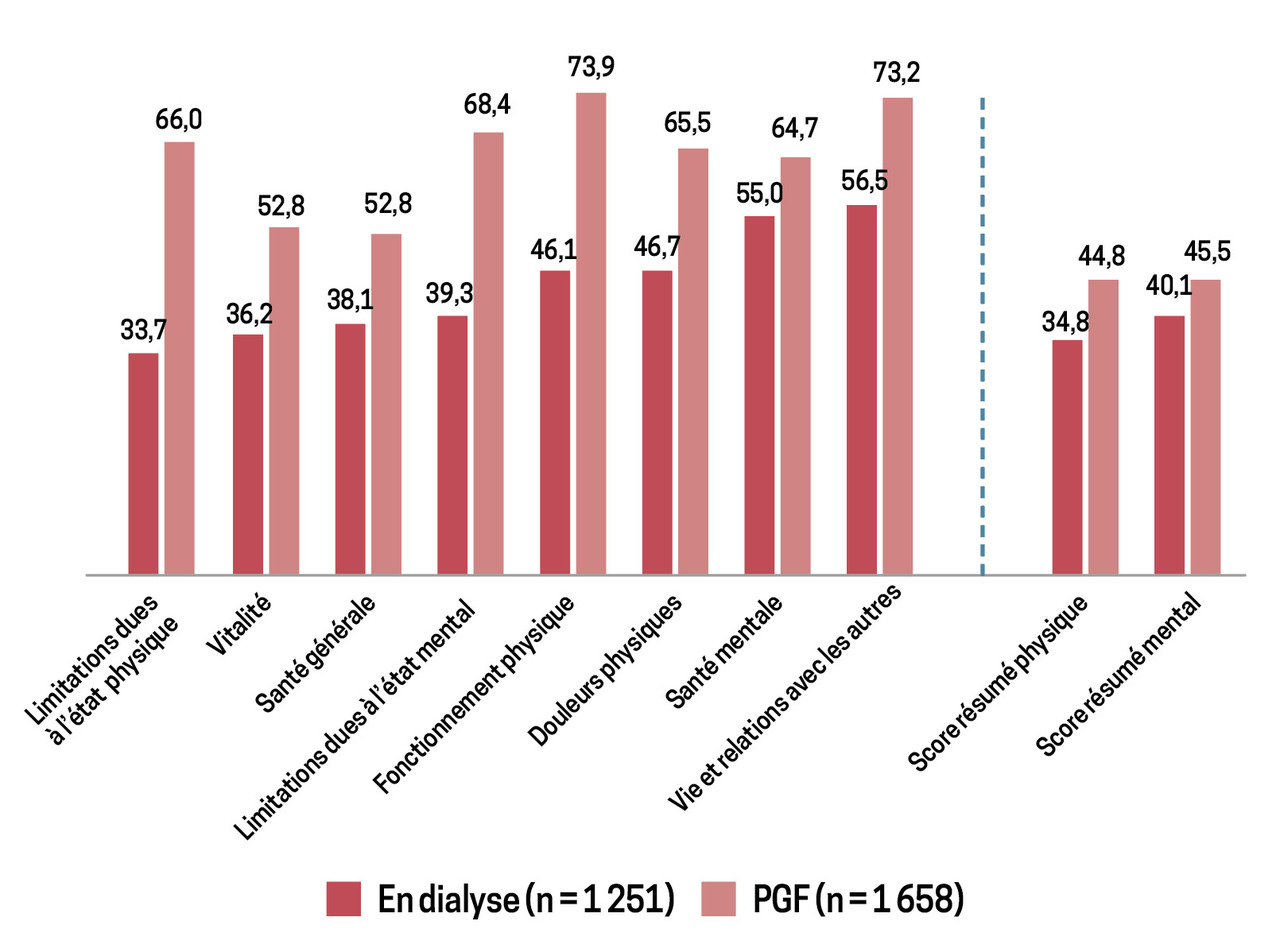
La maladie rénale chronique terminale est la seule pathologie à avoir fait l’objet en France de deux enquêtes transversales de qualité de vie.
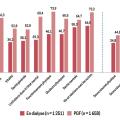
La dernière enquête, Quavi-REIN 2011, a été menée simultanément sur la greffe et la dialyse, auprès de 1 251 patients dialysés et 1 658 patients transplantés âgés de plus de 18 ans, dialysés ou greffés depuis plus d’un an. Elle a englobé différents critères, comme la santé générale, la douleur physique, la vie et les relations avec les autres, les traitements, les symptômes, etc.
Les scores de qualité de vie étaient plus élevés chez les greffés que chez les dialysés et se rapprochaient de ceux de la population générale. Les résultats montrent, après ajustement sur l’âge, le sexe et le nombre de comorbidités, que les dialysés inscrits sur liste d’attente ont une meilleure qualité de vie que les dialysés non inscrits. Les greffés préemptifs ont une meilleure qualité de vie que les malades greffés après avoir été dialysés (fig. 4).6
Espérance de vie
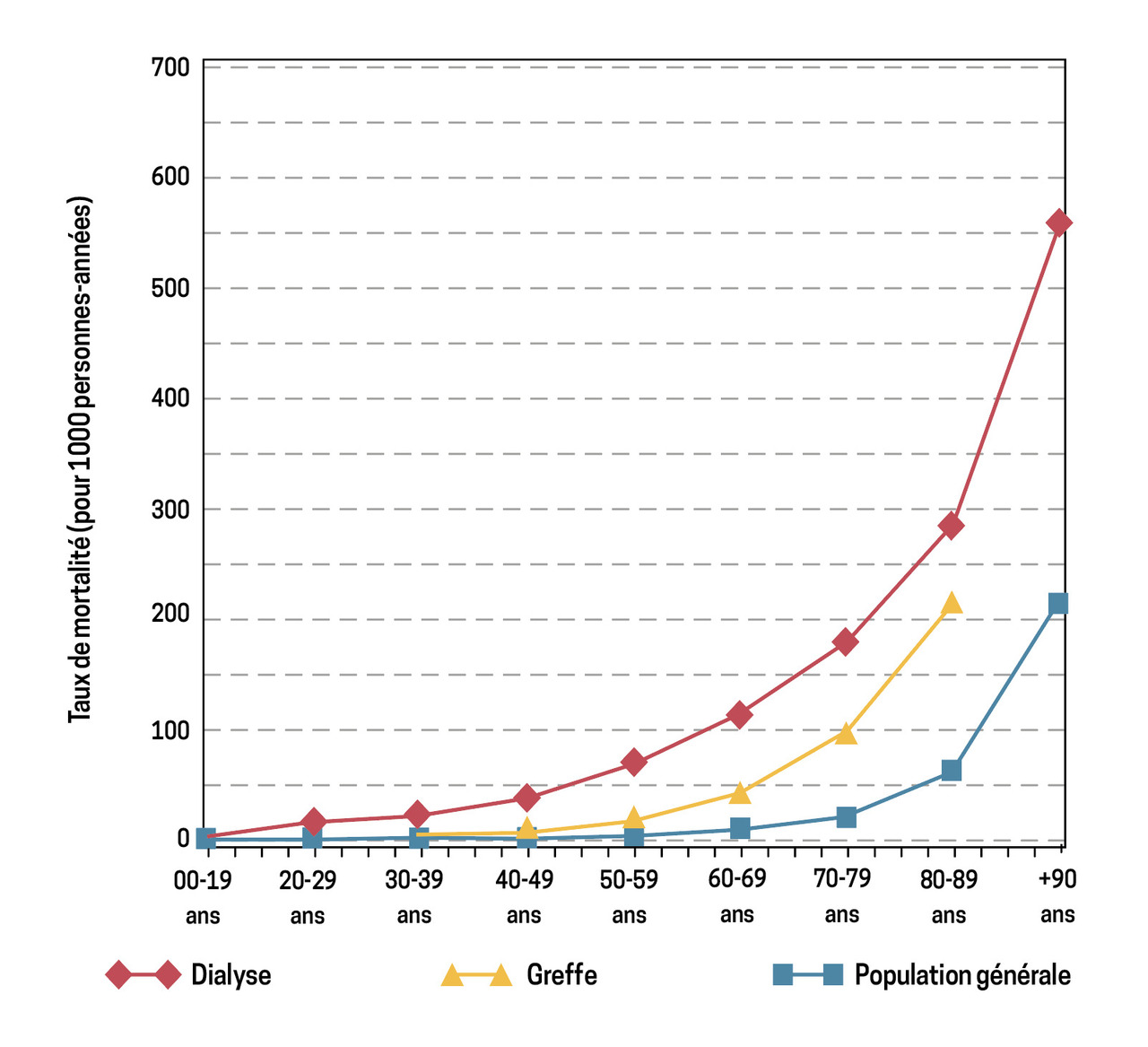
Par rapport à la population générale, l’espérance de vie des patients dialysés est réduite quel que soit l’âge des patients, mais elle est prolongée par la transplantation, jusqu’à 80 ans. Au-delà de cet âge, l’espérance de vie devient similaire entre patients greffés et patients dialysés (fig. 5).3
Suivi au long cours
Si la survie des greffons à un an est aujourd’hui de l’ordre de 90 %, elle atteint tout juste 60 % à dix ans et passe sous la barre des 50 % à quinze ans.
Comme les patients dialysés, ceux qui sont transplantés restent exposés à leurs comorbidités vasculaires (hypertension artérielle chronique et diabète, le plus souvent) et ont aussi une augmentation du risque infectieux et tumoral.
Le suivi post-transplantation constitue donc un véritable enjeu et ne porte pas seulement sur l’observance du traitement anti-rejet, indispensable pour assurer la survie maximale du greffon.3
Que dire à vos patients ?
Pour ralentir l’évolution de l’insuffisance rénale, des mesures de néphroprotection doivent être mises en place : contrôle de la pression artérielle, équilibre du diabète, alimentation pauvre en protéines et en sel (avec l’aide d’un diététicien), éviction des anti-inflammatoires non stéroïdiens même en topique, éviction du tabac et activité physique régulière.
Le suivi doit être rapproché et alterné entre le médecin traitant et le néphrologue afin de mieux prendre en charge les complications, préparer l’arrivée en dialyse et tout faire pour éviter de devoir la débuter en urgence.
Dès le stade 4 de la maladie rénale (DFG < 30 mL/min/1,73 m2), il existe un parcours renforcé comportant un suivi médical, infirmier, avec l’aide d’un diététicien et d’un psychologue si besoin, et des moyens de télésurveillance.
Il existe différentes options de traitement de l’insuffisance rénale terminale : transplantation, dialyses, traitement conservateur. L’équipe spécialisée en néphrologie informe le patient sur ces différentes options et l’accompagne dans son choix.
C’est au patient de choisir l’option thérapeutique la plus adaptée à son mode de vie, avec l’aide de son entourage, de son médecin traitant et de l’équipe pluridisciplinaire de néphrologie.
Il existe de nombreuses associations de patients : Renif, Renaloo, France Rein, AIRG-France, Association polykystose France.
2. HAS. Dispositif d’annonce d’insuffisance rénale avancée et de décision partagée sur le mode de suppléance. 2015,p. 1.
3. Agence de la biomédecine. Le rapport REIN. 2022. pp. 204, 256.
4. SFNDT. Traitement conservateur de la maladie rénale chronique stade 5 : guide pratique. pp. 155-6.
5. AFIDTN, AFU, SFNDT, SFT. Livre blanc de la transplantation rénale. 5 recommandations concrètes.pp. 11-12.
6. Briançon S, Speyer E, et al. Rapport Quavi-REIN. Agence de la biomédecine, 2011, pp. 19-22.

 Encadrés
Encadrés