La prévalence de la bronchopneumopathie chronique obstructive (BPCO) est de 5 à 12 % dans les pays à haut revenu.1 En France, la prévalence actuelle et les caractéristiques des patients atteints restent mal connues. En effet, les données les plus récentes datent de plus quinze ans ; une prévalence de 7,5 % était alors rapportée chez les adultes âgés de 45 ans et plus recrutés dans des centres de médecine préventive.2
Le diagnostic de BPCO est souvent trop tardif : selon l’étude de Kornmann et al., 58 % des patients nouvellement diagnostiqués ont déjà atteint un stade modéré à sévère.3 Et, selon les données les plus récentes de la Haute Autorité de santé (HAS), plus de deux tiers des patients atteints de BPCO ne sont pas diagnostiqués,4 une proportion similaire à celle retrouvée dans les études internationales.5
Les causes de ce retard diagnostique sont multifactorielles. La BPCO est une pathologie méconnue de la population générale, dont les symptômes sont souvent banalisés ou confondus avec d’autres pathologies telles que l’asthme. Le patient s’adapte progressivement au handicap dû à la réduction de sa fonction respiratoire. En France, une autre cause du sous-diagnostic est la nécessité d’une spirométrie pour confirmer la présence d’une obstruction persistante des voies respiratoires. En raison d’un rapport coût-efficacité insuffisant, le dépistage systématique des populations asymptomatiques à risque n’est pas recommandé.6 Les retards dans le parcours diagnostique conduisent à une prise en charge sous-optimale de la BPCO, avec une mise en œuvre tardive des traitements appropriés et une identification insuffisante des patients ayant un risque plus élevé d’exacerbations ou d’hospitalisations.7,8 Pourtant, une prise en charge précoce diminue les événements respiratoires, améliore les symptômes et la qualité de vie.9
Dans le guide de la HAS sur le parcours de soins du patient atteint de BPCO,10 le médecin généraliste joue un rôle central (encadré 1). L’objectif de cet article est de revenir sur chacun des points critiques de la prise en charge des patients avec un diagnostic ou une suspicion de BPCO.
Physiopathologie de la BPCO
Maladie chronique respiratoire, la BPCO se caractérise par une inflammation des bronches et du tissu pulmonaire.11 Sur le plan physiopathologique, l’obstruction bronchique est liée à plusieurs facteurs : l’inflammation provoque un épaississement des parois bronchiques et une hypersécrétion de mucus qui encombre les voies aériennes, souvent associée à une hyper-réactivité et une contraction des muscles lisses péribronchiques, diminuant le calibre des petites bronches. Enfin, la destruction emphysémateuse du parenchyme est responsable d’une perte de l’élasticité pulmonaire. L’emphysème entraîne à la fois une rupture des attaches alvéolaires, qui s’effondrent sur elles-mêmes, et une distension thoracique. Sur le plan fonctionnel, la BPCO se caractérise par une diminution non complètement réversible des débits expiratoires. Il s’y associe notamment, en cas d’emphysème, une augmentation des volumes respiratoires non mobilisables ou distension, s’aggravant à l’effort et majorant la dyspnée.
Population à risque
La BPCO, autrefois considérée comme une maladie induite par le tabagisme chez des sujets génétiquement prédisposés (le facteur le plus connu étant le déficit en alpha- 1 -antitrypsine), est désormais reconnue comme la conséquence d’une interaction entre le développement pulmonaire individuel et son environnement tout au long de la vie.12 Dans les pays à revenu élevé, plus de 70 % des patients atteints de BPCO sont fumeurs ou ex-fumeurs.1 Les trajectoires de la fonction pulmonaire menant à la BPCO sont maintenant mieux comprises, de même que les causes correspondantes.13 - 15
Des études de cohorte ont montré qu’environ la moitié des patients atteints de BPCO à l’âge adulte avaient une fonction respiratoire optimale à la fin de leur développement pulmonaire (vers l’âge de 20 ans), avant qu’elle ne décline à un rythme accéléré, principalement en raison d’expositions environnementales (fumée de tabac et/ou polluants professionnels, domestiques ou atmosphériques).16 - 18 L’autre moitié des patients atteints de BPCO ne parvient pas à atteindre une fonction optimale en raison d’une altération du développement et de la croissance pulmonaire liée à des événements survenus tôt dans la vie, y compris in utero (tabagisme maternel, prématurité, petit poids de naissance, tabagisme passif ou actif précoce, infections sévères des voies respiratoires, asthme dans l’enfance).
Redéfinir la BPCO
À la suite de ces observations, de nouvelles définitions ont été proposées.
La pré-BPCO est caractérisée par la présence de symptômes respiratoires (toux, expectorations, dyspnée souvent quotidienne et parfois négligée, respiration sifflante ou événements respiratoires aigus), d’anomalies structurelles sur l’imagerie (épaississement des parois bronchiques, emphysème, piégeage gazeux) et/ou d’une altération de la fonction pulmonaire (faible capacité de diffusion, obstruction des petites voies aériennes, distension) en l’absence d’obstruction des voies aériennes, donc chez des personnes ayant un rapport volume expiratoire maximal par seconde (VEMS) sur la capacité vitale forcée (CVF) normal.15
Le terme PRISm (preserved ratio impaired spirometry) désigne une altération du VEMS avec un VEMS/CVF normal. Ces anomalies de la fonction respiratoire sont associées à un risque accru d’exacerbations, au développement ultérieur d’une BPCO dans un tiers des cas et à un pronostic plus défavorable.
La possibilité que la BPCO découverte à l’âge adulte trouve son origine dans l’enfance a donné naissance au concept de survenue précoce. Mais cette notion reste discutée, et la définition fonctionnelle chez l’adulte est difficilement applicable à l’enfant.19 La prévalence de la BPCO de l’enfant n’est pas connue ; elle est principalement la conséquence d’une pathologie acquise (infections respiratoires virales récurrentes, bronchiolite oblitérante, dilatation des bronches non génétique, etc.), d’anomalies du développement pulmonaire (bronchodysplasie pulmonaire du prématuré, malformation du système respiratoire, cardiopathie, etc.) ou d’une origine génétique (maladie du canal chlore, dont mucoviscidose, dyskinésie ciliaire primitive, etc.). Ces enfants à risque de BPCO à l’âge adulte nécessitent, par conséquent, une surveillance particulière de leur fonction respiratoire et une prévention accrue des infections.
La filière de santé des maladies respiratoires rares RespiFIL, qui inclut les équipes pédiatriques du centre de référence RespiRare et les centres de compétence associés, constitue un réseau national pour aider les médecins généralistes dans leur démarche diagnostique.
Particularités de la BPCO chez la femme
La BPCO est davantage négligée chez la femme que dans la population masculine.20 Les médecins l’évoquent moins facilement chez les femmes, qui ont en moyenne moins souvent d’expectorations. Pourtant, la prévalence de la BPCO et la mortalité associée sont en augmentation chez les femmes, qui représentent près de la moitié des personnes atteintes de BPCO.21
Chez elles, face à des symptômes respiratoires, le diagnostic évoqué est plus volontiers l’asthme, alors même que la BPCO se développe plus rapidement.
Le tabagisme reste un facteur de risque et, à exposition égale, les femmes ont une plus grande susceptibilité à la fumée de tabac.22 L’aéro-contamination domestique et les expositions professionnelles (produits de nettoyage ménagers) sont également retrouvés comme facteurs de risque.23 En dépit de l’augmentation de la prévalence de la BPCO chez les femmes, ces dernières restent sous-représentées dans les études cliniques.
Prise en charge des patients BPCO en France : des défis à relever
Le sous-diagnostic de l’obstruction bronchique (BPCO et asthme) a été mis en évidence par Delmas et al. dans la cohorte française CONSTANCES (220 000 adultes volontaires de 18 à 69 ans recrutés entre 2012 et 2021).24 Les données spirométriques de 19 938 participants ont montré que 4,6 % d’entre eux avaient une limitation des débits expiratoires. Parmi ces derniers, 64,4 % n’avaient pas eu de diagnostic d’obstruction bronchique. Les principaux facteurs responsables du retard diagnostique sont l’absence de symptômes respiratoires, la sous-déclaration des symptômes aux professionnels de santé ou l’absence d’attribution des symptômes à la BPCO par les médecins.24
La prise en charge nécessairement multidisciplinaire, la pénurie de praticiens et les difficultés d’accès aux soins des populations défavorisées ou vivant en milieu rural isolé sont d’autres facteurs pouvant expliquer le retard ou l’absence de diagnostic de la BPCO.
Dépister et diagnostiquer
Le diagnostic d’obstruction bronchique non ou incomplètement réversible, constante dans la BPCO bien que non spécifique, repose sur la mise en évidence, au cours des épreuves fonctionnelles respiratoires (EFR), d’un rapport VEMS/CVF inférieur à 70 % après bronchodilatation. Il est souhaitable à cet égard de développer la spirométrie de détection en soins primaires, au moins en prébronchodilatateur. Sa réalisation nécessite une formation adaptée (par exemple, Spiroform BPCO de la SPLF) et une pratique régulière.
La BPCO est une maladie hétérogène, avec différents phénotypes qui regroupent des patients partageant les mêmes caractéristiques cliniques, spirométriques, fonctionnelles, radiologiques, génétiques.25 Parmi ces sous-groupes, il est capital de repérer les patients avec un profil « exacerbateur fréquent », caractérisé par la survenue de deux exacerbations ou plus, ou une exacerbation ayant nécessité une hospitalisation, au cours de l’année précédente. Les exacerbations sont définies par l’aggravation aiguë des symptômes respiratoires (toux, volume et purulence de l’expectoration, dyspnée) ; elles nécessitent un traitement spécifique. Les patients appartenant à ce sous-groupe ont un pronostic vital et fonctionnel particulièrement altéré et relèvent d’une prise en charge particulière.
Traitement pharmacologique mais pas seulement
La prise en charge des patients BPCO n’est pas seulement pharmacologique : l’exposition aux toxiques inhalés (le tabac en premier lieu) est à proscrire, mais il existe d’autres recommandations, dont le maintien d’une bonne hygiène de vie (équilibre diététique, exercice physique, vaccinations) et l’éducation clinique et thérapeutique. Dans certains cas, en particulier au décours des exacerbations sévères, une prise en charge globale dans le cadre de la réhabilitation respiratoire est nécessaire (encadré 2). Elle peut se faire au domicile, lors d’un séjour en centre spécialisé ou en externe et doit être prolongée pour être efficace.
Bronchodilatateurs de longue durée d’action d’abord !
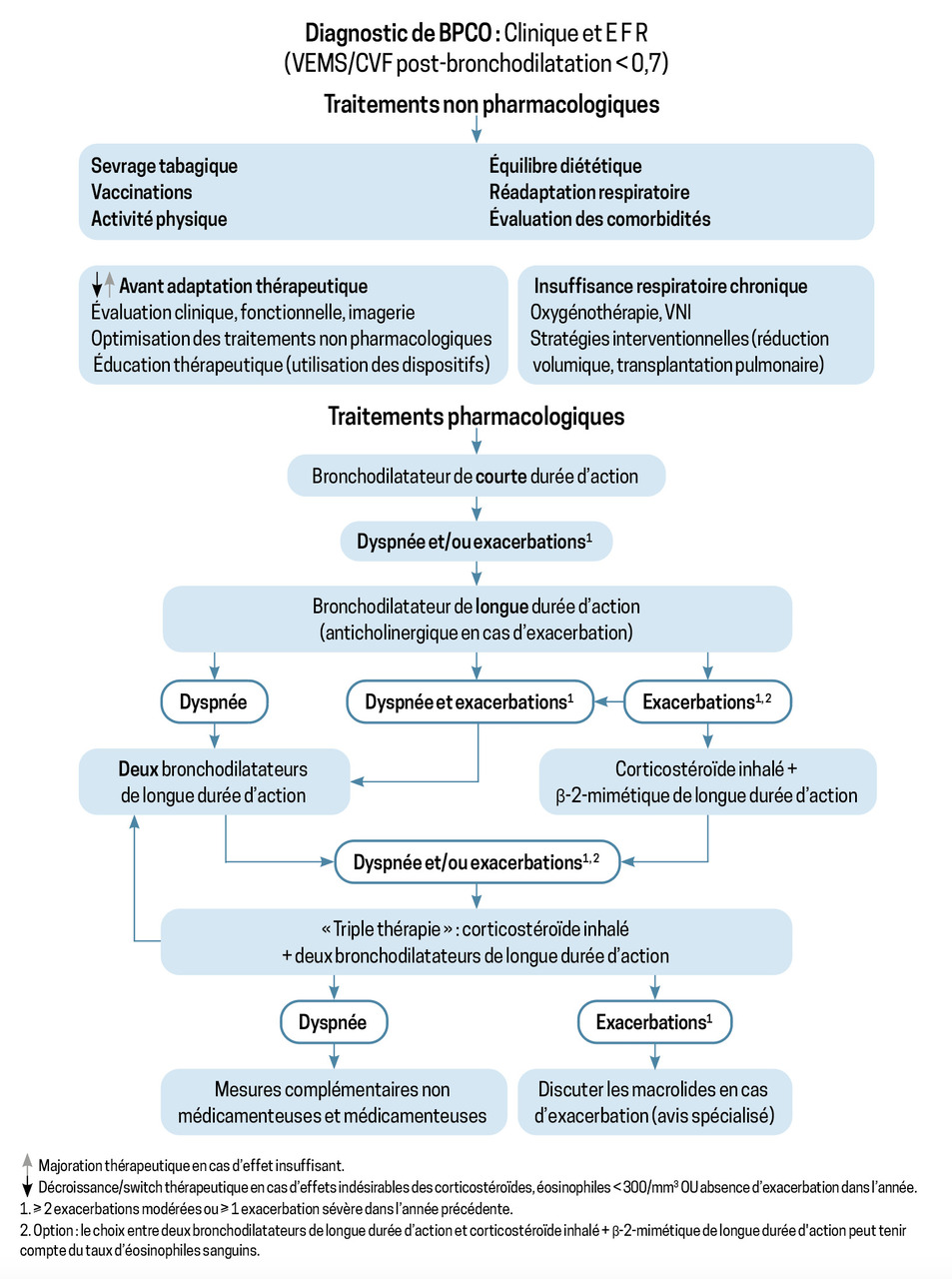
Sur le plan pharmacologique, les bronchodilatateurs inhalés sont les médicaments de base de la BPCO (figure).
En cas de dyspnée quotidienne ou d’exacerbation, un traitement par un bronchodilatateur de longue durée d’action en monothérapie est envisagé en première intention : LABA (long-acting beta-agonist, ou bêta-sympathomimétique de longue durée d’action) ou LAMA (long-acting muscarinic antagonist, ou anticholinergique de longue durée d’action).
Avant de recourir à l’escalade pharmacologique, il est important de s’assurer que le patient comprend bien sa maladie et les enjeux de sa prise en charge. Il faut souligner l’importance d’une bonne observance, du bon usage de son dispositif et de la technique d’inhalation (changer au besoin de dispositif d’inhalation) et de l’arrêt de la consommation de toxique (tabac). Enfin, il faut s’assurer de la prise en compte de diagnostics associés (comorbidités cardiovasculaires, métaboliques, psychiatriques, déconditionnement physique, etc.).
En cas de persistance, une bi- voire une trithérapie
Si la dyspnée ou les exacerbations persistent, une association de deux bronchodilatateurs de longue durée d’action (LABA + LAMA) est indiquée.26
Les corticoïdes inhalés (CSI) – toujours en association avec un bronchodilatateur de longue durée d’action – sont indiqués en cas d’exacerbations récurrentes ou d’asthme associé.
Si malgré la bithérapie les symptômes persistent, une « trithérapie » inhalée (LABA-LAMA-CSI) peut être prescrite (figure). La prescription initiale de cette trithérapie peut désormais être faite par un médecin généraliste, toutefois encadrée par les conditions suivantes : réalisation d’une exploration fonctionnelle respiratoire confirmant l’existence d’un trouble ventilatoire obstructif dans l’année précédant le traitement par trithérapie et consultation de pneumologie dans l’année suivant la prescription initiale afin de s’assurer du diagnostic et de l’indication.
Cette trithérapie doit être réévaluée régulièrement. Une désescalade thérapeutique peut être proposée chez des patients stabilisés, en particulier s’il existe des effets indésirables des corticoïdes inhalés (mycoses buccales, pneumonies, infection à mycobactérie, etc.).
Et en cas d’échec ?
Pour les patients restant insuffisamment contrôlés sous triple thérapie et en cas d’inflammation de type 2 – se caractérisant par un taux d’éosinophiles dans le sang élevé (≥ 300 cellules/µL) –, il sera très vraisemblablement possible de proposer prochainement une biothérapie ciblant les principales cytokines impliquées comme l’IL- 4/IL- 13 ou l’IL- 5.27 Ces biothérapies seront impérativement initiées par le pneumologue après évaluation complète (encadré 3).
Les corticostéroïdes oraux sont réservés à certaines exacerbations aiguës.
Les antitussifs, les mucolytiques ou les CSI pris isolément ne sont pas recommandés actuellement.
L’oxygénothérapie peut être prescrite pour une durée limitée à un mois par tout médecin pour passer le cap d’une exacerbation aiguë hypoxémiante. L’encadré 4 rappelle les indications de l’oxygénothérapie à long terme.
Des recommandations pratiques pour le diagnostic précoce, la prise en charge des exacerbations et la prescription des antibiotiques
Recherche systématique dans une population ciblée
Pour améliorer le diagnostic précoce, une recherche systématique de la BPCO (« case finding ») doit être réalisée chez tout patient, homme ou femme, de plus de 40 ans à risque (fumeur ou ex-fumeur, profession exposée) et ayant des symptômes chroniques, souvent quotidiens (dyspnée, toux, expectoration).28
Il est important de rechercher systématiquement et régulièrement ces symptômes à l’interrogatoire ou par questionnaire de type HAS.29
À l’avenir, le diagnostic de la BPCO pourrait également bénéficier de la tomodensitométrie thoracique proposée pour le dépistage du cancer du poumon chez certains patients exposés au tabac.1
Initier le traitement avant la spirométrie ?
Chez des patients symptomatiques, si le délai avant la réalisation de la spirométrie est trop long, il y a peu de risques à prescrire, en plus des conseils d’hygiène de vie (arrêt du tabac, lutte contre la sédentarité, etc.) :
- un bronchodilatateur inhalé, en particulier de courte durée d’action, à la demande en cas de dyspnée ;
- voire un bronchodilatateur inhalé de longue durée d’action en une ou deux prises par jour. Cette attitude pragmatique ne doit pas faire oublier l’importance de réaliser une mesure de la fonction respiratoire. Dans le doute, notamment en cas de suspicion d’asthme, il est souhaitable d’interrompre les bronchodilatateurs plusieurs heures avant la mesure pour permettre de réaliser un test de réversibilité interprétable.30
Exacerbations : un facteur pronostique important
Une fois le diagnostic de BPCO confirmé, les exacerbations, même légères, doivent être recherchées par l’interrogatoire et traitées. Le risque d’exacerbation est d’autant plus élevé que la fonction respiratoire est altérée, bien que des BPCO légères puissent aussi engendrer des exacerbations.31
Les conséquences des exacerbations sont majeures : risque de déclin de la qualité de vie et de la fonction respiratoire, augmentation du risque d’hospitalisation30 et de la mortalité (environ 50 % à quatre ans après une hospitalisation pour exacerbation sévère),32 sans compter les coûts de santé engendrés.33
La prise en charge des exacerbations implique une collaboration entre médecin généraliste et pneumologue. Les médecins généralistes sont en première ligne pour identifier une détérioration précoce de l’état du patient et mettre en place un traitement. Les exacerbations sévères qui mettent en jeu le pronostic vital à court terme imposent une hospitalisation en urgence. Ces épisodes sont l’occasion de revoir le traitement de fond, dont l’un des objectifs est la prévention des exacerbations. Une consultation de suivi par le médecin traitant dans les sept jours après la sortie est fortement préconisée par la HAS.33
Prise en charge des exacerbations
Le traitement des exacerbations comprend toujours un renforcement des bronchodilatateurs, avec parfois la prescription d’antibiotiques, en général pendant cinq jours si une origine bactérienne est suspectée (expectorations purulentes et/ou plus importantes)10 et/ou parfois celle de corticostéroïdes systémiques (30 à 40 mg/j pendant cinq jours, sans nécessité de décroissance progressive) en cas de bronchospasme, de doute avec un asthme ou de persistance des symptômes en dépit des traitements débutés auparavant.34
L’évolution doit être réévaluée à quarante-huit heures, avec demande d’un avis spécialisé en l’absence d’amélioration.
Une hospitalisation est indiquée si le patient présente l’un des critères suivants :34
- dyspnée à l’état basal ;
- respiration paradoxale ou utilisation des muscles respiratoires accessoires ;
- troubles de conscience ;
- contexte avec comorbidités (notamment cardiaques, diabète insulinodépendant, anémie), isolement ou précarité sociale…
D’autres critères peuvent être pris en compte, comme la présence de cyanose, d’œdèmes périphériques, de douleurs thoraciques, de signes d’hypercapnie (astérixis, sueurs, céphalées, hypertension artérielle, troubles de la vigilance, désorientation temporo-spatiale), un encombrement bronchique important, des difficultés à la toux, des modifications radiologiques, une saturation de l’hémoglobine en oxygène (SpO2) inférieure à 90 %, une pression partielle de dioxygène (PaO2) inférieure à 55 mmHg, un pH inférieur à 7,35, un taux de bicarbonate supérieur à 35 mmol/L ou encore des anomalies apparues sur l’ECG.
Une hospitalisation s’impose en cas d’hypoxémie nécessitant une oxygénothérapie.34
Trois recommandations pour un parcours personnalisé
Prise en charge pluridisciplinaire
La BPCO est une maladie chronique qui implique une prise en charge globale du fait de l’existence de comorbidités dans 90 % des cas.35 Les plus fréquentes sont cardiovasculaires (responsables d’une mortalité importante),36 psychiatriques (notamment chez la femme), ostéomusculaires (ostéoporose, sarcopénie),37 associées à de nombreuses autres (obésité, syndrome métabolique, diabète, insuffisance rénale, etc.).38
Un plan d’action personnalisé doit être mis en place dès le diagnostic et intégrer l’arrêt des toxiques inhalés (notamment tabac et cannabis, pouvant nécessiter une consultation d’addictologie), la réhabilitation (importance de l’activité physique), la prise en charge des comorbidités associées, notamment cardiovasculaires39 et la prise en charge pneumologique.
Réévaluer régulièrement
L’évaluation de l’observance et de la technique d’inhalation doit se faire à chaque consultation, afin de choisir le bon inhalateur, c’est-à-dire celui que le patient sait utiliser correctement.40 Cette évaluation est l’un des prérequis avant toute escalade thérapeutique chez les patients mal contrôlés.
Favoriser l’adhésion du patient
Le maintien des patients dans le parcours de soins est un enjeu crucial dans une maladie chronique telle que la BPCO où le retentissement psychologique et ses conséquences sur la motivation sont considérables. Pour proposer une prise en charge optimale centrée sur le patient, il est recommandé de :
- choisir l’inhalateur le mieux adapté en tenant compte des préférences et des capacités du patient ;
- simplifier la prescription (nombre de prises et de dispositifs limités) pour améliorer l’observance ;
- définir les objectifs cibles en concertation avec le patient dans le cadre d’un plan d’action personnalisé.
Rôles du médecin généraliste
Le médecin généraliste joue un rôle crucial aux différentes étapes du parcours de soins et de suivi.
Pour le diagnostic
En matière diagnostique, le rôle du médecin traitant est double :
- il prescrit une spirométrie aux sujets de plus de 40 ans ayant des symptômes évocateurs et/ou un ou plusieurs facteurs de risque ;
- il recherche des comorbidités chroniques associées (90 % des BPCO).
La réalisation de la spirométrie étant l’un des principaux freins au diagnostic, son développement en soins primaires reste un enjeu crucial si l’on veut prendre en charge les patients au stade le plus précoce de leur maladie.
Pour la prise en charge
Le médecin traitant met en place les mesures hygiéno-diététiques, l’éducation du patient et la prescription adaptée des médicaments, dont les vaccinations recommandées (vaccinations antigrippale et anti-Covid annuelles et vaccination antipneumococcique).41
Pour l’évaluation régulière
Le médecin traitant joue également un rôle dans le suivi de l’observance, de l’évolution de la maladie et des comorbidités, en veillant à rechercher les exacerbations, trop souvent négligées par les patients. L’évaluation de l’observance et de la technique d’inhalation doit se faire à chaque consultation, afin de choisir le bon inhalateur, c’est-à-dire celui que le patient sait utiliser correctement.40,42 Cette évaluation est l’un des prérequis avant toute escalade thérapeutique chez les patients mal contrôlés.
Par ailleurs, aider le patient à comprendre sa maladie et à évaluer sa qualité de vie à la suite d’une modification de ses habitudes (arrêt du tabac et activité physique) ou la bonne prise de son traitement inhalé est essentiel. Cela permet, en effet, d’améliorer l’adhésion.
Chef d’orchestre du parcours
Le médecin traitant joue un rôle de coordination des soins dans cette pathologie dont les conséquences ne se limitent que rarement au système respiratoire.
Adresser au pneumologue
L’avis du pneumologue reste incontournable pour confirmer le diagnostic, participer au suivi des patients insuffisamment contrôlés et proposer une prise en charge personnalisée (encadré 3). Cet avis est d’autant plus nécessaire avec l’arrivée de nouveaux traitements tels que les biothérapies. Ces avancées prometteuses dans la BPCO sont de véritables espoirs et témoignent d’une recherche toujours active, dans l’intérêt des patients.43
1. Faciliter le dialogue médecin-patient
À chaque stade de la maladie, le médecin facilite le dialogue avec le patient afin de l’aider :
- à mieux comprendre sa maladie respiratoire chronique et évaluer ses symptômes ;
- à devenir proactif dans sa prise en charge ;
- à définir et partager les objectifs à atteindre ;
- à évaluer l’efficacité de son traitement, son observance et le bon usage de son médicament inhalé ;
- à évaluer sa qualité de vie ;
- à réagir précocement face à une dégradation de son état ;
- à modifier ses habitudes de vie et pratiquer une activité physique régulière.
2. Réhabilitation respiratoire
La réhabilitation respiratoire comprend deux composantes essentielles : le réentraînement à l’exercice (avec reprise d’une activité physique adaptée) et l’éducation thérapeutique (ETP), auxquels sont associés le sevrage tabagique, le bilan et le suivi nutritionnels ainsi que la prise en charge psychosociale.
Les objectifs sont :
- l’augmentation de la capacité fonctionnelle d’effort du patient ;
- le développement de changements de comportement nécessaires à une amélioration de sa santé et de sa qualité de vie ;
- l’adhésion à long terme à ces comportements.
Les acteurs de cette réhabilitation sont avant tout le patient, le médecin traitant et le kinésithérapeute, mais il s’agit d’une prise en charge personnalisée où peuvent également intervenir : nutritionniste, patient expert, ergothérapeute, psychologue, tabacologue, infirmière spécialisée, assistante sociale, médecins d’autres spécialités...
3. Pourquoi et quand adresser au pneumologue ?
1. Pour confirmation et documentation du diagnostic incluant une spirométrie avec test pharmacologique (indispensable au diagnostic).
2. Pour évaluation plus précise si indiquée, non systématique :
- mesure des volumes non mobilisables (pléthysmographie), transfert du CO ;
- gaz du sang ;
- test d’effort (test de marche, épreuve d’effort cardiorespiratoire) ;
- polygraphie nocturne ;
- tomodensitométrie thoracique.
3. En cas de BPCO difficile à contrôler :
- dyspnée et/ou handicap disproportionné ;
- facteurs de risque de comorbidités ;
- exacerbations fréquentes ;
- dégradation clinique ;
- formes mixtes (association asthme et BPCO).
4. Indications de l’oxygénothérapie à long terme plus de quinze heures par jour en cas de BPCO
Les critères suivants doivent être présents :
- soit une PaO2 diurne à l’état stable ≤ 55 mmHg à deux reprises
- soit une PaO2 comprise entre 56 et 59 mmHg associée à un ou plusieurs éléments suivants : une polyglobulie (hématocrite > 55 %), des œdèmes périphériques, une hypertension artérielle pulmonaire avérée (pression artérielle pulmonaire moyenne > 25 mmHg sur cathétérisme cardiaque).
Sur le plan réglementaire, l’indication de l’oxygénothérapie à long terme impose le contrôle de deux gaz du sang en air ambiant séparés de quinze jours à un mois en état stable, puis une réévaluation entre un et trois mois après une exacerbation.
Que dire à vos patients ?
Un diagnostic précoce de BPCO, associé à une prise en charge proactive et centrée sur le patient, permet de mieux vivre avec la maladie.
Le patient a un rôle central à jouer, notamment dans le choix de l’inhalateur et en s’investissant dans l’éducation thérapeutique (prévention, observance, respect des règles hygiénodiététiques).
La bonne observance au long cours des traitements médicamenteux, une prévention adaptée (vaccinations obligatoires et recommandées à jour) et la mise en place de mesures hygiénodiététiques (arrêt du tabac, activité physique, alimentation équilibrée) contribuent à améliorer la qualité de vie.
2. Roche N, Dalmay F, Perez T, et al. Impact of chronic airflow obstruction in a working population. Eur Respir J 2008;31:1227-33.
3. Kornmann O, Beeh KM, Beier J, et al. Newly diagnosed chronic obstructive pulmonary disease. Clinical features and distribution of the novel stages of the Global Initiative for Obstructive Lung Disease. Respiration 2003;70:67-75.
4. HAS. Pertinence des soins. Bronchopneumopathie chronique obstructive. 10 messages pour améliorer votre pratique. Novembre 2019. https://tinyurl.com/439p4day
5. Gershon AS, Hwee J, Chapman KR, et al. Factors associated with undiagnosed and overdiagnosed COPD. Eur Respir J 2016;48:561-4.
6. Webber EM, Lin JS, Thomas RG. Screening for Chronic Obstructive Pulmonary Disease: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA 2022;327:1812-6.
7. Kostikas K, Price D, Gutzwiller FS, et al. Clinical Impact and Healthcare Resource Utilization Associated with Early versus Late COPD Diagnosis in Patients from UK CPRD Database. Int J Chron Obstruct Pulmon Dis 2020;15:1729-38.
8. Halpin DMG. Clinical Management of COPD in the Real World: Can Studies Reveal Errors in Management and Pathways to Improve Patient Care? Pragmat Obs Res 2023;14:51-61.
9. Aaron SD, Vandemheen KL, Whitmore GA, et al. Early Diagnosis and Treatment of COPD and Asthma. A Randomized, Controlled Trial. N Engl J Med 2024;390:2061-73.
10. HAS. Guide du parcours de soins. Bronchopneumopathie chronique obstructive. Janvier 2020. https://tinyurl.com/5b9dpzuk
11. Dey S, Eapen MS, Chia C, et al. Pathogenesis, clinical features of asthma COPD overlap, and therapeutic modalities. Am J Physiol Lung Cell Mol Physiol 2022;322:L64-L83.
12. Agusti A, Melen E, DeMeo DL, et al. Pathogenesis of chronic obstructive pulmonary disease: understanding the contributions of gene-environment interactions across the lifespan. Lancet Respir Med 2022;10:512-24.
13. Lange P, Celli B, Agusti A, et al. Lung-Function Trajectories Leading to Chronic Obstructive Pulmonary Disease. N Engl J Med 2015;373:111-22.
14. Stolz D, Mkorombindo T, Schumann DM, et al. Towards the elimination of chronic obstructive pulmonary disease: a Lancet Commission. Lancet 2022;400:921-72.
15. Celli B, Fabbri L, Criner G, et al. Definition and Nomenclature of Chronic Obstructive Pulmonary Disease: Time for Its Revision. Am J Respir Crit Care Med 2022;206:1317-25.
16. Mocelin HT, Fischer GB, Bush A. Adverse early-life environmental exposures and their repercussions on adult respiratory health. J Pediatr (Rio J) 2022;98 Suppl 1:S86-S95.
17. Yang W, Li F, Li C, et al. Focus on Early COPD: Definition and Early Lung Development. Int J Chron Obstruct Pulmon Dis 2021;16:3217-28.
18. Belgrave DCM, Granell R, Turner SW, et al. Lung function trajectories from pre-school age to adulthood and their associations with early life factors: a retrospective analysis of three population-based birth cohort studies. Lancet Respir Med 2018;6:526-34.
19. Postma DS, Bush A, van den Berge M. Risk factors and early origins of chronic obstructive pulmonary disease. Lancet 2015;385:899-909.
20. Jenkins CR, Chapman KR, Donohue JF, et al. Improving the Management of COPD in Women. Chest 2017;151:686-96.
21. Thun MJ, Carter BD, Feskanich D, et al. 50-year trends in smoking-related mortality in the United States. N Engl J Med 2013;368:351-64.
22. Gan WQ, Man SF, Postma DS, et al. Female smokers beyond the perimenopausal period are at increased risk of chronic obstructive pulmonary disease: a systematic review and meta-analysis. Respir Res 2006;7:52.
23. Raherison C, Biron E, Nocent-Ejnaini C, et al. Are there specific characteristics of COPD in women? Rev Mal Respir 2010;27:611-24.
24. Delmas MC, Benezet L, Ribet C, et al. Underdiagnosis of obstructive lung disease: findings from the French CONSTANCES cohort. BMC Pulm Med 2021;21:319.
25. Burgel P-R. Des définitions aux phénotypes de BPCO. La Presse Médicale 2014;43:1337-43.
26. Zysman M, Ribeiro Baptista B, Soumagne T, et al. Optimisation du traitement medicamenteux des patients atteints de BPCO en etat stable. Position de la Société de pneumologie de langue francaise. Actualisation 2021. Rev Mal Respir 2021;38:539-61.
27. Guecamburu M, Zysman M. Biologic agents in COPD management. Rev Mal Respir 2024;41:127-38.
28. Zhang Y, Steiner AL. Projected climate-driven changes in pollen emission season length and magnitude over the continental United States. Nat Commun 2022;13:1234.
29. HAS. Faites le test : aurais-je une BPCO ? Auto-questionnaire dépistage BPCO. 2014 https://bit.ly/4gmjn1q
30. Mapel DW, Roberts MH. New clinical insights into chronic obstructive pulmonary disease and their implications for pharmacoeconomic analyses. Pharmacoeconomics 2012;30:869-85.
31. Hurst JR, Vestbo J, Anzueto A, et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease. N Engl J Med 2010;363:1128-38.
32. Suissa S, Dell'Aniello S, Ernst P. Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax 2012;67:957-63.
33. Laurendeau C, Chouaid C, Roche N, et al. Prise en charge et coûts de la bronchopneumopathie chronique obstructive en France en 2011. Rev Mal Respir 2015;32:682-91.
34. Jouneau S, Dres M, Guerder A, et al. Management of acute exacerbations of chronic obstructive pulmonary disease (COPD). Guidelines from the Société de pneumologie de langue francaise (summary). Rev Mal Respir 2017;34:282-322.
35. Garcia-Olmos L, Alberquilla A, Ayala V, et al. Comorbidity in patients with chronic obstructive pulmonary disease in family practice: A cross sectional study. BMC Fam Pract 2013;14:11.
36. Stallberg B, Janson C, Larsson K, et al. Real-world retrospective cohort study ARCTIC shows burden of comorbidities in Swedish COPD versus non-COPD patients. NPJ Prim Care Respir Med 2018;28:33.
37. Negewo NA, McDonald VM, Gibson PG. Comorbidity in chronic obstructive pulmonary disease. Respir Investig 2015;53:249-58.
38. Cavailles A, Brinchault-Rabin G, Dixmier A, et al. Comorbidities of COPD. Eur Respir Rev 2013;22:454-75.
39. Troosters T, Janssens W, Demeyer H, et al. Pulmonary rehabilitation and physical interventions. Eur Respir Rev 2023;32.
40. Usmani OS. Choosing the right inhaler for your asthma or COPD patient. Ther Clin Risk Manag 2019;15:461-72.
41. Ministère du Travail, de la Santé et des Solidarités. Calendrier des vaccinations et recommandations vaccinales 2024. Avril 2024.
42. Zysman M, Ribeiro Baptista B, Soumagne T, et al. Pharmacological treatment optimisation in patients with stale COPD. Position of the French-language Respiratory Society. 2021 Update. Rev Mal Respir 2021;38:539-61.
43. HAS. Comment mettre en œuvre la réhabilitation respiratoire pour les patients ayant une bronchopneumopathie chronique obstructive ? 2014. https://bit.ly/4fMOMc3
44. Jébrak G. Oxygénothérapie à long terme dans les pathologies respiratoires chroniques. Rev Prat 2024;74:587-93.
45. Gueçamburu M, Zysman M. Prise en charge médicamenteuse de la BPCO. Rev Prat 2024;74(1);7-12.
Dans cet article
- Physiopathologie de la BPCO
- Population à risque
- Redéfinir la BPCO
- Particularités de la BPCO chez la femme
- Prise en charge des patients BPCO en France : des défis à relever
- Des recommandations pratiques pour le diagnostic précoce, la prise en charge des exacerbations et la prescription des antibiotiques
- Trois recommandations pour un parcours personnalisé
- Rôles du médecin généraliste

 Encadrés
Encadrés